Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse de nanogels sensibles aux stimuli à l’aide de la réticulation aqueuse en une étape et de la co-nanopolymérisation
Dans cet article
Résumé
Les nanogels constituent une excellente plateforme polyvalente de nanoparticules pour l’administration de produits biologiques. Des nano-gels polymères à base de poly(éthylène) glycol sensibles aux stimuli, capables d’encapsuler des charges utiles à base de protéines, ont été synthétisés à l’aide d’une stratégie de co-nanopolymérisation de réticulation en une étape dans des conditions aqueuses. La fabrication et la caractérisation optimales de ces nouvelles nanoparticules sont présentées ici.
Résumé
Des nanogels constitués de nanoparticules polymères réticulées ont été développés pour l’administration de nombreuses thérapies chimiques et biologiques, en raison de leur synthèse ascendante polyvalente et de leur biocompatibilité. Bien que diverses méthodes aient été employées pour la synthèse de nanogels à ce jour, très peu y sont parvenues sans l’utilisation de solvants organiques agressifs ou de températures élevées qui peuvent endommager l’intégrité de la charge utile biologique. En revanche, la méthodologie présentée ici réalise la synthèse de nanogels chargés en protéines d’une taille inférieure à 100 nm en utilisant des conditions de réaction douces. Ici, nous présentons une méthode d’encapsulation non covalente de charges utiles à base de protéines dans des nano-gels synthétisés à l’aide d’une technique de copolymérisation de réticulation à base aqueuse, en une seule étape. Dans cette technique, nous lions d’abord électrostatiquement une charge utile à base de protéines à un monomère d’ammonium quaternaire cationique, puis nous la réticulons et la copolymérisons simultanément à l’aide de persulfate d’ammonium et de N,N,N',N'-tétraméthyléthylènediamine pour former des nanogels qui piègent la charge utile protéique. La taille et l’indice de polydispersité des nanogels sont déterminés à l’aide de la diffusion dynamique de la lumière (DLS), tandis que la morphologie de surface est évaluée par microscopie électronique à transmission (MET). La masse de protéines piégée dans les nanogels est déterminée en calculant l’efficacité de l’encapsulation. De plus, la capacité de libération contrôlée des nanogels via la dégradation progressive des éléments structurels sensibles à l’oxydoréduction est également évaluée dans des essais de bioréduction. Nous fournissons des exemples de données d’optimisation des nanoparticules pour démontrer toutes les mises en garde de la synthèse et de la caractérisation des nanogels à l’aide de cette technique. En général, des nanogels de taille uniforme ont été obtenus avec une taille moyenne de 57 nm et une valeur d’indice de polydispersité de 0,093. Une efficacité d’encapsulation élevée de 76 % a été atteinte. De plus, les nanogels ont montré une libération contrôlée de jusqu’à 86 % de la protéine encapsulée par dégradation progressive de nouveaux composants sensibles à l’oxydoréduction en présence de glutathion sur 48 heures.
Introduction
Les nanogels sont des hydrogels tridimensionnels de taille submicronique avec des structures de réseau de polymères réticulés qui peuvent contenir de grandes quantités de fluides dans leur enveloppe centrale sans affecter leur intégrité morphologique1. En général, les nanogels sont synthétisés par la polymérisation de monomères fonctionnels par réticulation physique ou chimique dans des systèmes colloïdaux hétérogènes, tels que les microémulsions inverses eau dans huile 2,3. Les copolymères amphiphiles peuvent s’auto-assembler en structures nanométriques dans des environnements aqueux. Cependant, ils doivent être stabilisés à l’aide de stratégies de réticulation chimique impliquant des disulfures ou un couplage basé sur l’amide, la chimie click, ou peuvent être induits physiquement (stratégies hydrophobes, électrostatiques ou de liaisons hydrogène) ou photo-induits4. Parmi ces stratégies, l’auto-assemblage physique des polymères suivi d’une réticulation chimique a été signalé comme une technique de fabrication de nanogel réussie5. Alors qu’historiquement, le premier nanogel a été introduit dans les années 1990 par Vingradov et al.6, Akiyoshi et al.7 et Lemieux et al.8, récemment, une variété de nanogels intelligents composés de polymères naturels et synthétiques ont été développés et explorés pour diverses applications biomédicales9.
Les nanogels possèdent une grande capacité de rétention de cargaison, une grande surface, une stabilité in vivo, ainsi que des propriétés chimiques et mécaniques personnalisables10. La synthèse de nanogels est également évolutive et peut être aqueuse. De plus, la teneur accrue en eau des nanogels en fait des transporteurs efficaces de charges utiles biologiques sensibles11. De plus, la grande surface peut satisfaire de multiples besoins de bioconjugaison, permettant ainsi l’attachement de modalités de ciblage pour permettre un ciblage actif. Notamment, la polyvalence de la conception des nanogels permet l’utilisation d’une large gamme de monomères sensibles aux stimuli qui permettent un contrôle précis de leurs propriétés physicochimiques9. Cette capacité d’ingénierie unique permet l’amélioration rationnelle de la conception des nanogels, ce qui est difficile à réaliser avec des liposomes, des micelles ou des polymérimosomes utilisés de manière conventionnelle12,13. En incorporant des fractions sensibles aux stimuli dans des monomères spécialement conçus, les nanogels peuvent être conçus pour déclencher la libération contrôlée de leur charge utile en réponse à divers stimuli physiologiquement pertinents, tels que le pH, les conditions d’oxydoréduction, les enzymes, etc.9,14. Ces nanogels intelligents sont plus utiles que les nanogels conventionnels, car ils possèdent une stabilité supérieure pour une circulation sanguine prolongée, et ils peuvent supporter des conditions physiologiques pour maintenir l’intégrité de leur cargaison et favoriser sa libération contrôlée aux sites cibles souhaités15. En effet, en raison de leur nature polyvalente, les nanogels ont gagné du terrain dans le domaine biomédical, avec des avancées notables dans le développement de nanogels sensibles aux stimuli pour de nombreuses applications théranostiques et diagnostiques 2,16,17.
Les produits biologiques peuvent représenter une catégorie de produits pharmaceutiques composés de protéines, de peptides et/ou d’acides nucléiques et ont révolutionné le paysage thérapeutique en raison de leur remarquable sélectivité, devenant ainsi la classe de produits thérapeutiques à la croissance la plus rapide18. En effet, la croissance du marché de ces produits thérapeutiques est évidente dans la forte augmentation de leur approbation par la Federal Drug Association (FDA) des États-Unis, où les produits biologiques représentaient ~40 % du total des approbations de médicaments, en 202319. En plus de leur spécificité et de leur puissance, la découverte rapide de nouvelles cibles médicamenteuses, des processus de bio-ingénierie plus efficaces et une meilleure connaissance du devenir in vivo de ces produits thérapeutiques a conduit à une augmentation de leur utilisation20. Les produits biologiques traditionnels comprennent l’ARN interférent, les protéines de remplacement, les cytokines et les hormones qui sont généralement générés à l’aide de la technologie de l’ADN recombinant21. Depuis l’approbation de l’insuline recombinante humaine en 1982, des produits biologiques ont été mis au point pour traiter de nombreuses affections, notamment le cancer (p. ex., trastuzumab, avélumab), les maladies inflammatoires de l’intestin (p. ex., adalimumab, certolizumab) et les maladies génétiques rares (p. ex., mipomersan, myozyme, aldurazyme, fabrazyme)21. Bien que la grande spécificité des interactions des produits biologiques avec leurs cibles devrait théoriquement compenser les effets hors cible, plusieurs préoccupations cliniques ont émergé concernant leur utilisation concernant les effets secondaires indésirables22. Ces effets secondaires peuvent être regroupés en deux catégories, notamment la pharmacologie exagérée (stimulation excessive des cibles) et l’immunogénicité. De plus, leurs demi-vies courtes, leur biodisponibilité limitée, leurs dommages causés par la protéase, leur courte durée de conservation et leurs processus de production coûteux limitent leurs avantages thérapeutiques21. Les méthodes conventionnelles d’atténuation de ces problèmes impliquent une modification covalente de ces produits biologiques qui peut compromettre leur fonction et, par conséquent, leur efficacité23. Alternativement, l’approche nanomédicale de l’encapsulation des charges utiles thérapeutiques peut conférer de nombreux avantages aux propriétés pharmacologiques, notamment le ciblage passif du site enflammé via l’effet de perméation et de rétention améliorées (EPR)24. D’autres avantages associés aux nanoparticules peuvent inclure des temps de circulation améliorés, un taux de clairance réduit, une plus grande flexibilité de formulation, une meilleure perméation du système vasculaire et une meilleure absorption cellulaire25. Alors qu’une grande variété de formulations de nanoparticules sont actuellement à l’étude pour l’administration de charges utiles biologiques, peu d’entre elles peuvent émuler la multifonctionnalité des nanogels. En effet, les nanogels dépassent les capacités de charge atteintes par les nanoparticules à base de liposomes et de micelles, et ils présentent une plus grande stabilité colloïdale que la plupart des nanoparticules inorganiques. En tant que tels, les nanogels constituent une plate-forme précieuse pour l’administration de diverses thérapies biologiques.
Nous avons déjà réussi à administrer une enzyme antioxydante dans de nouveaux nanogels polymères réticulés sensibles à la métalloprotéinase matricielle, où la stratégie d’encapsulation légère utilisée a maintenu la bioactivité de la protéine lors de sa libération26. Dans ce travail, nous démontrons la synthèse optimisée de nanogels sensibles à l’oxydoréduction pour l’administration de charges utiles à base de protéines. Notamment, la méthodologie synthétique permet la synthèse de nanogels dans des conditions douces pour encapsuler la charge utile souhaitée, sans utiliser de solvants organiques agressifs ou de températures élevées. Nous avons exploité l’homéostasie redox dans l’environnement intracellulaire pour réguler la libération de la charge utile encapsulée27,28. En règle générale, le glutathion antioxydant (GSH), naturellement abondant, contrôle les potentiels redox extracellulaires et intracellulaires, où sa concentration varie entre 2-20 μM et 1-10 mM, respectivement29,30. À ce jour, de nombreuses nanoparticules sensibles à l’oxydoréduction ont été signalées, ce qui en fait une stratégie éprouvée et fiable pour permettre la libération contrôlée de médicaments in vivo27,28. En effet, des liaisons disulfure ont été installées dans des nanomatériaux polymères en utilisant des réticulants contenant du disulfure31,32, l’auto-assemblage de polymères biodégradables à partir de monomères contenant du disulfure33, et des promédicaments polymères sensibles à l’oxydoréduction ou des conjugués médicament/polymère34,35. Par conséquent, cette étude étudie l’incorporation d’un réticulant disulfure unique, hautement sensible au GSH, dans les nanoparticules polymères, permettant ainsi la libération contrôlée d’une charge utile protéique encapsulée.
Dans cette étude, la conception du nanogel a été centrée sur les critères suivants pour tenir compte de la spécificité et de la livraison de la charge utile : petite taille (~100 nm) et une distribution de taille uniforme (indice de polydispersité (IP)<0,3) pour assurer une pénétration efficace de l’endothélium et une stabilité in vivo 27 ; encapsulation efficace de la charge utile protéique et libération contrôlée de la charge utile en réponse au GSH. Nous rapportons la synthèse de nanogels réticulés sensibles au GSH, qui ont démontré des nanoparticules homogènes de taille inférieure à 100 nm, avec une efficacité d’encapsulation de 76 % de la charge utile protéique souhaitée.
Protocole
1. Synthèse d’un réticulant sensible à l’oxydoréduction
- Ajouter du chlorhydrate de méthacrylate de 2-aminoéthylique (44,79 mg, 0,270 mmol) et 0,063 mL de triéthylamine à 3 mL de dichlorométhane anhydre et laisser mélanger pendant 20 min sous un gazN2 inerte dans une fiole à fond rond de 25 mL.
- Dissoudre 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-Hexadécaoxa-28,29-dithiahexapentapentacontanedioïque (100 mg, 0,045 mmol) dans 1 mL de dichlorométhane anhydre et l’ajouter dans la fiole.
- Ajouter 4 mL de dichlorométhane anhydre dans la fiole. Enveloppez le ballon de réaction dans du papier d’aluminium et laissez-le mélanger sous N2 à température ambiante.
- Confirmer la formation du produit par chromatographie sur couche mince. Assurez-vous que les références sont correctes pour le matériau de départ tout en confirmant la formation du produit par cette méthode.
- La chromatographie sur couche mince est une méthode basée sur l’affinité utilisée pour séparer les composés souhaités du mélange réactionnel. Ici, utilisez la plaque de silice hautement polaire et adsorbante comme phase stationnaire. Placer l’échantillon de matériau de départ et l’échantillon de mélange réactionnel à une extrémité de la plaque de silice et les placer verticalement dans un bécher en verre fermé avec l’éluant (phase mobile : 5 % de méthanol : dichlorométhane).
- Par capillarité, la phase mobile se déplace vers le haut de la plaque de silice et les composés de l’échantillon migrent à des distances variables en fonction de leurs affinités pour les phases stationnaire et mobile. Lorsque le front du solvant a traversé les 3/4ème de la plaque, retirez la plaque et séchez-la. Les composés séparés apparaissent sous forme de taches sur la plaque. Quantifier le coefficient de rétention (Rf) du composé souhaité comme la distance parcourue par le composé/la distance parcourue par le solvant. Ici, Rf du produit était de 0,35. La lumière UV ou la coloration peuvent être utilisées pour visualiser les taches (permanganate de potassium).
- Concentrer le mélange sous vide et le purifier par chromatographie sur colonne flash (mélange isocratique de méthanol à 5 % : dichlorométhane)36. Introduire le mélange réactionnel sur le dessus d’une colonne de verre remplie de silice (phase stationnaire), puis éluer avec le système de solvant (phase mobile)36. Recueillir toutes les fractions et effectuer le dosage à l’aide de la CCM pour distinguer les fractions de produit à l’aide de la valeur Rf précédemment déterminée.
- Concentrez les fractions purifiées en évaporant le solvant à l’aide d’un évaporateur rotatif (température : 40 °C), réglez la pression du vide sur la pression atmosphérique pour éliminer d’abord le dichlorométhane à faible point d’ébullition. Lorsque le niveau du solvant cesse de diminuer, réglez la pression de vide à 337 mbar pour éliminer le méthanol et obtenir une huile jaune pâle, qui sera ensuite soumise à une caractérisation plus poussée pour confirmer la formation du produit37.
- Effectuer une analyse infrarouge à transformée de Fourier (FT-IR)38, une analyse RMN 1H (dans le diméthylsulfoxyde deutéré [DMSO-d 6))39, une analyse RMN 13C39 et une analyse du temps de vol par désorption/ionisation laser assistée par matrice (MALDI-ToF)40 pour confirmer la formation du produit avant d’effectuer les étapes suivantes.
- Pour l’analyse FT-IR, chargez 1 mg d’huile sur l’instrument pour obtenir les spectres.
- Pour les analyses RMN, dissoudre à nouveau 10 mg du produit dans 0,75 mL du solvant RMN approprié, transférer dans un tube RMN et fermer hermétiquement pour éviter les fuites. Chargez l’échantillon sur l’instrument RMN, après quoi les spectres sont obtenus39.
- Pour l’analyse par spectrométrie de masse, sceller 1 mg du produit dans un flacon, le dissoudre dans du DMSO et le charger sur l’instrument.
REMARQUE : L’analyse infrarouge fournit des informations concernant les groupes fonctionnels clés du produit souhaité, à savoir les étirements carbonyles (C=O) identifiés par le pic aigu à 1650 cm-1 indiquant la formation de la liaison amide, mettant ainsi en évidence la formation du produit. La RMN 1H et la RMN 13C fournissent des informations sur les environnements chimiques et peuvent ainsi être utilisées pour déterminer la composition chimique du produit souhaité via l’identification des environnements chimiques présents dans le composé. Enfin, l’utilisation de la spectrométrie de masse permet de vérifier la masse exacte du produit souhaité.
2. Tester le clivage de l’agent de réticulation disulfure avec du glutathion
- Incuber l’agent de réticulation sulfure (jusqu’à une concentration finale de 4,55 mg/mL) avec l’agent réducteur glutathion (DHG final : 10 mM), jusqu’à un volume final de 1 mL, pendant 24 h dans un flacon en verre de 1,5 mL.
- Pour confirmer le clivage de l’agent de liaison disulfure, soumettre le flacon à l’analyse MALDI-ToF26,40.
3. Synthèse de nanogels sensibles à l’oxydoréduction
- Assurez-vous que toute la verrerie à utiliser pour la réaction est exempte de poussière en lavant avec de l’eau désionisée filtrée (0,20 μm), puis en séchant la verrerie à l’aide d’air comprimé accessible via le service d’air comprimé sur le côté de la hotte. Fixez une buse sécurisée à la sortie d’air comprimé pour faciliter l’accès. Tenez fermement le flacon et positionnez-y la buse. Activez l’air comprimé en libérant un flux contrôlé dans le flacon. Observez le processus pour assurer un séchage efficace, en vérifiant s’il ne reste pas de contaminants ou d’humidité.
- Préparez un flacon en verre de 10 ml en le remplissant d’eau désionisée et scellez le ballon avec un septum en caoutchouc. Désoxygénez l’eau en faisant bouillonner N2 à travers celle-ci pendant au moins 30 minutes avant de commencer la réaction. Pour ce faire, remplissez un ballon avec du gaz N2 et attachez une aiguille au ballon ; Placez-le sur le septum et utilisez l’aiguille pour percer le septum en caoutchouc et permettre à N2 de s’écouler. Fixer une aiguille de sortie sur le ballon pour assurer un débit constant de N2.
- Dissoudre l’albumine sérique bovine (BSA ; 2 mg, 30 nmol) ou la BSA marquée Cy7 (2 mg, 30 nmol) dans 1 mL d’eau déminéralisée désoxygénée et l’ajouter à un autre flacon en verre propre de 10 mL.
- Ajouter la solution de chlorure de [2-(acryloyloxy)éthyl]triméthylammonium (AETC) (12,00 mg/10,86 μL, 0,060 mmol) dans la fiole et la sceller à l’aide d’un autre septum en caoutchouc. Assurez-vous que le mélange réactionnel est maintenu sous un flux constant de gaz N2 et agitez pendant 30 min.
- Dissoudre l’acrylamide (9,21 mg, 0,13 mmol) dans 1 mL d’eau déminéralisée désoxygénée et l’ajouter au mélange dans le flacon.
- Dissoudre l’agent de réticulation disulfure (4,44 mg, 0,004 mmol) dans 1 mL d’eau désionisée et l’ajouter au mélange dans le flacon. Rincer le mélange avec du gaz N2 pendant 20 min.
- Dissoudre le dodécylsulfate de sodium (2 mg, 0,007 mmol) dans 1 mL d’eau déminéralisée désoxygénée et l’ajouter au mélange à l’aide d’une seringue à rinçage de gaz N2 et remuer le mélange pendant 30 min.
REMARQUE : En rinçant la seringue avec du N2 , nous minimisons l’exposition du mélange réactionnel à l’oxygène de l’atmosphère, ce qui peut inhiber la réaction de polymérisation radicalaire. - Ajouter la N,N,N',N'-tétraméthyléthylènediamine (1,5 μL, 0,010 mmol) et laisser le mélange réactionnel se désoxygéner pendant 3 minutes sous gazN2 .
- Dissoudre le persulfate d’ammonium (1 mg, 0,004 mmol) dans 1 mL d’eau déminéralisée désoxygénée et l’ajouter au mélange réactionnel. Assurez-vous que le gaz N2 bouillonne dans le mélange réactionnel pendant 10 min.
REMARQUE : Si l’étape d’addition N2 est omise, il est probable que des particules blanches se forment dans le ballon de réaction. Il s’agit de particules et/ou d’agrégats de plus grande taille qui peuvent confondre toute caractérisation ultérieure. - Fermer le ballon sous une atmosphère N2 et laisser agir 3 h et 30 min à température ambiante.
- Pour mettre fin à la réaction, retirez le sceau de la fiole et laissez le mélange réactionnel remuer pendant au moins 10 min. Cela exposerait le mélange réactionnel à des niveaux atmosphériques de gazO2 , qui éteindrait ensuite tous les radicaux restants dans le mélange réactionnel. La réaction se termine lorsque le mélange prend un aspect bleu opalescent clair.
- Afin de purifier les nanogels, ajoutez le mélange réactionnel dans une unité de filtration centrifuge de 15 mL (100 kDa MWCO) et ajoutez de l’eau désionisée pour remplir l’unité centrifuge. Centrifuger le mélange réactionnel à 1000 x g pendant 10 min. Cela permettra d’éliminer tous les produits chimiques n’ayant pas réagi (ou la charge utile non encapsulée) qui sont inférieurs à 100 kDa et de concentrer l’échantillon de nanogel.
- Une fois que le niveau d’eau dans l’unité centrifuge diminue, ajoutez 2 mL d’eau déminéralisée pour diluer l’échantillon de nanogel et centrifugez pour concentrer le produit. Répétez cette étape 3 fois.
- Stocker l’échantillon à une température de 2 à 8 °C pour éviter la dégradation de la protéine encapsulée.
- Effectuer une analyse FT-IR et RMN 1H (dans le diméthylsulfoxyde deutéré [DMSO-d 6]) pour confirmer la polymérisation39,41. Pour préparer l’échantillon, lyophiliser 1 mL de la solution de nanogel dans un flacon de 1,5 mL. Le processus de lyophilisation consiste à congeler l’échantillon, puis à appliquer un vide pour éliminer le solvant gelé par sublimation, laissant derrière lui un résidu en poudre. Après la lyophilisation, dissoudre à nouveau l’échantillon dans le solvant RMN approprié, le transférer dans un tube RMN et le fermer hermétiquement. Chargez l’échantillon sur l’appareil RMN, comme décrit précédemment39. Pour l’analyse FT-IR, 1 mg de poudre sèche doit être chargé sur l’instrument pour obtenir les spectres.
4. Caractérisation morphologique des nanogels
- Diffusion dynamique de la lumière (DLS)
REMARQUE : Le diamètre hydrodynamique (nm), l’indice de polydispersité (PI) et le potentiel zêta ont été mesurés à 25 °C, à une longueur d’onde laser de 632,8 nm et à un détecteur de signal de 173° à l’aide d’une machine DLS. Chaque exécution a mesuré 25 cycles de sous-balayage.- Mesure de la taille hydrodynamique (nm)
- Préparez une cuvette ou une cellule capillaire pliée jetable en la nettoyant avec de l’eau déminéralisée filtrée. Soufflez de l’air comprimé dans la cuvette (adaptée aux mesures de potentiel DLS et zêta) pour vous assurer qu’elle est exempte de grosses particules de poussière.
- Remplissez la cuvette avec au moins 50 à 100 μL de l’échantillon et diluez-le dans 750 à 1000 μL d’eau déminéralisée filtrée. Lors de l’utilisation d’une cuvette à potentiel zêta, assurez-vous que la cuvette a été remplie d’échantillon sans formation de bulles, ce qui peut perturber les mesures.
- Placez la cuvette à l’intérieur de l’instrument DLS, en vous assurant qu’elle a été correctement insérée. Pour ce faire, ouvrez le couvercle du compartiment à échantillons de l’instrument DLS. Tenez la cuvette par ses bords supérieurs pour éviter les empreintes digitales sur les fenêtres optiques. Assurez-vous que la cuvette est correctement insérée dans le support de cuvette, en vous assurant qu’elle est de niveau et alignée avec le chemin optique de l’instrument. Fermez le compartiment à échantillon pour éviter les interférences de la lumière ambiante.
REMARQUE : Le média de dilution est filtré à l’aide d’un filtre à seringue de taille de pores de 0,45 μm. - Cliquez pour démarrer la mesure de la taille des particules sur le logiciel de la machine DLS correspondant.
- Sélectionnez les résultats correspondant à l’échantillon pour obtenir la moyenne z (taille moyenne des particules), le PI moyen, le nombre de kilocomptes par seconde (kcps), le potentiel zêta et les graphiques pertinents. Assurez-vous que la fonction de corrélation présente une courbe sigmoïdale lisse, car cela suggère un échantillon uniforme.
- Une fois l’analyse terminée, retirez la cuvette du DLS.
- Mesure de la taille hydrodynamique (nm)
- Microscopie électronique à transmission (MET)
- Préparez les échantillons en plaçant 10 μL de la solution de nanoparticules (0,077 mg/mL) sur des grilles de cuivre recouvertes de carbone. Sécher à l’air libre à température ambiante pendant 1 h.
- Lavez les grilles avec de l’eau déminéralisée filtrée et teignez avec 5 μL d’acétate d’uranyle filtré à 1 % dans de l’eau pendant 2 min.
- Après avoir trempé l’excès de colorant avec du papier filtre, séchez les grilles pendant la nuit à température ambiante. Capturez des images TEM le lendemain à un grossissement de 45 000x à l’aide d’une caméra à champ clair.
- Utilisez le logiciel fourni pour le traitement d’images (résolution : 2048 x 2048 pixels).
5. Quantification de protéines (BSA) encapsulées dans les nanogels à l’aide d’un dosage d’acide micro-bicinchoninique (BCA)
- Selon le protocole de dosage des microBCA (indiqué sur le site Web du fabricant), générez une courbe standard basée sur une concentration protéique prédéfiniede 42.
- Après leur synthèse, purifier les nanogels encapsulant des protéines à l’aide d’unités de filtration centrifuge de 15 mL avec 100 kDa de MWCO (1000 x g, 10 min) comme décrit aux étapes 3.12 à 3.14.
- Collecter le filtrat et l’analyser à l’aide du dosage des microBCA (protocole disponible sur le site du fabricant). Mesurer l’absorbance à 562 nm à l’aide d’un lecteur de plaques. Comme cette mesure est corrélée à la concentration de protéines non encapsulées, déterminez la masse de la protéine encapsulée. Pour calculer le % d’efficacité d’encapsulation (EE), utilisez l’équation suivante :
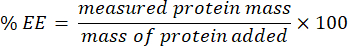
6. Quantification de la libération de protéines par les nanogels en présence de glutathion
- Incuber 200 μL de 5 mg/mL de nanogels chargés de Cy7BSA avec 200 μL de 10 mM de glutathion (GSH) dans les unités de filtration centrifuge de 0,5 mL (100 kDa MWCO). Placez les unités de filtration dans un bain-marie pour maintenir la température à 37 °C.
- Centrifuger à 1000 x g pendant 3 min toutes les 10 min pendant au moins 1 h - puis toutes les 2 à 8 h.
- Prélever le filtrat et l’utiliser pour une analyse plus approfondie. Maintenir le volume du filtrat à l’intérieur des unités de filtration centrifuge à 500 μL en ajoutant plus d’eau désionisée ou de PBS.
- Mesurez la quantité de protéines dans les filtrats en vous référant à une courbe standard pour les nanogels chargés de Cy7BSA, où l’absorbance de la protéine fluorescente a été mesurée à l’aide d’un instrument nanodrop à 750 nm.
REMARQUE : Cette courbe standard peut être calculée en préparant des dilutions en série de Cy7BSA dans la plage de 0 mg/mL à 2 mg/mL. Les valeurs obtenues à partir de la nanogoutte peuvent être interpolées par rapport à cette courbe d’étalonnage pour déterminer l’efficacité de l’encapsulation.
Résultats
Synthèse et caractérisation d’un diacrylate de disulfure de poly(éthylène glycol) (PEG) Le réticulant sensible à l’oxydoréduction a été synthétisé par la substitution nucléophile d’un ester de N-hydroxysuccinimide (NHS) par le méthacrylate de 2-aminoéthyle via la formation d’une liaison amide (Figure 1). La synthèse du produit requis a été validée principalement par RMN 1H (figure supplé...
Discussion
La demande croissante de produits biologiques spécifiques à une cible dans l’industrie biopharmaceutique a entraîné le besoin de technologies capables d’améliorer leurs profils pharmacologiques in vivo, tout en prévenant leur dégradation physiologique rapide et en compensant tout effet secondaire indésirable. Dans cet esprit, une procédure simple pour la synthèse de nanogels chargés de protéines est décrite. Comme indiqué dans le protocole, l’agent de réticu...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer. Il n’y a aucun détail financier à déclarer.
Remerciements
Nous remercions le département de chimie de l’Imperial College de Londres et l’Institut des sciences de la vie du Conseil de recherches médicales pour leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
Références
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935 (2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038 (2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181 (2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016 (2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon