このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
水性ワンステップ架橋法とコナノ重合法による刺激応答性ナノゲルの合成
要約
ナノゲルは、生物製剤の送達のための優れた汎用性の高いナノ粒子プラットフォームです。タンパク質ベースのペイロードをカプセル化できる刺激応答性ポリ(エチレン)グリコールベースの高分子ナノゲルを、水性条件下でのワンステップ架橋コナノ重合戦略を使用して合成しました。これらの新規ナノ粒子の最適な作製と特性評価について、以下で紹介します。
要約
架橋高分子ナノ粒子からなるナノゲルは、その汎用性の高いボトムアップ合成と生体適合性により、数多くの化学的および生物学的治療薬の送達のために開発されてきました。ナノゲル合成にはこれまでさまざまな方法が採用されてきましたが、生物学的ペイロードの完全性を損なう可能性のある刺激の強い有機溶媒や高温を使用せずにそれを達成した方法はほとんどありません。対照的に、ここで紹介する方法論は、穏やかな反応条件を使用して、100 nm未満のサイズのタンパク質を充填したナノゲルの合成を達成します。ここでは、水性ベースのシングルステップ架橋共重合技術を使用して合成されたナノゲル内のタンパク質ベースのペイロードの非共有結合カプセル化の方法を紹介します。この技術では、最初にタンパク質ベースのペイロードをカチオン性第四級アンモニウムモノマーに静電結合し、同時に過硫酸アンモニウムと N,N,N',N'-テトラメチルエチレンジアミンを使用して架橋および共重合して、タンパク質ペイロードをトラップするナノゲルを形成します。ナノゲルのサイズと多分散指数は動的光散乱(DLS)を使用して決定され、表面形態は透過型電子顕微鏡(TEM)によって評価されます。ナノゲル内に閉じ込められたタンパク質の質量は、カプセル化効率を計算することによって決定されます。さらに、酸化還元応答性構造要素の段階的な分解によるナノゲルの放出制御能力も、バイオリダクションアッセイで評価されます。この手法を使用したナノゲルの合成と特性評価のすべての注意点を示すために、ナノ粒子最適化データの例を提供します。一般に、平均サイズ57nmおよび多分散指数値0.093で、均一サイズのナノゲルが得られました。76%という高い封止効率を達成しました。さらに、ナノゲルは、グルタチオンの存在下で48時間にわたって新規の酸化還元応答性成分が徐々に分解することにより、カプセル化されたタンパク質の最大86%の制御された放出を示しました。
概要
ナノゲルは、架橋されたポリマーネットワーク構造を持つ3次元のサブミクロンサイズのハイドロゲルであり、形態学的完全性に影響を与えることなく、コアシェル内に大量の流体を保持できます1。一般に、ナノゲルは、油中水型逆マイクロエマルジョン2,3のような不均一なコロイド系における物理的または化学的架橋による機能性モノマーの重合によって合成される。両親媒性共重合体は、水性環境下でナノスケールの構造に自己組織化することができます。ただし、ジスルフィドまたはアミドベースのカップリングを含む化学的架橋戦略、クリックケミストリーを使用して安定化させるか、物理的に誘導(疎水性、静電、または水素結合戦略)または光誘起4。これらの戦略の中で、ポリマーの物理的自己組織化とそれに続く化学的架橋は、成功したナノゲル製造技術として報告されています5。歴史的には、最初のナノゲルは1990年代にVingradovら6、秋吉ら7、Lemieuxら8によって導入されましたが、最近では、天然ポリマーと合成ポリマーの両方で構成されるさまざまなスマートナノゲルが開発され、多様な生物医学的応用が検討されています9。
ナノゲルは、広範な貨物保持能力、大きな表面積、生体内安定性、ならびにカスタマイズ可能な化学的および機械的特性を有する10。ナノゲルの合成もスケーラブルであり、水性ベースにすることができます。さらに、ナノゲルの強化された含水量は、ナノゲルを敏感な生物学的ペイロードの効果的な担体にする11。さらに、表面積が大きいため、複数のバイオコンジュゲーションのニーズを満たすことができるため、ターゲティングモダリティをアタッチしてアクティブターゲティングが可能になります。特に、ナノゲル設計の汎用性により、広範囲の刺激応答性モノマーを使用することができ、これにより、それらの物理化学的特性9の精密な制御が可能になる。このユニークなエンジニアリング性により、従来使用されていたリポソーム、ミセル、またはポリメロソーム12,13では達成が困難であったナノゲル設計の合理的な改善が可能になる。特別に設計されたモノマー内に刺激応答性部分を組み込むことにより、ナノゲルは、pH、酸化還元条件、酵素などのさまざまな生理学的に関連する刺激に応答してペイロードの制御された放出を誘発するように設計することができる9,14。このようなスマートナノゲルは、従来のナノゲルよりも有用であり、なぜなら、それらは、拡張された血液循環に対して優れた安定性を有し、そして、それらの貨物の完全性を維持し、所望の標的部位におけるその制御された放出を媒介するための生理学的条件に耐えることができるからである15。実際、ナノゲルは、その汎用性の高い性質により、生物医学分野での牽引力を獲得しており、多数のセラノスティクスおよび診断アプリケーションのための刺激応答性ナノゲルの開発において顕著な進歩を遂げています2,16,17。
生物製剤は、タンパク質、ペプチド、および/または核酸からなる医薬品のカテゴリーを代表することができ、その驚くべき選択性により治療環境に革命をもたらし、それによって最も急速に成長している治療薬のクラスになりました18。実際、このような治療薬の市場が拡大していることは、2023年に米国連邦医薬品協会(FDA)による承認が急増したことからも明らかで、生物学的製剤は全医薬品承認の~40%を占めています19。その特異性と効力に加えて、新規創薬標的の迅速な発見、より効率的なバイオエンジニアリングプロセス、およびこれらの治療薬の 生体内 運命に関する知識の深化により、それらの使用が増加しています20。従来の生物製剤には、干渉RNA、置換タンパク質、サイトカイン、ホルモンなどがあり、これらは通常、組換えDNA技術を用いて生成される21。1982年にヒト組換えインスリンが承認されて以来、がん(トラスツズマブ、アベルマブなど)、炎症性腸疾患(アダリムマブ、セルトリズマブなど)、まれな遺伝性疾患(ミポメルサン、ミオザイム、アルデュラザイム、ファブラザイムなど)など、多くの疾患に対して生物学的製剤が開発されてきた21。生物製剤とその標的との相互作用の高い特異性は、理論的にはオフターゲット効果を相殺するはずですが、望ましくない副作用に関連するそれらの使用にはいくつかの臨床的懸念が浮上しています22。これらの副作用は、誇張された薬理学(標的の過剰刺激)と免疫原性の2つのカテゴリーに分類できます。さらに、半減期が短い、バイオアベイラビリティが限られている、プロテアーゼによる損傷、保存期間が短い、および高価な製造プロセスが、治療上の利点を制限しています21。これらの問題を緩和する従来の方法は、これらの生物製剤の共有結合的修飾を含み、それがそれらの機能、したがって有効性を損なう可能性がある23。あるいは、治療用ペイロードをカプセル化するナノメディシンアプローチは、薬理学的特性、最も重要なことに、強化された浸透および保持(EPR)効果24を介して炎症部位への受動的標的化に多くの利点を与えることができる。他のナノ粒子関連の利点には、循環時間の延長、クリアランス率の低下、製剤の柔軟性の向上、血管系の透過性および細胞取り込みの改善が含まれる可能性がある25。現在、生物学的ペイロードの送達のために多種多様なナノ粒子製剤が研究されていますが、ナノゲルの多機能性を模倣できるものはほとんどありません。実際、ナノゲルは、リポソームおよびミセルベースのナノ粒子によって達成される負荷容量を超えており、ほとんどの無機ナノ粒子よりも高いコロイド安定性を示します。このように、ナノゲルは、さまざまな生物学的治療薬の送達のための貴重なプラットフォームを提供します。
我々はこれまでに、新規のマトリックスメタロプロテイナーゼ応答性架橋高分子ナノゲル内に抗酸化酵素を送達することに成功しており、そこでは、使用された穏やかなカプセル化戦略により、放出時にタンパク質の生理活性が維持された26。この研究では、タンパク質ベースのペイロードの送達のための酸化還元応答性ナノゲルの最適化された合成を実証します。特に、この合成法により、刺激の強い有機溶媒や高温を使用せずに、温和な条件で目的のペイロードをカプセル化したナノゲル合成が可能になります。我々は、細胞内環境内の酸化還元恒常性を利用して、カプセル化されたペイロード27,28の放出を調節した。通常、自然に豊富な抗酸化グルタチオン(GSH)は、その濃度がそれぞれ2〜20μMから1〜10mMの範囲である細胞外および細胞内の酸化還元電位を制御します29,30。現在までに、多数の酸化還元感受性ナノ粒子が報告されており、これはin vivoでの薬物の制御放出を可能にする実証済みの信頼性の高い戦略となっています27,28。実際、ジスルフィド結合は、ジスルフィド含有架橋剤31,32、ジスルフィド含有モノマー33からの生分解性ポリマーの自己組織化、および酸化還元応答性ポリマープロドラッグまたは薬物/ポリマーコンジュゲート34,35を使用して、高分子ナノ材料内に設置されています.したがって、この研究では、高分子ナノ粒子内に独自の高GSH感受性ジスルフィド架橋剤が組み込まれ、カプセル化されたタンパク質ペイロードの制御された放出を可能にすることを調査しています。
この研究では、ナノゲルの設計は、特異性とペイロード送達に対処するための次の基準を中心に行われました:内皮の効率的な浸透と in vivo 安定性を確保するための、小さなサイズ(~100 nm)と均一なサイズ分布(多分散指数(PI)<0.3)27;タンパク質ペイロードの効率的なカプセル化、およびGSHに応答したペイロードの制御された放出。我々は、所望のタンパク質ペイロードの76%のカプセル化効率で、均質なサブ100nmサイズのナノ粒子を示したGSH応答性架橋ナノゲルの合成を報告する。
プロトコル
1. 酸化還元応答性架橋剤の合成
- 2-アミノエチルメタクリレート塩酸塩(44.79 mg、0.270 mmol)と0.063 mLのトリエチルアミンを3 mLの無水ジクロロメタンに加え、25 mLの丸底フラスコ中の不活性N2 ガス下で20分間混合します。
- 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-ヘキサデカオキサ-28,29-ジチアヘキサペンタコンタン二酸ジ-N-スクシンイミジルエステル(100mg、0.045mmol)を無水ジクロロメタン1mLに溶解し、フラスコに加える。
- フラスコに無水ジクロロメタン4mLを加えます。反応フラスコをアルミホイルで包み、室温でN2 の下で撹拌する。
- 薄層クロマトグラフィーによる生成物の形成を確認します。この方法による製品形成を確認する際には、出発物質の正しい参照を確認してください。
- 薄層クロマトグラフィーは、反応混合物から目的の化合物を分離するために使用される親和性ベースの方法です。ここでは、高極性で吸着性のシリカプレートを固定相として使用します。出発物質サンプルと反応混合物サンプルをシリカプレートの一端にスポットし、溶離液(移動相:5%メタノール:ジクロロメタン)を入れた閉じたガラスビーカーに垂直に置きます。
- 毛細管現象により、移動相はシリカプレートを上に移動し、サンプル化合物は固定相と移動相の親和性に応じてさまざまな距離を移動します。溶剤の前面がプレートの3/4th を横切ったら、プレートを取り外して乾燥させます。分離された化合物は、プレート上にスポットとして現れます。目的の化合物の保持係数(Rf) を、化合物の移動距離/溶媒の移動距離として定量化します。ここで、製品のRf は0.35でした。UV光または染色を使用して、スポット(過マンガン酸カリウム)を視覚化できます。
- 混合物を 真空中で 濃縮し、フラッシュカラムクロマトグラフィー(5%メタノールのアイソクラティック混合物:ジクロロメタン)36で精製する。反応混合物をシリカ充填ガラスカラム(固定相)の上部に導入し、次いで溶媒系(移動相)で溶出する36。すべての画分を収集し、TLCを使用してアッセイし、以前に決定されたRf値 を使用して製品画分を区別します。
- 精製した画分をロータリーエバポレーター(温度:40°C)で溶媒を蒸発させて濃縮し、真空圧を大気圧にして低沸点のジクロロメタンを先に除去します。溶媒のレベルの低下が止まったら、真空圧を337mbarに設定してメタノールを除去し、淡黄色の油を得る。その後、生成物の形成を確認するためにさらに特性評価を行う37。
- フーリエ変換赤外(FT-IR)分析38、1H NMR(重水素化ジメチルスルホキシド(DMSO-d 6)中)39、13C NMR39およびマトリックス支援レーザー脱離イオン化飛行時間型(MALDI-ToF)40分析を実施して、次のステップを実行する前に製品形成を確認します。
- FT-IR分析では、1 mgのオイルを装置にロードしてスペクトルを取得します。
- NMR分析では、製品10 mgを関連するNMR溶媒0.75 mLに再溶解し、NMRチューブに移して漏れを防ぐためにしっかりと密封します。サンプルをNMR装置にロードし、その後、スペクトルが得られる39。
- 質量分析では、1 mgの製品をバイアルに密封し、DMSOに溶解して装置にロードします。
注:赤外線分析は、目的の製品の主要な官能基に関する情報を提供します、すなわち、1650 cm-1 の鋭いピークによって識別されるカルボニル伸長(C = O)は、アミド結合の形成を示し、それによって製品の形成を強調します。 1H NMRおよび 13Cは、化学環境に関する情報を提供するため、化合物中に存在する化学環境の同定を通じて、目的の製品の化学組成を決定するために使用できます。最後に、質量分析を使用することで、目的の製品の正確な質量を確認することができます。
2. グルタチオンによるジスルフィド架橋剤の切断試験
- ジスルフィド架橋剤(最終濃度4.55 mg/mL)と還元剤グルタチオン(最終[GSH]:10 mM)を最終容量1 mLまで、1.5 mLガラスバイアル中で24時間インキュベートします。
- ジスルフィドリンカーの切断を確認するために、バイアルをMALDI-ToF分析26,40に提出する。
3. 酸化還元応答性ナノゲル合成
- 反応に使用するすべてのガラス器具に粉塵がないことを確認するには、ろ過した(0.20μm)脱イオン水で洗浄し、その後、ヒュームフードの側面にある圧縮空気ユーティリティからアクセスできる圧縮空気を使用してガラス器具を乾燥させます。圧縮空気出口に安全なノズルを取り付けて、アクセスを容易にします。バイアルをしっかりと持ち、ノズルをバイアルに配置します。圧縮空気を活性化し、制御された流れをバイアルに放出します。効果的な乾燥を確保するためのプロセスを観察し、残留する汚染物質や水分を確認します。
- 10mLのガラスバイアルを脱イオン水で満たして調製し、フラスコをゴム製のセプタムで密封します。反応を開始する前に、少なくとも30分間、水にN2 をバブリングして水を脱酸素します。これを行うには、バルーンにN2 ガスを満たし、バルーンに針を取り付けます。それを中隔に置き、針を使用してゴム製の中隔を突き刺し、N2 の流れを待ちます。フラスコに出口針を取り付けて、N2の流れが一定になるようにします。
- ウシ血清アルブミン(BSA;2 mg、30 nmol)またはCy7タグ付きBSA(2 mg、30 nmol)を1 mLの脱酸素脱イオン水に溶解し、別の清潔な10 mLガラスバイアルに加えます。.
- [2-(アクリロイルオキシ)エチル]トリメチルアンモニウムクロリド(AETC)溶液(12.00 mg / 10.86 μL、0.060 mmol)をフラスコに加え、別のゴム製セプタムを使用して密封します。.反応混合物がN2 ガスの一定の流れの下に保たれていることを確認し、30分間攪拌します。
- アクリルアミド(9.21mg、0.13mmol)を1mLの脱酸素脱イオン水に溶解し、バイアル内の混合物に加えます。
- ジスルフィド架橋剤(4.44 mg、0.004 mmol)を1 mLの脱イオン水に溶解し、バイアル中の混合物に加えます。混合物をN2 ガスで20分間洗い流します。
- ドデシル硫酸ナトリウム(2mg、0.007mmol)を1mLの脱酸素脱イオン水に溶解し、N2 ガス洗浄シリンジを介して混合物に加え、混合物を30分間攪拌します。
注:シリンジをN2 で洗い流すことにより、ラジカル重合反応を阻害する可能性のある大気中の酸素への反応混合物の曝露を最小限に抑えます。 - N、N、N'、N'-テトラメチルエチレンジアミン(1.5μL、0.010mmol)を加え、反応混合物をN2ガス下で3分間脱酸素化させます。
- 過硫酸アンモニウム(1 mg、0.004 mmol)を1 mLの脱酸素脱イオン水に溶解し、反応混合物に加えます。.N2 ガスが反応混合物中を10分間泡立っていることを確認します。
注:N2 添加ステップを省略すると、反応フラスコに白い粒子が形成される可能性があります。これらはより大きなサイズの粒子や凝集体であり、それ以上の特性評価を混乱させる可能性があります。 - フラスコをN2 雰囲気下で密封し、室温で3時間30分撹拌します。
- 反応を終了するには、フラスコからシールを取り外し、反応混合物を少なくとも10分間攪拌します。これにより、反応混合物は大気レベルのO2 ガスにさらされ、反応混合物に残っているラジカルが急冷されます。混合物が透明な青色の乳白色の外観を呈すると、反応は終了します。
- ナノゲルを精製するために、反応混合物を15 mL遠心フィルターユニット(100 kDa MWCO)に加え、脱イオン水を加えて遠心ユニットを満たします。反応混合物を1000 x g で10分間遠心分離します。これにより、100 kDa未満の未反応の化学物質(またはカプセル化されていないペイロード)が除去され、ナノゲルサンプルが濃縮されます。
- 遠心ユニット内の水位が減少したら、2 mLの脱イオン水を加えてナノゲルサンプルを希釈し、遠心分離して製品を濃縮します。この手順を3回繰り返します。
- カプセル化されたタンパク質の分解を防ぐために、サンプルを2〜8°Cで保存します。
- FT-IRおよび1H NMR(重水素化ジメチルスルホキシド(DMSO-d 6))分析を実施して、重合を確認します39,41。サンプルを調製するには、1.5 mLのバイアルに1 mLのナノゲル溶液を凍結乾燥します。凍結乾燥プロセスでは、サンプルを凍結した後、真空を適用して凍結した溶媒を昇華させて除去し、粉末状の残留物を残します。凍結乾燥後、サンプルを関連するNMR溶媒に再溶解し、NMRチューブに移してしっかりと密封します。前述したように、サンプルをNMR装置にロードする39。FT-IR分析では、1 mgの乾燥粉末を装置にロードしてスペクトルを取得する必要があります。
4. ナノゲルの形態学的特性評価
- 動的光散乱(DLS)
注:流体力学的直径(nm)、多分散指数(PI)、およびゼータ電位は、DLSマシンを使用して25°C、632.8nmレーザー波長、および173°信号検出器で測定されました。各ランでは、25回のサブスキャンサイクルを測定しました。- 流体力学的サイズ(nm)測定
- キュベットまたは使い捨ての折り畳み毛細血管セルをろ過した脱イオン水で洗浄して調製します。圧縮空気をキュベット(DLSとゼータ電位測定の両方に適しています)に吹き込み、大きな粉塵粒子がないことを確認します。
- キュベットに少なくとも50〜100μLのサンプルを入れ、750〜1000μLのろ過脱イオン水で希釈します。ゼータ電位キュベットを使用する際は、キュベットにサンプルが充填されており、測定に支障をきたす可能性のある気泡が発生していないことを確認してください。
- キュベットをDLS機器の内側に入れ、正しく挿入されていることを確認します。これを行うには、DLS装置のファイルコンパートメントカバーを開きます。光学窓に指紋がつかないように、キュベットの上端を持ってください。キュベットがキュベットホルダーに正しく装着されていることを確認し、キュベットが水平で機器の光路と位置合わせされていることを確認してください。サンプルコンパートメントを閉じて、周囲光の干渉を防ぎます。
注:希釈媒体は、0.45μmの孔径シリンジフィルターを使用してろ過されます。 - クリックして、関連するDLSマシンソフトウェアで粒子サイズ測定を開始します。
- サンプルに対応する結果を選択して、z平均(平均粒子サイズ)、平均PI、キロカウント/秒(kcps)、ゼータ電位、および関連するグラフィックを取得します。相関関数が滑らかなシグモイド曲線を示すことを確認します。これは、サンプルが均一であることを示唆しています。
- 分析が完了したら、DLSからキュベットを取り外してください。
- 流体力学的サイズ(nm)測定
- 透過型電子顕微鏡(TEM)
- 10 μLのナノ粒子溶液(0.077 mg/mL)を炭素被覆銅グリッド上に置いてサンプルを調製します。室温で1時間風乾します。
- グリッドをろ過した脱イオン水で洗浄し、ろ過した1%酢酸ウラニル5μLを水に溶かして2分間染色します。
- 余分な染色剤を濾紙に浸した後、グリッドを室温で一晩乾燥させます。翌日、明視野カメラを使用して45,000倍の倍率でTEM画像をキャプチャします。
- 画像処理には付属のソフトウェア(解像度:2048×2048ピクセル)を使用してください。
5. マイクロビシンコニン酸(BCA)アッセイを用いたナノゲル内包タンパク質(BSA)の定量
- microBCAアッセイプロトコル(製造元のウェブサイトに記載)に従って、事前に定義されたタンパク質濃度42に基づいて標準曲線を生成します。
- 合成後、ステップ3.12-3.14で説明したように、100 kDa MWCO(1000 x g、 10分)の15 mL遠心フィルターユニットを使用して、タンパク質カプセル化ナノゲルを精製します。
- 濾液を採取し、microBCAアッセイ(プロトコールはメーカーのウェブサイトで入手可能)を使用して分析します。プレートリーダーを使用して562nmでの吸光度を測定します。この測定値はカプセル化されていないタンパク質濃度と相関しているため、カプセル化されたタンパク質の質量を決定します。カプセル化効率 (EE) % を計算するには、次の式を使用します。
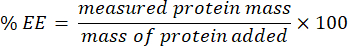
6. グルタチオン存在下でのナノゲルからのタンパク質放出の定量化
- 0.5 mL遠心フィルターユニット(100 kDa MWCO)で、200 μLの5 mg/mL Cy7BSA充填ナノゲルと200 μLの10 mMグルタチオン(GSH)をインキュベートします。フィルターユニットをウォーターバスに入れて、温度を37°Cに保ちます。
- 1000 x g で3分間、10分ごとに少なくとも1時間、その後2〜8時間ごとに遠心分離します。
- ろ液を採取し、さらなる分析に使用します。遠心フィルターユニット内の濾液の量を500μLに維持するには、脱イオン水またはPBSを追加します。
- Cy7BSAを充填したナノゲルの標準曲線を参照して、濾液中のタンパク質の量を測定し、蛍光タンパク質の吸光度を750 nmのナノドロップ装置を使用して測定します。
注:この標準曲線は、0 mg/mL から 2 mg/mL の範囲で Cy7BSA の段階希釈液を調製することで計算できます。ナノ滴から得られた値は、この検量線に対して補間して、カプセル化効率を決定することができます。
結果
ポリ(エチレングリコール)(PEG)ジスルフィドジアクリレート架橋剤の合成とキャラクタリゼー ション酸化還元応答性架橋剤は、 N-ヒドロキシスクシンイミド(NHS)エステルを2-アミノエチルメタクリレートに求核置換することにより、アミド結合の形成を介して合成されました(図1)。必要な製品の合成は、主に 1HNMR(
ディスカッション
バイオ医薬品業界における標的特異的バイオ医薬品の需要の高まりにより、in vivoの薬理学的プロファイルを改善しながら、急速な生理学的劣化を防ぎ、望ましくない副作用を相殺できる技術の必要性が高まっています。このことを念頭に置いて、タンパク質をロードしたナノゲルを合成するための簡単な手順について説明します。プロトコルに示されている?...
開示事項
著者には、開示すべき利益相反はありません。申告する財務上の詳細はありません。
謝辞
インペリアル・カレッジ・ロンドン化学科とMedical Research Council Institute of Life Sciencesのご支援に感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
参考文献
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935 (2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038 (2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181 (2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016 (2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved