Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Синтез стимул-чувствительных наногелей с использованием водного одноступенчатого сшивания и со-нанополимеризации
В этой статье
Резюме
Наногели являются отличной и универсальной платформой для наночастиц для доставки биологических препаратов. Чувствительные к стимулам полимерные наногели на основе полиэтиленгликоля, способные инкапсулировать полезные нагрузки на основе белка, были синтезированы с использованием одноступенчатой стратегии сшивки ко-нанополимеризации в водных условиях. Здесь представлены оптимальные схемы изготовления и характеристики этих новых наночастиц.
Аннотация
Наногели, состоящие из сшитых полимерных наночастиц, были разработаны для доставки многочисленных химических и биологических терапевтических средств благодаря их универсальному восходящему синтезу и биосовместимости. Несмотря на то, что на сегодняшний день для синтеза наногелей используются различные методы, очень немногие из них достигли этого без использования агрессивных органических растворителей или высоких температур, которые могут повредить целостность биологической нагрузки. В отличие от этого, представленная здесь методология обеспечивает синтез наногелей размером менее 100 нм, загруженных белком, с использованием мягких условий реакции. В данной работе мы представляем метод нековалентной инкапсуляции полезных нагрузок на основе белка в наногелях, которые были синтезированы с использованием одноступенчатой технологии сшивки на водной основе. В этом методе мы первоначально электростатически связываем полезную нагрузку на основе белка с катионным четвертичным мономером аммония и одновременно сшиваем и сополимеризуем ее с использованием персульфата аммония и N,N,N',N'-тетраметилэтилендимина с образованием наногелей, которые захватывают полезную нагрузку белка. Размер и показатель полидисперсии наногелей определяют с помощью динамического рассеяния света (DLS), а морфологию поверхности оценивают с помощью просвечивающей электронной микроскопии (ПЭМ). Масса белка, заключенного в наногелях, определяется путем расчета эффективности инкапсуляции. Кроме того, способность наногелей к контролируемому высвобождению за счет постепенной деградации редокс-чувствительных структурных элементов также оценивается в анализах биовосстановления. Мы приводим примеры данных оптимизации наночастиц, чтобы продемонстрировать все предостережения синтеза и характеризации наногелей с использованием этого метода. В целом, были получены наногели одинакового размера со средним размером 57 нм и значением индекса полидисперсии 0,093. Была достигнута высокая эффективность инкапсуляции – 76%. Кроме того, наногели продемонстрировали контролируемое высвобождение до 86% инкапсулированного белка путем постепенной деградации новых редокс-чувствительных компонентов в присутствии глутатиона в течение 48 ч.
Введение
Наногели представляют собой трехмерные гидрогели субмикронного размера с сшитыми полимерными сетчатыми структурами, которые могут удерживать большое количество жидкостей в своей основной оболочке, не влияя на их морфологическуюцелостность. В общем случае, наногели синтезируются путем полимеризации функциональных мономеров путем физического или химического сшивания в гетерогенных коллоидных системах, таких как обратные микроэмульсии типа «вода в масле» 2,3. Амфифильные сополимеры могут самособираться в наноразмерные структуры в водных средах. Тем не менее, они должны быть стабилизированы с помощью стратегий химического сшивания с использованием дисульфидов или амидных связей, клик-химии или могут быть физически индуцированы (гидрофобные, электростатические или водородные связи) или фотоиндуцированы. Среди этих стратегий физическая самосборка полимеров с последующим химическим сшиванием была отмечена как успешныйметод изготовления наногелей. Несмотря на то, что исторически первый наногель был представлен в 1990-х годах Винградовым и др.6, Акиёси и др.7 и Лемье и др.8, в последнее время было разработано и исследовано множество умных наногелей, состоящих как из натуральных, так и синтетических полимеров, для различных биомедицинскихприменений.
Наногели обладают обширной способностью удерживать груз, большой площадью поверхности, стабильностью in vivo, а также настраиваемыми химическими и механическимисвойствами. Синтез наногелей также масштабируем и может быть на водной основе. Кроме того, повышенное содержание воды в наногелях делает их эффективными носителями чувствительных биологических полезных нагрузок11. Кроме того, большая площадь поверхности может удовлетворить многочисленные потребности в биоконъюгации, тем самым позволяя прикреплять модальности нацеливания для обеспечения активного нацеливания. Примечательно, что универсальность конструкции наногеля позволяет использовать широкий спектр чувствительных к стимулам мономеров, что позволяет точно контролировать их физико-химические свойства9. Эта уникальная инженерная способность позволяет рационально усовершенствовать конструкцию наногеля, что трудно достичь с помощью традиционно используемых липосом, мицелл или полимеросом12,13. Путем включения чувствительных на стимулы фрагментов в специально разработанные мономеры, наногели могут быть сконструированы таким образом, чтобы инициировать контролируемое высвобождение их полезной нагрузки в ответ на различные физиологически значимые стимулы, такие как рН, окислительно-восстановительные условия, ферменты и т.д.9,14. Такие «умные» наногели более полезны, чем обычные наногели, поскольку они обладают превосходной стабильностью для расширенного кровообращения, и они могут выдерживать физиологические условия для поддержания целостности своего груза и опосредуют его контролируемое высвобождение в желаемыхцелевых участках. Действительно, благодаря своей универсальной природе, наногели завоевали популярность в биомедицинской сфере, с заметными успехами в разработке наногелей, реагирующих на стимулы, для многочисленных тераностических и диагностических применений 2,16,17.
Биологические препараты могут представлять собой категорию фармацевтических продуктов, состоящих из белков, пептидов и/или нуклеиновых кислот, и они произвели революцию в терапевтическом ландшафте благодаря своей замечательной селективности, став, таким образом, самым быстрорастущим классом терапевтических средств18. Действительно, растущий рынок таких терапевтических средств очевиден в резком росте их одобрения Федеральной ассоциацией по лекарственным средствам США (FDA), где биологические препараты составили ~40% от общего числа одобренных лекарств в 2023году19. В дополнение к их специфичности и эффективности, быстрое открытие новых мишеней для лекарств, более эффективные биоинженерные процессы и более глубокое знание судьбы этих терапевтических средств in vivo привели к их более широкому использованию. К традиционным биологическим препаратам относятся интерферирующие РНК, заместительные белки, цитокины и гормоны, которые обычно генерируются с использованием технологии рекомбинантной ДНК21. С момента утверждения человеческого рекомбинантного инсулина в 1982 году были разработаны биологические препараты для лечения многих заболеваний, включая рак (например, трастузумаб, авелумаб), воспалительные заболевания кишечника (например, адалимумаб, цертолизумаб) и редкие генетические заболевания (например, мипомерсан, миозим, альдуразим, фабразим)21. В то время как высокая специфичность взаимодействия биологических препаратов с их мишенями теоретически должна компенсировать любые побочные эффекты, в связи с их использованием возник ряд клинических проблем, связанных с нежелательными побочнымиэффектами. Эти побочные эффекты можно сгруппировать в две категории, включая преувеличенную фармакологию (чрезмерная стимуляция мишеней) и иммуногенность. Кроме того, их короткий период полураспада, ограниченная биодоступность, повреждение протеазы, короткий срок хранения и дорогостоящие производственные процессы ограничивают их терапевтические преимущества21. Традиционные методы смягчения этих проблем включают ковалентную модификацию этих биологических препаратов, которая может поставить под угрозу их функцию и, следовательно, эффективность. В качестве альтернативы, наномедицинский подход к инкапсуляции терапевтических полезных нагрузок может обеспечить многочисленные преимущества фармакологических свойств, наиболее важным из которых является пассивное нацеливание на воспаленный участок засчет эффекта усиленной проникающей и удерживающей способности (ЭПР). Другие преимущества, связанные с наночастицами, могут включать увеличение времени циркуляции, снижение скорости выведения, большую гибкость состава, улучшенное проникновение в сосуды и поглощениеклетками25. В то время как в настоящее время исследуется огромное разнообразие составов наночастиц для доставки биологических полезных нагрузок, лишь немногие из них могут эмулировать многофункциональность наногелей. Действительно, наногели превосходят нагрузочную способность, достигаемую наночастицами на основе липосомы и мицелл, и они демонстрируют большую коллоидную стабильность, чем большинство неорганических наночастиц. Таким образом, наногели представляют собой ценную платформу для доставки различных биологических терапевтических средств.
Ранее мы успешно доставили антиоксидантный фермент в новые матричные металлопротеиназно-чувствительные сшитые полимерные наногели, где используемая стратегия мягкой инкапсуляции поддерживала биологическую активность белка после высвобождения26. В этой работе мы демонстрируем оптимизированный синтез редокс-чувствительных наногелей для доставки полезных нагрузок на основе белка. Примечательно, что синтетическая методология позволяет синтезировать наногели с использованием мягких условий для инкапсуляции желаемой полезной нагрузки, без использования агрессивных органических растворителей или высоких температур. Мы использовали окислительно-восстановительный гомеостаз во внутриклеточной среде для регуляции высвобождения инкапсулированной полезной нагрузки27,28. Как правило, широко распространенный в природе антиоксидант глутатион (GSH) контролирует внеклеточный и внутриклеточный окислительно-восстановительные потенциалы, где его концентрация колеблется от 2-20 мкМ до 1-10 мМ, соответственно29,30. На сегодняшний день было зарегистрировано множество окислительно-восстановительных чувствительных наночастиц, что делает эту стратегию проверенной и надежной для обеспечения контролируемого высвобождения лекарств in vivo27,28. Действительно, дисульфидные связи были установлены в полимерных наноматериалах с использованием дисульфидсодержащих сшивающих агентов31,32, самосборки биоразлагаемых полимеров из дисульфидсодержащих мономеров33 и редокс-чувствительных полимерных пролекарств или лекарственно-полимерных конъюгатов34,35. Таким образом, в данном исследовании изучается включение уникального, высокочувствительного к GSH дисульфидного сшивающего агента в полимерные наночастицы, тем самым обеспечивая контролируемое высвобождение инкапсулированного белка полезной нагрузки.
В этом исследовании дизайн наногеля был сосредоточен на следующих критериях специфичности и доставки полезной нагрузки: малый размер (~100 нм) и равномерное распределение по размерам (индекс полидисперсности (PI)<0,3) для обеспечения эффективного проникновения эндотелия и стабильности in vivo 27; эффективная инкапсуляция полезной нагрузки белка и контролируемое высвобождение полезной нагрузки в ответ на GSH. Мы сообщаем о синтезе GSH-чувствительных сшитых наногелей, которые продемонстрировали однородные наночастицы размером менее 100 нм с эффективностью инкапсуляции желаемой полезной нагрузки белка 76%.
протокол
1. Синтез редокс-чувствительного сшивающего агента
- Добавьте 2-аминоэтилметакрилата гидрохлорид (44,79 мг, 0,270 ммоль) и 0,063 мл триэтиламина к 3 мл безводного дихлорметана и дайте перемешать в течение 20 минут под инертным газом N2 в колбе с круглым дном объемом 25 мл.
- Растворите 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-гексадекаокса-28,29-дитиагекксапентаконтандиевой кислоты ди-N-сукцинимидиловый эфир (100 мг, 0,045 ммоль) в 1 мл безводного дихлорметана и добавьте в колбу.
- Добавьте в колбу 4 мл безводного дихлорметана. Заверните реакционную колбу в алюминиевую фольгу и оставьте перемешиваться под N2 при комнатной температуре.
- Подтвердите формирование продукта с помощью тонкослойной хроматографии. Убедитесь в правильности ссылок на исходный материал при подтверждении формирования продукта этим методом.
- Тонкослойная хроматография — это метод, основанный на аффинности, используемый для отделения желаемых соединений от реакционной смеси. Здесь в качестве неподвижной фазы используется высокополярная и адсорбирующая пластина из диоксида кремния. Поместите образец исходного материала и образец реакционной смеси на один конец пластины с кремнеземом и поместите вертикально в закрытый стеклянный стакан с элюэнтом (подвижная фаза: 5% метанола: дихлорметана).
- Под действием капилляров подвижная фаза перемещается вверх по кварцевой пластинке, а соединения образца мигрируют на различные расстояния в зависимости от их сродства к стационарной и подвижной фазам. Когда фронт растворителя пересечет 3/4пластины, снимите пластину и высушите ее. Отделенные соединения проявляются в виде пятен на пластине. Количественно определите коэффициент удерживания (Rf) желаемого соединения как расстояние, пройденное соединением/расстояние, пройденное растворителем. Здесь Rf произведения составил 0,35. Для визуализации пятен можно использовать ультрафиолетовый свет или окрашивание (марганцовка).
- Смесь сконцентрировать в вакууме и очистить с помощью флэш-колоночной хроматографии (изократическая смесь 5% метанола: дихлорметана)36. Введите реакционную смесь в верхнюю часть стеклянной колонны, заполненной диоксидом кремния (неподвижная фаза), а затем вымывайте с помощью системы растворителя (подвижная фаза)36. Соберите все фракции и проведите анализ с помощью TLC, чтобы различить фракции продукта по ранее определенному значению Rf .
- Концентрируйте очищенные фракции путем выпаривания растворителя с помощью ротационного испарителя (температура: 40 °C), установите вакуумное давление на атмосферное давление, чтобы сначала удалить низкокипящий дихлорметан. Когда уровень растворителя перестает снижаться, установите вакуумное давление на 337 мбар для удаления метанола и получения бледно-желтого цвета, которое затем будет подвергнуто дальнейшим характеристикам для подтверждения формирования продукта37.
- Проведите инфракрасный анализ с преобразованием Фурье38, 1Н ЯМР (в дейтерированном диметилсульфоксиде (DMSO-d 6))39, 13C ЯМР39 и матриксный лазерный анализ времени пролета с помощью лазерной десорбции/ионизации (MALDI-ToF)40 для подтверждения формирования продукта перед выполнением следующих шагов.
- Для ИК-Фурье анализа загрузите 1 мг масла на прибор, чтобы получить спектры.
- Для анализа ЯМР повторно растворите 10 мг продукта в 0,75 мл соответствующего растворителя ЯМР, переложите в пробирку для ЯМР и плотно закройте во избежание утечки. Загрузите образец на прибор ЯМР, после чего получаются спектры39.
- Для проведения масс-спектрометрического анализа 1 мг продукта запечатать во флаконе, растворить в ДМСО и загрузить на прибор.
Инфракрасный анализ предоставляет информацию о ключевых функциональных группах в желаемом продукте, а именно карбонильные участки (C=O), идентифицированные по острому пику на 1650 см-1 , указывают на образование амидной связи, тем самым выделяя образование продукта. ЯМР 1Н и 13С предоставляют информацию о химических средах и, таким образом, могут быть использованы для определения химического состава желаемого продукта путем идентификации химических сред, присутствующих в соединении. Наконец, с помощью масс-спектрометрии можно проверить точную массу желаемого продукта.
2. Тестовое расщепление дисульфидного сшивающего агента глутатионом
- Инкубируйте сшивающий агент дисульфидов (до конечной концентрации 4,55 мг/мл) с восстановителем глутатионом (конечная [GSH]: 10 мМ) до конечного объема 1 мл в течение 24 ч в стеклянном флаконе объемом 1,5 мл.
- Чтобы подтвердить расщепление линкера дисульфида, отправьте флакон на анализ MALDI-ToF26,40.
3. Редокс-чувствительный синтез наногелей
- Убедитесь, что вся стеклянная посуда, используемая для реакции, очищена от пыли, промыв ее фильтрованной (0,20 мкм) деионизированной водой и затем высушив стеклянную посуду сжатым воздухом, доступ к которому можно получить через систему сжатого воздуха со стороны вытяжного шкафа. Прикрепите надежное сопло к выпускному отверстию сжатого воздуха, чтобы облегчить доступ. Надежно держите флакон и поместите в него сопло. Активируйте сжатый воздух, выпуская контролируемую струю во флакон. Наблюдайте за процессом, чтобы обеспечить эффективную сушку, проверяя наличие оставшихся загрязнений или влаги.
- Приготовьте стеклянный флакон объемом 10 мл, наполнив его деионизированной водой, и запечатайте колбу резиновой перегородкой. Деоксигенируйте воду, пропуская через нее пузырькиN2 в течение не менее 30 минут до начала реакции. Для этого наполните баллон газом N2 и прикрепите к нему иглу; поместите его на перегородку и с помощью иглы проткните резиновую перегородку и дайте N2 течь. Присоедините выходную иглу к колбе, чтобы обеспечить постоянный поток N2.
- Растворите бычий сывороточный альбумин (БСА; 2 мг, 30 нмоль) или меченный Cy7 БСА (2 мг, 30 нмоль) в 1 мл деоксигенированной деионизированной воды и добавьте в другой чистый стеклянный флакон объемом 10 мл.
- Добавьте в колбу раствор [2-(акрилокси)этил]триметиламмония хлорида (АТЦ) (12,00 мг/10,86 мкмоль, 0,060 ммоль) и запечатайте ее другой резиновой перегородкой. Убедитесь, что реакционная смесь поддерживается под постоянным потоком газаN2 , и перемешивайте в течение 30 минут.
- Растворите акриламид (9,21 мг, 0,13 ммоль) в 1 мл дезоксигенированной деионизированной воды и добавьте в смесь во флаконе.
- Дисульфидный сшиватель растворить (4,44 мг, 0,004 ммоль) в 1 мл деионизированной воды и добавить в смесь во флаконе. Промойте смесь газом N2 в течение 20 минут.
- Растворите додецилсульфат натрия (2 мг, 0,007 ммоль) в 1 мл дезоксигенированной деионизированной воды и добавьте в смесь с помощью шприца с газовой промывкой N2 и перемешивайте смесь в течение 30 минут.
ПРИМЕЧАНИЕ: Промывая шприцN2 , мы минимизируем воздействие на реакционную смесь кислорода в атмосфере, который может ингибировать реакцию радикальной полимеризации. - Добавьте N,N,N',N'-тетраметилэтилендиамин (1,5 μл, 0,010 ммоль) и дайте реакционной смеси деоксигенироваться в течение 3 минут под давлением газаN2 .
- Растворите персульфат аммония (1 мг, 0,004 ммоль) в 1 мл дезоксигенированной деионизированной воды и добавьте в реакционную смесь. Убедитесь, что газ N2 пузырится через реакционную смесь в течение 10 минут.
Примечание: Если пропустить стадию добавленияN2 , то вполне вероятно, что в реакционной колбе образуются белые частицы. Это частицы и/или агрегаты более крупного размера, которые могут исказить любые дальнейшие характеристики. - Запечатайте колбу под атмосферой N2 и оставьте перемешивать на 3 часа 30 минут при комнатной температуре.
- Чтобы завершить реакцию, снимите пломбу с колбы и дайте реакционной смеси помешать не менее 10 минут. Это подвергнет реакционную смесь воздействию атмосферных уровней газообразногоО2 , что затем погасит все оставшиеся радикалы в реакционной смеси. Реакция заканчивается, когда смесь приобретает прозрачный голубой опалесцирующий вид.
- Чтобы очистить наногели, добавьте реакционную смесь в центробежный фильтр объемом 15 мл (100 кДа MWCO) и добавьте деионизированную воду для заполнения центробежного блока. Центрифугируйте реакционную смесь при 1000 х г в течение 10 минут. Это позволит удалить любые непрореагировавшие химические вещества (или неинкапсулированную полезную нагрузку) с емкостью менее 100 кДа и сконцентрировать образец наногеля.
- Как только уровень воды в центробежной установке уменьшится, добавьте 2 мл деионизированной воды, чтобы разбавить образец наногеля, и центрифугуйте для концентрации продукта. Повторите этот шаг 3 раза.
- Храните образец при температуре 2-8 °C, чтобы предотвратить деградацию инкапсулированного белка.
- Проведение ИК-Фурье и 1Н ЯМР анализа (в дейтерированном диметилсульфоксиде (ДМСО-d 6)) для подтверждения полимеризации39,41. Чтобы приготовить образец, сублимационно высушите 1 мл раствора наногеля во флаконе объемом 1,5 мл. Процесс сублимационной сушки включает в себя замораживание образца с последующим применением вакуума для удаления замерзшего растворителя путем сублимации, оставляя после себя порошкообразный остаток. После сублимационной сушки повторно растворите образец в соответствующем растворителе ЯМР, переложите в ЯМР-пробирку и плотно закройте ее. Загрузите образец в ЯМР-аппарат, как описано ранее39. Для проведения ИК-Фурье анализа на прибор следует загрузить 1 мг сухого порошка для получения спектров.
4. Морфологическая характеристика наногеля
- Динамическое рассеяние света (DLS)
ПРИМЕЧАНИЕ: Гидродинамический диаметр (нм), индекс полидисперсии (PI) и дзета-потенциал были измерены при 25 °C, длине волны лазера 632,8 нм и детекторе сигнала 173° с использованием устройства DLS. Каждый прогон измерялся 25 циклами подсканирования.- Измерение гидродинамических размеров (нм)
- Подготовьте кювету или одноразовую свернутую капиллярную ячейку, очистив ее фильтрованной деионизированной водой. Вдуйте сжатый воздух в кювету (подходит как для измерений DLS, так и для измерения дзета-потенциала), чтобы убедиться, что в ней нет крупных частиц пыли.
- Заполните кювету не менее чем на 50-100 мкл образца и разведите в 750-1000 мкл отфильтрованной деионизированной воды. При использовании кюветы с дзета-потенциалом убедитесь, что кювета заполнена образцом без образования пузырьков, которые могут нарушить результаты измерений.
- Поместите кювету внутрь инструмента DLS, убедившись, что она была правильно вставлена. Для этого откройте крышку отсека для образцов прибора DLS. Держите кювету за верхние края, чтобы избежать отпечатков пальцев на оптических окнах. Убедитесь, что кювета правильно установлена в держателе кюветы, убедившись, что она находится на одном уровне и выровнена с оптическим путем прибора. Закройте отсек для образцов, чтобы предотвратить внешние световые помехи.
ПРИМЕЧАНИЕ: Разбавляющая среда фильтруется с помощью шприцевого фильтра размером пор 0,45 мкм. - Нажмите, чтобы начать измерение размера частиц в соответствующем программном обеспечении машины DLS.
- Выберите результаты, соответствующие выборке, чтобы получить z-среднее значение (средний размер частиц), среднее PI, количество килограммов в секунду (kcps), дзета-потенциал и соответствующие графики. Убедитесь, что корреляционная функция демонстрирует гладкую сигмоидальную кривую, так как это предполагает однородную выборку.
- После завершения анализа извлеките кювету из DLS.
- Измерение гидродинамических размеров (нм)
- Просвечивающая электронная микроскопия (ПЭМ)
- Подготовьте образцы, поместив 10 мкл раствора наночастиц (0,077 мг/мл) на медные сетки с углеродным покрытием. Сушка на воздухе при комнатной температуре в течение 1 ч.
- Промойте решетки отфильтрованной деионизированной водой и добавьте 5 мкл фильтрованного 1% уранилацетата в воду в течение 2 минут.
- Пропитав излишки красителя фильтровальной бумагой, просушите сетки в течение ночи при комнатной температуре. На следующий день с помощью камеры с ярким полем можно получить изображения TEM с увеличением 45 000x.
- Используйте предоставленное программное обеспечение для обработки изображений (разрешение: 2048 x 2048 пикселей).
5. Количественное определение белка (БСА), инкапсулированного в наногелях с использованием анализа микробицинхониловой кислоты (ВСА)
- В соответствии с протоколом анализа microBCA (приведенным на сайте производителя), сгенерируйте стандартную кривую на основе заранее определенной концентрации белка42.
- После их синтеза очистите инкапсулирующие белки наногели с использованием центробежных фильтрующих установок объемом 15 мл с 100 кДа MWCO (1000 x g, 10 мин), как описано на этапах 3.12-3.14.
- Соберите фильтрат и проанализируйте его с помощью анализа microBCA (протокол доступен на сайте производителя). Измерьте поглощение на длине волны 562 нм с помощью считывателя пластин. Поскольку это измерение коррелирует с концентрацией неинкапсулированного белка, определите массу инкапсулированного белка. Для расчета эффективности инкапсуляции (EE) % используйте следующее уравнение:
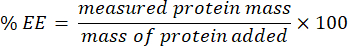
6. Количественная оценка высвобождения белка из наногелей в присутствии глутатиона
- Инкубируйте 200 мкл 5 мг/мл наногелей, загруженных Cy7BSA, с 200 мкл 10 мМ глутатиона (GSH) в центробежных фильтрующих установках объемом 0,5 мл (100 кДа MWCO). Поместите фильтрующие блоки на водяную баню, чтобы поддерживать температуру на уровне 37 °C.
- Центрифугируйте при 1000 х г в течение 3 мин каждые 10 мин в течение не менее 1 ч - затем каждые 2-8 ч.
- Соберите фильтрат и используйте для дальнейшего анализа. Поддерживайте объем фильтрата в центробежных фильтрующих установках на уровне 500 μл, добавляя больше деионизированной воды или PBS.
- Измерьте количество белка в фильтратах, обратившись к стандартной кривой для наногелей, загруженных Cy7BSA, где поглощение флуоресцентного белка измерялось с помощью нанокапли при длине волны 750 нм.
ПРИМЕЧАНИЕ: Эту стандартную кривую можно рассчитать путем подготовки последовательных разведений Cy7BSA в диапазоне от 0 мг/мл до 2 мг/мл. Значения, полученные из нанокапли, могут быть интерполированы относительно этой калибровочной кривой для определения эффективности инкапсуляции.
Результаты
Синтез и характеристика поли(этиленгликоля) (ПЭГ) дисульфидного диакрилатного сшивающего агента Редокс-чувствительный сшивающий агент был синтезирован путем нуклеофильной замены эфира N-гидроксисукцинимида (NHS) на 2-аминоэтилметакрилат путем образова?...
Обсуждение
Растущий спрос на целевые биологические препараты в биофармацевтической промышленности вызвал потребность в технологиях, которые могут улучшить их фармакологические профили in vivo, предотвращая их быструю физиологическую деградацию и компенсируя любые нежелат...
Раскрытие информации
Авторы не могут раскрывать конфликты интересов. Никаких финансовых подробностей для декларирования нет.
Благодарности
Мы благодарим химический факультет Имперского колледжа Лондона и Институт наук о жизни Совета по медицинским исследованиям за их поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
Ссылки
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935 (2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038 (2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181 (2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016 (2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены