É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese de Nanogéis Responsivos a Estímulos utilizando Reticulação Aquosa de Uma Etapa e Co-nanopolimerização
Neste Artigo
Resumo
Os nanogéis são uma plataforma de nanopartículas excelente e versátil para a entrega de produtos biológicos. Nanogéis poliméricos à base de polietilenoglicol responsivos a estímulos, capazes de encapsular cargas úteis à base de proteínas, foram sintetizados usando uma estratégia de co-nanopolimerização de reticulação de uma etapa em condições aquosas. A fabricação e caracterização ideais dessas novas nanopartículas são apresentadas aqui.
Resumo
Os nanogéis constituídos por nanopartículas poliméricas reticuladas foram desenvolvidos para a entrega de inúmeras terapêuticas químicas e biológicas, devido à sua versátil síntese e biocompatibilidade de baixo para cima. Embora vários métodos tenham sido empregados para a síntese de nanogéis até o momento, muito poucos o alcançaram sem o uso de solventes orgânicos agressivos ou altas temperaturas que podem danificar a integridade da carga biológica. Em contraste, a metodologia apresentada aqui realiza a síntese de nanogéis carregados com proteínas de tamanho sub-100 nm usando condições de reação leves. Aqui, apresentamos um método para o encapsulamento não covalente de cargas úteis à base de proteínas dentro de nanogéis que foram sintetizados usando uma técnica de copolimerização de reticulação de etapa única à base de água. Nesta técnica, inicialmente ligamos eletrostaticamente uma carga útil baseada em proteína a um monômero de amônio quaternário catiônico e, simultaneamente, reticulamos e copolimerizamos usando persulfato de amônio e N, N, N ', N'-tetrametiletilenodiamina para formar nanogéis que aprisionam a carga útil da proteína. O tamanho e o índice de polidispersidade dos nanogéis são determinados usando espalhamento dinâmico de luz (DLS), enquanto a morfologia da superfície é avaliada por microscopia eletrônica de transmissão (MET). A massa de proteína aprisionada dentro dos nanogéis é determinada calculando a eficiência de encapsulamento. Além disso, a capacidade de liberação controlada dos nanogéis por meio da degradação gradual de elementos estruturais responsivos a redox também é avaliada em ensaios de biorredução. Fornecemos exemplos de dados de otimização de nanopartículas para demonstrar todas as ressalvas da síntese e caracterização de nanogéis usando esta técnica. Em geral, nanogéis de tamanho uniforme foram obtidos com um tamanho médio de 57 nm e um valor de índice de polidispersidade de 0,093. Uma alta eficiência de encapsulamento de 76% foi alcançada. Além disso, os nanogéis exibiram liberação controlada de até 86% da proteína encapsulada pela degradação gradual de novos componentes responsivos a redox na presença de glutationa ao longo de 48 h.
Introdução
Os nanogéis são hidrogéis tridimensionais, de tamanho submicrométrico, com estruturas de rede polimérica reticuladas que podem conter grandes quantidades de fluidos dentro de seu invólucro central sem afetar sua integridade morfológica1. Em geral, os nanogéis são sintetizados pela polimerização de monômeros funcionais via reticulação física ou química em sistemas coloidais heterogêneos, como microemulsões inversas de água em óleo 2,3. Os copolímeros anfifílicos podem se auto-montar em estruturas em nanoescala em ambientes aquosos. No entanto, eles devem ser estabilizados usando estratégias de reticulação química envolvendo dissulfetos ou acoplamento à base de amida, química de clique, ou podem ser fisicamente induzidos (estratégias hidrofóbicas, eletrostáticas ou de ligação de hidrogênio) ou foto-induzidos4. Dentre essas estratégias, a automontagem física de polímeros seguida de reticulação química tem sido relatada como uma técnica de fabricação de nanogelbem-sucedida 5. Embora historicamente o primeiro nanogel tenha sido introduzido na década de 1990 por Vingradov et al.6, Akiyoshi et al.7 e Lemieux et al.8, ultimamente, uma variedade de nanogéis inteligentes compostos de polímeros naturais e sintéticos foram desenvolvidos e explorados para diversas aplicações biomédicas9.
Os nanogéis possuem ampla capacidade de retenção de carga, grande área de superfície, estabilidade in vivo, bem como propriedades químicas e mecânicas personalizáveis10. A síntese de nanogéis também é escalável e pode ser de base aquosa. Além disso, o maior teor de água dos nanogéis os torna portadores eficazes de cargas biológicas sensíveis11. Além disso, a alta área de superfície pode satisfazer várias necessidades de bioconjugação, permitindo assim a anexação de modalidades de direcionamento para permitir o direcionamento ativo. Notavelmente, a versatilidade do design do nanogel permite o uso de uma ampla gama de monômeros responsivos a estímulos que permitem o controle preciso de suas propriedades físico-químicas9. Essa capacidade única de engenharia permite a melhoria racional do design de nanogel, o que é difícil de alcançar com lipossomas, micelas ou polimerossomos usados convencionalmente12,13. Ao incorporar porções responsivas a estímulos em monômeros especificamente projetados, os nanogéis podem ser projetados para desencadear a liberação controlada de sua carga útil em resposta a vários estímulos fisiologicamente relevantes, como pH, condições redox, enzimas, etc.9,14. Esses nanogéis inteligentes são mais úteis do que os nanogéis convencionais, pois possuem estabilidade superior para circulação sanguínea prolongada e podem suportar condições fisiológicas para manter a integridade de sua carga e mediar sua liberação controlada nos locais-alvo desejados15. De fato, devido à sua natureza versátil, os nanogéis ganharam força na arena biomédica, com avanços notáveis no desenvolvimento de nanogéis responsivos a estímulos para inúmeras aplicações teranósticas e diagnósticas 2,16,17.
Os biológicos podem representar uma categoria de produtos farmacêuticos que consistem em proteínas, peptídeos e/ou ácidos nucléicos e revolucionaram o cenário terapêutico devido à sua notável seletividade, tornando-se assim a classe terapêutica de crescimento mais rápido18. De fato, o crescente mercado para essas terapias é evidente no aumento acentuado de sua aprovação pela Federal Drug Association (FDA) dos EUA, onde os produtos biológicos representaram ~40% do total de aprovações de medicamentos, em 202319. Além de sua especificidade e potência, descobertas rápidas de novos alvos de drogas, processos de bioengenharia mais eficientes e maior conhecimento do destino in vivo dessas terapêuticas levaram ao aumento de seu uso20. Os produtos biológicos tradicionais incluem RNA interferente, proteínas de reposição, citocinas e hormônios que geralmente são gerados usando a tecnologia de DNA recombinante21. Desde a aprovação da insulina recombinante humana em 1982, os produtos biológicos foram desenvolvidos para muitas condições, incluindo câncer (por exemplo, trastuzumabe, avelumabe), doença inflamatória intestinal (por exemplo, adalimumabe, certolizumabe) e doenças genéticas raras (por exemplo, mipomersan, miozima, aldurazima, fabrazima)21. Embora a alta especificidade das interações dos produtos biológicos com seus alvos deva teoricamente compensar quaisquer efeitos fora do alvo, várias preocupações clínicas surgiram com seu uso relacionado a efeitos colaterais indesejados22. Esses efeitos colaterais podem ser agrupados em duas categorias, incluindo farmacologia exagerada (superestimulação de alvos) e imunogenicidade. Além disso, suas meias-vidas curtas, biodisponibilidade limitada, danos à protease, vida útil curta e processos de produção caros limitam seus benefícios terapêuticos21. Os métodos convencionais de mitigação desses problemas envolvem modificação covalente desses biológicos que podem comprometer sua função e, portanto, eficácia23. Alternativamente, a abordagem da nanomedicina para encapsular cargas terapêuticas pode conferir inúmeras vantagens às propriedades farmacológicas, mais importante, o direcionamento passivo ao local inflamado por meio do efeito de permeação e retenção aprimoradas (EPR)24. Outros benefícios associados às nanopartículas podem incluir tempos de circulação aprimorados, taxa de depuração reduzida, maior flexibilidade da formulação, melhor permeação da vasculatura e captação celular25. Embora uma enorme variedade de formulações de nanopartículas esteja atualmente sob investigação para a entrega de cargas biológicas, poucas podem emular a multifuncionalidade dos nanogéis. De fato, os nanogéis excedem as capacidades de carga alcançadas pelas nanopartículas à base de lipossomalas e micelas e exibem maior estabilidade coloidal do que a maioria das nanopartículas inorgânicas. Como tal, os nanogéis apresentam uma plataforma valiosa para a entrega de várias terapêuticas biológicas.
Anteriormente, entregamos com sucesso uma enzima antioxidante em novos nanogéis poliméricos reticulados responsivos à metaloproteinase da matriz, onde a estratégia de encapsulamento suave usada manteve a bioatividade da proteína após a liberação26. Neste trabalho, demonstramos a síntese otimizada de nanogéis responsivos a redox para a entrega de cargas úteis baseadas em proteínas. Notavelmente, a metodologia sintética permite a síntese de nanogéis usando condições suaves para encapsular a carga útil desejada, sem o uso de solventes orgânicos agressivos ou altas temperaturas. Exploramos a homeostase redox dentro do ambiente intracelular para regular a liberação da carga útil encapsulada27,28. Tipicamente, a glutationa antioxidante naturalmente abundante (GSH) controla os potenciais redox extracelular e intracelular, onde sua concentração varia entre 2-20 μM e 1-10 mM, respectivamente29,30. Até o momento, numerosas nanopartículas sensíveis a redox foram relatadas, tornando esta uma estratégia comprovada e confiável para permitir a liberação controlada de medicamentos in vivo27,28. De fato, as ligações dissulfeto foram instaladas em nanomateriais poliméricos usando reticuladores contendo dissulfeto31 , 32 , automontagem de polímeros biodegradáveis a partir de monômeros contendo dissulfeto33 e pró-fármacos poliméricos responsivos a redox ou conjugados de medicamento / polímero34 , 35. Portanto, este estudo investiga a incorporação de um reticulador dissulfeto exclusivo e altamente sensível ao GSH dentro das nanopartículas poliméricas, permitindo assim a liberação controlada de uma carga útil de proteína encapsulada.
Neste estudo, o design do nanogel foi centrado nos seguintes critérios para abordar a especificidade e a entrega da carga útil: tamanho pequeno (~ 100 nm) e uma distribuição de tamanho uniforme (índice de polidispersidade (PI) <0,3) para garantir a penetração eficiente do endotélio e estabilidade in vivo 27; encapsulamento eficiente da carga útil da proteína e liberação controlada da carga útil em resposta ao GSH. Relatamos a síntese de nanogéis reticulados responsivos a GSH, que demonstraram nanopartículas homogêneas de tamanho sub-100 nm, com uma eficiência de encapsulamento de 76% da carga útil da proteína desejada.
Protocolo
1. Síntese de reticulador responsivo a redox
- Adicionar cloridrato de 2-aminoetilmetacrilato (44,79 mg, 0,270 mmol) e 0,063 ml de trietilamina a 3 ml de diclorometano anidro e deixar misturar durante 20 min sob um gás N2 inerte num balão de fundo redondo de 25 ml.
- Dissolver o éster di-N-succinimidílico do ácido 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-hexadecaoxa-28,29-ditiahexapentacontanedióico (100 mg, 0,045 mmol) em 1 ml de diclorometano anidro e adicionar ao balão.
- Adicionar 4 ml de diclorometano anidro ao balão. Envolver o balão de reacção em folha de alumínio e deixar agitar sob N2 à temperatura ambiente.
- Confirmar a formação do produto por cromatografia em camada fina. Garanta as referências corretas para o material de partida enquanto confirma a formação do produto por este método.
- A cromatografia em camada fina é um método baseado em afinidade usado para separar os compostos desejados da mistura de reação. Aqui, use a placa de sílica altamente polar e adsorvente como uma fase estacionária. Colocar a amostra de matéria-prima e a amostra da mistura de reacção numa extremidade da placa de sílica e colocá-la verticalmente num copo de vidro fechado com o eluente (fase móvel: 5% de metanol: diclorometano).
- Por ação capilar, a fase móvel sobe pela placa de sílica e os compostos da amostra migram distâncias variadas, dependendo de suas afinidades com as fases estacionária e móvel. Quando afrente do solvente tiver cruzado 3/4 da placa, remova a placa e seque-a. Os compostos separados aparecem como manchas na placa. Quantificar o factor de retenção (Rf) do composto pretendido como a distância percorrida pelo composto/distância percorrida pelo solvente. Aqui, Rf do produto foi 0,35. Luz ultravioleta ou coloração podem ser usadas para visualizar as manchas (permanganato de potássio).
- Concentrar a mistura no vácuo e purificar por cromatografia em coluna flash (mistura isocrática de 5% de metanol: diclorometano)36. Introduza a mistura de reação no topo de uma coluna de vidro cheia de sílica (fase estacionária) e, em seguida, elui com o sistema de solvente (fase móvel) 36 . Recolha todas as frações e analise utilizando a TLC para distinguir as frações do produto utilizando o valor Rf previamente determinado.
- Concentrar as fracções purificadas por evaporação do solvente utilizando um evaporador rotativo (temperatura: 40 °C), regular a pressão de vácuo para a pressão atmosférica para remover primeiro o diclorometano de ponto de ebulição mais baixo. Quando o nível do solvente parar de diminuir, ajuste a pressão de vácuo para 337 mbar para remover o metanol e obter um óleo amarelo-pálido, que será então submetido a uma caracterização adicional para confirmar a formação do produto37.
- Realize a análise de infravermelho por transformada de Fourier (FT-IR)38, 1H NMR (em dimetilsulfóxido deuterado (DMSO-d 6))39, 13C NMR39 e análise de tempo de voo de dessorção/ionização a laser assistida por matriz (MALDI-ToF)40 para confirmar a formação do produto antes de realizar as próximas etapas.
- Para análise FT-IR, carregue 1 mg do óleo no instrumento para obter os espectros.
- Para análises de RMN, dissolva novamente 10 mg do produto em 0,75 mL do solvente de RMN relevante, transfira para um tubo de RMN e feche bem para evitar vazamentos. Carregue a amostra no instrumento de RMN, após o que os espectros são obtidos39.
- Para a análise por espectrometria de massa, sele 1 mg do produto em um frasco, dissolva em DMSO e carregue no instrumento.
NOTA: A análise infravermelha fornece informações sobre os principais grupos funcionais no produto desejado, ou seja, os trechos de carbonila (C = O) identificados pelo pico agudo a 1650 cm-1 indicam a formação da ligação amida, destacando assim a formação do produto. A RMN de 1H e a RMN de 13C fornecem informações sobre os ambientes químicos e, portanto, podem ser usadas para determinar a composição química do produto desejado por meio da identificação dos ambientes químicos presentes no composto. Finalmente, o uso da espectrometria de massa pode verificar a massa exata do produto desejado.
2. Teste a clivagem do reticulador de dissulfeto com glutationa
- Incubar o reticulador de dissulfeto (até uma concentração final de 4,55 mg / mL) com o agente redutor glutationa (final [GSH]: 10 mM), até um volume final de 1 mL, por 24 h em um frasco de vidro de 1,5 mL.
- Para confirmar a clivagem do ligante dissulfeto, submeter o frasco para injetáveisà análise MALDI-ToF 26,40.
3. Síntese de nanogel responsiva a redox
- Certifique-se de que todos os artigos de vidro a serem usados para a reação estejam livres de poeira, lavando com água deionizada filtrada (0.20 μm) e, posteriormente, secando os artigos de vidro usando ar comprimido que pode ser acessado através da rede de ar comprimido na lateral da capela. Conecte um bico seguro à saída de ar comprimido para facilitar a acessibilidade. Segure o frasco com firmeza e posicione o bico nele. Ative o ar comprimido, liberando um fluxo controlado no frasco. Observe o processo para garantir uma secagem eficaz, verificando se há contaminantes ou umidade restantes.
- Prepare um frasco de vidro de 10 mL enchendo-o com água deionizada e sele o frasco com um septo de borracha. Desoxigene a água borbulhando N2 por pelo menos 30 minutos antes de iniciar a reação. Para fazer isso, encha um balão com gás N2 e prenda uma agulha no balão; coloque-o no septo e use a agulha para perfurar o septo de borracha e permitir o fluxo de N2 . Colocar uma agulha de saída no balão para assegurar um fluxo constante de N2.
- Dissolva a albumina de soro bovino (BSA; 2 mg, 30 nmol) ou BSA marcada com Cy7 (2 mg, 30 nmol) em 1 mL de água desionizada desoxigenada e adicione a outro frasco de vidro limpo de 10 mL.
- Adicionar a solução de cloreto de [2-(acriloiloxi)etil]trimetilamónio (AETC) (12,00 mg/10,86 μL, 0,060 mmol) ao balão e selá-lo com outro septo de borracha. Certifique-se de que a mistura de reação seja mantida sob um fluxo constante de gás N2 e mexa por 30 min.
- Dissolva a acrilamida (9,21 mg, 0,13 mmol) em 1 ml de água desoxigenada desionizada e adicione à mistura no frasco para injetáveis.
- Dissolva o reticulador dissulfeto (4,44 mg, 0,004 mmol) em 1 mL de água deionizada e adicione à mistura no frasco. Lave a mistura com gás N2 por 20 min.
- Dissolva o dodecil sulfato de sódio (2 mg, 0,007 mmol) em 1 mL de água desoxigenada deionizada e adicione à mistura por meio de uma seringa com lavagem com gás N2 e agite a mistura por 30 min.
NOTA: Ao lavar a seringa com N2 , minimizamos a exposição da mistura de reação ao oxigênio na atmosfera, o que pode inibir a reação de polimerização radical. - Adicione N,N,N',N'-tetrametiletilenodiamina (1,5 μL, 0,010 mmol) e deixe a mistura de reação desoxigenar por 3 min sob gás N2 .
- Dissolva o persulfato de amônio (1 mg, 0,004 mmol) em 1 mL de água desoxigenada deionizada e adicione à mistura de reação. Certifique-se de que o gás N2 esteja borbulhando através da mistura de reação por 10 min.
NOTA: Se a etapa de adição de N2 for omitida, é provável que partículas brancas se formem no balão de reação. Estas são partículas e/ou agregados de tamanho maior e podem confundir qualquer caracterização adicional. - Fechar o balão sob uma atmosfera de N2 e deixar agitar durante 3 h e 30 min à temperatura ambiente.
- Para terminar a reação, retire o selo do balão e deixe a mistura de reação mexer por pelo menos 10 min. Isso exporia a mistura de reação a níveis atmosféricos de gás O2 , que então extinguiria quaisquer radicais remanescentes na mistura de reação. A reação termina quando a mistura assume uma aparência opalescente azul clara.
- Para purificar os nanogéis, adicione a mistura de reação a uma unidade de filtro centrífugo de 15 mL (100 kDa MWCO) e adicione água deionizada para encher a unidade centrífuga. Centrifugue a mistura de reação a 1000 x g por 10 min. Isso removerá quaisquer produtos químicos não reagidos (ou carga útil não encapsulada) que sejam menores que 100 kDa e concentrará a amostra de nanogel.
- Assim que o nível de água na unidade centrífuga diminuir, adicione 2 mL de água deionizada para diluir a amostra de nanogel e centrifugue para concentrar o produto. Repita esta etapa 3x.
- Armazenar a amostra a 2-8 °C para evitar a degradação da proteína encapsulada.
- Realize a análise de FT-IR e RMN 1H (em dimetilsulfóxido deuterado (DMSO-d 6)) para confirmar a polimerização39,41. Para preparar a amostra, liofilize 1 mL da solução de nanogel em um frasco de 1,5 mL. O processo de liofilização envolve o congelamento da amostra e, em seguida, a aplicação de vácuo para remover o solvente congelado por sublimação, deixando para trás um resíduo em pó. Após a liofilização, dissolva novamente a amostra no solvente de RMN relevante, transfira para um tubo de RMN e feche-o firmemente. Carregue a amostra na máquina de RMN, conforme descrito anteriormente39. Para a análise FT-IR, 1 mg do pó seco deve ser carregado no instrumento para obter os espectros.
4. Caracterização morfológica de nanogel
- Espalhamento dinâmico de luz (DLS)
NOTA: O diâmetro hidrodinâmico (nm), o índice de polidispersidade (PI) e o potencial zeta foram medidos a 25 ° C, comprimento de onda do laser de 632,8 nm e detector de sinal de 173 ° usando uma máquina DLS. Cada execução mediu 25 ciclos de sub-varredura.- Medição de tamanho hidrodinâmico (nm)
- Prepare uma cubeta ou uma célula capilar dobrada descartável limpando-a com água deionizada filtrada. Sopre ar comprimido na cubeta (adequado para medições de potencial DLS e zeta) para garantir que esteja livre de grandes partículas de poeira.
- Encha a cubeta com pelo menos 50-100 μL da amostra e dilua em 750-1000 μL de água deionizada filtrada. Ao usar uma cubeta de potencial zeta, certifique-se de que a cubeta foi preenchida com sample sem formação de bolhas, o que pode perturbar as medições.
- Coloque a cubeta dentro do instrumento DLS, certificando-se de que foi inserida corretamente. Para fazer isso, abra o sample tampa do compartimento do instrumento DLS. Segure a cubeta pelas bordas superiores para evitar impressões digitais nas janelas ópticas. Certifique-se de que a cubeta esteja encaixada corretamente no suporte da cubeta, certificando-se de que esteja nivelada e alinhada com o caminho óptico do instrumento. Feche o sample compartimento para evitar interferência de luz ambiente.
NOTA: O meio de diluição é filtrado com um filtro de seringa de poros de 0,45 μm. - Clique para iniciar a medição do tamanho das partículas no software da máquina DLS relevante.
- Selecione os resultados correspondentes à amostra para obter a média z (tamanho médio da partícula), PI médio, quilocontagens por segundo (kcps), potencial zeta e gráficos relevantes. Certifique-se de que a função de correlação exiba uma curva sigmoidal suave, pois isso sugere uma amostra uniforme.
- Quando a análise estiver concluída, remova a cubeta do DLS.
- Medição de tamanho hidrodinâmico (nm)
- Microscopia eletrônica de transmissão (MET)
- Prepare as amostras colocando 10 μL da solução de nanopartículas (0,077 mg/mL) em grades de cobre revestidas de carbono. Seque ao ar em temperatura ambiente por 1 h.
- Lave as grades com água deionizada filtrada e manche com 5 μL de acetato de uranila a 1% filtrado em água por 2 min.
- Depois de embeber o excesso de agente de coloração com papel de filtro, seque as grades durante a noite em temperatura ambiente. Capture imagens TEM no dia seguinte com ampliação de 45.000x usando uma câmera de campo claro.
- Use o software fornecido para processamento de imagem (resolução: 2048 x 2048 pixels).
5. Quantificação da proteína (BSA) encapsulada nos nanogéis usando um ensaio de ácido micro-bicinconínico (BCA)
- De acordo com o protocolo de ensaio microBCA (fornecido no site do fabricante), gere uma curva padrão com base em uma concentração de proteína pré-definida42.
- Após a sua síntese, purificar os nanogéis encapsulantes de proteínas utilizando unidades de filtro centrífugo de 15 ml com 100 kDa MWCO (1000 x g, 10 min), conforme descrito nos passos 3.12-3.14.
- Colete o filtrado e analise usando o ensaio microBCA (protocolo disponível no site do fabricante). Medir a absorvância a 562 nm utilizando um leitor de placas. Como essa medição se correlaciona com a concentração de proteína não encapsulada, determine a massa da proteína encapsulada. Para calcular a eficiência de encapsulamento (EE) %, use a seguinte equação:
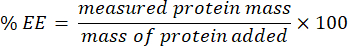
6. Quantificação da liberação de proteínas de nanogéis na presença de glutationa
- Incubar 200 μL de 5 mg/mL de nanogéis carregados com Cy7BSA com 200 μL de glutationa 10 mM (GSH) nas unidades de filtro centrífugo de 0,5 mL (100 kDa MWCO). Coloque as unidades filtrantes em banho-maria para manter a temperatura a 37 °C.
- Centrifugue a 1000 x g por 3 min a cada 10 min por pelo menos 1 h - depois a cada 2-8 h.
- Recolher o filtrado e utilizar para análise posterior. Mantenha o volume do filtrado dentro das unidades de filtro centrífugo em 500 μL adicionando mais água deionizada ou PBS.
- Meça a quantidade de proteína nos filtrados consultando uma curva padrão para nanogéis carregados com Cy7BSA, onde a absorbância da proteína fluorescente foi medida usando um instrumento nanodrop a 750 nm.
NOTA: Esta curva padrão pode ser calculada preparando diluições seriadas de Cy7BSA na faixa de 0 mg / mL a 2 mg / mL. Os valores obtidos do nanodrop podem ser interpolados contra esta curva de calibração para determinar a eficiência do encapsulamento.
Resultados
Síntese e caracterização do reticulador de diacrilato de dissulfeto de poli(etilenoglicol) (PEG) O reticulador responsivo a redox foi sintetizado pela substituição nucleofílica de um éster N-hidroxisuccinimida (NHS) pelo metacrilato de 2-aminoetila por meio da formação de uma ligação amida (Figura 1). A síntese do produto requerido foi validada principalmente por RMN de 1H (Figura Suplementar 1
Discussão
A crescente demanda por produtos biológicos específicos na indústria biofarmacêutica impulsionou a necessidade de tecnologias que possam melhorar seus perfis farmacológicos in vivo, evitando sua rápida degradação fisiológica e compensando quaisquer efeitos colaterais indesejados. Com isso em mente, é descrito um procedimento simples para a síntese de nanogéis carregados de proteínas. Conforme indicado no protocolo, o reticulador responsivo a redox precisa ser sintet...
Divulgações
Os autores não têm conflitos de interesse a divulgar. Não há detalhes financeiros a serem declarados.
Agradecimentos
Agradecemos ao Departamento de Química do Imperial College London e ao Instituto de Ciências da Vida do Conselho de Pesquisa Médica por seu apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
Referências
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935 (2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038 (2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181 (2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016 (2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados