È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi di nanogel responsivi agli stimoli mediante reticolazione acquosa in un solo passaggio e co-nanopolimerizzazione
In questo articolo
Riepilogo
I nanogel sono un'eccellente e versatile piattaforma di nanoparticelle per la somministrazione di farmaci biologici. I nano-gel polimerici a base di poli(etilene) glicole responsivi agli stimoli, in grado di incapsulare carichi utili basati su proteine, sono stati sintetizzati utilizzando una strategia di co-nanopolimerizzazione cross-linking in un'unica fase in condizioni acquose. La fabbricazione e la caratterizzazione ottimali di queste nuove nanoparticelle sono presentate qui.
Abstract
I nanogel costituiti da nanoparticelle polimeriche reticolate sono stati sviluppati per la somministrazione di numerose terapie chimiche e biologiche, grazie alla loro versatile sintesi dal basso verso l'alto e alla biocompatibilità. Mentre fino ad oggi sono stati impiegati vari metodi per la sintesi di nanogel, pochissimi l'hanno raggiunta senza l'uso di solventi organici aggressivi o alte temperature che possono danneggiare l'integrità del carico biologico. Al contrario, la metodologia qui presentata realizza la sintesi di nanogel caricati con proteine di dimensioni inferiori a 100 nm utilizzando condizioni di reazione blande. Qui, presentiamo un metodo per l'incapsulamento non covalente di carichi utili basati su proteine all'interno di nano-gel che sono stati sintetizzati utilizzando una tecnica di copolimerizzazione reticolante a base acquosa, a passaggio singolo. In questa tecnica, inizialmente leghiamo elettrostaticamente un carico utile basato su proteine a un monomero cationico di ammonio quaternario e contemporaneamente lo reticoliamo e lo copolimerizziamo utilizzando persolfato di ammonio e N,N,N',N'-tetrametiletilendiammina per formare nanogel che intrappolano il carico utile proteico. La dimensione e l'indice di polidispersione dei nanogel sono determinati utilizzando la diffusione dinamica della luce (DLS), mentre la morfologia della superficie è valutata mediante microscopia elettronica a trasmissione (TEM). La massa di proteina intrappolata all'interno dei nanogel viene determinata calcolando l'efficienza di incapsulamento. Inoltre, la capacità di rilascio controllato dei nanogel attraverso la graduale degradazione di elementi strutturali redento-reattivi viene valutata anche nei saggi di bioriduzione. Forniamo esempi di dati di ottimizzazione delle nanoparticelle per dimostrare tutti gli avvertimenti della sintesi e della caratterizzazione dei nanogel utilizzando questa tecnica. In generale, sono stati ottenuti nanogel di dimensioni uniformi con una dimensione media di 57 nm e un valore dell'indice di polidispersione di 0,093. È stata raggiunta un'elevata efficienza di incapsulamento del 76%. Inoltre, i nanogel hanno mostrato un rilascio controllato fino all'86% della proteina incapsulata mediante degradazione graduale di nuovi componenti redentori in presenza di glutatione nell'arco di 48 ore.
Introduzione
I nanogel sono idrogel tridimensionali, di dimensioni inferiori al micron, con strutture di rete polimerica reticolata che possono trattenere grandi quantità di fluidi all'interno del loro guscio centrale senza comprometterne l'integrità morfologica1. In generale, i nanogel sono sintetizzati mediante polimerizzazione di monomeri funzionali tramite reticolazione fisica o chimica in sistemi colloidali eterogenei, come le microemulsioni inverse acqua-in-olio 2,3. I copolimeri anfifilici possono auto-assemblarsi in strutture su scala nanometrica in ambienti acquosi. Tuttavia, devono essere stabilizzati utilizzando strategie di reticolazione chimica che coinvolgono disolfuri o accoppiamento a base di ammidi, chimica a clic, oppure possono essere indotte fisicamente (strategie idrofobiche, elettrostatiche o di legame idrogeno) o fotoindotte4. Tra queste strategie, l'autoassemblaggio fisico di polimeri seguito da reticolazione chimica è stata segnalata come una tecnica di fabbricazione di nanogeldi successo 5. Mentre storicamente, il primo nanogel è stato introdotto negli anni '90 da Vingradov et al.6, Akiyoshi et al.7 e Lemieux et al.8, ultimamente, una varietà di nanogel intelligenti composti da polimeri naturali e sintetici è stata sviluppata ed esplorata per diverse applicazioni biomediche9.
I nanogel possiedono un'ampia capacità di ritenzione del carico, un'ampia superficie, stabilità in vivo e proprietà chimiche e meccaniche personalizzabili10. Anche la sintesi dei nanogel è scalabile e può essere a base acquosa. Inoltre, l'elevato contenuto d'acqua dei nanogel li rende portatori efficaci di carichi biologici sensibili11. Inoltre, l'elevata area superficiale può soddisfare molteplici esigenze di bioconiugazione, consentendo così l'associazione di modalità di targeting per consentire il targeting attivo. In particolare, la versatilità del design dei nanogel consente l'uso di un'ampia gamma di monomeri sensibili agli stimoli che consentono un controllo preciso delle loro proprietà fisico-chimiche9. Questa ingegnerizzazione unica consente il miglioramento razionale del design dei nanogel, che è difficile da ottenere con liposomi, micelle o polimerisomi usati convenzionalmente12,13. Incorporando frazioni sensibili agli stimoli all'interno di monomeri appositamente progettati, i nanogel possono essere ingegnerizzati per innescare il rilascio controllato del loro carico utile in risposta a vari stimoli fisiologicamente rilevanti, come il pH, le condizioni redox, gli enzimi, ecc.9,14. Tali nanogel intelligenti sono più utili dei nanogel convenzionali, in quanto possiedono una stabilità superiore per una circolazione sanguigna estesa e possono sopportare condizioni fisiologiche per mantenere l'integrità del loro carico e mediare il suo rilascio controllato nei siti target desiderati15. Infatti, grazie alla loro natura versatile, i nanogel hanno guadagnato terreno nell'arena biomedica, con notevoli progressi nello sviluppo di nanogel sensibili agli stimoli per numerose applicazioni teranostiche e diagnostiche 2,16,17.
I farmaci biologici possono rappresentare una categoria di prodotti farmaceutici costituiti da proteine, peptidi e/o acidi nucleici e hanno rivoluzionato il panorama terapeutico grazie alla loro notevole selettività, diventando così la classe di terapie in più rapida crescita18. In effetti, il mercato in crescita di tali terapie è evidente nel forte aumento della loro approvazione da parte della Federal Drug Association (FDA) degli Stati Uniti, dove i farmaci biologici hanno rappresentato ~40% delle approvazioni totali di farmaci, nel 202319. Oltre alla loro specificità e potenza, le rapide scoperte di nuovi bersagli farmacologici, processi di bioingegneria più efficienti e una maggiore conoscenza del destino in vivo di queste terapie hanno portato al loro aumento dell'uso20. I farmaci biologici tradizionali includono RNA interferente, proteine sostitutive, citochine e ormoni che vengono solitamente generati utilizzando la tecnologia del DNA ricombinante21. Dall'approvazione dell'insulina umana ricombinante nel 1982, sono stati sviluppati farmaci biologici per molte condizioni, tra cui il cancro (ad esempio, trastuzumab, avelumab), le malattie infiammatorie intestinali (ad esempio, adalimumab, certolizumab) e le malattie genetiche rare (ad esempio, mipomersan, myozyme, aldurazyme, fabrazyme)21. Mentre l'elevata specificità delle interazioni dei farmaci biologici con i loro bersagli dovrebbe teoricamente compensare qualsiasi effetto off-target, sono emerse diverse preoccupazioni cliniche relative al loro uso in relazione agli effetti collaterali indesiderati22. Questi effetti collaterali possono essere raggruppati in due categorie, tra cui la farmacologia esagerata (sovrastimolazione dei bersagli) e l'immunogenicità. Inoltre, la loro breve emivita, la biodisponibilità limitata, il danno alla proteasi, la breve durata di conservazione e i costosi processi di produzione ne limitano i benefici terapeutici21. I metodi convenzionali per mitigare questi problemi comportano la modifica covalente di questi farmaci biologici che può comprometterne la funzione e, quindi, l'efficacia23. In alternativa, l'approccio nanomedico all'incapsulamento dei carichi utili terapeutici può conferire numerosi vantaggi alle proprietà farmacologiche, in primo luogo, il targeting passivo al sito infiammato tramite l'effetto di permeazione e ritenzione (EPR) potenziato24. Altri vantaggi associati alle nanoparticelle possono includere tempi di circolazione migliorati, velocità di clearance ridotte, maggiore flessibilità della formulazione, migliore permeazione vascolare e assorbimento cellulare25. Mentre un'enorme varietà di formulazioni di nanoparticelle è attualmente in fase di studio per la consegna di carichi biologici, pochi possono emulare la multifunzionalità dei nanogel. Infatti, i nanogel superano le capacità di carico raggiunte dalle nanoparticelle a base di liposomi e micelle e mostrano una maggiore stabilità colloidale rispetto alla maggior parte delle nanoparticelle inorganiche. In quanto tali, i nanogel rappresentano una piattaforma preziosa per la somministrazione di varie terapie biologiche.
In precedenza abbiamo fornito con successo un enzima antiossidante all'interno di nanogel polimerici reticolati reattivi alla metalloproteinasi di una nuova matrice, in cui la strategia di incapsulamento lieve utilizzata ha mantenuto la bioattività della proteina al momento del rilascio26. In questo lavoro, dimostriamo la sintesi ottimizzata di nanogel redox reattivi per la somministrazione di carichi utili basati su proteine. In particolare, la metodologia sintetica consente la sintesi di nanogel utilizzando condizioni blande per incapsulare il carico utile desiderato, senza l'uso di solventi organici aggressivi o alte temperature. Abbiamo sfruttato l'omeostasi redox all'interno dell'ambiente intracellulare per regolare il rilascio del payload incapsulato27,28. Tipicamente, l'antiossidante naturale glutatione (GSH) controlla i potenziali redox extracellulari e intracellulari, dove la sua concentrazione varia tra 2-20 μM e 1-10 mM, rispettivamente29,30. Ad oggi, sono state riportate numerose nanoparticelle sensibili alla redox, rendendo questa una strategia collaudata e affidabile per consentire il rilascio controllato di farmaci in vivo27,28. Infatti, i legami disolfuro sono stati installati all'interno di nanomateriali polimerici utilizzando reticolanti contenenti disolfuro31,32, autoassemblaggio di polimeri biodegradabili da monomeri contenenti disolfuro33 e profarmaci polimerici responsivi redox o coniugati farmaco/polimero34,35. Pertanto, questo studio indaga l'incorporazione di un reticolante disolfuro unico, altamente sensibile al GSH, all'interno delle nanoparticelle polimeriche, consentendo così il rilascio controllato di un carico utile proteico incapsulato.
In questo studio, la progettazione di nanogel è stata incentrata sui seguenti criteri per affrontare la specificità e l'erogazione del carico utile: dimensioni ridotte (~100 nm) e una distribuzione dimensionale uniforme (indice di polidispersione (PI)<0,3) per garantire una penetrazione efficiente dell'endotelio e stabilità in vivo 27; incapsulamento efficiente del carico utile proteico e rilascio controllato del carico utile in risposta al GSH. Riportiamo la sintesi di nanogel reticolati responsivi al GSH, che hanno dimostrato nanoparticelle omogenee di dimensioni inferiori a 100 nm, con un'efficienza di incapsulamento del 76% del payload proteico desiderato.
Protocollo
1. Sintesi di reticolante reattivo alla redox
- Aggiungere il cloridrato di 2-amminoetilmetacrilato (44,79 mg, 0,270 mmol) e 0,063 mL di trietilammina a 3 mL di diclorometano anidro e lasciare miscelare per 20 minuti sotto un gas inerte N2 in un pallone a fondo tondo da 25 mL.
- Sciogliere 4,7,10,13,16,19,22,25,32,35,38,41,44,47,50,53-Hexadecaoxa-28,29-ditiahexapentacontanedioic acid di-N-succinimidyl estere (100 mg, 0,045 mmol) in 1 mL di diclorometano anidro e aggiungere al pallone.
- Aggiungere 4 ml di diclorometano anidro al pallone. Avvolgere il pallone di reazione in un foglio di alluminio e lasciare agitare sotto N2 a temperatura ambiente.
- Confermare la formazione del prodotto mediante cromatografia su strato sottile. Garantire i riferimenti corretti per il materiale di partenza confermando la formazione del prodotto con questo metodo.
- La cromatografia su strato sottile è un metodo basato sull'affinità utilizzato per separare i composti desiderati dalla miscela di reazione. In questo caso, utilizzare la piastra di silice altamente polare e adsorbente come fase stazionaria. Posizionare il campione di materiale di partenza e il campione della miscela di reazione su un'estremità della piastra di silice e posizionarli verticalmente in un becher di vetro chiuso con l'eluente (fase mobile: 5% metanolo: diclorometano).
- Per azione capillare, la fase mobile si sposta verso l'alto sulla piastra di silice e i composti del campione migrano a distanze variabili a seconda delle loro affinità per le fasi stazionarie e mobili. Quando il fronte del solvente ha attraversato i 3/4 della piastra, rimuovere la lastra e asciugarla. I composti separati appaiono come macchie sulla piastra. Quantificare il fattore di ritenzione (Rf) del composto desiderato come la distanza percorsa dal composto/la distanza percorsa dal solvente. Qui, Rf del prodotto era 0,35. La luce UV o la colorazione possono essere utilizzate per visualizzare le macchie (permanganato di potassio).
- Concentrare la miscela nel vuoto e purificare mediante cromatografia su colonna flash (miscela isocratica di metanolo al 5%: diclorometano)36. Introdurre la miscela di reazione sulla parte superiore di una colonna di vetro riempita di silice (fase stazionaria) e quindi eluire con il sistema solvente (fase mobile)36. Raccogliere tutte le frazioni e analizzare utilizzando TLC per distinguere le frazioni del prodotto utilizzando il valore Rf precedentemente determinato.
- Concentrare le frazioni purificate facendo evaporare il solvente utilizzando un evaporatore rotante (temperatura: 40 °C), impostare la pressione del vuoto sulla pressione atmosferica per rimuovere prima il diclorometano a bassa ebollizione. Quando il livello del solvente smette di diminuire, impostare la pressione del vuoto a 337 mbar per rimuovere il metanolo e ottenere un olio giallo pallido, che sarà quindi sottoposto a un'ulteriore caratterizzazione per confermare la formazione del prodotto37.
- Condurre analisi a infrarossi in trasformata di Fourier (FT-IR)38, 1H NMR (in dimetilsolfossido deuterato (DMSO-d 6))39, 13C NMR39 e analisi del tempo di volo/ionizzazione laser assistita da matrice (MALDI-ToF)40 per confermare la formazione del prodotto prima di eseguire i passaggi successivi.
- Per l'analisi FT-IR, caricare 1 mg di olio sullo strumento per ottenere gli spettri.
- Per le analisi NMR, sciogliere nuovamente 10 mg di prodotto in 0,75 mL del relativo solvente NMR, trasferire in una provetta NMR e sigillare ermeticamente per evitare perdite. Caricare il campione sullo strumento NMR, dopodiché si ottengono gli spettri39.
- Per l'analisi con spettrometria di massa, sigillare 1 mg di prodotto in un flaconcino, sciogliere in DMSO e caricare sullo strumento.
NOTA: L'analisi all'infrarosso fornisce informazioni riguardanti i gruppi funzionali chiave nel prodotto desiderato, vale a dire gli allungamenti carbonilici (C=O) identificati dal picco acuto a 1650 cm-1 indica la formazione del legame ammidico, evidenziando così la formazione del prodotto. L'NMR 1H e il 13C forniscono informazioni sugli ambienti chimici e quindi possono essere utilizzati per determinare la composizione chimica del prodotto desiderato attraverso l'identificazione degli ambienti chimici presenti nel composto. Infine, l'uso della spettrometria di massa può verificare l'esatta massa del prodotto desiderato.
2. Test di scissione del reticolante disolfuro con glutatione
- Incubare il reticolante disolfuro (ad una concentrazione finale di 4,55 mg/mL) con l'agente riducente glutatione (finale [GSH]: 10 mM), ad un volume finale di 1 mL, per 24 ore in un flaconcino di vetro da 1,5 mL.
- Per confermare la scissione del linker del disolfuro, inviare la fiala per l'analisi MALDI-ToF 26,40.
3. Sintesi di nanogel reattivi alla redox
- Assicurarsi che tutta la vetreria da utilizzare per la reazione sia priva di polvere lavandola con acqua deionizzata filtrata (0,20 μm) e successivamente asciugando la vetreria con aria compressa accessibile tramite l'utenza dell'aria compressa sul lato della cappa. Collegare un ugello sicuro all'uscita dell'aria compressa per facilitarne l'accessibilità. Tenere saldamente il flaconcino e posizionare l'ugello al suo interno. Attivare l'aria compressa, rilasciando un flusso controllato nella fiala. Osservare il processo per garantire un'asciugatura efficace, controllando la presenza di eventuali contaminanti o umidità residui.
- Preparare un flaconcino di vetro da 10 ml riempiendolo con acqua deionizzata e sigillare il pallone con un setto di gomma. Deossigenare l'acqua facendo gorgogliare N2 attraverso di essa per almeno 30 minuti prima di iniziare la reazione. Per fare ciò, riempi un palloncino con gas N2 e attacca un ago al palloncino; posizionarlo sul setto e utilizzare l'ago per perforare il setto di gomma e consentire il flusso di N2 . Collegare un ago di uscita al pallone per garantire un flusso costante di N2.
- Sciogliere l'albumina sierica bovina (BSA; 2 mg, 30 nmol) o la BSA marcata con Cy7 (2 mg, 30 nmol) in 1 mL di acqua deionizzata deossigenata e aggiungere a un'altra fiala di vetro pulita da 10 mL.
- Aggiungere la soluzione di [2-(acriloilossi)etil]trimetilammonio cloruro (AETC) (12,00 mg/10,86 μL, 0,060 mmol) al pallone e sigillarlo con un altro setto di gomma. Assicurarsi che la miscela di reazione sia mantenuta sotto un flusso costante di gas N2 e mescolare per 30 minuti.
- Sciogliere l'acrilammide (9,21 mg, 0,13 mmol) in 1 mL di acqua deossigenata deionizzata e aggiungere alla miscela nel flaconcino.
- Sciogliere il reticolante disolfuro (4,44 mg, 0,004 mmol) in 1 mL di acqua deionizzata e aggiungere alla miscela nel flaconcino. Sciacquare la miscela con gas N2 per 20 min.
- Sciogliere il sodio dodecil solfato (2 mg, 0,007 mmol) in 1 mL di acqua deossigenata deionizzata e aggiungere alla miscela tramite una siringa lavata con gas N2 e mescolare la miscela per 30 minuti.
NOTA: Lavando la siringa con N2 riduciamo al minimo l'esposizione della miscela di reazione all'ossigeno nell'atmosfera che può inibire la reazione di polimerizzazione dei radicali. - Aggiungere N,N,N',N'-tetrametiletilendiammina (1,5 μL, 0,010 mmol) e lasciare deossigenare la miscela di reazione per 3 minuti sotto N2 gas.
- Sciogliere il persolfato di ammonio (1 mg, 0,004 mmol) in 1 mL di acqua deionizzata deossigenata e aggiungerlo alla miscela di reazione. Assicurarsi che il gas N2 gorgogli attraverso la miscela di reazione per 10 minuti.
NOTA: Se la fase di aggiunta di N2 viene omessa, è probabile che si formino particelle bianche nel pallone di reazione. Si tratta di particelle e/o aggregati di dimensioni maggiori e possono confondere qualsiasi ulteriore caratterizzazione. - Sigillare il matraccio in atmosfera N2 e lasciare agitare per 3 ore e 30 minuti a temperatura ambiente.
- Per terminare la reazione, rimuovere il sigillo dal pallone e lasciare mescolare la miscela di reazione per almeno 10 minuti. Ciò esporrebbe la miscela di reazione ai livelli atmosferici di gas O2 , che quindi estinguerebbe eventuali radicali rimanenti nella miscela di reazione. La reazione termina quando la miscela assume un aspetto opalescente blu chiaro.
- Per purificare i nanogel, aggiungere la miscela di reazione a un'unità di filtro centrifugo da 15 mL (100 kDa MWCO) e aggiungere acqua deionizzata per riempire l'unità centrifuga. Centrifugare la miscela di reazione a 1000 x g per 10 min. In questo modo si rimuovono tutte le sostanze chimiche non reagite (o il carico utile non incapsulato) che sono inferiori a 100 kDa e si concentra il campione di nanogel.
- Una volta che il livello dell'acqua nell'unità centrifuga diminuisce, aggiungere 2 ml di acqua deionizzata per diluire il campione di nanogel e centrifugare per concentrare il prodotto. Ripeti questo passaggio 3 volte.
- Conservare il campione a 2-8 °C per evitare la degradazione della proteina incapsulata.
- Condurre l'analisi FT-IR e 1H NMR (in dimetilsolfossido deuterato (DMSO-d 6)) per confermare la polimerizzazione39,41. Per preparare il campione, liofilizzare 1 mL della soluzione di nanogel in un flaconcino da 1,5 mL. Il processo di liofilizzazione prevede il congelamento del campione e l'applicazione di un vuoto per rimuovere il solvente congelato attraverso la sublimazione, lasciando un residuo in polvere. Dopo la liofilizzazione, sciogliere nuovamente il campione nel relativo solvente NMR, trasferirlo in una provetta NMR e chiuderla ermeticamente. Caricare il campione sulla macchina NMR, come descritto in precedenza39. Per l'analisi FT-IR, è necessario caricare 1 mg di polvere secca sullo strumento per ottenere gli spettri.
4. Caratterizzazione morfologica dei nanogel
- Diffusione dinamica della luce (DLS)
NOTA: Il diametro idrodinamico (nm), l'indice di polidispersione (PI) e il potenziale zeta sono stati misurati a 25 °C, lunghezza d'onda laser di 632,8 nm e rivelatore di segnale a 173° utilizzando una macchina DLS. Ogni corsa ha misurato 25 cicli di scansione secondaria.- Misura della dimensione idrodinamica (nm)
- Preparare una cuvetta o una cella capillare ripiegata usa e getta pulendola con acqua deionizzata filtrata. Soffiare aria compressa nella cuvetta (adatta sia per le misurazioni del potenziale DLS che zeta) per assicurarsi che sia priva di particelle di polvere di grandi dimensioni.
- Riempire la cuvetta con almeno 50-100 μL del campione e diluire in 750-1000 μL di acqua deionizzata filtrata. Durante l'utilizzo di una cuvetta con potenziale zeta, assicurarsi che la cuvetta sia stata riempita con il campione senza formazione di bolle, che possono disturbare le misurazioni.
- Inserire la cuvetta all'interno dello strumento DLS, assicurandosi che sia stata inserita correttamente. A tale scopo, aprire il coperchio del vano campioni dello strumento DLS. Tenere la cuvetta per i bordi superiori per evitare impronte digitali sulle finestre ottiche. Assicurarsi che la cuvetta sia posizionata correttamente nel supporto della cuvetta assicurandosi che sia in piano e allineata con il percorso ottico dello strumento. Chiudere lo scomparto del campione per evitare interferenze con la luce ambientale.
NOTA: Il mezzo di diluizione viene filtrato utilizzando un filtro per siringa con pori da 0,45 μm. - Fare clic per avviare la misurazione della dimensione delle particelle sul relativo software della macchina DLS.
- Selezionare i risultati corrispondenti al campione per ottenere la media z (dimensione media delle particelle), il PI medio, il numero di chilogrammi al secondo (kcps), il potenziale zeta e i relativi grafici. Assicurarsi che la funzione di correlazione presenti una curva sigmoidale uniforme, in quanto ciò suggerisce un campione uniforme.
- Una volta completata l'analisi, rimuovere la cuvetta dal DLS.
- Misura della dimensione idrodinamica (nm)
- Microscopia elettronica a trasmissione (TEM)
- Preparare i campioni posizionando 10 μL della soluzione di nanoparticelle (0,077 mg/mL) su griglie di rame rivestite di carbonio. Asciugare all'aria a temperatura ambiente per 1 ora.
- Lavare le griglie con acqua deionizzata filtrata e colorare con 5 μL di acetato di uranile filtrato all'1% in acqua per 2 minuti.
- Dopo aver imbevuto l'eccesso di colorante con carta da filtro, asciugare le griglie per una notte a temperatura ambiente. Cattura immagini GST il giorno successivo con un ingrandimento di 45.000x utilizzando una fotocamera a campo chiaro.
- Utilizzare il software fornito per l'elaborazione delle immagini (risoluzione: 2048 x 2048 pixel).
5. Quantificazione della proteina (BSA) incapsulata all'interno dei nanogel utilizzando un saggio di acido micro-bicinchoninico (BCA)
- Secondo il protocollo di analisi microBCA (fornito sul sito Web del produttore), generare una curva standard basata su una concentrazione proteica predefinita42.
- Dopo la loro sintesi, purificare i nanogel che incapsulano le proteine utilizzando unità filtranti centrifughe da 15 mL con MWCO da 100 kDa (1000 x g, 10 min) come descritto nei passaggi 3.12-3.14.
- Raccogliere il filtrato e analizzarlo utilizzando il test microBCA (protocollo disponibile sul sito web del produttore). Misurare l'assorbanza a 562 nm utilizzando un lettore di piastre. Poiché questa misurazione è correlata alla concentrazione di proteina non incapsulata, determinare la massa della proteina incapsulata. Per calcolare l'efficienza di incapsulamento (EE) %, utilizzare la seguente equazione:
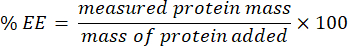
6. Quantificazione del rilascio proteico da nanogel in presenza di glutatione
- Incubare 200 μL di 5 mg/mL di nanogel caricati con Cy7BSA con 200 μL di 10 mM di glutatione (GSH) nelle unità di filtro centrifughe da 0,5 mL (100 kDa MWCO). Porre le unità filtranti a bagnomaria per mantenere la temperatura a 37 °C.
- Centrifugare a 1000 x g per 3 minuti ogni 10 minuti per almeno 1 ora - poi ogni 2-8 ore.
- Raccogliere il filtrato e utilizzarlo per ulteriori analisi. Mantenere il volume del filtrato all'interno delle unità filtranti centrifughe a 500 μL aggiungendo altra acqua deionizzata o PBS.
- Misurare la quantità di proteine nei filtrati facendo riferimento a una curva standard per nanogel caricati con Cy7BSA, in cui l'assorbanza della proteina fluorescente è stata misurata utilizzando uno strumento nanodrop a 750 nm.
NOTA: Questa curva standard può essere calcolata preparando diluizioni seriali di Cy7BSA nell'intervallo da 0 mg/mL a 2 mg/mL. I valori ottenuti dalla nanogoccia possono essere interpolati rispetto a questa curva di calibrazione per determinare l'efficienza di incapsulamento.
Risultati
Sintesi e caratterizzazione di reticolante di poli(etilenglicole) (PEG) disolfuro diacrilato Il reticolante redox reattivo è stato sintetizzato mediante la sostituzione nucleofila di un estere N-idrossisuccinimide (NHS) con il 2-amminoetilmetacrilato attraverso la formazione di un legame ammidico (Figura 1). La sintesi del prodotto richiesto è stata validata principalmente mediante 1H NMR (Figura Supplementare 1...
Discussione
La crescente domanda di farmaci biologici specifici per l'industria biofarmaceutica ha determinato la necessità di tecnologie in grado di migliorare i profili farmacologici in vivo, prevenendone la rapida degradazione fisiologica e compensando eventuali effetti collaterali indesiderati. Con questo in mente, viene descritta una procedura semplice per la sintesi di nanogel caricati con proteine. Come indicato nel protocollo, il reticolante redento-reattivo deve essere sintetizzat...
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare. Non ci sono dettagli finanziari da dichiarare.
Riconoscimenti
Ringraziamo il Dipartimento di Chimica dell'Imperial College di Londra e l'Istituto di Scienze della Vita del Medical Research Council per il loro sostegno.
Materiali
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| 2-( acryloyloxy)ethyl]trimethylammonium chloride solution | Sigma Aldrich | 496146 | |
| 2-aminoethyl methacrylatehydrochloride | Sigma Aldrich | 516155 | |
| 4,7,10,13,16,19,22,25,32,35,38,41, 44,47,50,53-Hexadecaoxa-28,29-dithiahexapentacontanedioic acid di-N-succinimidyl ester | Sigma Aldrich | 671630 | |
| Acrylamide | Sigma Aldrich | 23701 | |
| Ammonium persulfate | Sigma Aldrich | 248614 | |
| Bovine serum albumin | Sigma Aldrich | B6917 | |
| Cy7- labelled bovine serum albumin | Nanocs | BS1-S7-1 | |
| Deuterated dimethyl sulfoxide | Sigma Aldrich | 547239 | |
| Dichloromethane | Sigma Aldrich | 270997 (anhydrous) and D65100 | |
| Glutathione | Sigma Aldrich | G4251 | |
| Methanol | Sigma Aldrich | 34860 | |
| N,N,N’,N’-tetramethylethylenediamine | Sigma Aldrich | 411019 | |
| Phosphate buffered saline | ThermoFisher | 10010023 | |
| Sodium dodecyl sulfate | Sigma Aldrich | 436143 | |
| Triethylamine | Sigma Aldrich | 471283 | |
| Uranyl Acetate | Agar Scientific | AGR1260A | |
| Equipment necessary for nanogel synthesis and characterisation | |||
| Amicon Ultra-15 Centrifugal filter units (100kDa MWCO) | Merck Millipore | C7715 | |
| Camera | Olympus | Veleta | |
| Carbon-coated copper grids | Agar Scientific | AGS160 | |
| Dialysis tubing (100kDa MWCO) | Spectrum labs | 11405949 | |
| Dynamic Light Scattering | Malvern | Zetasizer Nano Ultra | |
| Freeze dryer | Labconco | WZ-03336-01 | |
| Infrared spectroscopy | Agilent | Cary 630 FTIR | |
| iTEM software | Olympus | ||
| Mass spectrometry | Waters | Micromass MALDI microMX MALDI Q-ToF | |
| MF-MilliporeTM membrane filter (0.45/0.2μm pore size) | Merck Millipore, UK | HAWP04700, GSWP04700 | |
| Micro BCA Protein Assay Kit | ThermoFisher | 23235 | |
| Plate reader | Beckman | Coulter-PARADIGM | |
| Proton and Carbon-13 nuclear magnetic resonance data | Bruker | 400MHz AV-400 NMR spectrometer | |
| Rotary evaporator | Buchi | R-114 Rotary Vap System | |
| Single-use needles | Sterican | 4665643 | |
| Suba-Seal septa | Sigma Aldrich | Z124575 | |
| Transmission electron microscopy | Phillips | CM 100 TEM | |
| UV-vis spectrophotometer | Nanodrop | Nanodrop One/One C microvolume |
Riferimenti
- Zhang, X., Malhotra, S., Molina, M., Haag, R. Micro- and nanogels with labile crosslinks - from synthesis to biomedical applications. Chem Soc Rev. 44 (7), 1948-1973 (2015).
- Chacko, R. T., Ventura, J., Zhuang, J., Thayumanavan, S. Polymer nanogels: A versatile nanoscopic drug delivery platform. Adv Drug Del Rev. 64 (9), 836-851 (2012).
- Hajebi, S., et al. Stimulus-responsive polymeric nanogels as smart drug delivery systems. Acta Biomaterialia. 92, 1-18 (2019).
- Lee, V. Y., et al. Nanogel star polymer architectures: A nanoparticle platform for modular programmable macromolecular self-assembly, intercellular transport, and dual-mode cargo delivery. Adv Mat. 23 (39), 4509-4515 (2015).
- Ekkelenkamp, A., Rachèl Elzes, M., Engbersen, J. F., Paulusse, J. M. Responsive crosslinked polymer nanogels for imaging and therapeutics delivery. J Mat Chem B. 6 (2), 210-235 (2018).
- Vinogradov, S. V., Zeman, A. D., Batrakova, E. V., Kabanov, A. V. Polyplex nanogel formulations for drug delivery of cytotoxic nucleoside analogs. J Control Rel. 107 (1), 143-157 (2015).
- Akiyoshi, K., Deguchi, S., Moriguchi, N., Yamaguchi, S., Sunamoto, J. Self-aggregates of hydrophobized polysaccharides in water. Formation and characteristics of nanoparticles. Macromol. 26 (12), 3062-3068 (1993).
- Lemieux, P., et al. Block and graft copolymers and NanoGel copolymer networks for DNA delivery into cell. J Drug Target. 8 (2), 91-105 (2000).
- Preman, N. K., Barki, R. R., Vijayan, A., Sanjeeva, S. G., Johnson, R. P. Recent developments in stimuli-responsive polymer nanogels for drug delivery and diagnostics: A review. Euro J Pharma Biopharmac. 157, 121-153 (2020).
- Oh, J. K., Drumright, R., Siegwart, D. J., Matyjaszewski, K. The development of microgels/nanogels for drug delivery applications. Prog Poly Sci. 33 (4), 448-477 (2008).
- Jiang, Y., Chen, J., Deng, C., Suuronen, E. J., Zhong, Z. Click hydrogels, microgels and nanogels: Emerging platforms for drug delivery and tissue engineering. Biomat. 35 (18), 4969-4985 (2014).
- Napier, M. E., DeSimone, J. M. Nanoparticle drug delivery platform. Poly Rev. 47 (3), 321-327 (2007).
- Malmsten, M. Soft drug delivery systems. Soft Matt. 2 (9), 760-769 (2006).
- Kamaly, N., Yameen, B., Wu, J., Farokhzad, O. C. Degradable controlled-release polymers and polymeric nanoparticles: Mechanisms of controlling drug release. Che Rev. 116 (4), 2602-2663 (2016).
- Molina, M., et al. Stimuli-responsive nanogel composites and their application in nanomedicine. Chem Soc Rev. 44 (17), 6161-6186 (2015).
- Ma, Y., Ge, Y., Li, L. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique. Mat Sci Eng: C. 71, 1281-1292 (2017).
- Wang, H., Qian, J., Ding, F. Recent advances in engineered chitosan-based nanogels for biomedical applications. J Mat Chem B. 5 (34), 6986-7007 (2017).
- Durán-Lobato, M., Niu, Z., Alonso, M. J. Oral delivery of biologics for precision medicine. Adv Mat. 32 (13), 1901935 (2020).
- de la Torre, B. G., Albericio, F. The pharmaceutical industry in 2022: An analysis of FDA drug approvals from the perspective of molecules. Molecules. 28 (3), 1038 (2023).
- Škalko-Basnet, N. Biologics: The role of delivery systems in improved therapy. Biologics. 8, 107-114 (2014).
- Andrews, L., Ralston, S., Blomme, E., Barnhart, K. A snapshot of biologic drug development: Challenges and opportunities. Human Exp Toxicol. 34 (12), 1279-1285 (2015).
- Sathish, J. G., et al. Challenges and approaches for the development of safer immunomodulatory biologics. Nat Rev Drug Disc. 12 (4), 306-324 (2013).
- Pfister, D., Morbidelli, M. Process for protein PEGylation. J Control Rel. 180, 134-149 (2014).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat Biotechnol. 33 (9), 941-951 (2015).
- Golombek, S. K., et al. Tumor targeting via EPR: Strategies to enhance patient responses. Adv Drug Del Rev. 130, 17-38 (2018).
- Basak, S., et al. Simultaneous cross-linking and cross-polymerization of enzyme responsive polyethylene glycol nanogels in confined aqueous droplets for reduction of low-density lipoprotein oxidation. Biomacromol. 22 (2), 386-398 (2021).
- Morgulchik, N., Kamaly, N. Meta-analysis of in vitro drug-release parameters reveals predictable and robust kinetics for redox-responsive drug-conjugated therapeutic nanogels. ACS Appl Nano Mat. 4 (5), 4256-4268 (2021).
- Ghorbani, M., Hamishehkar, H. Redox-responsive smart nanogels for intracellular targeting of therapeutic agents: Applications and recent advances. J Drug Target. 27 (4), 408-422 (2019).
- Bajic, V. P., et al. Glutathione "redox homeostasis" and its relation to cardiovascular disease. Oxi Med Cell Long. 2019, e5028181 (2019).
- Forman, H. J., Zhang, H., Rinna, A. Glutathione: Overview of its protective roles, measurement, and biosynthesis. Mol Asp Med. 30 (1-2), 1-12 (2009).
- Wang, Y. C., et al. Core-shell-corona micelle stabilized by reversible cross-linkage for intracellular drug delivery. Macromol Rapid Comm. 31 (13), 1201-1206 (2010).
- Elkassih, S. A., Kos, P., Xiong, H., Siegwart, D. J. Degradable redox-responsive disulfide-based nanogel drug carriers via dithiol oxidation polymerization. Biomat Sci. 7 (2), 607-617 (2019).
- Hu, X., et al. Stimuli-responsive polymersomes for biomedical applications. Biomacromol. 18 (3), 649-673 (2017).
- Navath, R. S., Wang, B., Kannan, S., Romero, R., Kannan, R. M. Stimuli-responsive star poly(ethylene glycol) drug conjugates for improved intracellular delivery of the drug in neuroinflammation. J Control Release. 142 (3), 447-456 (2010).
- Ling, X., et al. Glutathione-responsive prodrug nanoparticles for effective drug delivery and cancer therapy. ACS Nano. 13 (1), 357-370 (2019).
- Still, W. C., Kahn, M., Mitra, A. Rapid chromatographic technique for preparative separations with moderate resolution. J Org Chem. 43 (14), 2923-2925 (1978).
- JoVE. JoVE science education database - Organic chemistry. Rotary evaporation to remove solvent. JoVE. , (2023).
- JoVE. JoVE science education database - Organic chemistry II. Infrared spectroscopy. JoVE. , (2024).
- JoVE. science education database - Organic chemistry. Nuclear magnetic resonance (NMR) spectroscopy. JoVE. , (2023).
- Kim, J. Sample preparation for matrix-assisted laser desorption/ionization mass spectrometry. Mass Spec Lett. 6, 27-30 (2015).
- Liu, P., Pearce, C. M., Anastasiadi, R. M., Resmini, M., Castilla, A. M. Covalently crosslinked nanogels: An NMR study of the effect of monomer reactivity on composition and structure. Polymers. 11 (2), 353 (2019).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Anal Biochem. 150 (1), 76-85 (1985).
- Yu, M., Wu, J., Shi, J., Farokhzad, O. C. Nanotechnology for protein delivery: Overview and perspectives. J Control Release. 240, 24-37 (2016).
- Zhang, Y., Zhang, D., Wang, J. T., Zhang, X., Yang, Y. Fabrication of stimuli-responsive nanogels for protein encapsulation and traceless release without introducing organic solvents, surfactants, or small-molecule cross-linkers. Poly Chem. 12 (4), 554-563 (2021).
- Kamaly, N., et al. Targeted interleukin-10 nanotherapeutics developed with a microfluidic chip enhance resolution of inflammation in advanced atherosclerosis. ACS Nano. 10 (5), 5280-5292 (2016).
- Lu, R., et al. Probing the secondary structure of bovine serum albumin during heat-induced denaturation using mid-infrared fiberoptic sensors. Analyst. 140 (3), 765-770 (2015).
- Abrosimova, K. V., Shulenina, O. V., Paston, S. V. FTIR study of secondary structure of bovine serum albumin and ovalbumin. J Phys: Conf Ser. 769, 012016 (2016).
- Kabanov, A. V., Vinogradov, S. V. Nanogels as pharmaceutical carriers: Finite networks of infinite capabilities. Ang Chem Int Ed Eng. 48 (30), 5418-5429 (2009).
- Li, C., Obireddy, S. R., Lai, W. F. Preparation and use of nanogels as carriers of drugs. Drug Del. 28 (1), 1594-1602 (2021).
- Kulkarni, J. A., et al. The current landscape of nucleic acid therapeutics. Nat Nanotechnol. 16 (6), 630-643 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon