A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מעגלים דיגיטליים גנטיים המבוססים על מערכות CRISPR-Cas וחלבונים אנטי-קריספר
* These authors contributed equally
Summary
מערכות CRISPR-Cas וחלבונים אנטי-קריספר שולבו בתוכנית של שערים בוליאניים בשמרי אפייה (Saccharomyces cerevisiae). המעגלים הלוגיים הקטנים החדשים הראו ביצועים טובים והעמיקו את ההבנה של גורמי שעתוק מבוססי dCas9/dCas12a והתכונות של חלבונים אנטי-קריספר.
Abstract
גנים סינתטיים לשערים בוליאניים ולמעגלים דיגיטליים יש מגוון רחב של יישומים, החל מאבחון רפואי ועד לטיפול סביבתי. גילוי מערכות CRISPR-Cas והמעכבים הטבעיים שלהן - חלבוני האנטי-קריספר (Acrs) - מספק כלי חדש לתכנון ויישום מעגלים דיגיטליים של גנים in vivo . כאן, אנו מתארים פרוטוקול העוקב אחר הרעיון של מחזור ההנדסה הביולוגית "תכנון-בנייה-בדיקה-למידה" ועושה שימוש ב- dCas9/dCas12a יחד עם ה- Acrs המתאימים שלהם כדי ליצור רשתות שעתוק קטנות, שחלקן מתנהגות כמו שערים בוליאניים, ב - Saccharomyces cerevisiae. תוצאות אלה מציינות את המאפיינים של dCas9/dCas12a כגורמי שעתוק. בפרט, כדי להשיג הפעלה מקסימלית של ביטוי גנים, dSpCas9 צריך לקיים אינטראקציה עם RNA פיגום מהונדס שאוסף עותקים מרובים של תחום ההפעלה VP64 (AD). לעומת זאת, dCas12a יאוחה, במסוף C, עם VP64-p65-Rta (VPR) AD חזק. יתר על כן, הפעילות של שני חלבוני Cas אינה משופרת על ידי הגדלת כמות sgRNA/crRNA בתא. מאמר זה גם מסביר כיצד לבנות שערים בוליאניים בהתבסס על אינטראקציית CRISPR-dCas-Acr. תחום קשירת ההורמונים המאוחה AcrIIA4 של קולטן האסטרוגן האנושי הוא הליבה של שער NOT המגיב ל-β-אסטרדיול, בעוד ש-AcrVAs המסונתזים על ידי מקדם GAL1 המושרה מאפשרים לחקות שערי כן ו-NOT עם גלקטוז כקלט. במעגלים האחרונים, AcrVA5, יחד עם dLbCas12a, הראו את ההתנהגות הלוגית הטובה ביותר.
Introduction
בשנת 2011, חוקרים הציעו שיטה חישובית ופיתחו תוכנה מתאימה לתכנון אוטומטי של מעגלי גנים סינתטיים דיגיטליים1. המשתמש היה צריך לציין את מספר הקלטים (שלוש או ארבע) ולמלא את טבלת האמת המעגלית; זה סיפק את כל המידע הדרוש כדי לגזור את מבנה המעגל באמצעות טכניקות מאלקטרוניקה. טבלת האמת תורגמה לשתי נוסחאות בוליאניות בשיטת מפת קרנאו2. כל נוסחה בוליאנית מורכבת ממשפטים המתארים פעולות לוגיות (סכום או כפל) בין (חלק) קלטי המעגל ושלילותיהם (הליטרלים). סעיפים, בתורם, מסוכמים (OR) או מוכפלים (AND) כדי לחשב את פלט המעגל. כל מעגל יכול להתממש על פי כל אחת משתי הנוסחאות המתאימות: האחת כתובה בצורת קופה (מכפלה של סכומים) והשנייה בצורת SOP (סכום מוצרים). הראשון מורכב מכפל של סעיפים (כלומר, שערים בוליאניים) המכילים סכום לוגי של הליטרלים. האחרון, לעומת זאת, הוא סכום של סעיפים שבהם מכפילים את המילוליים.
מעגלים חשמליים יכולים להתממש, על קרש לחם, על ידי חיווט פיזי של שערים שונים יחד. הזרם החשמלי מאפשר חילופי אותות בין השערים, מה שמוביל לחישוב הפלט.
בביולוגיה המצב מורכב יותר. שער בוליאני יכול להתממש כיחידת שעתוק (TU; כלומר, הרצף "מקדם-קידוד אזור-מסיים" בתוך תאים איקריוטים), שבו שעתוק או תרגום (או שניהם) מוסדרים. לפיכך, לפחות שני סוגים של מולקולות יוצרים חיווט ביולוגי: חלבוני גורם השעתוק והרנ"א האנטיסנס שאינו מקודד1.
מעגל דיגיטלי גנטי מאורגן בשתיים או שלוש שכבות של שערים, כלומר: 1) שכבת הקלט, העשויה משערי כן (חיץ) ולא וממירה את כימיקלי הקלט למולקולות חיווט; 2) השכבה הפנימית, המורכבת מכמה TUs שיש סעיפים בנוסחה הבוליאנית המתאימה. אם המעגל מתוכנן על פי נוסחת SOP, כל סעיף בשכבה הפנימית יפיק את פלט המעגל (למשל, פלואורסצנציה) במה שנקרא ארכיטקטורת פלט מבוזר. אם משתמשים בנוסחת המכפלה של סכום (POS), נדרשת שכבה סופית 3), שתכיל שער כפל יחיד האוסף את מולקולות החיווט מהשכבה הפנימית.
בסך הכל, בביולוגיה סינתטית, ניתן לתכנן סכמות רבות ושונות עבור אותו מעגל. הם נבדלים במספר ובסוג של TUs ומולקולות חיווט. על מנת לבחור את הפתרון הקל ביותר ליישום בתאי שמרים, כל תכנון מעגל משויך לציון סיבוכיות S, המוגדר כ
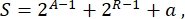
כאשר A מייצג את מספר המפעילים, R מייצג את מספר המדכאים, ו-A הוא כמות מולקולות האנטיסנס RNA. אם מפעילים או מדכאים נעדרים מהמעגל, תרומתם ל-S היא אפס. לכן, קשה יותר לממש סכמת מעגלים במעבדה (S גבוהה) כאשר היא דורשת מספר גבוה של גורמי שעתוק אורתוגונליים. משמעות הדבר היא כי מפעילים ומדכאים חדשים יונדסו דה נובו על מנת לממש את החיווט המלא בתוך המעגלים הדיגיטליים. באופן עקרוני, ניתן להרכיב חלבונים קושרי דנ"א חדשים באמצעות חלבוני אצבע אבץ3 ואפקטי TAL4 כתבניות. עם זאת, אפשרות זו נראית מפרכת מדי וגוזלת זמן; לכן, יש להסתמך בעיקר על רנ"א קטן ובקרת תרגום כדי לסיים מעגלי גנים מורכבים.
במקור, שיטה זו פותחה כדי לייצר מעגלים דיגיטליים בחיידקים. ואכן, בתאים איקריוטים, במקום רנ"א אנטיסנס, מתאים יותר לדבר על מיקרו-רנ"א (miRNAs) או על רנ"א מפריע קטן (siRNAs)5. עם זאת, מסלול RNAi אינו קיים שמרים S. cerevisiae. לפיכך, יש לבחור ברשתות תמלול מלאות. נניח שמעגל חשמלי זקוק לחמישה מפעילים וחמישה מדכאים; ציון הסיבוכיות שלו יהיה S = 32. ניתן להפחית את מורכבות המעגל על ידי החלפת 10 גורמי השעתוק ב- dCas96 יחיד (Cas9 חסר נוקלאז) המאוחה לתחום הפעלה (AD). כפי שמוצגב-7, dCas9-AD פועל כמדכא בשמרים בעת קשירת מקדם בין תיבת TATA ל-TSS (אתר התחלת שעתוק) וכמפעיל בעת קשירה טובה במעלה הזרם של תיבת TATA. לפיכך, ניתן להחליף 10 גורמי שעתוק בחלבון היתוך dCas9-AD יחיד ו-10 sgRNA (RNA מנחה יחיד) לקבלת ציון סיבוכיות כולל של S = 11. זה מהיר וקל לסנתז עשרה sgRNAs, בעוד שכפי שצוין קודם לכן, הרכבה של 10 חלבונים תדרוש עבודה ארוכה ומסובכת הרבה יותר.
לחלופין, ניתן להשתמש בשני חלבוני dCas אורתוגונליים (למשל, dCas9 ו-dCas12a): אחד כדי להתיך לאלצהיימר, והשני חשוף או בשילוב עם תחום דיכוי. ציון הסיבוכיות יגדל ביחידה אחת בלבד (S = 12). לפיכך, מערכות CRISPR-dCas הן המפתח לבניית מעגלים ספרתיים מורכבים מאוד של גנים בשמרי אפייה (S. cerevisiae).
מאמר זה מאפיין באופן עמוק את היעילות של מדכאים ומפעילים מבוססי dCas9 ו-dCas12a בשמרים. התוצאות מראות כי הם אינם דורשים כמות גבוהה של sgRNA כדי לייעל את פעילותם, ולכן פלסמידים אפיזומליים הם העדיפו להימנע. יתר על כן, מפעילים מבוססי dCas9 יעילים הרבה יותר בעת שימוש ב-RNA פיגום (scRNA) המגייס עותקים של VP64 AD. לעומת זאת, dCas12a עובד היטב כאשר הוא מאוחה ישירות ל-VPR AD החזק. יתר על כן, מקדם מופעל סינתטי דורש מספר משתנה של אתרי מטרה, בהתאם לתצורה של מפעיל (למשל, שלושה בעת שימוש dCas12a-VPR, שישה עבור dCas9-VP64, ורק אחד עם dCas9 ו scRNA). כמדחיק, dCas12a נראה נוקב יותר בעת קשירת אזור הקידוד ולא המקדם.
כחיסרון, עם זאת, CRISPR-dCas9/dCas12a אינם מתקשרים ישירות עם כימיקלים. לכן, ייתכן שלא יועיל להם בשכבת הקלט. מסיבה זו נחקרו עיצובי שערים בוליאניים חלופיים המכילים חלבונים אנטי-קריספר (Acrs). Acrs לפעול על (d)Cas חלבונים ולעכב את פעולתם8. לפיכך, הם אמצעי לווסת את הפעילות של מערכות CRISPR-(d)Cas. מאמר זה מנתח ביסודיות את האינטראקציות בין סוג II Acrs ו- (d)Cas9, כמו גם סוג V Acrs ו- (d)Cas12a ב- S. cerevisiae. מכיוון ש-Acrs קטנים בהרבה מחלבוני Cas, שער NOT המגיב לאסטרוגן β-אסטרדיול נבנה על ידי איחוי תחום קשירת ההורמונים של קולטן האסטרוגן האנושי 9-HBD(hER)-ל-AcrIIA4. חוץ מזה, קומץ שערים של כן ו-NOT שביטאו dCas12a(-AD) באופן מכונן ו-AcrVAs עם אינדוקציה עם גלקטוז מומשו. כיום, שערים אלה משמשים רק כהוכחת היתכנות. עם זאת, הם גם מייצגים את הצעד הראשון לקראת חשיבה מחודשת עמוקה על האלגוריתם לביצוע התכנון האוטומטי החישובי של מעגלים דיגיטליים של גנים סינתטיים בתאי שמרים.
Disclosures
המחברים מצהירים כי אין אינטרס כלכלי מתחרה.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
Copyright © 2025 MyJoVE Corporation. All rights reserved