A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פיגומי הידרוג'ל גרגיריים מג'לטין מתקרילויל: ייצור מיקרוג'ל בתפוקה גבוהה, ליופיליזציה, הרכבה כימית והדפסה ביולוגית תלת-ממדית
In This Article
Summary
מאמר זה מתאר פרוטוקולים לייצור מיקרו-ג'ל ג'לטין מתקרילויל בתפוקה גבוהה באמצעות התקנים מיקרופלואידים, המרת מיקרו-ג'לים לאבקה מתרחפת (מיקרו-אירוג'לים), הרכבה כימית של מיקרו-ג'לים ליצירת פיגומי הידרוג'ל גרגיריים, ופיתוח ביו-דיו הידרוג'ל גרגירי עם מיקרו-נקבוביות משומרת להדפסה ביולוגית תלת-ממדית.
Abstract
הופעתם של פיגומי הידרוג'ל גרגיריים (GHS), המיוצרים באמצעות הרכבת מיקרו-חלקיקי הידרוג'ל (HMPs), אפשרה היווצרות פיגומים מיקרו-נקבוביים באתרם. שלא כמו הידרוג'לים קונבנציונליים בתפזורת, נקבוביות מיקרוסקוליות מחוברות זו לזו ב-GHS מאפשרות חדירת תאים שאינה תלויה בהתפרקות, כמו גם העברת חמצן, חומרים מזינים ותוצרי לוואי של תאים. ג'לטין מהונדס Methacryloyl (GelMA), ביופולימר מבוסס חלבון הניתן להצלבה כימית המכיל דבק תאים ומויטי מתכלים, נמצא בשימוש נרחב כחומר ביולוגי מגיב לתאים/מאלף. המרת GelMA בתפזורת ל- GHS עשויה לפתוח שפע של הזדמנויות להנדסת רקמות והתחדשות. במאמר זה, אנו מדגימים את ההליכים של ייצור מיקרו-ג'ל GelMA בתפוקה גבוהה, המרה למיקרו-ג'לים יבשים הניתנים להשעיה חוזרת (מיקרו-אירוג'לים), היווצרות GHS באמצעות הרכבה כימית של מיקרו-ג'לים, וייצור ביו-דיו גרעיני להדפסה ביולוגית של אקסטרוזיה. אנו מראים כיצד טיפול פיסיקוכימי רציף באמצעות קירור ופוטוקרוסלינקינג מאפשר היווצרות GHS חזק מבחינה מכנית. כאשר האור אינו נגיש (למשל, במהלך הזרקת רקמות עמוקה), ניתן להרכיב ביו-אורתוגונלים של GelMA HMPs מוצלבים בנפרד באמצעות קרוסלינקינג אנזימטי באמצעות טרנסגלוטמינאזות. לבסוף, הדפסה ביולוגית תלת-ממדית (תלת-ממדית) של GHS מיקרו-נקבובי בצפיפות אריזה נמוכה של HMP מודגמת באמצעות הרכבה עצמית בין-פנים של ננו-חלקיקים הטעונים הטרוגנית.
Introduction
הרכבת אבני בניין של HMP ליצירת פיגומים הנדסיים לרקמות זכתה לתשומת לב עצומה בשנים האחרונות1. GHS, המיוצרים באמצעות הרכבת HMP, הם בעלי תכונות ייחודיות בהשוואה למקביליהם בתפזורת, כולל מיקרופורוזיות בקנה מידה תאי שמקורן בחללים החלקיים בין אבני הבניין הבדידות. תכונות נוספות, כגון יכולת הזרקה, מודולריות ונוקשות מנותקת מנקבוביות, הופכות את GHS לפלטפורמה מבטיחה לשיפור תיקון רקמות והתחדשות2. ביו-חומרים שונים שימשו לייצור GHS, כולל פולימרים סינתטיים מבוססי PEG3,4 ורב-סוכרים, כגון אלגינט5 וחומצה היאלורונית 6,7. מבין הפולימרים ממקור טבעי, הביופולימר מבוסס החלבון הנפוץ ביותר לייצור GHS הוא GelMA 8,9,10,11, חומר ביולוגי12,13 הניתן להצלבה, תואם ביולוגית, דבק ביולוגי ומתכלה.
ניתן לייצר HMPs באמצעות תחליב אצווה8, מיקוד זרימה 14,15 או תחליב שלב9,11 התקנים מיקרופלואידים, ערבוב 16, או coacervationמורכב 17,18. בדרך כלל, יש פשרה בין תפוקת הייצור לבין חד-פיזור HMP. לדוגמה, טכניקת המיזוג מניבה HMPs בעלי צורה לא סדירה ומפוזרים מאוד. תחליב אצווה או קו-סרבציה מורכבת מאפשר ייצור של כמויות גדולות של HMPs כדוריים רב-מפוזרים. התקנים מיקרופלואידים ממוקדי זרימה שימשו לייצור טיפות חד-פזורות מאוד עם מקדם שונות של <5%, אולם התפוקה נמוכה משמעותית. בהתקנים מיקרופלואידים של תחליב צעדים, השלבים המקביליים מאוד מאפשרים ייצור בתפוקה גבוהה של HMPsחד-מפוזרים 19.
אבני הבניין של HMP מג'לטין מעובד Methacryloyl (GelMA) מגיבות לחום וניתנות להצלבה כימית, מה שמאפשר ייצור GHS קל20. עם קירור מתחת לטמפרטורת התמיסה הקריטית העליונה (UCST)21 (למשל, ב-4°C), טיפות המכילות תמיסת GelMA מומרות לקופות חולים מוצלבות פיזית. אבני בניין אלה של HMP נארזות לאחר מכן באמצעות כוחות חיצוניים (למשל, באמצעות צנטריפוגה) כדי להניב מתלי מיקרוג'ל תקועים. קשרים בין חלקיקים נוצרים בין HMPs סמוכים באמצעות קרוסלינקינג כימי (פוטו) ליצירת GHS14 חזק מכנית. אחת התכונות החשובות ביותר של GHS היא מיקרופורוזיות, המאפשרת חדירה קלה של תאים במבחנה11 וצמיחה מוגברת של רקמות in vivo22. הדפסה ביולוגית תלת-ממדית (תלת-ממדית) של HMPs מתבצעת באופן קונבנציונלי באמצעות מתלי מיקרו-ג'ל צפופים, תוך התפשרות על מיקרו-נקבוביות23.
לאחרונה פיתחנו סוג חדש של ביו-דיו גרעיני המבוסס על ננו-הנדסה בין-פנים של מיקרו-ג'לים GelMA באמצעות ספיחה של ננו-חלקיקים טעונים הטרוגנית, ולאחר מכן הרכבה עצמית הפיכה של ננו-חלקיקים. אסטרטגיה זו הופכת מיקרו-ג'לים ארוזים באופן רופף למניבי גזירה ושחול להדפסה ביולוגית תלת-ממדית, המשמרת את הנקבוביות בקנה מידה מיקרוסקולרי של GHS11 המיוצר בתוספים. מאמר זה מציג את השיטות לייצור טיפות GelMA בתפוקה גבוהה, המרת טיפות אלה ל- HMPs מוצלבים פיזית, ייצור HMPs של GelMA באמצעות אבקה ניתנת להשעיה, היווצרות GelMA GHS, הכנת ביודיו גרעיני ננו-מהונדס של GelMA (NGB) והדפסה ביולוגית תלת-ממדית.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים, המכשירים והריאגנטים המשמשים בפרוטוקול זה.
1. סינתזת GelMA
הערה: סינתזת GelMA צריכה להתבצע במכסה אדים כימי, ויש להשתמש בציוד מגן אישי מתאים (PPE) כל הזמן.
- הוסף 200 מ"ל של מלח חוצץ פוספט של Dulbecco (DPBS, 1x) לבקבוק Erlenmeyer וחמם את התמיסה עד שהיא מגיעה 50 ° C. כסו את הבקבוק ברדיד אלומיניום למניעת אידוי.
- הוסף 20 גרם של אבקת ג'לטין לתמיסת DPBS ב 50 ° C תוך ערבוב ב 240 סל"ד עד האבקה מומס לחלוטין.
- הוסף 16, 2.5 או 0.5 מ"ל של מתקרילט אנהידריד (MA) לתמיסת הג'לטין באמצעות פיפטה פסטר זכוכית כדי לסנתז GelMA עם רמה גבוהה, בינונית או נמוכה של החלפת מתקרילויל, בהתאמה.
זהירות: MA הוא חומר מסוכן. יש להשתמש ב- PPE תקין בעת עבודה עם MA. MA הוא גם רגיש לאור, לכן הגן על התגובה מפני אור על ידי עטיפת הבקבוק ברדיד אלומיניום. - לאחר שעתיים, הוסף 400 מ"ל של DPBS ב- 50 ° C כדי לעצור את התגובה. אפשר לערבב להמשיך בטמפרטורה של 50°C למשך 10 דקות.
- יוצקים את התמיסה לתוך צינורות קרום דיאליזה עם חיתוך משקל מולקולרי של 12-14 kDa ולאחר מכן מניחים את הצינור בתוך 5 ליטר מלאה במים טהורים במיוחד של 40 מעלות צלזיוס. מערבבים את המים ב-240 סל"ד וב-40 מעלות צלזיוס.
- Dialyze את התמיסה נגד מים טהורים במיוחד במשך 10 ימים ולשנות את המים 2 פעמים ביום כדי להסיר אנהידריד methacrylate unreacted, תוצרי לוואי, וזיהומים אחרים.
- לאחר 10 ימים, הוסף 400 מ"ל של מים טהורים במיוחד ב 40 ° C לתמיסת GelMA. ערבבו את התמיסה במהירות 240 סל"ד למשך 15 דקות.
- סנן את התמיסה פעמיים באמצעות מסנני קפה, ולאחר מכן סנן ואקום באמצעות יחידת סינון ואקום 0.2 מיקרומטר.
- יוצקים 25 מ"ל של התמיסה המסוננת לתוך צינורות צנטריפוגה 50 מ"ל ולהקפיא אותם ב -80 ° C, הצבת צינורות אופקית.
- לאחר יומיים, להסיר את הכובעים ולכסות את צינורות צנטריפוגה עם מגבונים מעבדה. השתמשו בסרט דבק או בגומייה כדי להחזיק את המגבונים בחוזקה.
- Lyophilize פתרון GelMA קפוא כדי להניב GelMA מוצק לבן.
- כדי לבצע ספקטרוסקופיית תהודה מגנטית גרעינית של פרוטונים (1 H NMR), יש להוסיף בנפרד 30 מ"ג אבקת ג'לטין (בקרה) או GelMA שעבר ליופיליזציה ב-1מ"ל של תחמוצת דאוטריום (D2O) ולשמור על הדגימות בטמפרטורה של 37°C עד שאבקת הג'לטין או הג'ל מומסים לחלוטין.
- קבל את ספקטרום 1 H NMR וקבע את מידתהחלפת המתקרילויל על ידי שילוב חומצות ארומטיות ושיאי פרוטון ליזין מתילן במשמרות כימיות של ~ 6.5-7.5 ו~ 3.0 ppm, בהתאמה. השתמש בשיא החומצות הארומטיות כהפניה וקבע את מידת ההחלפה (DS) באמצעות פסגות ליזין מתילן בהתבסס על משוואה (1):
DS (%) = [1 - (אזור ליזין מתילן בג'למה) / אזור ליזין מתילן בג'לטין)] × 100 (1)
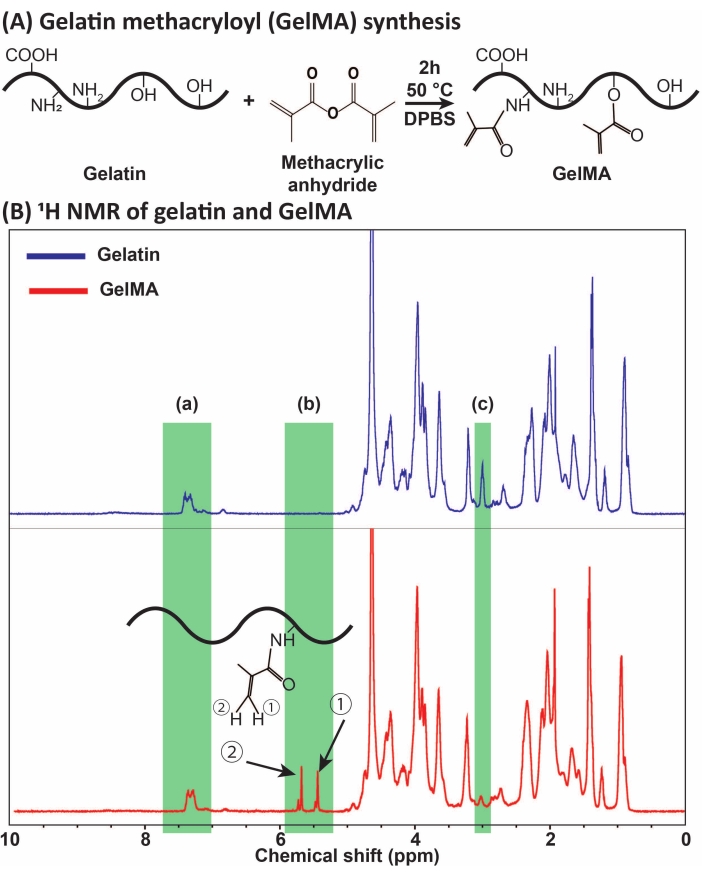
איור 1: סינתזה ואפיון של GelMA. (A) תגובת סינתזת GelMA. ג'לטין שונה עם אנהידריד מתאקרילי ב 50 ° C במשך 2 שעות. (B) ספקטרום התהודה המגנטית הגרעינית של פרוטון (1H NMR) של ג'לטין ו- GelMA: (א) השיא עבור חומצות ארומטיות, שנבחר כנקודת הייחוס לכיול, (ב) הקבוצה הפונקציונלית של ויניל מגיעה לשיאים לאחר שינוי MA של ג'לטין, ו- (ג) השיא עבור חלבוני ליזין. בדוגמה זו, מידת ההחלפה של MA הייתה 71% ± 3% (n = 3). נתון זה שונה באישור Ataie et al.11 קיצורים: GelMA = ג'לטין מתקרילויל; DPBS = מלח חוצץ פוספט של Dulbecco; MA = מתקרילויל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. ייצור מיקרוג'ל GelMA בתפוקה גבוהה
- מיקרו-ייצור עובש מאסטר של התקן
הערה: תבניות מאסטר עשויות להיות מיקרו-פבריקטיביות באמצעות ליתוגרפיה רכה באמצעות סדרת KMPR 1000 photoresist שלילי19.- הפשירו KMPR 1025 ו-1035 למשך הלילה. יש להימנע מחשיפה לאור.
- כדי לצפות את השכבה הראשונה על רקיק, הוסף KMPR 1025 ישירות למרכז הפרוסת כדי ליצור עיגול של כ -5 ס"מ של photoresist. הפעל את מעיל הסחרור ב-3,000 סל"ד למשך 30 שניות.
- אופים רך במשך 12 דקות על פלטה של 100 מעלות צלזיוס. לאחר מכן, מצננים על צלחת הקירור למשך 5 דקות.
- חברו את מסיכת השכבה הראשונה לסודה ליים הריקה, ולאחר מכן חשפו את הפרוסת המצופה לאור UV באמצעות מיישר מסכה לקבלת 645 mJ/cm2 של המינון.
- לאחר האפייה במשך 3 דקות על פלטה של 100 מעלות צלזיוס. מצננים על צלחת הקירור למשך 5 דקות.
הערה: אין לפתח לאחר שלב זה. לפתח רק פעם אחת בסוף התהליך. - סובב את השכבה השנייה על רקיק באמצעות KMPR 1035. הפעל את מעיל הסחרור ב-1,000 סל"ד למשך 30 שניות.
- אופים רך במשך 30 דקות על פלטה של 100 מעלות צלזיוס. מצננים על צלחת הקירור למשך 5 דקות.
- חברו את מסיכת השכבה השנייה לסודה סיד הריקה ויישרו את המסכה השנייה באמצעות היישור באמצעות סימני יישור סטנדרטיים. יש לחשוף לאור UV באמצעות מיישר מסכה עד 2,000 mJ/cm2.
- לאחר האפייה במשך 5 דקות על פלטה של 100 מעלות צלזיוס.
- פיתוח במשך >6 דקות במפתח SU-8.
הערה: אם הוופל נראה חלבי, יש להמשיך בפיתוח במשך זמן רב יותר. השתמש במפתח חדש בכל פעם ובין לבין לקבלת תוצאה טובה יותר. - ריסוס עם איזופרופנול. מוודאים שהוופל צלול, ללא שאריות חלביות. יבשו היטב את הפרוסות באמצעות גז חנקן (N2).
- ייצור התקנים מיקרופלואידים
- מזגו 50 גרם של חלק בסיס פולידימתילסילוקסאן (PDMS) לכוס פלסטיק שקופה. לאחר מכן, להוסיף 5 גרם של crosslinker לכוס פלסטיק. מערבבים במרץ את הבסיס והקרוסלינקר בעזרת מרית עד לקבלת מרקם קרמי.
- יש לשאוב את התערובת באמצעות חומר מייבש למשך 20 דקות עד שהיא מתבהרת. יוצקים את התערובת על תבנית האב, אשר מונחת בפנים ומודבקת לצלחת פטרי.
הערה: ודא שעובי (גובה) PDMS שנשפך הוא ≤8 מ"מ. - הכניסו את צלחת הפטרי למייבש ושאבו שוב את תערובת ה-PDMS למשך 20 דקות עד שכל הבועות יוסרו. מניחים את צלחת הפטרי בתנור של 70°C למשך שעתיים עד שה-PDMS מוצלב. הוציאו את צלחת הפטרי מהתנור ותנו לה להתקרר.
- חותכים את המכשירים מתוך התבנית באמצעות אזמל. נתקו את המכשירים לאט מהתבנית הראשית. השתמש בניקוב הביופסיה (קוטר 1.5 מ"מ) כדי לחתוך חורים דרך הפתחים והשקע.
- הסירו אבק ממכשירי PDMS וממגלשות הזכוכית באמצעות מסקינג טייפ, והניחו את מגלשות הזכוכית והמכשירים בתא ניקוי פלזמה. בצע את טיפול הפלזמה במשך 45 שניות (החל כאשר החדר הופך סגול) עם לחץ אוויר מתחת 400 mTorr. הסר את המגלשות והמכשירים מהתא, הנח את המכשיר על מגלשות הזכוכית והפעל לחץ קל. הכניסו את המכשיר לתנור בטמפרטורה של 70°C למשך 30 דקות כדי לשפר את ההדבקה.
- מלא את המכשירים בטריכלורו (1H,1H,2H,2H-perfluorooctyl)סילאן (F-סילאן, 2% v/v) בנוזל המהונדס כדי להפוך את פני השטח של התעלה לפלואורופיליים. הזריקו את תמיסת F-silane דרך השקע וודאו שכל המכשירים חשופים. המתן 5-10 דקות.
הערה: F-silane צריך להיות מוכן טרי. בנוסף, F-silane לא צריך להיות חשוף לאוויר במשך זמן רב. - שאפו את תמיסת F-silane מתוך המכשיר דרך כניסת התמיסה המימית. שטפו את המכשיר פעמיים באמצעות הנוזל ההנדסי ושאפו שוב. הכניסו את המכשיר לתנור בטמפרטורה של 70°C למשך 30 דקות כדי לאדות את יתרת השמן.
- היווצרות טיפות וייצור מיקרוג'ל GelMA
- הוסף 10 מ"ג של ליתיום פניל-2,4,6-trimethylbenzoylphosphinate (LAP) ל 10 מ"ל של DPBS כדי להכין תמיסת photoinitiator (PI) (0.1% w / v). הגן על התמיסה מפני אור על ידי עטיפתה ברדיד אלומיניום.
- ממיסים את כמות הג'למה הרצויה בתמיסת PI ומכניסים אותה לתנור 37°C למשך שעה עד לקבלת תמיסה ברורה. הגן על התמיסה מפני אור על ידי עטיפה ברדיד אלומיניום.
- כדי להכין את שלב השמן, הכינו 2% v/v של תמיסת פעילי שטח תואמת ביולוגית בנוזל ההנדסי.
- הכנס את צינורות Tygon בכניסות ובשקעים של התקן PDMS. הכנס מחט קהה 25 G בקצה השני של צינורות Tygon עבור כניסות. השתמש באורך הצינור המינימלי האפשרי.
- הניחו את המכשיר מתחת למיקרוסקופ. שמור על הסביבה חמה (~ 40 ° C) באמצעות מייבש שיער ו / או מחמם חלל.
- טען את תמיסות המים והשמן במזרקים נפרדים, המחוברים למכשיר. הפעל את משאבות המזרקים עם ספיקות של 160 ו- 80 מיקרוליטר לדקה עבור פאזות השמן (רציף) והמים (מפוזרים), בהתאמה.
הערה: התחל תחילה את שלב השמן; ודא שהשמן ממלא את התעלה, ואז התחל את השלב המימי. - אספו את הטיפות במיכל והעריכו אותן בתא ההדמיה באמצעות הדמיה במיקרוסקופ אופטי.
- הניחו את הטיפות על 4°C למשך הלילה תוך הגנה עליהן מפני אור כדי להתחיל GelMA HMP crosslinking פיזי ולהמיר את הטיפות למיקרו-ג'לים יציבים ב-4°C.
3. המרת מיקרו-ג'לים לאבקה מתלייה באמצעות טכנולוגיית MEtoP (Microengineered Emulsion-to-powder)
הערה: פותחה טכנולוגיית MEtoP להמרת HMPs מבוססי תחליב שמן במים לאבקת מיקרו-חלקיקים (מיקרו-אירוג'לים) עם תכונות שמורות, כגון יכולת השעיה, צורה, גודל והרכבה.
- כדי ליישם את MEtoP, אסוף את HMPs מוצלבים פיזית בנוזל ההנדסי באמצעות צינורות מיקרוצנטריפוגות עמידים תרמית או cryovials. פתחו את מכסי הצינור ואטמו אותם באמצעות מגבון מעבדה וסרט הדבקה.
- הקפאה עמוקה של HMPs מוצלבים פיזית בחנקן נוזלי (-196°C) למשך 10 דקות.
- העבירו את השפופרות הקפואות למכשיר מייבש הקפאה. Lyophilize את הצינורות בלחץ נמוך (למשל, 0.06 mbar) במשך 6 שעות לפחות כדי להניב אבקה.
הערה: כאשר מחזור הליופיליזציה מסתיים, שבור את הלחץ לאט כדי שהאבקה לא תאבד. - הוסף 1 מ"ל של תמיסת PI מקוררת (0.1% w / v, 4 ° C) לאבקה כדי ליצור תרחיפים מיקרוג'ל. מערבולת במשך 5 שניות, ואז צנטריפוגה ב 3,000 × גרם במשך 15 שניות. השליכו את הסופרנטנט.
- העבירו את מתלה המיקרוג'ל הארוז לתבנית באמצעות פיפטת תזוזה חיובית, ולאחר מכן חשיפה לאור UV באורך גל של 400 ננומטר בעוצמה של 15 mW / cm2 למשך 60 שניות ליצירת GHS.

איור 2: הכנת אבקת מיקרו-חלקיקים GelMA באמצעות טכנולוגיית MEtoP. (A) תמונות של אבקת GelMA המתקבלות מטכנולוגיית MEtoP או מליופיליזציה קונבנציונלית של HMP. בטכנולוגיית MEtoP או בליופיליזציה קונבנציונלית, HMPs מושהים במדיה פעילי שטח או מימיים, בהתאמה. הנוזל ההנדסי מגן על הפאזה המפוזרת (HMPs) מפני צבירה ומשמר את התכונות הפיזיוכימיות של מיקרו-חלקיקי GelMA במהלך ליופיליזציה. (B) המחשה סכמטית של קופות חולים מיובשות שהוכנו באמצעות MEtoP בהשוואה ל-HMP שעבר ליופיליזציה קונבנציונלית בתווך מימי. (C) תמונות SEM של מיקרו-חלקיקי GelMA מיובשים שהוכנו באמצעות MEtoP בהשוואה לליופיליזציה קונבנציונלית. פסי קנה מידה = 2 מ"מ (משמאל; A), 500 מיקרומטר (מימין; A), 10 מיקרומטר (משמאל; C), ו-200 מיקרומטר (מימין; ג). נתון זה שונה באישור שייח'י ואחרים 26 קיצורים: GelMA = ג'לטין מתקרילויל; DPBS = מלח חוצץ פוספט של Dulbecco; MEtoP = תחליב מיקרו-מהונדס לאבקה; HMP = מיקרו-חלקיק הידרוג'ל; SEM = מיקרוסקופ אלקטרונים סורק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. היווצרות GelMA GHS
הערה: פרוטוקול זה מיועד להכנת 400 μL של תרחיף מיקרוג'ל. עבור כמויות גדולות יותר, יש צורך בקנה מידה. כדי לשמור על הצלבה פיזית בין קופות החולים GelMA, יש לבצע את כל השלבים בטמפרטורה של כ-4°C על ידי הנחת מיכלי המיקרוג'ל בדלי מי קרח.
- הוסף 400 μL של תמיסת 1H,1H-perfluoro-1-octanol (PFO) בנוזל ההנדסי (20% v/v) לקופות החולים GelMA מוצלבות פיזית. לאחר מכן, מערבולת עבור 5 שניות וצנטריפוגה עבור 15 שניות ב 300 × גרם.
הערה: יש להכין את תמיסת ה- PFO בנוזל ההנדסי טרי ולאחסן במיכל סגור כדי למנוע אידוי. - הסר את שלב השמן מקופות החולים GelMA באמצעות צנרת.
- הוסף 400 μL של תמיסת PI (0.1% w/v) ב 4 ° C לתרחיף מיקרוג'ל. לאחר מכן, מערבולת במשך 5 שניות וצנטריפוגה ב 300 × גרם במשך 15 שניות. השליכו את השמן לאחר מכן.
- חזור על השלב הקודם אבל צנטריפוגה ב 3,000 × גרם. הסר את הסופרנאטנט של קופות החולים GelMA ארוזות באמצעות פיפטינג.
- העבירו את קופות החולים הארוזות של GelMA לתבנית באמצעות פיפטת תזוזה חיובית, ולאחר מכן חשיפה לאור UV (אורך גל = 400 ננומטר, עוצמה = 15 mW / cm2, זמן חשיפה = 60 שניות).
5. דיו ביולוגי גרעיני ננו-מהונדס (NGB) להדפסה ביולוגית תלת-ממדית של GHS עם מיקרו-נקבוביות שמורה
- הוסף 100 מ"ג של אבקת ננו-טסיות ל-3 מ"ל של מים אולטרה-טהורים בטמפרטורה של 4°C כדי ליצור פיזור ננו-חלקיקים (3.33% w/v). מערבבים את הפיזור במרץ בתוך מקרר בטמפרטורה של 4°C למשך 15 דקות כדי לקלף את הננו-חלקיקים שהצטברו בדרך אחרת. ננו-חלקיקים שעברו קילוף תקין מניבים פיזור ברור.
- יש להמיס 50 מ"ג של LAP ב-5 מ"ל של מים אולטרה-טהורים בטמפרטורה של 4°C להכנת תמיסת PI (1% w/v).
- הוסף 333 μL של תמיסת PI (1% w/v) לפיזור ננו-חלקיקים מתקלפים. יש לעטוף ברדיד אלומיניום כדי להגן מפני אור הסביבה. מערבול במשך דקה אחת כדי לערבב את פיזור הננו-חלקיקים ואת PI. ריכוזי החרסית וה-PI הסופיים הם 3% w/v ו-0.1% w/v, בהתאמה.
- הוסף PFO 20% v/v בנוזל הנדסי (4° C) לספקי הכוח המשולבים פיזית של GelMA ביחס נפח של 1:1. מערבולת ביסודיות במשך 5 שניות. לאחר מכן, צנטריפוגה ב 300 × גרם במשך 15 שניות ולהשליך את שלב הנפט המכיל את פעילי השטח.
- הוסף את פיזור הננו-חלקיקים בתוספת LAP (4 ° C) ל- GelMA HMPs השטופים. מערבולת למשך 15 שניות, צנטריפוגה ב- 3,000 × גרם למשך 15 שניות, והשליך את שארית השמן בתחתית כמו גם את פיזור הסופרנאטנט.
- אחסנו את המתלה בטמפרטורה של 4°C תוך הגנה עליו מפני אור באמצעות רדיד אלומיניום למשך יום אחד. המוצר של שלב זה הוא GelMA NGB.
- טען את ה- NGB לתוך מזרק 3 מ"ל, אטם את המזרק הטעון עם מכסה ופרפילם, ודופק צנטריפוגה ב 200 × גרם כדי להסיר את האוויר הלכוד. העבר את הדיו הביולוגי למחסנית של 3 מ"ל באמצעות מחבר Luer-Lok נקבה-נקבה. צנטריפוגו את המחסנית לזמן קצר במהירות של 200 × גרם שוב כדי להסיר את האוויר הלכוד. שמרו את ה-NGB על 4°C במקרר לפני השימוש.
- לפני הכנת ביו-דיו עמוס תאים, הכינו תרחיף תאים מרוכז (למשל, NIH/3T3 murine fibroblast), המכיל ~24 מיליון תאים ב-100 מיקרוליטר של תווך תרבית תאים. טען את מתלה התא לתוך מזרק 3 מ"ל, חבר את המזרק טעון NGB ואת המזרק טעון התא באמצעות מחבר Luer-Lok נקבה, וערבב את התאים ואת NGB בעדינות על ידי דחיפה קדימה ואחורה 40x.
- הדפס את ה-NGB או ה-NGB עמוס התאים באמצעות מדפסת ביולוגית מתאימה עם פייה חרוטית סטנדרטית. טען את הזרבובית לתוך ראש ההדפסה של 3 מ"ל. שמור על טמפרטורת מיטת ההדפסה מתחת ל-10°C. מטב פרמטרים של הדפסה כגון מהירות ולחץ גב לפני ההדפסה.
- בחר את סוג המצע והזרבובית (מזרק פנאומטי 3 מ"ל מצויד בפייה חרוטית סטנדרטית), כייל את המדפסת הביולוגית באמצעות הנחיות ההתקן, בחר קובץ gcode או STL רצוי והתחל להדפיס.
הערה: בעת ביצוע הדפסה ביולוגית עמוסת תאים, יש לשמור את כל החומרים והמכשירים תחת ארון הבטיחות הביולוגי כדי למזער זיהום. - לאחר ההדפסה, חשוף את המבנה לאור UV עבור photocrosslinking (אורך גל = 400 ננומטר, עוצמה = 15 mW / cm2, זמן חשיפה = 60 s).
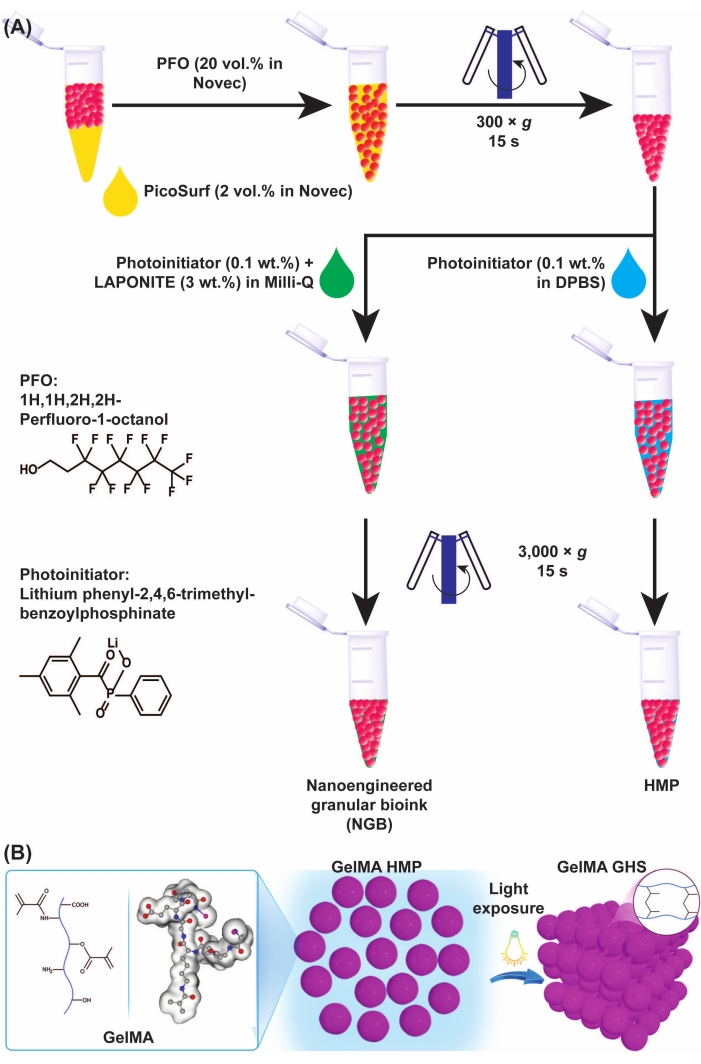
איור 3: סכמות של מיקרו-ג'ל GelMA והיווצרות GHS. (A) סכמות של הפרדת מיקרוג'ל GelMA משמן והכנת NGB. PFO (20% v/v בנוזל הנדסי) נוסף לתחליב שמן מיקרוג'ל GelMA ביחס נפחי של 1:1, ואחריו מערבולות וצנטריפוגות ב 300 × גרם במשך 15 שניות. כדי לייצר GelMA GHS, פתרון PI (LAP 0.1% w/v ב-DPBS) נוסף ל-GelMA HMPs, ואחריו מערבולות וצנטריפוגות ב-3,000 × גרם למשך 15 שניות. להכנת ה-NGB, תמיסת PI (LAP 0.1% w/v במים אולטרה-טהורים) ופיזור ננו-טסיות (3% w/v במים אולטרה-טהורים) נוספו למתלה GelMA HMP, ואחריו מערבולות וצנטריפוגות ב-3,000 × גרם למשך 15 שניות. איור 3A שונה באישור Ataie, Z. et al.11 (B) חשיפת HMPs ארוזים של GelMA לאור מניבה GHS. איור 3B שונה באישור שייח'י ואחרים.15 קיצורים: GelMA = ג'לטין מתקרילויל; GHS = פיגום הידרוג'ל גרגירי; NGB = ביו-דיו גרעיני ננו-מהונדס; PFO = 1H,1H-perfluoro-1-octanol; PI = photoinitiator; LAP = ליתיום פניל-2,4,6-trimethylbenzoylphosphinate; HMP = מיקרו-חלקיק הידרוג'ל; DPBS = מלח חוצץ פוספט של Dulbecco. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
GelMA סונתז באמצעות התגובה של ג'לטין עם MA, כפי שמוצג באיור 1A. על ידי התאמת תנאי התגובה, כגון ריכוז MA, התקבלו דרגות שונות של החלפת MA. כדי לכמת את מידת ההחלפה של MA, GelMA הוערכה באמצעות ספקטרוסקופיית NMR של 1H (איור 1B). קבוצות פונקציונליות ויניל עם שיאים מייצג?...
Access restricted. Please log in or start a trial to view this content.
Discussion
ג'לטין ונגזרותיו הם הביו-חומרים מבוססי החלבון הנפוצים ביותר לייצור HMP. ניתן להתגבר על האתגר של תפוקה לעומת גודל חלקיקים, ניתן להתגבר על פשרה באמצעות התקנים מיקרופלואידים של תחליב צעדים. מכשירים אלה מסוגלים ליצור יותר מ -40 מיליון טיפות בשעה, עם מקדם שונות פחות מ -5% 27. במאמר זה דנו...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
המחברים רוצים להודות לט' פונד, מומחה לתמיכה במחקר במחלקה להנדסה כימית באוניברסיטת פנסילבניה סטייט (פן סטייט), לצוות מעבדת הננו-פבריקציה בפן סטייט, ולד"ר ג'יי דה רוטה מ-Partillion Bioscience על העזרה והדיון בנוגע לתהליכי ננו-פבריקציה. א. שייח'י מודה על תמיכתם של המכון לחקר חומרים (MRI) והמכללה לחומר הנדסי במענקי זרעים ברמה האנושית, מרכז ההתכנסות למערכות חומרים רב-תכליתיות חיות (LiMC2) ואשכול המצוינות בחיים, מערכות חומרים אדפטיביות ואוטונומיות אנרגיה (livMatS) חומרים חיים רב-תכליתיים תוכנית מענקי זרעים למחקר שיתופי, וקרן הסטארט-אפ מפן סטייט. המחקר שדווח בפרסום זה נתמך חלקית על ידי המכון הלאומי לדימות ביו-רפואי וביו-הנדסה (NIBIB) של המכונים הלאומיים לבריאות (NIH) תחת פרס מספר R56EB032672.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
References
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394(2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115(2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122(2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076(2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390(2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , 17/279,283 (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644(2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194(2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076(2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , 17/425,027 (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved