Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Échafaudages d’hydrogel granulaire méthacryloyl de gélatine : fabrication de microgel à haut débit, lyophilisation, assemblage chimique et bio-impression 3D
Dans cet article
Résumé
Cet article décrit les protocoles de fabrication de microgel méthacryloyl à haut débit à l’aide de dispositifs microfluidiques, la conversion de microgels en poudre resuspension (micro-aérogels), l’assemblage chimique de microgels pour former des échafaudages d’hydrogel granulaires et le développement de bio-encres d’hydrogel granulaires avec microporosité préservée pour la bio-impression 3D.
Résumé
L’émergence d’échafaudages d’hydrogel granulaires (SGH), fabriqués par assemblage de microparticules d’hydrogel (HMP), a permis la formation d’échafaudages microporeux in situ. Contrairement aux hydrogels en vrac conventionnels, les pores interconnectés à l’échelle microscopique du SGH facilitent l’infiltration cellulaire indépendante de la dégradation ainsi que le transfert d’oxygène, de nutriments et de sous-produits cellulaires. La gélatine modifiée par le méthacryloyl (GelMA), un biopolymère à base de protéines (photo)chimiquement réticulable contenant de l’adhésif cellulaire et des fractions biodégradables, a été largement utilisé comme biomatériau réactif aux cellules/instructif. La conversion de GelMA en vrac en GHS peut ouvrir une pléthore de possibilités pour l’ingénierie tissulaire et la régénération. Dans cet article, nous démontrons les procédures de fabrication de microgel GelMA à haut débit, de conversion en microgels secs resuspendables (micro-aérogels), de formation de SGH via l’assemblage chimique de microgels et de fabrication de bio-encre granulaire pour la bio-impression par extrusion. Nous montrons comment un traitement physico-chimique séquentiel par refroidissement et photoréticulation permet la formation d’un SGH mécaniquement robuste. Lorsque la lumière est inaccessible (par exemple, lors d’une injection de tissus profonds), les HMP GelMA réticulés individuellement peuvent être assemblés bioorthogonalement par réticulation enzymatique à l’aide de transglutaminases. Enfin, la bioimpression tridimensionnelle (3D) du SGH microporeux à faible densité de tassement HMP est démontrée par l’auto-assemblage interfacial de nanoparticules chargées hétérogènes.
Introduction
L’assemblage de blocs de construction HMP pour former des échafaudages d’ingénierie tissulaire a suscité une attention considérable au cours des dernières années1. Les SGH, fabriqués par assemblage HMP, ont des propriétés uniques par rapport à leurs homologues en vrac, y compris la microporosité à l’échelle de la cellule provenant des espaces vides entre les blocs de construction discrets. Des propriétés supplémentaires, telles que l’injectabilité, la modularité et la rigidité découplée de la porosité, font de GHS une plate-forme prometteuse pour améliorer la réparation et la régénérationdes tissus 2. Différents biomatériaux ont été utilisés pour la fabrication du SGH, y compris les polymères synthétiques à base de PEG3,4 et les polysaccharides, tels que l’alginate5 et l’acide hyaluronique 6,7. Parmi les polymères d’origine naturelle, le biopolymère à base de protéines le plus courant pour la fabrication du SGH est le GelMA 8,9,10,11, un biomatériau réticulable, biocompatible, bioadhésif et biodégradable12,13.
Les HMP peuvent être fabriqués par émulsification discontinue8, focalisation en flux 14,15 ou émulsification par étapes9,11 par mélange, mélange 16, ou coacervation complexe 17,18. Habituellement, il y a un compromis entre le débit de fabrication et la monodispersité HMP. Par exemple, la technique de mélange donne des HMP de forme irrégulière et hautement polydispersées. L’émulsification discontinue ou la coacervation complexe permet la production de grands volumes de HMP sphériques polydispersés. Des dispositifs microfluidiques focalisant l’écoulement ont été utilisés pour fabriquer des gouttelettes hautement monodispersées avec un coefficient de variation de <5%, mais le débit est significativement faible. Dans les dispositifs microfluidiques à émulsification par étapes, les étapes hautement parallélisées permettent la fabrication à haut débit de HMP monodispersés19.
Les blocs de construction HMP de gélatine modifiée au méthacryloyl (GelMA) sont thermoréactifs et (photo)chimiquement réticulables, ce qui facilite la fabrication du SGH20. Lors du refroidissement en dessous de la température supérieure de la solution critique (UCST)21 (par exemple, à 4 °C), les gouttelettes contenant une solution GelMA sont converties en HMP physiquement réticulés. Ces blocs de construction HMP sont ensuite emballés en utilisant des forces externes (par exemple, par centrifugation) pour produire des suspensions de microgel coincées. Des liaisons interparticulaires sont établies entre les HMP adjacentes par réticulation (photo)chimique pour former le SGH14 mécaniquement robuste. L’une des propriétés les plus importantes du SGH est la microporosité, qui permet une pénétration cellulaire facile in vitro11 et une croissance tissulaire améliorée in vivo22. La bio-impression tridimensionnelle (3D) des HMP est classiquement réalisée à l’aide de suspensions de microgel serrées, compromettant la microporosité23.
Nous avons récemment développé une nouvelle classe de bio-encres granulaires basées sur la nano-ingénierie interfaciale des microgels GelMA via l’adsorption de nanoparticules chargées hétérogènement, suivie d’un auto-assemblage réversible de nanoparticules. Cette stratégie rend les microgels emballés en vrac bioimprimables en cisaillement et en extrusion 3D, ce qui préserve la porosité à l’échelle microscopique du GHS11 fabriqué de manière additive. Cet article présente les méthodes de fabrication de gouttelettes GelMA à haut débit, la conversion de ces gouttelettes en HMP physiquement réticulées, la fabrication de HMP GelMA à l’aide de poudre resuspension, la formation de GelMA GHS, la préparation de bioencre granulaire (NGB) nano-ingénierie GelMA et la bioimpression 3D.
Access restricted. Please log in or start a trial to view this content.
Protocole
REMARQUE : Consultez le tableau des matériaux pour plus de détails sur tous les matériaux, instruments et réactifs utilisés dans ce protocole.
1. Synthèse de GelMA
REMARQUE: La synthèse de GelMA doit être effectuée dans une hotte chimique et un équipement de protection individuelle (EPI) approprié doit être utilisé tout le temps.
- Ajouter 200 mL de solution saline tamponnée au phosphate de Dulbecco (DPBS, 1x) dans une fiole d’erlenmeyer et chauffer la solution jusqu’à ce qu’elle atteigne 50 °C. Couvrir le ballon de papier d’aluminium pour éviter l’évaporation.
- Ajouter 20 g de gélatine en poudre à la solution de DPBS à 50 °C tout en agitant à 240 rpm jusqu’à dissolution complète de la poudre.
- Ajouter 16, 2,5 ou 0,5 mL d’anhydride de méthacrylate (MA) à la solution de gélatine goutte à goutte via une pipette Pasteur en verre pour synthétiser GelMA avec un degré élevé, moyen ou faible de substitution de méthacryloyle, respectivement.
ATTENTION : L’AM est une matière dangereuse. Un EPI approprié doit être utilisé lorsque vous travaillez avec l’AM. L’AM est également sensible à la lumière, alors protégez la réaction de la lumière en enveloppant le flacon de papier d’aluminium. - Après 2 h, ajouter 400 mL de DPBS à 50 °C pour arrêter la réaction. Laisser l’agitation se poursuivre à 50 °C pendant 10 min.
- Versez la solution dans un tube à membrane de dialyse avec une coupure de poids moléculaire de 12-14 kDa, puis placez le tube dans un bécher de 5 L rempli d’eau ultrapure à 40 °C. Remuer l’eau à 240 tr/min et 40 °C.
- Dialyser la solution contre l’eau ultrapure pendant 10 jours et changer l’eau 2x par jour pour éliminer l’anhydride de méthacrylate qui n’a pas réagi, les sous-produits et autres impuretés.
- Après 10 jours, ajouter 400 ml d’eau ultrapure à 40 °C à la solution GelMA. Remuer la solution à 240 tr/min pendant 15 min.
- Filtrer la solution deux fois à l’aide de filtres à café, puis filtrer sous vide via une unité de filtration sous vide de 0,2 μm.
- Verser 25 mL de la solution filtrée dans des tubes à centrifuger de 50 mL et les congeler à -80 °C en plaçant les tubes horizontalement.
- Après 2 jours, retirez les bouchons et couvrez les tubes de centrifugation avec des lingettes de laboratoire. Utilisez du ruban adhésif ou un élastique pour tenir fermement les lingettes.
- Lyophiliser la solution congelée de GelMA pour obtenir du GelMA solide blanc.
- Pour effectuer la spectroscopie par résonance magnétique nucléaire protonique (RMN1 H), ajouter séparément 30 mg de poudre de gélatine (témoin) ou de GelMA lyophilisée dans 1 mL d’oxyde de deutérium (D2O) et maintenir les échantillons à 37 °C jusqu’à ce que la poudre de gélatine ou GelMA soit entièrement dissoute.
- Obtenir les spectres RMN 1H et déterminer le degré de substitution du méthacryloyle en intégrant les pics de protons des acides aromatiques et de la lysine méthylène à des décalages chimiques de ~6,5-7,5 et ~3,0 ppm, respectivement. Utiliser le pic d’acides aromatiques comme référence et déterminer le degré de substitution (DS) à l’aide des pics de lysine méthylène sur la base de l’équation (1):
DS (%) = [1 - (Aire de lysine méthylène dans GelMA / Aire de lysine méthylène dans la gélatine)] × 100 (1)
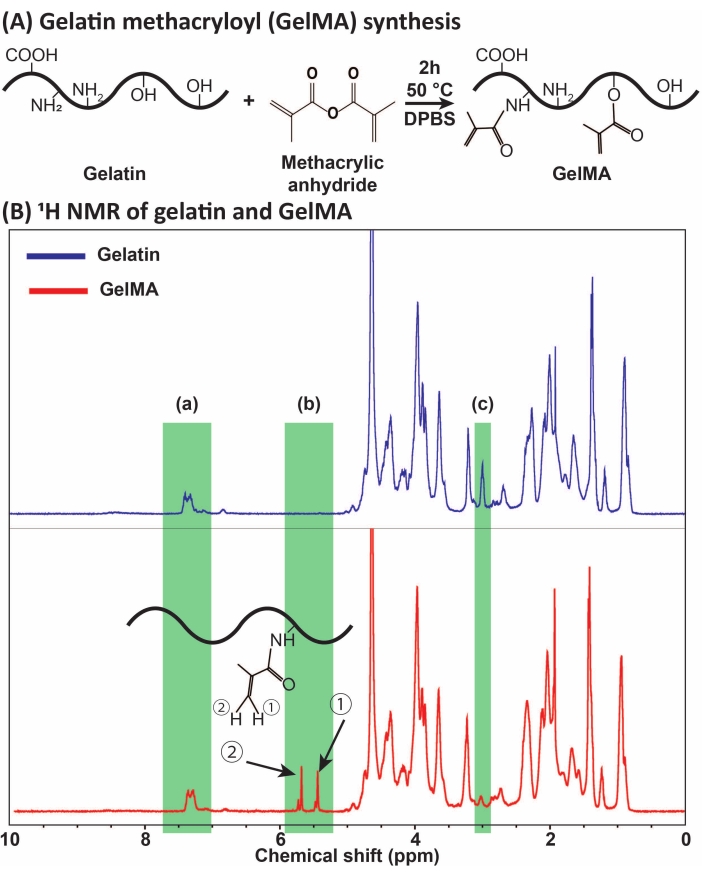
Figure 1 : Synthèse et caractérisation de GelMA. (A) Réaction de synthèse de GelMA. La gélatine est modifiée avec de l’anhydride méthacrylique à 50 °C pendant 2 h. (B) Les spectres de résonance magnétique nucléaire protonique (RMN 1H) de la gélatine et de la GelMA: (a) le pic pour les acides aromatiques, qui est choisi comme référence pour l’étalonnage, (b) les pics du groupe fonctionnel vinylique après la modification MA de la gélatine, et (c) le pic pour les protéines lysine. Dans cet exemple, le degré de substitution de l’AM était de 71 % ± 3 % (n = 3). Cette figure a été modifiée avec la permission d’Ataie et coll.11 Abréviations : GelMA = méthacryloyl de gélatine; DPBS = solution saline tamponnée au phosphate de Dulbecco; MA = méthacryloyl. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Fabrication de microgel GelMA à haut débit
- Microfabrication de moules maîtres de dispositif
NOTE: Les moules maîtres peuvent être microfabriqués par lithographie douce à l’aide de la résine photosensible négative KMPR1000 série 19.- Décongeler KMPR 1025 et 1035 pendant la nuit. Évitez toute exposition à la lumière.
- Pour enduire la première couche sur la plaquette, ajoutez KMPR 1025 directement au milieu de la plaquette pour former un cercle de résine photosensible d’environ 5 cm. Faites fonctionner le spin coater à 3 000 tr/min pendant 30 s.
- Cuire au four pendant 12 min sur une plaque chauffante à 100 °C. Ensuite, refroidissez sur la plaque de refroidissement pendant 5 min.
- Fixez le masque de première couche à la chaux sodée vierge, puis exposez la plaquette enduite à la lumière UV à l’aide d’un aligneur de masque pendant 645 mJ/cm2 de dosage.
- Laisser cuire pendant 3 min sur une plaque chauffante à 100 °C. Laisser refroidir sur la plaque de refroidissement pendant 5 min.
Remarque : Ne pas développer après cette étape. Ne développez qu’une seule fois à la fin du processus. - Enduisez la deuxième couche sur la plaquette à l’aide du KMPR 1035. Faites fonctionner le spin coater à 1 000 tr/min pendant 30 s.
- Cuire mollement pendant 30 min sur une plaque chauffante à 100 °C. Laisser refroidir sur la plaque de refroidissement pendant 5 min.
- Fixez le masque de deuxième couche à la chaux sodée vierge et alignez le deuxième masque à l’aide de l’aligneur à l’aide de panneaux d’alignement standard. Exposez-vous à la lumière UV à l’aide d’un aligneur de masque jusqu’à 2 000 mJ/cm2.
- Cuire pendant 5 min sur une plaque chauffante à 100 °C.
- Développer pendant >6 min dans le développeur SU-8.
REMARQUE: Si la plaquette semble laiteuse, le développement doit être poursuivi plus longtemps. Utilisez un nouveau développeur à chaque fois et entre les deux pour un meilleur résultat. - Pulvériser avec de l’isopropanol. Assurez-vous que la gaufrette est claire, sans résidus laiteux. Sécher soigneusement la plaquette à l’aide d’azote (N2) gazeux.
- Fabrication de dispositifs microfluidiques
- Versez 50 g de pièce de base en polydiméthylsiloxane (PDMS) dans un gobelet en plastique transparent. Ensuite, ajoutez 5 g de réticulation dans le gobelet en plastique. Mélanger vigoureusement la base et la réticulation à l’aide d’une spatule jusqu’à obtention d’une texture crémeuse.
- Dégazer le mélange sous vide à l’aide d’un dessiccateur pendant 20 minutes jusqu’à ce qu’il devienne clair. Versez le mélange sur le moule maître, qui est placé à l’intérieur et collé sur une boîte de Pétri.
REMARQUE: Assurez-vous que l’épaisseur (hauteur) du PDMS coulé est de ≤8 mm. - Mettez la boîte de Petri dans le dessiccateur et dégazez à nouveau le mélange PDMS sous vide pendant 20 minutes jusqu’à ce que toutes les bulles soient éliminées. Placer la boîte de Petri dans un four à 70 °C pendant 2 h jusqu’à ce que le PDMS soit réticulé. Sortez la boîte de Petri du four et laissez-la refroidir.
- Découpez les appareils hors du moule à l’aide d’un scalpel. Détachez lentement les appareils du moule maître. Utilisez le poinçon de biopsie (1,5 mm de diamètre) pour percer des trous à travers les entrées et la sortie.
- Enlevez toute poussière des appareils PDMS et des lames de verre à l’aide de ruban de masquage, et placez les lames de verre et les appareils dans une chambre de nettoyage au plasma. Effectuer le traitement au plasma pendant 45 s (à partir du moment où la chambre devient violette) avec une pression d’air inférieure à 400 mTorr. Retirez les lames et les appareils de la chambre, placez l’appareil sur les lames de verre et appliquez une légère pression. Mettez l’appareil dans l’étuve à 70 °C pendant 30 minutes pour améliorer la liaison.
- Remplir les dispositifs avec du trichloro(1H,1H,2H,2H-perfluorooctyl)silane (F-silane, 2% v/v) dans le fluide d’ingénierie pour rendre la surface du canal fluorophile. Injectez la solution de F-silane à travers la sortie et assurez-vous que tous les appareils sont exposés. Attendez 5-10 min.
NOTE: Le F-silane doit être préparé fraîchement. De plus, le F-silane ne doit pas être exposé à l’air pendant une longue période. - Aspirer la solution de F-silane hors de l’appareil par l’entrée de solution aqueuse. Lavez l’appareil deux fois en utilisant le liquide technique et aspirez à nouveau. Placer l’appareil dans l’étuve à 70 °C pendant 30 min pour évaporer l’huile restante.
- Formation de gouttelettes et fabrication de microgel GelMA
- Ajouter 10 mg de phényl-2,4,6-triméthylbenzoylphosphinate de lithium (LAP) à 10 mL de DPBS pour préparer une solution photoinitiatrice (PI) (0,1 % p/v). Protégez la solution de la lumière en l’enveloppant dans du papier d’aluminium.
- Dissoudre la quantité désirée de GelMA dans la solution PI et la placer dans l’étuve à 37 °C pendant 1 h jusqu’à l’obtention d’une solution limpide. Protégez la solution de la lumière en l’enveloppant dans du papier d’aluminium.
- Pour préparer la phase huileuse, faire une solution de tensioactif biocompatible à 2% v/v dans le fluide d’ingénierie.
- Insérez le tube Tygon dans les entrées et la sortie du périphérique PDMS. Insérez une aiguille émoussée de 25 G à l’autre extrémité du tube Tygon pour les entrées. Utilisez la longueur minimale possible du tube.
- Placez l’appareil sous le microscope. Gardez l’environnement au chaud (~40 °C) à l’aide d’un sèche-cheveux et/ou d’un radiateur.
- Chargez les solutions aqueuses et huileuses dans des seringues séparées, connectées à l’appareil. Démarrez les pompes à seringue avec des débits de 160 et 80 μL/min pour les phases huileuse (continue) et aqueuse (dispersée), respectivement.
REMARQUE: Commencez d’abord la phase huileuse; Assurez-vous que l’huile remplit le canal, puis commencez la phase aqueuse. - Recueillir les gouttelettes dans un récipient et les évaluer dans la chambre d’imagerie par imagerie par imagerie par microscopie optique.
- Placez les gouttelettes à 4 °C pendant la nuit tout en les protégeant de la lumière pour initier la réticulation physique GelMA HMP et convertir les gouttelettes en microgels stables à 4 °C.
3. Conversion des microgels en poudre resuspension via la technologie MEtoP (microengineered emulsion-to-powder)
REMARQUE: La technologie MEtoP pour convertir les HMP à base d’émulsion d’huile dans l’eau en poudre de microparticules (micro-aérogels) avec des propriétés préservées, telles que la remise en suspension, la forme, la taille et l’assemblage, a été développée.
- Pour mettre en œuvre le MEtoP, collectez les HMP physiquement réticulés dans le fluide d’ingénierie à l’aide de tubes microcentrifugés ou de cryovials thermiquement durables. Ouvrez les capuchons du tube et scellez-les avec une lingette de laboratoire et du ruban adhésif.
- Congeler les HMP physiquement réticulés dans de l’azote liquide (-196 °C) pendant 10 min.
- Transférer les tubes surgelés dans un lyophilisateur. Lyophiliser les tubes à basse pression (p. ex. 0,06 mbar) pendant au moins 6 h pour donner de la poudre.
REMARQUE: Lorsque le cycle de lyophilisation est terminé, cassez lentement la pression afin que la poudre ne soit pas perdue. - Ajouter 1 mL de solution de PI refroidie (0,1 % p/v, 4 °C) à la poudre pour obtenir des suspensions de microgel. Vortex pendant 5 s, puis centrifuger à 3 000 × g pendant 15 s. Jetez le surnageant.
- Transférer la suspension de microgel emballée dans un moule à l’aide d’une pipette volumétrique, suivie d’une exposition à la lumière UV à une longueur d’onde de 400 nm avec une intensité de 15 mW/cm2 pendant 60 s pour former le SGH.

Figure 2 : Préparation de la poudre de microparticules GelMA via la technologie MEtoP. (A) Images de poudre de GelMA obtenues à partir de la technologie MEtoP ou de la lyophilisation conventionnelle de HMP. Dans la technologie MEtoP ou la lyophilisation conventionnelle, les HMP sont respectivement en suspension dans un tensioactif à l’huile ou dans un milieu aqueux. Le fluide technique protège la phase dispersée (HMP) de l’agrégation et préserve les propriétés physico-chimiques des microparticules GelMA lors de la lyophilisation. (B) Illustration schématique de HMP séchés préparés via le MEtoP par rapport aux HMP lyophilisés classiquement en milieu aqueux. (C) Images MEB de microparticules GelMA séchées préparées via le MEtoP par rapport à la lyophilisation conventionnelle. Barres d’échelle = 2 mm (à gauche; A), 500 μm (droite; A), 10 μm (gauche; C) et 200 μm (à droite; C). Cette figure a été modifiée avec la permission de Sheikhi et coll.26 Abréviations : GelMA = méthacryloyl de gélatine; DPBS = solution saline tamponnée au phosphate de Dulbecco; MEtoP = émulsion microtechnique en poudre; HMP = microparticule d’hydrogel; MEB = microscopie électronique à balayage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Formation de GelMA GHS
NOTE: Ce protocole est pour la préparation de 400 μL de suspension de microgel. Pour les plus grandes quantités, une mise à l’échelle est nécessaire. Pour maintenir les HMP GelMA physiquement réticulés, toutes les étapes doivent être effectuées à environ 4 °C en plaçant les récipients de microgel dans un seau d’eau glacée.
- Ajouter 400 μL de solution de 1H,1H-perfluoro-1-octanol (PFO) dans le fluide technique (20 % v/v) aux HMP GelMA physiquement réticulés. Ensuite, vortex pendant 5 s et centrifuger pendant 15 s à 300 × g.
REMARQUE : La solution de PFO contenue dans le fluide technique doit être préparée fraîchement et entreposée dans un récipient fermé pour éviter l’évaporation. - Retirez la phase huileuse des HMP GelMA par pipetage.
- Ajouter 400 μL de solution PI (0,1 % p/v) à 4 °C à la suspension de microgel. Ensuite, tourbillonner pendant 5 s et centrifuger à 300 × g pendant 15 s. Jetez l’huile par la suite.
- Répétez l’étape précédente mais centrifugez à 3 000 × g. Retirer le surnageant des HMP GelMA emballés par pipetage.
- Transférer les HMP GelMA emballés dans un moule à l’aide d’une pipette volumétrique, suivi d’une exposition aux rayons UV (longueur d’onde = 400 nm, intensité = 15 mW/cm2, temps d’exposition = 60 s).
5. Bio-encres granulaires nano-modifiées (NGB) pour la bioimpression 3D du SGH avec microporosité préservée
- Ajouter 100 mg de poudre de nanoplaquettes à 3 mL d’eau ultrapure à 4 °C pour former une dispersion de nanoparticules (3,33 % p/v). Vortex la dispersion vigoureusement à l’intérieur d’un réfrigérateur à 4 °C pendant 15 minutes pour exfolier les nanoparticules autrement agrégées. Des nanoparticules correctement exfoliées donnent une dispersion claire.
- Dissoudre 50 mg de LAP dans 5 mL d’eau ultrapure à 4 °C pour préparer une solution mère de PI (1 % p/v).
- Ajouter 333 μL de solution PI (1 % p/v) à la dispersion de nanoparticules exfoliées. Envelopper dans du papier d’aluminium pour protéger contre la lumière ambiante. Vortex pendant 1 min pour mélanger la dispersion des nanoparticules et PI. Les concentrations finales d’argile et d’IP sont respectivement de 3 % p/v et de 0,1 % p/v.
- Ajouter du PFO 20 % v/v dans un fluide technique (4 °C) aux HMP GelMA physiquement réticulés à un rapport de volume de 1:1. Vortex à fond pendant 5 s. Ensuite, centrifuger à 300 × g pendant 15 s et éliminer la phase huileuse contenant l’agent tensioactif.
- Ajouter la dispersion de nanoparticules supplémentée en LAP (4 °C) aux HMP GelMA lavés. Vortex pendant 15 s, centrifuger à 3 000 × g pendant 15 s et éliminer le reste d’huile au fond ainsi que la dispersion surnageante.
- Conserver la suspension à 4 °C tout en la protégeant de la lumière à l’aide de papier aluminium pendant 1 jour. Le produit de cette étape est le GelMA NGB.
- Charger le NGB dans une seringue de 3 mL, sceller la seringue chargée avec un capuchon et un parafilm, et centrifuger à impulsions à 200 × g pour éliminer l’air emprisonné. Transférer la bio-encre dans une cartouche de 3 ml à l’aide d’un connecteur Luer-Lok femelle-femelle. Centrifuger brièvement la cartouche à 200 × g pour éliminer l’air emprisonné. Conservez le NGB à 4 °C au réfrigérateur avant de l’utiliser.
- Avant la préparation de bioencre chargée de cellules, préparer une suspension cellulaire concentrée (p. ex. cellules de fibroblastes murins NIH/3T3), contenant ~24 millions de cellules dans 100 μL de milieu de culture cellulaire. Chargez la suspension cellulaire dans une seringue de 3 mL, couplez la seringue chargée de NGB et la seringue chargée de cellules à l’aide d’un connecteur Luer-Lok femelle-femelle, et mélangez doucement les cellules et le NGB en poussant 40x d’avant en arrière.
- Imprimez le NGB ou le NGB chargé de cellules à l’aide d’une bio-imprimante appropriée avec une buse conique standard. Chargez la buse dans la tête d’impression de 3 mL. Maintenez la température du lit d’impression en dessous de 10 °C. Optimisez les paramètres d’impression tels que la vitesse et la contre-pression avant l’impression.
- Sélectionnez le substrat et le type de buse (seringue pneumatique de 3 mL équipée d’une buse conique standard), calibrez la bioimprimante à l’aide des directives de l’appareil, sélectionnez le gcode ou le fichier STL souhaitable et lancez l’impression.
REMARQUE : Lors de la bio-impression chargée de cellules, tous les matériaux et dispositifs doivent être conservés sous l’enceinte de sécurité biologique afin de minimiser la contamination. - Après l’impression, exposez la construction à la lumière UV pour la photoréticulation (longueur d’onde = 400 nm, intensité = 15 mW/cm2, temps d’exposition = 60 s).
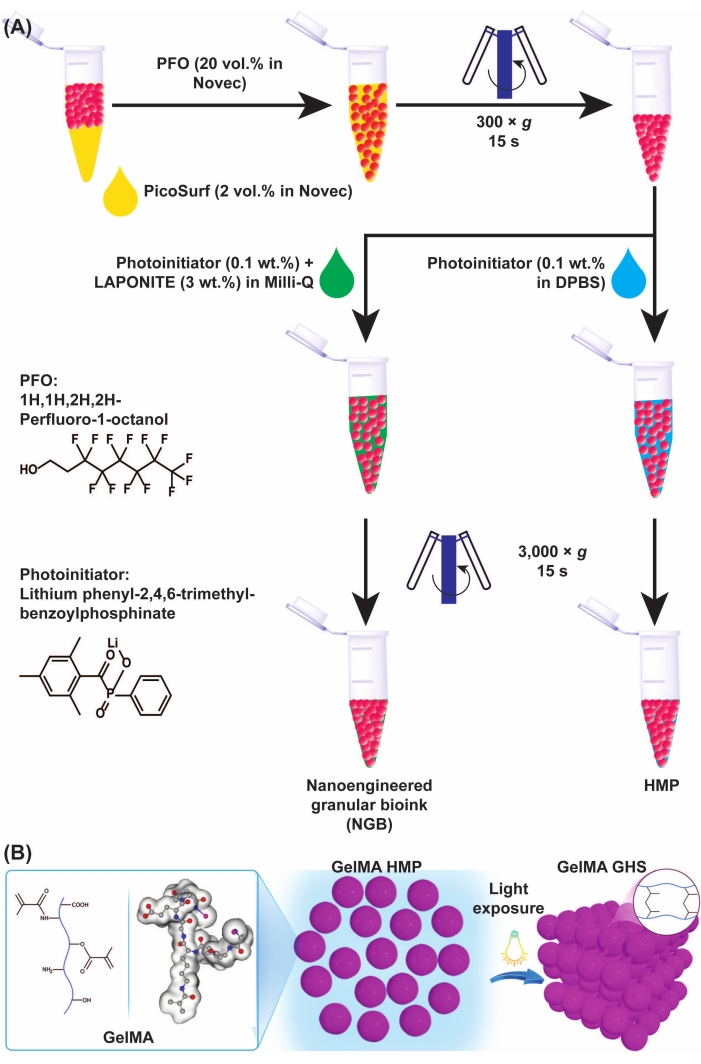
Figure 3 : Schémas de la formation du microgel GelMA et du SGH. (A) Schémas de la séparation du microgel GelMA de la préparation de l’huile et du NGB. Le PFO (20% v/v dans le fluide technique) a été ajouté à l’émulsion microgel-huile GelMA dans un rapport volumétrique de 1:1, suivi d’un vortex et d’une centrifugation à 300 × g pendant 15 s. Pour fabriquer GelMA GHS, la solution PI (LAP 0,1% p/v en DPBS) a été ajoutée aux HMP GelMA, suivie d’un vortex et d’une centrifugation à 3 000 × g pendant 15 s. Pour la préparation du NGB, la solution PI (LAP 0,1 % p/v dans de l’eau ultrapure) et la dispersion nanoplaquettaire (3 % p/v dans de l’eau ultrapure) ont été ajoutées à la suspension GelMA HMP, suivies d’un vortex et d’une centrifugation à 3 000 × g pendant 15 s. La figure 3A a été modifiée avec la permission d’Ataie, Z. et coll.11 (B) L’exposition de HMP GelMA emballés à la lumière donne un SGH. La figure 3B a été modifiée avec la permission de Sheikhi et coll.15 Abréviations : GelMA = méthacryloyl de gélatine; SGH = échafaudage d’hydrogel granulaire; NGB = bio-encre granulaire nano-modifiée; PFO = 1H,1H-perfluoro-1-octanol; PI = photoinitiateur; LAP = phényl-2,4,6-triméthylbenzoylphosphinate de lithium; HMP = microparticule d’hydrogel; DPBS = Solution saline tamponnée au phosphate de Dulbecco. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
GelMA a été synthétisé par la réaction de la gélatine avec l’AM, comme présenté à la figure 1A. En adaptant les conditions de réaction, telles que la concentration d’AM, différents degrés de substitution de MA ont été obtenus. Pour quantifier le degré de substitution de l’AM, GelMA a été évalué par spectroscopie RMN 1H (Figure 1B). Les groupes fonctionnels vinyliques avec des pics représentatifs aux changements chim...
Access restricted. Please log in or start a trial to view this content.
Discussion
La gélatine et ses dérivés sont les biomatériaux à base de protéines les plus couramment utilisés pour la fabrication de HMP. Le défi du compromis entre le débit et la monodispersité granulométrique peut être surmonté à l’aide de dispositifs microfluidiques à émulsification par étapes. Ces appareils sont capables de former plus de 40 millions de gouttelettes par heure, avec un coefficient de variation inférieur à 5%27. Dans cet article, nous avons discuté de la microfabricati...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs aimeraient remercier T. Pond, spécialiste du soutien à la recherche au département de génie chimique de la Pennsylvania State University (Penn State), le personnel du laboratoire de nanofabrication de Penn State et le Dr J. de Rutte de Partillion Bioscience pour leur aide et leur discussion concernant les processus de nanofabrication. A. Sheikhi remercie le soutien du Materials Research Institute (MRI) et du College of Engineering Materials Matter at the Human Level Seed Grants, du Convergence Center for Living Multifunctional Material Systems (LiMC2) et du Cluster of Excellence Living, Adaptive and Energy-autonomous Materials Systems (livMatS) Living Multifunctional Materials Collaborative Research Seed Grant Program, ainsi que du fonds de démarrage de Penn State. La recherche rapportée dans cette publication a été partiellement soutenue par le National Institute of Biomedical Imaging and Bioengineering (NIBIB) des National Institutes of Health (NIH) sous le numéro d’attribution R56EB032672.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Références
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394(2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115(2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122(2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076(2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390(2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , 17/279,283 (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644(2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194(2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076(2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , 17/425,027 (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon