É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Suportes de hidrogel granular de metacriloíla de gelatina: fabricação de microgel de alto rendimento, liofilização, montagem química e bioimpressão 3D
Neste Artigo
Resumo
Este artigo descreve protocolos para a fabricação de microgel de metacriloíla de gelatina de alto rendimento usando dispositivos microfluídicos, conversão de microgéis em pó ressuspendível (micro-aerogéis), montagem química de microgéis para formar arcabouços de hidrogel granular e desenvolvimento de biotintas de hidrogel granulares com microporosidade preservada para bioimpressão 3D.
Resumo
O surgimento de arcabouços granulares de hidrogel (GHS), fabricados via montagem de micropartículas de hidrogel (HMPs), possibilitou a formação de arcabouços microporosos in situ. Ao contrário dos hidrogéis convencionais a granel, os poros de microescala interconectados no GHS facilitam a infiltração celular independente da degradação, bem como a transferência de oxigênio, nutrientes e subprodutos celulares. A gelatina modificada com metacriloíla (GelMA), um biopolímero (foto)quimicamente reticulável, à base de proteínas, contendo adesivo celular e metades biodegradáveis, tem sido amplamente utilizada como biomaterial responsivo/instrutivo a células. A conversão de GelMA em GHS em massa pode abrir uma infinidade de oportunidades para engenharia e regeneração de tecidos. Neste artigo, demonstramos os procedimentos de fabricação de microgel GelMA de alto rendimento, conversão em microgéis secos ressussuspendíveis (micro-aerogéis), formação de GHS através da montagem química de microgéis e fabricação de biotinta granular para bioimpressão por extrusão. Mostramos como um tratamento físico-químico sequencial via resfriamento e fotoreticulação permite a formação de GHS mecanicamente robusto. Quando a luz é inacessível (por exemplo, durante a injeção de tecidos profundos), HMPs de GelMA reticulados individualmente podem ser montados bioortogonalmente via reticulação enzimática usando transglutaminases. Finalmente, a bioimpressão tridimensional (3D) de GHS microporoso em baixa densidade de empacotamento de HMP é demonstrada através da automontagem interfacial de nanopartículas heterogêneamente carregadas.
Introdução
A montagem de blocos de construção HMP para formar arcabouços de engenharia de tecidos ganhou enorme atenção nos últimos anos1. GHS, fabricado via montagem HMP, tem propriedades únicas em comparação com suas contrapartes a granel, incluindo microporosidade em escala celular originada dos espaços vazios entre os blocos de construção discretos. Propriedades adicionais, como injetabilidade, modularidade e rigidez dissociada da porosidade, tornam o GHS uma plataforma promissora para melhorar o reparo e a regeneração tecidual2. Diferentes biomateriais têm sido utilizados para a fabricação de GHS, incluindo polímeros sintéticos à base de PEG3,4 e polissacarídeos, como alginato5 e ácido hialurônico 6,7. Dentre os polímeros naturalmente derivados, o biopolímero proteico mais comum para a fabricação de GHS é o GelMA 8,9,10,11, um biomaterial reticulável, biocompatível, bioadesivo e biodegradável 12,13.
As HMPs podem ser fabricadas através de dispositivos microfluídicos de emulsificação em batelada8, focalização de fluxo 14,15 ou emulsificação em passo9,11, mistura 16 ou coacervação complexa17,18. Normalmente, há um trade-off entre o rendimento de fabricação e a monodispersidade do HMP. Por exemplo, a técnica de mistura produz HMPs de forma irregular e altamente polidispersas. A emulsificação em batelada ou coacervação complexa permite a produção de grandes volumes de HMPs esféricas polidispersas<. Em dispositivos microfluídicos de emulsificação em etapas, as etapas altamente paralelizadas permitem a fabricação de HMPs monodispersas19.
Os blocos de construção HMP de gelatina modificada com metacriloíla (GelMA) são termorresponsivos e (foto)quimicamente reticuláveis, permitindo a fácil fabricação de GHS20. Após o resfriamento abaixo da temperatura crítica superior da solução (UCST)21 (por exemplo, a 4 °C), gotículas contendo uma solução de GelMA são convertidas em HMPs reticuladas fisicamente. Esses blocos de construção HMP são então embalados usando forças externas (por exemplo, via centrifugação) para produzir suspensões de microgel emperradas. Ligações interparticuladas são estabelecidas entre HMPs adjacentes via reticulação (foto)química para formar GHS14 mecanicamente robusto. Uma das propriedades mais importantes do GHS é a microporosidade, permitindo fácil penetração celular in vitro11 e maior crescimento tecidual in vivo22. A bioimpressão tridimensional (3D) de HMPs é convencionalmente realizada utilizando suspensões de microgel bem embaladas, comprometendo a microporosidade23.
Recentemente, desenvolvemos uma nova classe de biotintas granulares baseada na nanoengenharia interfacial de microgéis GelMA via adsorção de nanopartículas heterogêneamente carregadas, seguida de automontagem reversível de nanopartículas. Essa estratégia torna os microgéis vagamente embalados produzindo cisalhamento e extrusão 3D bioimprimíveis, o que preserva a porosidade em microescala do GHS11 fabricado aditivamente. Este artigo apresenta os métodos para fabricação de gotículas de GelMA de alto rendimento, convertendo essas gotículas em HMPs fisicamente reticuladas, fabricando HMPs de GelMA usando pó ressuspendível, formação de GelMA GHS, preparação de biotinta granular nanoprojetada (NGB) de GelMA e bioimpressão 3D.
Protocolo
NOTA: Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, instrumentos e reagentes usados neste protocolo.
1. Síntese de GelMA
NOTA: A síntese de GelMA deve ser realizada em uma capela de fumaça química, e equipamentos de proteção individual (EPIs) adequados devem ser usados o tempo todo.
- Adicionar 200 ml de solução salina tamponada com fosfato de Dulbecco (DPBS, 1x) a um balão de Erlenmeyer e aquecer a solução até atingir 50 °C. Cubra o balão com papel alumínio para evitar a evaporação.
- Adicionar 20 g de gelatina em pó à solução de DPBS a 50 °C, agitando a 240 rpm até dissolver completamente o pó.
- Adicionar 16, 2,5 ou 0,5 mL de anidrido de metacrilato (MA) à solução de gelatina gota a gota através de uma pipeta de vidro Pasteur para sintetizar GelMA com um alto, médio ou baixo grau de substituição de metacriloíla, respectivamente.
CUIDADO: A MA é um material perigoso. EPIs adequados devem ser usados ao trabalhar com MA. O MA também é sensível à luz, portanto, proteja a reação da luz envolvendo o frasco com papel alumínio. - Após 2 h, adicionar 400 mL de DPBS a 50 °C para interromper a reação. Deixe a agitação continuar a 50 °C durante 10 min.
- Despeje a solução em um tubo de membrana de diálise com corte de peso molecular de 12-14 kDa e, em seguida, coloque o tubo em um copo de 5 L preenchido com água ultrapura a 40 °C. Mexa a água a 240 rpm e 40 °C.
- Dialise a solução contra água ultrapura por 10 dias e troque a água 2x ao dia para remover anidrido de metacrilato não reagido, subprodutos e outras impurezas.
- Após 10 dias, adicionar 400 ml de água ultrapura a 40 °C à solução de GelMA. Agite a solução a 240 rpm durante 15 min.
- Filtrar a solução duas vezes usando filtros de café, seguidos de filtração a vácuo através de uma unidade de filtração a vácuo de 0,2 μm.
- Deite 25 ml da solução filtrada em tubos centrífugos de 50 ml e congele-os a -80 °C, colocando os tubos horizontalmente.
- Após 2 dias, retire as tampas e cubra os tubos da centrífuga com lenços umedecidos de laboratório. Use fita adesiva ou um elástico para segurar bem os lenços.
- Liofilizar a solução congelada de GelMA para produzir GelMA sólido branco.
- Para realizar espectroscopia de ressonância magnética nuclear de prótons (RMN de 1 H), adicionar separadamente 30 mg de gelatina em pó (controle) ou GelMA liofilizado em 1mL de óxido de deutério (D2O) e manter as amostras a 37 °C até que o pó de gelatina ou GelMA esteja totalmente dissolvido.
- Obter os espectros de RMN de 1H e determinar o grau de substituição de metacriloíla integrando os picos de ácidos aromáticos e prótons de metileno lisina em deslocamentos químicos de ~6,5-7,5 e ~3,0 ppm, respectivamente. Utilizar como referência o pico de ácidos aromáticos e determinar o grau de substituição (DS) utilizando picos de lisina de metileno com base na equação (1):
DS (%) = [1 - (Área de lisina metileno em GelMA / Área de lisina metileno em gelatina)] × 100 (1)
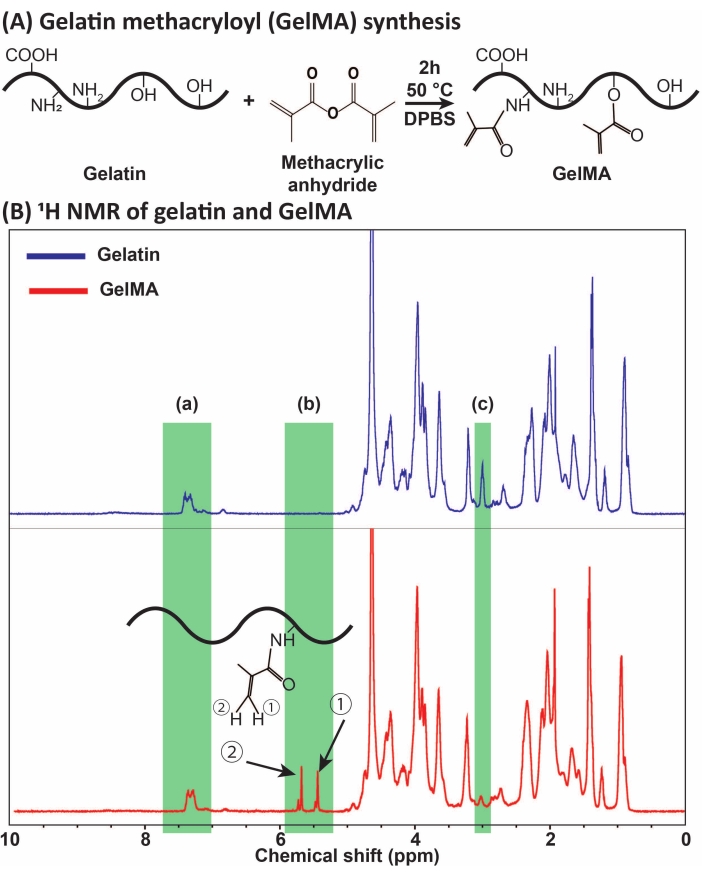
Figura 1: Síntese e caracterização do GelMA. (A) Reação de síntese do GelMA. A gelatina é modificada com anidrido metacrílico a 50 °C por 2 h. (B) Os espectros de ressonância magnética nuclear de prótons (RMN de 1H) da gelatina e do GelMA: (a) o pico para ácidos aromáticos, que é selecionado como referência para calibração, (b) picos do grupo funcional vinil após a modificação da MA da gelatina, e (c) o pico para proteínas de lisina. Neste exemplo, o grau de substituição da MA foi de 71% ± 3% (n = 3). Essa figura foi modificada com permissão de Ataie et al.11 Abreviaturas: GelMA = gelatina metacriloil; DPBS = solução salina tamponada com fosfato de Dulbecco; MA = metacriloil. Clique aqui para ver uma versão maior desta figura.
2. Fabricação de microgel GelMA de alto rendimento
- Microfabricação de molde mestre de dispositivo
NOTA: Os moldes mestres podem ser microfabricados através de litografia suave utilizando o fotorresiste negativo KMPR 1000 série19.- Descongele KMPR 1025 e 1035 durante a noite. Evite qualquer exposição à luz.
- Para revestir a primeira camada do wafer, adicione KMPR 1025 diretamente no meio do wafer para fazer um círculo de aproximadamente 5 cm de fotorresistência. Execute o revestidor de giro a 3.000 rpm por 30 s.
- Leve ao forno por 12 min em uma placa de aquecimento a 100 °C. Em seguida, esfrie na placa de resfriamento por 5 min.
- Fixe a máscara de primeira camada à cal sodada em branco e, em seguida, exponha o wafer revestido à luz UV usando um alinhador de máscara para 645 mJ/cm2 de dosagem.
- Leve ao forno por 3 min em uma placa de aquecimento de 100 °C. Esfriar na placa de resfriamento por 5 min.
Observação : não desenvolver após esta etapa. Desenvolva apenas uma vez ao final do processo. - Gire revestir a segunda camada sobre o wafer usando o KMPR 1035. Execute o revestidor de giro a 1.000 rpm por 30 s.
- Leve ao forno por 30 min em uma placa de aquecimento de 100 °C. Esfriar na placa de resfriamento por 5 min.
- Fixe a máscara de segunda camada à cal sodada em branco e alinhe a segunda máscara usando o alinhador através de sinais de alinhamento padrão. Expor à luz UV usando um alinhador de máscara até 2.000 mJ/cm2.
- Leve ao forno por 5 min em uma placa de aquecimento de 100 °C.
- Desenvolva por >6 min no desenvolvedor SU-8.
NOTA: Se o wafer parecer leitoso, o desenvolvimento deve ser continuado por mais tempo. Use o novo desenvolvedor sempre e entre eles para obter um resultado melhor. - Borrifar com isopropanol. Certifique-se de que o wafer está limpo, sem resíduos leitosos. Secar bem o wafer usando gás nitrogênio (N2).
- Fabricação de dispositivos microfluídicos
- Despeje 50 g de parte da base de polidimetilsiloxano (PDMS) em um copo plástico transparente. Em seguida, adicione 5 g do reticulante ao copo plástico. Misture a base e o reticulante usando uma espátula vigorosamente até obter uma textura cremosa.
- Desgaseifique a mistura a vácuo usando um exsicador por 20 min até que fique clara. Despeje a mistura sobre o molde mestre, que é colocado dentro e colado em uma placa de Petri.
NOTA: Certifique-se de que a espessura (altura) do PDMS derramado é de ≤8 mm. - Coloque a placa de Petri no exsicador e desgaseifique a mistura de PDMS novamente por 20 min até que todas as bolhas sejam removidas. Colocar a placa de Petri num forno a 70 °C durante 2 h até que o PDMS seja reticulado. Retire a placa de Petri do forno e deixe esfriar.
- Corte os dispositivos para fora do molde usando um bisturi. Retire os dispositivos lentamente do molde mestre. Use o punch de biópsia (1,5 mm de diâmetro) para cortar orifícios através das entradas e da saída.
- Remova qualquer poeira dos dispositivos PDMS e das lâminas de vidro usando fita adesiva e coloque as lâminas de vidro e os dispositivos em uma câmara de limpeza de plasma. Realizar o tratamento a plasma por 45 s (começando quando a câmara fica roxa) com pressão de ar abaixo de 400 mTorr. Retire as corrediças e os dispositivos da câmara, coloque o dispositivo sobre as lâminas de vidro e aplique uma leve pressão. Coloque o dispositivo no forno a 70 °C por 30 min para melhorar a colagem.
- Encha os dispositivos com tricloro(1H,1H,2H,2H-perfluorooctil)silano (F-silano, 2% v/v) no fluido projetado para tornar a superfície do canal fluorofílica. Injete a solução de silano F através da saída e certifique-se de que todos os dispositivos estão expostos. Aguarde 5-10 min.
NOTA: F-silano deve ser preparado na hora. Além disso, o silano F não deve ser exposto ao ar por muito tempo. - Aspirar a solução de silano F para fora do dispositivo através da entrada da solução aquosa. Lave o dispositivo duas vezes usando o fluido de engenharia e aspirar novamente. Colocar o dispositivo no forno a 70 °C durante 30 minutos para evaporar o óleo restante.
- Formação de gotículas e fabricação de microgel GelMA
- Adicionar 10 mg de fenil-2,4,6-trimetilbenzoilfosfinato de lítio (LAP) a 10 ml de DPBS para preparar uma solução de fotoiniciador (PI) (0,1% p/v). Proteja a solução da luz envolvendo-a em papel alumínio.
- Dissolver a quantidade desejada de GelMA na solução PI e colocá-la no forno a 37 °C durante 1 h até obter uma solução límpida. Proteja a solução da luz envolvendo-a em papel alumínio.
- Para preparar a fase oleosa, faça um v/v de 2% de solução de surfactante biocompatível no fluido de engenharia.
- Insira a tubulação Tygon nas entradas e saídas do dispositivo PDMS. Introduza uma agulha romba de 25 G na outra extremidade do tubo Tygon para entradas. Use o menor comprimento de tubulação possível.
- Coloque o dispositivo sob o microscópio. Mantenha o ambiente aquecido (~40 °C) usando um secador de cabelo e/ou um aquecedor de ambiente.
- Coloque as soluções aquosas e oleosas em seringas separadas, conectadas ao dispositivo. Acionar as bombas de seringa com vazões de 160 e 80 μL/min para as fases oleosa (contínua) e aquosa (dispersa), respectivamente.
NOTA: Inicie a fase oleosa primeiro; Certifique-se de que o óleo preenche o canal e, em seguida, inicie a fase aquosa. - Coletar as gotículas em um recipiente e avaliá-las na câmara de imagem por microscopia óptica.
- Coloque as gotículas a 4 °C durante a noite, protegendo-as da luz para iniciar a reticulação física GelMA HMP e converter as gotículas em microgéis estáveis a 4 °C.
3. Conversão de microgéis em pó ressuspendível através da tecnologia de emulsão em pó microengenharia (MEtoP)
NOTA: A tecnologia MEtoP para converter HMPs à base de emulsão de óleo em água em pó de micropartículas (micro-aerogéis) com propriedades preservadas, como ressuspensividade, forma, tamanho e montagem, foi desenvolvida.
- Para implementar o MEtoP, colete as HMPs reticuladas fisicamente no fluido de engenharia usando tubos de microcentrífuga termicamente duráveis ou criovials. Abra as tampas dos tubos e seque-as com um lenço e fita adesiva de laboratório.
- Congelar profundamente as HMPs reticuladas fisicamente em nitrogênio líquido (-196 °C) por 10 min.
- Transfira os tubos congelados por flash para um instrumento de liofilização. Liofilizar os tubos a baixa pressão (por exemplo, 0,06 mbar) por pelo menos 6 h para produzir pó.
NOTA: Quando o ciclo de liofilização terminar, quebre a pressão lentamente para que o pó não seja perdido. - Adicionar 1 ml de solução de PI resfriada (0,1% p/v, 4 °C) ao pó para fazer suspensões de microgel. Vórtice por 5 s, depois centrifugar a 3.000 × g por 15 s. Descarte o sobrenadante.
- Transfira a suspensão de microgel embalada para um molde usando uma pipeta de deslocamento positivo, seguida de exposição à luz UV no comprimento de onda de 400 nm com uma intensidade de 15 mW/cm2 por 60 s para formar GHS.

Figura 2: Preparação do pó de micropartículas GelMA via tecnologia MEtoP. (A) Imagens do pó de GelMA obtidas da tecnologia MEtoP ou liofilização convencional de HMP. Na tecnologia MEtoP ou liofilização convencional, as HMPs são suspensas em meio óleo-surfactante ou aquoso, respectivamente. O fluido de engenharia protege a fase dispersa (HMPs) da agregação e preserva as propriedades físico-químicas das micropartículas de GelMA durante a liofilização. (B) Ilustração esquemática de HMPs secas preparadas via MEtoP comparadas com HMP liofilizadas convencionalmente em meio aquoso. (C) Imagens de microscopia eletrônica de varredura de micropartículas secas de GelMA preparadas via MEtoP em comparação com liofilização convencional. Barras de escala = 2 mm (esquerda; A), 500 μm (direita; A), 10 μm (esquerda; C) e 200 μm (direita; C). Essa figura foi modificada com permissão de Sheikhi et al.26 Abreviaturas: GelMA = gelatina metacriloil; DPBS = solução salina tamponada com fosfato de Dulbecco; MEtoP = emulsão em pó microprojetada; HMP = micropartícula de hidrogel; MEV = microscopia eletrônica de varredura. Clique aqui para ver uma versão maior desta figura.
4. Formação de GelMA GHS
NOTA: Este protocolo destina-se à preparação de 400 μL de suspensão de microgel. Para quantidades maiores, é necessário aumentar a escala. Para manter os HMPs GelMA fisicamente reticulados, todas as etapas devem ser executadas a cerca de 4 °C colocando os recipientes de microgel em um balde de água gelada.
- Adicionar 400 μL de solução de 1H,1H-perfluoro-1-octanol (PFO) no fluido de engenharia (20% v/v) aos HMPs GelMA reticulados fisicamente. Em seguida, vórtice por 5 s e centrífuga por 15 s a 300 × g.
NOTA: A solução de PFO no fluido de engenharia deve ser preparada na hora e armazenada em um recipiente fechado para evitar a evaporação. - Remova a fase oleosa dos HMPs GelMA através de pipetagem.
- Adicionar 400 μL de solução de PI (0,1% p/v) a 4 °C à suspensão de microgel. Em seguida, vórtice por 5 s e centrifugação a 300 × g por 15 s. Descarte o óleo depois.
- Repita o passo anterior, mas centrifugue a 3.000 × g. Remova o sobrenadante de HMPs GelMA embalados através de pipetagem.
- Transferir os HMPs GelMA embalados para um molde usando uma pipeta de deslocamento positivo, seguida de exposição à luz UV (comprimento de onda = 400 nm, intensidade = 15 mW/cm2, tempo de exposição = 60 s).
5. Biotintas granulares nanoprojetadas (NGB) para a bioimpressão 3D de GHS com microporosidade preservada
- Adicionar 100 mg de pó de nanoplaquetas a 3 mL de água ultrapura a 4 °C para formar uma dispersão de nanopartículas (3,33% p/v). Vórtice a dispersão vigorosamente dentro de um frigorífico a 4 °C durante 15 minutos para esfoliar as nanopartículas de outro modo agregadas. Nanopartículas adequadamente esfoliadas produzem uma dispersão clara.
- Dissolver 50 mg de LAP em 5 mL de água ultrapura a 4 °C para preparar uma solução de PI estoque (1% p/v).
- Adicionar 333 μL de solução de PI (1% p/v) à dispersão de nanopartículas esfoliadas. Embrulhe em papel alumínio para proteger contra a luz ambiente. Vórtice por 1 min para misturar a dispersão de nanopartículas e PI. As concentrações finais de argila e IP são de 3% p/v e 0,1% p/v, respectivamente.
- Adicione PFO 20% v/v em fluido de engenharia (4 °C) aos HMPs GelMA reticulados fisicamente em uma relação de volume de 1:1. Vórtice completamente por 5 s. Em seguida, centrifugar a 300 × g por 15 s e descartar a fase oleosa que contém o tensoativo.
- Adicione a dispersão de nanopartículas suplementada com ALP (4 °C) aos HMPs GelMA lavados. Vórtice por 15 s, centrífuga a 3.000 × g por 15 s e descarte o óleo restante no fundo, bem como a dispersão sobrenadante.
- Guarde a suspensão a 4 °C, protegendo-a da luz usando papel alumínio durante 1 dia. O produto desta etapa é o GelMA NGB.
- Coloque o NGB em uma seringa de 3 mL, sele a seringa carregada com tampa e parafilme e centrífugo de pulso a 200 × g para remover o ar aprisionado. Transfira a biotinta para um cartucho de 3 mL usando um conector Luer-Lok fêmea-fêmea. Centrifugar o cartucho brevemente a 200 × g novamente para remover o ar preso. Mantenha o NGB a 4 °C no frigorífico antes de utilizar.
- Antes da preparação de biotinta carregada de células, prepare uma suspensão celular concentrada (por exemplo, células de fibroblastos murinos NIH/3T3), contendo ~24 milhões de células em 100 μL de meio de cultura celular. Coloque a suspensão celular em uma seringa de 3 mL, acople a seringa carregada com NGB e a seringa carregada com célula usando um conector Luer-Lok fêmea-fêmea e misture as células e o NGB suavemente empurrando para frente e para trás 40x.
- Imprima o NGB ou NGB carregado de células usando uma bioimpressora apropriada com um bico cônico padrão. Coloque o bocal na cabeça de impressão de 3 mL. Mantenha a temperatura da cama de impressão abaixo de 10 °C. Otimize os parâmetros de impressão, como velocidade e contrapressão , antes da impressão.
- Selecione o substrato e o tipo de bico (seringa pneumática de 3 mL equipada com bico cônico padrão), calibre a bioimpressora usando as diretrizes do dispositivo, selecione o arquivo gcode ou STL desejável e inicie a impressão.
NOTA: Ao realizar a bioimpressão carregada de células, todos os materiais e dispositivos devem ser mantidos sob o gabinete de segurança biológica para minimizar a contaminação. - Após a impressão, expor a construção à luz UV para fotoreticulação (comprimento de onda = 400 nm, intensidade = 15 mW/cm2, tempo de exposição = 60 s).
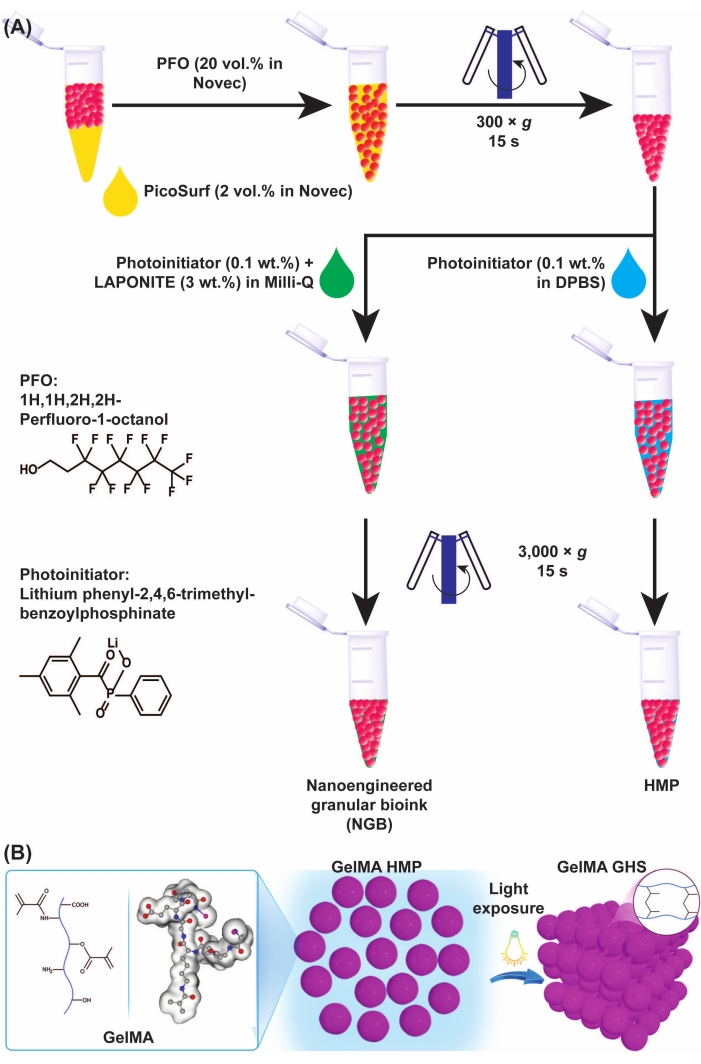
Figura 3: Esquemas de formação de microgel GelMA e GHS. (A) Esquemas da separação de microgel GelMA da preparação de óleo e NGB. PFO (20% v/v em fluido de engenharia) foi adicionado à emulsão de óleo de microgel GelMA na proporção volumétrica de 1:1, seguido de vórtice e centrifugação a 300 × g por 15 s. Para a confecção do GelMA GHS, a solução de IP (LAP 0,1% p/v em DPBS) foi adicionada aos HMPs do GelMA, seguida de vórtice e centrifugação a 3.000 × g por 15 s. Para o preparo do NGB, a solução de IP (LAP 0,1% p/v em água ultrapura) e a dispersão de nanoplaquetas (3% p/v em água ultrapura) foram adicionadas à suspensão GelMA HMP, seguida de vórtice e centrifugação a 3.000 × g por 15 s. A Figura 3A foi modificada com permissão de Ataie, Z. et al.11 (B) A exposição de HMPs embalados de GelMA à luz produz GHS. A Figura 3B foi modificada com permissão de Sheikhi et al.15 Abreviaturas: GelMA = gelatina metacriloil; GHS = arcabouço de hidrogel granular; NGB = biotinta granular nanoprojetada; FOP = 1H,1H-perfluoro-1-octanol; IP = fotoiniciador; LAP = fenil-2,4,6-trimetilbenzoilfosfinato de lítio; HMP = micropartícula de hidrogel; DPBS = solução salina tamponada com fosfato de Dulbecco. Clique aqui para ver uma versão maior desta figura.
Resultados
O GelMA foi sintetizado através da reação da gelatina com MA, conforme apresentado na Figura 1A. Adaptando-se as condições de reação, tais como a concentração de MA, diferentes graus de substituição de MA foram obtidos. Para quantificar o grau de substituição da MA, o GelMA foi avaliado por espectroscopia de RMN de 1H (Figura 1B). Grupos funcionais de vinil com picos representativos nos deslocamentos químicos de ~5-6 ppm confir...
Discussão
A gelatina e seus derivados são os biomateriais proteicos mais comumente utilizados para a fabricação de HMP. O desafio do trade-off de monodispersidade de produção versus tamanho de partícula pode ser superado usando dispositivos microfluídicos de emulsificação por etapas. Esses dispositivos são capazes de formar mais de 40 milhões de gotículas por hora, com coeficiente de variação inferior a 5%27. Neste artigo, discutimos a microfabricação de gotículas contendo soluções de Gel...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Os autores gostariam de agradecer a T. Pond, especialista em apoio à pesquisa do Departamento de Engenharia Química da Universidade Estadual da Pensilvânia (Penn State), à equipe do Laboratório de Nanofabricação da Penn State e ao Dr. J. de Rutte da Partillion Bioscience pela ajuda e discussão sobre os processos de nanofabricação. A. Sheikhi agradece o apoio do Materials Research Institute (MRI) e da College of Engineering Materials Matter at the Human Level seed grants, do Convergence Center for Living Multifunctional Material Systems (LiMC2) e do Cluster of Excellence Living, Adaptive and Energy-autonomous Materials Systems (livMatS) Living Multifunctional Materials Collaborative Research Seed Grant Program, e do fundo de startups da Penn State. A pesquisa relatada nesta publicação foi parcialmente apoiada pelo Instituto Nacional de Imagem Biomédica e Bioengenharia (NIBIB) dos Institutos Nacionais de Saúde (NIH) sob o número de prêmio R56EB032672.
Materiais
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Referências
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394 (2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115 (2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122 (2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076 (2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390 (2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644 (2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071 (2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076 (2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados