Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Желатиновые метакрилоилгранулированные гидрогелевые каркасы: высокопроизводительное изготовление микрогелей, лиофилизация, химическая сборка и 3D-биопечать
В этой статье
Резюме
В данной статье описываются протоколы изготовления высокопроизводительных желатиновых метакрилоиловых микрогелей с использованием микрофлюидных устройств, превращения микрогелей в ресуспендируемый порошок (микроаэрогели), химической сборки микрогелей с образованием гранулированных гидрогелевых каркасов и разработки гранулированных гидрогелевых биочернил с сохраненной микропористостью для 3D-биопечати.
Аннотация
Появление гранулированных гидрогелевых каркасов (GHS), изготовленных путем сборки гидрогелевых микрочастиц (HMP), позволило образовать микропористые каркасы in situ. В отличие от обычных объемных гидрогелей, взаимосвязанные микромасштабные поры в СГС облегчают независимую от деградации клеточную инфильтрацию, а также перенос кислорода, питательных веществ и клеточных побочных продуктов. Модифицированный метакрилоилом желатин (GelMA), (фото)химически сшиваемый биополимер на основе белка, содержащий клеточный клей и биоразлагаемые фрагменты, широко используется в качестве клеточно-чувствительного / инструктивного биоматериала. Преобразование объемного GelMA в GHS может открыть множество возможностей для тканевой инженерии и регенерации. В этой статье мы демонстрируем процедуры высокопроизводительного изготовления микрогелей GelMA, превращения в ресуспендируемые сухие микрогели (микроаэрогели), формирования GHS путем химической сборки микрогелей и изготовления гранулированных биочернил для экструзионной биопечати. Мы показываем, как последовательная физико-химическая обработка с помощью охлаждения и фотосшивания позволяет формировать механически прочную СГС. Когда свет недоступен (например, во время глубокой инъекции в ткани), индивидуально сшитые HMP GelMA могут быть биоортогонально собраны с помощью ферментативного сшивания с использованием трансглутаминаз. Наконец, трехмерная (3D) биопечать микропористых GHS при низкой плотности упаковки HMP демонстрируется с помощью межфазной самосборки гетерогенных заряженных наночастиц.
Введение
Сборка строительных блоков HMP для формирования каркасов тканевой инженерии привлекла огромное внимание в последние несколько лет1. GHS, изготовленные с помощью сборки HMP, обладают уникальными свойствами по сравнению со своими объемными аналогами, включая микропористость в масштабе ячейки, происходящую из пустых пространств среди дискретных строительных блоков. Дополнительные свойства, такие как инъекционность, модульность и отделенная жесткость от пористости, делают GHS многообещающей платформой для улучшения восстановления и регенерации тканей2. Для изготовления СГС использовались различные биоматериалы, в том числе синтетические полимеры на основе ПЭГ3,4 и полисахариды, такие как альгинат5 и гиалуроновая кислота 6,7. Среди полимеров природного происхождения наиболее распространенным биополимером на основе белка для изготовления СГС является GelMA 8,9,10,11, сшиваемый, биосовместимый, биоадгезивный и биоразлагаемый биоматериал 12,13.
ГМП могут быть изготовлены с помощью периодического эмульгирования 8, фокусировкипотока 14,15 или ступенчатого эмульгирования9,11 микрофлюидных устройств, смешивания 16 или комплексной коацервации17,18. Обычно существует компромисс между производительностью производства и монодисперсностью HMP. Например, метод смешивания позволяет получить ГМП неправильной формы и с высокой полидисперсностью. Периодическое эмульгирование или сложное коацервация позволяет производить большие объемы полидисперсных сферических ГМП. Микрофлюидные устройства, фокусирующие поток, использовались для изготовления высокомонодисперсных капель с коэффициентом вариации <5%, однако пропускная способность значительно ниже. В микрофлюидных устройствах ступенчатого эмульгирования ступени с высокой степенью распараллеливания обеспечивают высокую пропускную способность изготовления монодисперсных HMP19.
Модифицированные метакрилоилом желатиновые (GelMA) строительные блоки HMP являются термочувствительными и (фото)химически сшиваемыми, что позволяет легко изготавливать СГС20. При охлаждении ниже верхней критической температуры раствора (UCST)21 (например, при 4 °C) капли, содержащие раствор GelMA, превращаются в физически сшитые HMP. Затем эти строительные блоки HMP упаковываются с использованием внешних сил (например, с помощью центрифугирования) с образованием застрявших микрогелевых суспензий. Межчастичные связи устанавливаются между соседними HMP посредством (фото)химического сшивания с образованием механически прочного GHS14. Одним из наиболее важных свойств СГС является микропористость, обеспечивающая легкое проникновение клеток in vitro11 и усиленное врастание тканей in vivo22. Трехмерная (3D) биопечать ГМП обычно выполняется с использованием плотно упакованных микрогелевых суспензий, что снижает микропористость23.
Недавно мы разработали новый класс гранулированных биочернил, основанный на межфазной наноинженерии микрогелей GelMA путем адсорбции гетерогенных заряженных наночастиц с последующей обратимой самосборкой наночастиц. Эта стратегия делает неплотно упакованные микрогели пригодными для сдвига и экструзии 3D-биопечати, что сохраняет микромасштабную пористость GHS11, изготовленного аддитивно. В этой статье представлены методы высокопроизводительного изготовления капель GelMA, преобразования этих капель в физически сшитые HMP, изготовления HMP GelMA с использованием ресуспендируемого порошка, формирования GelMA GHS, получения наноинженерных гранулированных биочернил GelMA (NGB) и 3D-биопечати.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Смотрите Таблицу материалов для получения подробной информации обо всех материалах, инструментах и реагентах, используемых в этом протоколе.
1. Синтез GelMA
ПРИМЕЧАНИЕ: Синтез GelMA должен проводиться в химическом вытяжном шкафу, и следует постоянно использовать надлежащие средства индивидуальной защиты (СИЗ).
- Добавьте 200 мл фосфатного буферного физиологического раствора Dulbecco (DPBS, 1x) в колбу Эрленмейера и нагрейте раствор до тех пор, пока он не достигнет 50 ° C. Накройте колбу алюминиевой фольгой, чтобы предотвратить испарение.
- Добавьте 20 г желатинового порошка в раствор DPBS при 50 °C, помешивая при 240 об/мин до полного растворения порошка.
- Добавьте 16, 2,5 или 0,5 мл метакрилатного ангидрида (МА) в раствор желатина по каплям через стеклянную пастеровскую пипетку для синтеза GelMA с высокой, средней или низкой степенью замещения метакрилоила соответственно.
ВНИМАНИЕ: MA является опасным материалом. При работе с МА следует использовать соответствующие СИЗ. MA также чувствителен к свету, поэтому защитите реакцию от света, обернув колбу алюминиевой фольгой. - Через 2 часа добавьте 400 мл DPBS при 50 ° C, чтобы остановить реакцию. Продолжайте перемешивать при температуре 50 °C в течение 10 минут.
- Вылейте раствор в диализную мембранную трубку с отсечкой молекулярной массы 12-14 кДа, а затем поместите трубку в стакан объемом 5 л, заполненный сверхчистой водой с температурой 40 °C. Перемешайте воду при 240 об/мин и 40 °C.
- Диализируйте раствор против сверхчистой воды в течение 10 дней и меняйте воду 2 раза в день, чтобы удалить непрореагировавший метакрилатный ангидрид, побочные продукты и другие примеси.
- Через 10 дней добавьте в раствор GelMA 400 мл сверхчистой воды при 40 °C. Перемешивайте раствор при 240 об/мин в течение 15 мин.
- Дважды отфильтруйте раствор с помощью кофейных фильтров с последующей вакуумной фильтрацией с помощью вакуумной фильтрации 0,2 мкм.
- Налейте 25 мл отфильтрованного раствора в центрифужные пробирки объемом 50 мл и заморозьте их при -80 °C, расположив пробирки горизонтально.
- Через 2 дня снимите колпачки и накройте пробирки центрифуги лабораторными салфетками. Используйте скотч или резинку, чтобы плотно удерживать салфетки.
- Лиофилизируйте замороженный раствор GelMA для получения белого твердого GelMA.
- Для проведения спектроскопии протонного ядерного магнитного резонанса (1 Н ЯМР) отдельно добавьте 30 мг желатинового порошка (контроль) или лиофилизированного GelMA в 1мл оксида дейтерия (D2O) и поддерживайте образцы при 37 ° C до полного растворения желатинового порошка или GelMA.
- Получение спектровЯМР 1 Н и определение степени замещения метакрилоила путем интегрирования пиков ароматических кислот и лизинметиленовых протонов при химических сдвигах ~ 6,5-7,5 и ~ 3,0 частей на миллион соответственно. Используйте пик ароматических кислот в качестве эталона и определите степень замещения (DS), используя пики лизинметилена на основе уравнения (1):
DS (%) = [1 - (Площадь лизинметилена в GelMA / Площадь лизинметилена в желатине)] × 100 (1)
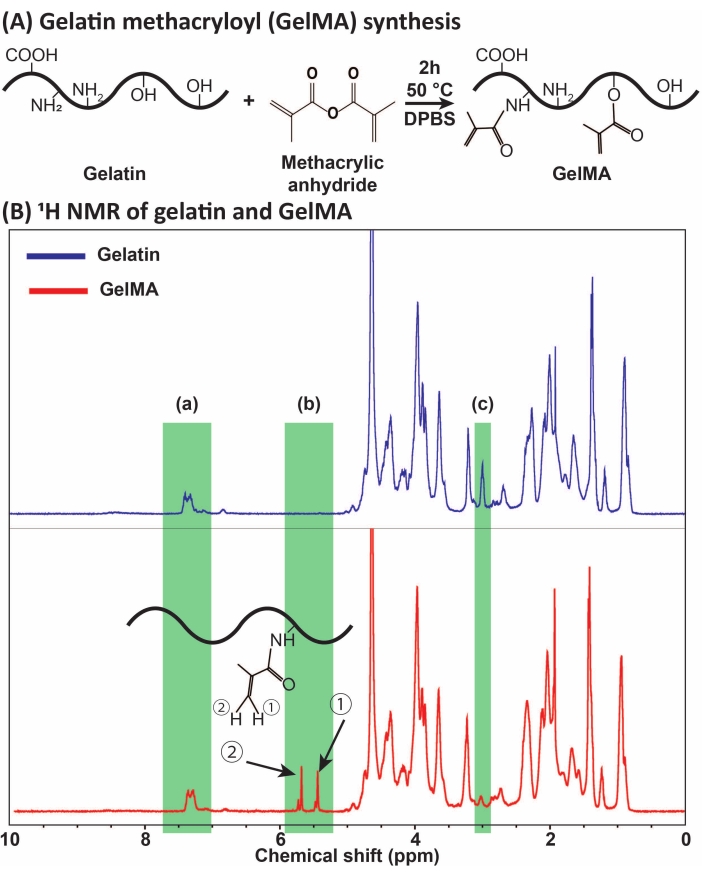
Рисунок 1: Синтез и характеристика GelMA . (A) Реакция синтеза GelMA. Желатин модифицируют метакриловым ангидридом при 50 °C в течение 2 ч. (B) Спектры протонного ядерного магнитного резонанса (1Н ЯМР) желатина и GelMA: (а) пик для ароматических кислот, который выбран в качестве эталона для калибровки, (б) пики виниловой функциональной группы после модификации MA желатина и (c) пик для белков лизина. В этом примере степень замещения MA составила 71% ± 3% (n = 3). Этот рисунок был изменен с разрешения Ataie et al.11 Сокращения: GelMA = желатинметакрилоил; DPBS = фосфатно-буферный физиологический раствор Дульбекко; MA = метакрилоил. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Высокопроизводительное производство микрогеля GelMA
- Устройство микроизготовления мастер-формы
ПРИМЕЧАНИЕ: Мастер-формы могут быть изготовлены на микрооснове с помощью мягкой литографии с использованием негативного фоторезиста KMPR1000 серии 19.- Оттепель KMPR 1025 и 1035 за ночь. Избегайте воздействия света.
- Чтобы покрыть первый слой на пластине, добавьте KMPR 1025 непосредственно в середину пластины, чтобы получился круг фоторезиста длиной около 5 см. Запустите отжимную машину с покрытием со скоростью 3 000 об/мин в течение 30 с.
- Выпекать 12 минут на плите с температурой 100 °C. Затем охладите на охлаждающей плите в течение 5 минут.
- Прикрепите маску первого слоя к пустой натронной извести, затем подвергните пластину с покрытием ультрафиолетовому излучению с помощью выравнивателя маски для дозировки 645 мДж /см2 .
- Выпекайте 3 минуты на плите с температурой 100 °C. Охладите на охлаждающей пластине в течение 5 минут.
ПРИМЕЧАНИЕ: Не развивайтесь после этого шага. Развивайте только один раз в конце процесса. - Нанесите второй слой на пластину с помощью KMPR 1035. Запустите машину для отжима с частотой вращения 1 000 об/мин в течение 30 секунд.
- Мягкая выпекать 30 минут на плите с температурой 100 °C. Охладите на охлаждающей пластине в течение 5 минут.
- Прикрепите маску второго слоя к пустой натронной извести и выровняйте вторую маску с помощью элайнера с помощью стандартных знаков выравнивания. Подвергайте воздействию ультрафиолетового излучения с помощью выравнивателя маски до 2,000 мДж/см2.
- Выпекайте 5 минут на плите с температурой 100 °C.
- Разработка в течение >6 мин в проявителе СУ-8.
ПРИМЕЧАНИЕ: Если пластина выглядит молочной, разработку следует продолжать в течение более длительного времени. Используйте свежий разработчик каждый раз и между ними для лучшего результата. - Опрыскать изопропанолом. Убедитесь, что пластина прозрачная, без остатков молока. Тщательно высушите пластину с использованием газообразного азота (N2).
- Изготовление микрофлюидных устройств
- Налейте 50 г базовой части полидиметилсилоксана (ПДМС) в прозрачный пластиковый стаканчик. Затем добавьте 5 г сшивающего агента в пластиковый стаканчик. Энергично перемешайте основу и сшивающий агент лопаткой до получения кремовой текстуры.
- Вакуумную дегазацию смеси с помощью эксикатора в течение 20 минут до тех пор, пока она не станет прозрачной. Вылейте смесь в мастер-форму, которую помещают внутрь и приклеивают к чашке Петри.
ПРИМЕЧАНИЕ: Убедитесь, что толщина (высота) заливаемого PDMS составляет ≤8 мм. - Поместите чашку Петри в эксикатор и снова вакуумируйте дегазацию смеси PDMS в течение 20 минут, пока не будут удалены все пузырьки. Поместите чашку Петри в печь с температурой 70 °C на 2 часа до тех пор, пока PDMS не будет сшита. Достаньте чашку Петри из духовки и дайте ей остыть.
- Вырежьте устройства из формы с помощью скальпеля. Медленно отсоедините устройства от мастер-формы. Используйте пуансон для биопсии (диаметр 1,5 мм), чтобы прорезать отверстия во входных и выходных отверстиях.
- Удалите пыль с устройств PDMS и предметных стекол с помощью малярной ленты и поместите предметные стекла и устройства в камеру плазменного очистителя. Выполняйте плазменную обработку в течение 45 с (начиная с того момента, когда камера становится фиолетовой) при давлении воздуха менее 400 мТорр. Извлеките предметные стекла и устройства из камеры, поместите устройство на предметные стекла и слегка надавите. Поместите устройство в духовку при температуре 70 °C на 30 минут, чтобы улучшить сцепление.
- Заполните устройства трихлор(1H,1H,2H,2H,2H-перфтороктил)силаном (F-силан, 2% об./об.) в инженерной жидкости, чтобы сделать поверхность канала флюорофильной. Введите раствор F-силана через выпускное отверстие и убедитесь, что все устройства открыты. Подождите 5-10 минут.
ПРИМЕЧАНИЕ: F-силан должен быть приготовлен свежим. Кроме того, F-силан не должен подвергаться длительному воздействию воздуха. - Аспирируйте раствор F-силана из устройства через вход водного раствора. Дважды вымойте устройство инженерной жидкостью и снова аспирируйте. Поместите устройство в духовку с температурой 70 °C на 30 минут, чтобы испарить оставшееся масло.
- Образование капель и изготовление микрогеля GelMA
- Добавьте 10 мг фенил-2,4,6-триметилбензоилфосфината лития (LAP) к 10 мл DPBS для приготовления раствора фотоинициатора (PI) (0,1% мас. / об.). Защитите раствор от света, завернув его в алюминиевую фольгу.
- Растворите желаемое количество GelMA в растворе PI и поместите его в духовку с температурой 37 °C на 1 ч до получения прозрачного раствора. Защитите раствор от света, завернув в алюминиевую фольгу.
- Чтобы приготовить масляную фазу, сделайте 2% v/v биосовместимого раствора поверхностно-активного вещества в инженерной жидкости.
- Вставьте трубку Tygon во входные и выходные отверстия устройства PDMS. Вставьте тупую иглу 25 G в другой конец трубки Tygon для впускных отверстий. Используйте минимально возможную длину трубки.
- Поместите прибор под микроскоп. Поддерживайте тепло окружающей среды (~ 40 ° C) с помощью фена и / или обогревателя.
- Загрузите водный и масляный растворы в отдельные шприцы, подключенные к устройству. Запускайте шприцевые насосы с расходом 160 и 80 мкл / мин для масляной (непрерывной) и водной (дисперсной) фаз соответственно.
ПРИМЕЧАНИЕ: Сначала запустите масляную фазу; Убедитесь, что масло заполняет канал, затем начните водную фазу. - Соберите капли в контейнер и оцените их в камере визуализации с помощью оптической микроскопии.
- Поместите капли при температуре 4 ° C на ночь, защищая их от света, чтобы инициировать физическое сшивание GelMA HMP и преобразовать капли в стабильные микрогели при 4 ° C.
3. Преобразование микрогелей в ресуспендируемый порошок с помощью микроинженерной технологии «эмульсия-порошок» (MEtoP)
ПРИМЕЧАНИЕ: Была разработана технология MEtoP для преобразования ГМП на основе масляной эмульсии воды в порошок микрочастиц (микроаэрогели) с сохраненными свойствами, такими как ресуспендируемость, форма, размер и сборка.
- Для реализации MEtoP соберите физически сшитые HMP в конструкционную жидкость с помощью термопрочных микроцентрифужных пробирок или криовиалов. Откройте крышки пробирок и запечатайте их лабораторной салфеткой и скотчем.
- Глубоко заморозьте физически сшитые ГМП в жидком азоте (-196 °C) в течение 10 минут.
- Перенесите трубки мгновенной заморозки в сублимационную сушилку. Лиофилизируют пробирки при низком давлении (например, 0,06 мбар) в течение не менее 6 ч для получения порошка.
ПРИМЕЧАНИЕ: Когда цикл лиофилизации завершится, медленно снижайте давление, чтобы порошок не потерялся. - Добавьте 1 мл охлажденного раствора PI (0,1% мас./об., 4 °C) в порошок для получения микрогелевых суспензий. Вихрь в течение 5 с, затем центрифуга при 3000 × г в течение 15 с. Откажитесь от надосадочной жидкости.
- Перенесите упакованную микрогелевую суспензию в форму с помощью пипетки с положительным вытеснением с последующим воздействием ультрафиолетового излучения на длине волны 400 нм с интенсивностью 15 мВт/см2 в течение 60 с с с образованием СГС.

Рисунок 2: Приготовление порошка микрочастиц GelMA по технологии MEtoP. (A) Изображения порошка GelMA, полученные с помощью технологии MEtoP или обычной лиофилизации HMP. В технологии MEtoP или обычной лиофилизации HMP суспендируются в масляном поверхностно-активном веществе или водной среде соответственно. Конструкционная жидкость защищает дисперсную фазу (ГМП) от агрегации и сохраняет физико-химические свойства микрочастиц GelMA при лиофилизации. (B) Схематическое изображение высушенных ГМП, приготовленных с помощью MEtoP, по сравнению с традиционно лиофилизированным HMP в водной среде. (C) СЭМ-изображения высушенных микрочастиц GelMA, полученных с помощью MEtoP, по сравнению с обычной лиофилизацией. Масштабные линейки = 2 мм (слева; А), 500 мкм (справа; А), 10 мкм (слева; C) и 200 мкм (справа; C). Этот рисунок был изменен с разрешения Sheikhi et al.26 Сокращения: GelMA = желатинметакрилоил; DPBS = фосфатно-буферный физиологический раствор Дульбекко; MEtoP = микроинженерная эмульсия в порошок; HMP = микрочастица гидрогеля; СЭМ = сканирующая электронная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Формирование GelMA GHS
ПРИМЕЧАНИЕ: Этот протокол предназначен для приготовления 400 мкл микрогелевой суспензии. Для больших количеств необходимо масштабирование. Чтобы сохранить физически сшитые HMP GelMA, все этапы следует выполнять при температуре около 4 ° C, поместив контейнеры с микрогелями в ведро с ледяной водой.
- Добавьте 400 мкл раствора 1H,1H-перфтор-1-октанола (PFO) в инженерную жидкость (20% об./об.) к физически сшитым HMP GelMA. Затем вихрь в течение 5 с и центрифуга в течение 15 с при 300 × г.
ПРИМЕЧАНИЕ: Раствор ПФО в технической жидкости следует готовить свежим способом и хранить в закрытом контейнере для предотвращения испарения. - Удалите масляную фазу из GelMA HMP с помощью пипетки.
- Добавьте 400 мкл раствора PI (0,1% мас./об.) при 4 °C к микрогелевой суспензии. Затем вихревая в течение 5 с и центрифуга при 300 × г в течение 15 с. После этого выбросьте масло.
- Повторите предыдущий шаг, но центрифугу на 3000 × г. Удалите надосадочную жидкость упакованных HMP GelMA с помощью пипетки.
- Перенесите упакованные HMP GelMA в форму с помощью пипетки прямого вытеснения с последующим воздействием ультрафиолетового излучения (длина волны = 400 нм, интенсивность = 15 мВт/см2, время воздействия = 60 с).
5. Наноинженерные гранулированные биочернила (NGB) для 3D-биопечати GHS с сохраненной микропористостью
- Добавьте 100 мг порошка нанотромбоцитов в 3 мл сверхчистой воды с температурой 4 °C, чтобы получить дисперсию наночастиц (3,33% мас./об.). Энергично встряхните дисперсию в холодильнике с температурой 4 °C в течение 15 минут, чтобы отшелушить агрегированные наночастицы. Правильно отслоенные наночастицы дают четкую дисперсию.
- Растворите 50 мг LAP в 5 мл сверхчистой воды с температурой 4 °C, чтобы приготовить исходный раствор PI (1% мас./об.).
- Добавьте 333 мкл раствора PI (1% мас./об.) к дисперсии расслоенных наночастиц. Заверните в алюминиевую фольгу для защиты от окружающего света. Встряхните в течение 1 мин, чтобы смешать дисперсию наночастиц и PI. Конечные концентрации глины и PI составляют 3% мас./об. и 0,1% мас./об., соответственно.
- Добавьте PFO 20% v/v в конструкционную жидкость (4 °C) к физически сшитым HMP GelMA в объемном соотношении 1:1. Тщательно перемешайте в течение 5 с. Затем центрифугу при 300 × г в течение 15 с и отбрасывают масляную фазу, содержащую поверхностно-активное вещество.
- Добавьте дисперсию наночастиц с добавлением LAP (4 °C) в промытые HMP GelMA. Vortex в течение 15 с, центрифугу при 3,000 × г в течение 15 с и выбросьте оставшееся масло на дне, а также надосадочную дисперсию.
- Храните суспензию при температуре 4 °C, защищая ее от света алюминиевой фольгой в течение 1 дня. Продуктом этого шага является GelMA NGB.
- Загрузите NGB в шприц объемом 3 мл, запечатайте загруженный шприц колпачком и парапленкой и включите импульсную центрифугу на 200 × г , чтобы удалить захваченный воздух. Перенесите биочернила на картридж объемом 3 мл с помощью разъема Луэра-Лока «мама-мама». Снова кратковременно центрифугируйте картридж на 200 × г , чтобы удалить захваченный воздух. Перед использованием храните NGB при температуре 4 °C в холодильнике.
- Перед подготовкой биочернил, нагруженной клетками, приготовьте концентрированную клеточную суспензию (например, клетки мышиных фибробластов NIH / 3T3), содержащую ~ 24 миллиона клеток в 100 мкл среды для культивирования клеток. Загрузите клеточную суспензию в шприц объемом 3 мл, соедините шприц, загруженный NGB, и шприц, загруженный клетками, с помощью соединителя Luer-Lok «мама-мама», и осторожно перемешайте клетки и NGB, нажимая вперед и назад 40 раз.
- Распечатайте NGB или NGB с ячейками с помощью подходящего биопринтера со стандартным коническим соплом. Загрузите сопло в печатающую головку объемом 3 мл. Поддерживайте температуру печатного стола ниже 10 °C. Оптимизируйте параметры печати, такие как скорость и противодавление , перед печатью.
- Выберите подложку и тип сопла (пневматический шприц объемом 3 мл, оснащенный стандартным коническим соплом), откалибруйте биопринтер, следуя инструкциям по устройству, выберите желаемый файл gcode или STL и начните печать.
ПРИМЕЧАНИЕ: При выполнении клеточной биопечати все материалы и устройства должны храниться под шкафом биологической безопасности, чтобы свести к минимуму загрязнение. - После печати подвергните конструкцию воздействию ультрафиолета для фотосшивания (длина волны = 400 нм, интенсивность = 15 мВт/см2, время экспозиции = 60 с).
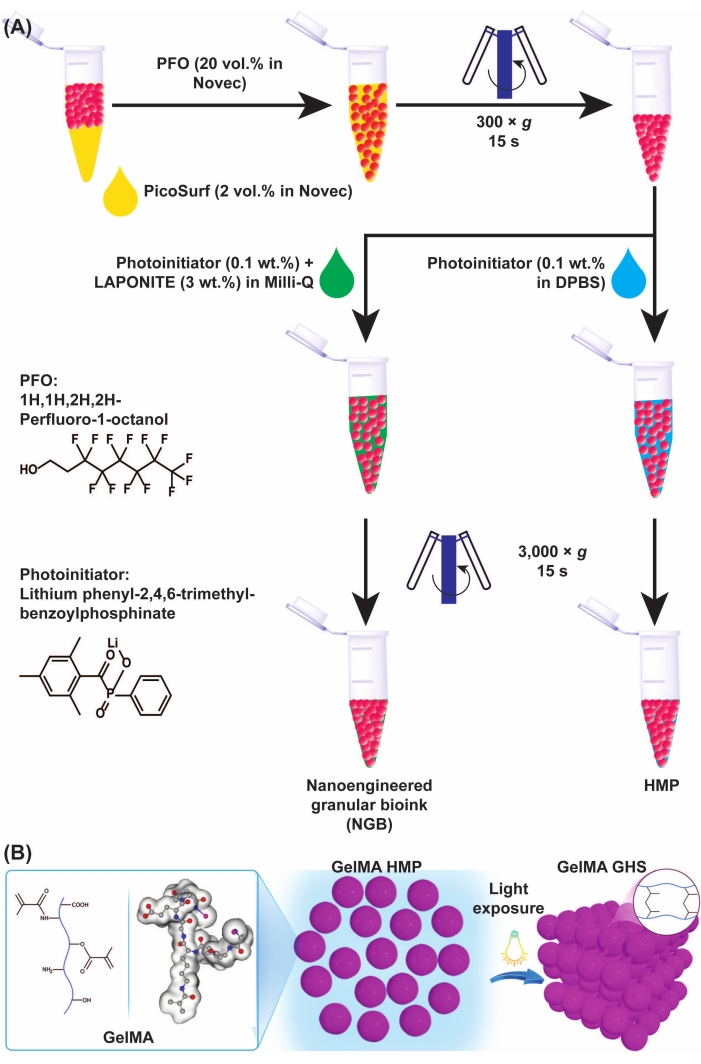
Рисунок 3: Схемы формирования микрогеля GelMA и СГС. (A) Схемы отделения микрогеля GelMA от масла и получения NGB. ПФО (20% об./об. в конструкционной жидкости) добавляли к эмульсии микрогеля и масла GelMA в объемном соотношении 1:1 с последующим вихревым и центрифугированием при 300 × г в течение 15 с. Для изготовления GelMA GHS раствор PI (LAP 0,1% мас./об. в DPBS) добавляли к HMP GelMA с последующим вихревым и центрифугированием при 3,000 × г в течение 15 с. Для приготовления NGB к суспензии GelMA HMP добавляли раствор PI (LAP 0,1% мас./об. в сверхчистой воде) и дисперсию нанотромбоцитов (3% мас./об. в сверхчистой воде) с последующим вихревым перемешиванием и центрифугированием при 3,000 × г в течение 15 с. Рисунок 3A был изменен с разрешения Ataie, Z. et al.11 (B) Воздействие упакованных GelMA HMP на свет дает GHS. Рисунок 3B был изменен с разрешения Sheikhi et al.15 Сокращения: GelMA = желатинметакрилоил; СГС = гранулированный гидрогелевый каркас; NGB = наноинженерные гранулированные биочернила; ПФО = 1Н, 1Н-перфтор-1-октанол; ПИ = фотоинициатор; LAP = фенил-2,4,6-триметилбензоилфосфинат лития; HMP = микрочастица гидрогеля; DPBS = фосфатно-буферный физиологический раствор Дульбекко. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
GelMA был синтезирован в результате реакции желатина с MA, как показано на рисунке 1А. Путем адаптации условий реакции, таких как концентрация МА, были получены различные степени замещения МА. Для количественной оценки степени замещения MA GelMA оценивали с помощью 1-час...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Желатин и его производные являются наиболее часто используемыми биоматериалами на основе белка для изготовления HMP. Проблема компромисса между пропускной способностью и монодисперсностью размера частиц может быть решена с помощью микрофлюидных устройств со ступенчатой эмульгацией....
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы хотели бы поблагодарить Т. Понда, специалиста по поддержке исследований на кафедре химической инженерии Университета штата Пенсильвания (штат Пенсильвания), сотрудников лаборатории нанотехнологий в штате Пенсильвания и доктора Дж. А. Шейхи выражает признательность за поддержку Научно-исследовательского института материалов (MRI) и Колледжа инженерных материалов на начальных грантах человеческого уровня, Центра конвергенции живых многофункциональных материальных систем (LiMC2) и Кластера передового опыта живых, адаптивных и энергоавтономных систем материалов (livMatS) Программы грантов для совместных исследований живых многофункциональных материалов, а также фонда стартапов штата Пенсильвания. Исследования, представленные в этой публикации, были частично поддержаны Национальным институтом биомедицинской визуализации и биоинженерии (NIBIB) Национальных институтов здравоохранения (NIH) под номером R56EB032672.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Ссылки
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394(2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115(2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122(2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076(2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390(2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , 17/279,283 (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644(2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194(2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076(2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , 17/425,027 (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены