Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Jelatin Metakriloil Granül Hidrojel İskeleleri: Yüksek Verimli Mikrojel İmalatı, Liyofilizasyon, Kimyasal Montaj ve 3D Biyobaskı
Bu Makalede
Özet
Bu makalede, mikroakışkan cihazlar kullanılarak yüksek verimli jelatin metakriloil mikrojel üretimi, mikrojellerin yeniden askıya alınabilir toza (mikro-aerojeller) dönüştürülmesi, granüler hidrojel iskeleleri oluşturmak için mikrojellerin kimyasal montajı ve 3D biyobaskı için korunmuş mikroporoziteye sahip granüler hidrojel biyomürekkeplerinin geliştirilmesi için protokoller açıklanmaktadır.
Özet
Hidrojel mikropartiküllerinin (HMP'ler) birleştirilmesiyle üretilen granüler hidrojel iskelelerin (GHS) ortaya çıkması, mikro gözenekli iskele oluşumunu in situ olarak sağlamıştır. Geleneksel dökme hidrojellerin aksine, GHS'deki birbirine bağlı mikro ölçekli gözenekler, bozunmadan bağımsız hücre infiltrasyonunun yanı sıra oksijen, besin ve hücresel yan ürün transferini kolaylaştırır. Metakriloil-modifiye jelatin (GelMA), hücre yapıştırıcısı ve biyolojik olarak parçalanabilir moieties içeren (fotoğraf) kimyasal olarak çapraz bağlanabilen, protein bazlı bir biyopolimer, hücreye duyarlı / öğretici bir biyomateryal olarak yaygın olarak kullanılmaktadır. Toplu GelMA'yı GHS'ye dönüştürmek, doku mühendisliği ve rejenerasyonu için çok sayıda fırsat yaratabilir. Bu makalede, yüksek verimli GelMA mikrojel üretimi, yeniden askıya alınabilir kuru mikrojellere (mikro-aerojeller) dönüştürme, mikrojellerin kimyasal montajı yoluyla GHS oluşumu ve ekstrüzyon biyobaskısı için granüler biyomürekkep üretimi prosedürlerini göstereceğiz. Soğutma ve fotoçapraz bağlama yoluyla sıralı bir fizikokimyasal işlemin mekanik olarak sağlam GHS'nin oluşumunu nasıl sağladığını gösteriyoruz. Işığa erişilemediğinde (örneğin, derin doku enjeksiyonu sırasında), ayrı ayrı çapraz bağlı GelMA HMP'ler, transglutaminazlar kullanılarak enzimatik çapraz bağlama yoluyla biyoortogonal olarak birleştirilebilir. Son olarak, düşük HMP paketleme yoğunluğunda mikrogözenekli GHS'nin üç boyutlu (3D) biyobaskısı, heterojen olarak yüklü nanopartiküllerin ara yüzey kendi kendine montajı yoluyla gösterilmiştir.
Giriş
Doku mühendisliği iskeleleri oluşturmak için HMP yapı taşlarının montajı son birkaç yılda büyük ilgi görmüştür1. HMP montajı ile üretilen GHS, ayrık yapı taşları arasındaki boşluk boşluklarından kaynaklanan hücre ölçeğinde mikro gözeneklilik de dahil olmak üzere, toplu muadilleriyle karşılaştırıldığında benzersiz özelliklere sahiptir. Enjekte edilebilirlik, modülerlik ve gözeneklilikten ayrılmış sertlik gibi ek özellikler, GHS'yi doku onarımını ve yenilenmesini geliştirmek için umut verici bir platform haline getirir2. GHS üretimi için sentetik PEG bazlı polimerler3,4 ve aljinat5 ve hyaluronik asit 6,7 gibi polisakkaritler dahil olmak üzere farklı biyomalzemeler kullanılmıştır. Doğal olarak türetilmiş polimerler arasında, GHS üretimi için en yaygın protein bazlı biyopolimer, çapraz bağlanabilir, biyouyumlu, biyoyapıştırıcı ve biyolojik olarak parçalanabilir bir biyomalzeme olan GelMA 8,9,10,11'dir 12,13.
HMP'ler, toplu emülsifikasyon8, akış odaklı 14,15 veya adım emülsifikasyon 9,11 mikroakışkan cihazlar,harmanlama 16 veya karmaşık koapervasyon17,18 yoluyla üretilebilir. Genellikle, imalat verimi ile HMP monodispersitesi arasında bir denge vardır. Örneğin, karıştırma tekniği düzensiz şekilli ve yüksek oranda polidağılmış HMP'ler verir. Toplu emülsifikasyon veya karmaşık koaservasyon, büyük hacimlerde çok dağınık küresel HMP'lerin üretilmesini sağlar. Akış odaklı mikroakışkan cihazlar,% <5'lik bir varyasyon katsayısına sahip yüksek oranda monodisperse damlacıklar üretmek için kullanılmıştır, ancak verim önemli ölçüde düşüktür. Kademeli emülsifikasyon mikroakışkan cihazlarda, yüksek oranda paralelleştirilmiş adımlar, monodisperse HMP'lerin19'unun yüksek verimli imalatını sağlar.
Metakriloil modifiye jelatin (GelMA) HMP yapı taşları ısıya duyarlı ve (fotoğraf) kimyasal olarak çapraz bağlanabilir, bu da kolay GHS üretimisağlar 20. Üst kritik çözelti sıcaklığının (UCST)21 altında soğutulduktan sonra (örneğin, 4 °C'de), bir GelMA çözeltisi içeren damlacıklar fiziksel olarak çapraz bağlı HMP'lere dönüştürülür. Bu HMP yapı taşları daha sonra sıkışmış mikrojel süspansiyonları elde etmek için dış kuvvetler (örneğin, santrifüjleme yoluyla) kullanılarak paketlenir. Parçacıklar arası bağlantılar, mekanik olarak sağlam GHS14'ü oluşturmak için bitişik HMP'ler arasında (fotoğraf) kimyasal çapraz bağlama yoluyla kurulur. GHS'nin en önemli özelliklerinden biri, in vitro11 facile hücre penetrasyonunu ve in vivo22'de gelişmiş doku büyümesini sağlayan mikro gözenekliliktir. HMP'lerin üç boyutlu (3D) biyobaskısı, geleneksel olarak sıkıca paketlenmiş mikrojel süspansiyonları kullanılarak gerçekleştirilir ve mikroporoziteden ödün verir23.
Son zamanlarda, heterojen olarak yüklü nanopartiküllerin adsorpsiyonu yoluyla GelMA mikrojellerinin ara yüz nanomühendisliğine dayanan yeni bir granüler biyomürekkep sınıfı geliştirdik, ardından nanopartikül geri dönüşümlü kendi kendine montaj. Bu strateji, gevşek bir şekilde paketlenmiş mikrojelleri kesme verimli ve ekstrüzyon 3D biyo-yazdırılabilir hale getirir, bu da eklemeli olarak üretilen GHS11'in mikro ölçekli gözenekliliğini korur. Bu makalede, yüksek verimli GelMA damlacık üretimi, bu damlacıkların fiziksel olarak çapraz bağlı HMP'lere dönüştürülmesi, yeniden askıya alınabilir toz kullanılarak GelMA HMP'lerin üretilmesi, GelMA GHS oluşumu, GelMA nanomühendislik granüler biyomürekkep (NGB) hazırlığı ve 3D biyobaskı yöntemleri sunulmaktadır.
Protokol
NOT: Bu protokolde kullanılan tüm malzemeler, aletler ve reaktiflerle ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. GelMA sentezi
NOT: GelMA sentezi kimyasal bir davlumbazda yapılmalı ve her zaman uygun kişisel koruyucu ekipman (KKD) kullanılmalıdır.
- Bir Erlenmeyer şişesine 200 mL Dulbecco fosfat tamponlu salin (DPBS, 1x) ekleyin ve çözeltiyi 50 ° C'ye ulaşana kadar ısıtın. Buharlaşmayı önlemek için şişeyi alüminyum folyo ile örtün.
- DPBS çözeltisine 50 ° C'de 20 g jelatin tozu ekleyin ve toz tamamen çözünene kadar 240 rpm'de karıştırın.
- GelMA'yı sırasıyla yüksek, orta veya düşük derecede metakriloil ikamesi ile sentezlemek için bir cam Pasteur pipeti aracılığıyla jelatin çözeltisine damla damla 16, 2.5 veya 0.5 mL metakrilat anhidrit (MA) ekleyin.
DİKKAT: MA tehlikeli bir maddedir. MA ile çalışırken uygun KKD kullanılmalıdır. MA ayrıca ışığa duyarlıdır, bu nedenle şişeyi alüminyum folyo ile sararak reaksiyonu ışıktan koruyun. - 2 saat sonra, reaksiyonu durdurmak için 50 ° C'de 400 mL DPBS ekleyin. Karıştırmanın 50 °C'de 10 dakika boyunca devam etmesine izin verin.
- Çözeltiyi 12-14 kDa moleküler ağırlık kesme ile bir diyaliz membran borusuna dökün ve ardından tüpü 40 ° C ultra saf su ile doldurulmuş 5 L'lik bir beher içine yerleştirin. Suyu 240 rpm ve 40 °C'de karıştırın.
- Çözeltiyi 10 gün boyunca ultra saf suya karşı diyaliz edin ve reaksiyona girmemiş metakrilat anhidrit, yan ürünler ve diğer safsızlıkları gidermek için suyu günde 2 kez değiştirin.
- 10 gün sonra, GelMA çözeltisine 40 ° C'de 400 mL ultra saf su ekleyin. Çözeltiyi 240 rpm'de 15 dakika karıştırın.
- Kahve filtrelerini kullanarak çözeltiyi iki kez filtreleyin, ardından 0,2 μm vakum filtreleme ünitesi ile vakum filtrelemesi yapın.
- Filtrelenmiş çözeltinin 25 mL'sini 50 mL santrifüj tüplerine dökün ve tüpleri yatay olarak yerleştirerek -80 ° C'de dondurun.
- 2 gün sonra, kapakları çıkarın ve santrifüj tüplerini laboratuvar mendilleriyle örtün. Mendilleri sıkıca tutmak için bant veya lastik bant kullanın.
- Beyaz katı GelMA elde etmek için dondurulmuş GelMA çözeltisini liyofilize edin.
- Proton nükleer manyetik rezonans (1H NMR) spektroskopisi yapmak için, ayrı ayrı 1 mL döteryum oksit (D2O) içine 30 mg jelatin tozu (kontrol) veya liyofilize GelMA ekleyin ve jelatin tozu veya GelMA tamamen çözünene kadar numuneleri 37 ° C'de tutun.
- 1H NMR spektrumunu elde edin ve aromatik asitleri ve lizin metilen proton zirvelerini sırasıyla ~ 6.5-7.5 ve ~ 3.0 ppm'lik kimyasal kaymalarda entegre ederek metakriloil ikame derecesini belirleyin. Aromatik asitlerin pik noktasını referans olarak kullanın ve denkleme (1) dayanarak lizin metilen piklerini kullanarak ikame derecesini (DS) belirleyin:
DS (%) = [1 - (GelMA'da lizin metilen alanı / Jelatinde lizin metilen alanı)] × 100 (1)
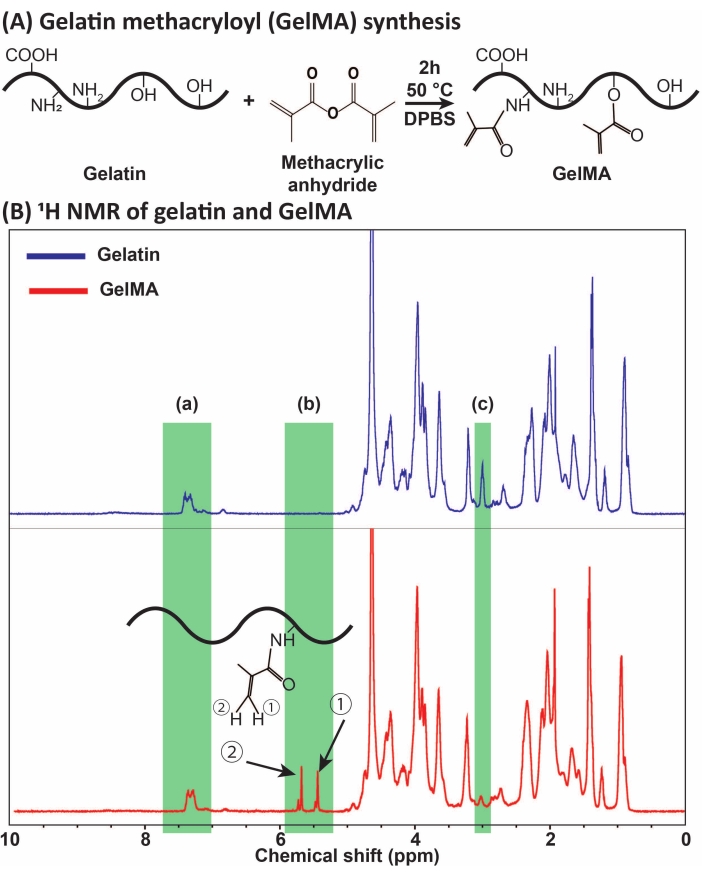
Resim 1: GelMA sentezi ve karakterizasyonu. (A) GelMA sentez reaksiyonu. Jelatin, 2 saat boyunca 50 ° C'de metakrilik anhidrit ile modifiye edilir. (B) Jelatin ve GelMA'nın proton nükleer manyetik rezonans (1H NMR) spektrumları: (a) kalibrasyon için referans olarak seçilen aromatik asitler için zirve, (b) jelatinin MA modifikasyonundan sonra vinil fonksiyonel grup zirveleri ve (c) lizin proteinleri için zirve. Bu örnekte, MA ikame derecesi% 71 ±% 3 idi (n = 3). Bu rakam Ataie et al.11 Kısaltmaların izniyle değiştirilmiştir: GelMA = jelatin metakriloil; DPBS = Dulbecco'nun fosfat tamponlu salini; MA = metakriloil. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. Yüksek verimli GelMA mikrojel imalatı
- Cihaz ana kalıp mikrofabrikasyonu
NOT: Ana kalıplar, KMPR 1000 negatif fotorezistli seri19 kullanılarak yumuşak litografi yoluyla mikrofabrikasyon yapılabilir.- KMPR 1025 ve 1035'i bir gecede çözün. Işığa maruz kalmaktan kaçının.
- Gofret üzerindeki ilk katmanı kaplamak için, yaklaşık 5 cm'lik bir fotodirenç çemberi oluşturmak için KMPR 1025'i doğrudan gofretin ortasına ekleyin. Sıkma kaplayıcıyı 30 s boyunca 3.000 rpm'de çalıştırın.
- 100 °C'lik bir ocakta 12 dakika yumuşak pişirin. Ardından, soğutma plakasında 5 dakika soğutun.
- İlk katman maskesini boş soda kirecine takın, ardından kaplanmış gofreti 645 mJ /cm2 dozaj için bir maske hizalayıcı kullanarak UV ışığına maruz bırakın.
- 100 ° C'lik bir ocakta 3 dakika pişirin. Soğutma plakasında 5 dakika soğutun.
NOT: Bu adımdan sonra geliştirmeyin. Sürecin sonunda sadece bir kez geliştirin. - KMPR 1035'i kullanarak gofret üzerindeki ikinci katmanı döndürün. Sıkma kaplayıcıyı 30 s boyunca 1.000 rpm'de çalıştırın.
- 100 °C'lik bir ocakta 30 dakika yumuşak pişirin. Soğutma plakasında 5 dakika soğutun.
- İkinci katman maskesini boş soda kirecine takın ve hizalayıcıyı kullanarak ikinci maskeyi standart hizalama işaretleriyle hizalayın. 2.000 mJ/cm2'ye kadar bir maske hizalayıcı kullanarak UV ışığına maruz bırakın.
- 100 ° C'lik bir ocakta 5 dakika pişirin.
- SU-8 geliştiricisinde >6 dakika boyunca geliştirin.
NOT: Gofret sütlü görünüyorsa, geliştirme daha uzun süre devam ettirilmelidir. Daha iyi bir sonuç için her seferinde ve arada yeni geliştirici kullanın. - İzopropanol ile püskürtün. Gofretin temiz olduğundan ve sütlü kalıntı kalmadığından emin olun. Gofreti azot (N2) gazı kullanarak iyice kurulayın.
- Mikroakışkan cihaz imalatı
- 50 g polidimetilsiloksan (PDMS) baz kısmını şeffaf bir plastik kaba dökün. Ardından, plastik kaba 5 g çapraz bağlayıcı ekleyin. Tabanı ve çapraz bağlayıcıyı kremsi bir doku elde edene kadar bir spatula kullanarak kuvvetlice karıştırın.
- Berraklaşana kadar 20 dakika boyunca bir kurutucu kullanarak karışımın gazını vakumlayın. Karışımı, içine yerleştirilen ve bir Petri kabına bantlanan ana kalıba dökün.
NOT: Dökülen PDMS'nin kalınlığının (yüksekliğinin) ≤8 mm olduğundan emin olun. - Petri kabını kurutucuya koyun ve tüm kabarcıklar çıkarılana kadar PDMS karışımını 20 dakika boyunca tekrar gazdan arındırın. Petri kabını, PDMS çapraz bağlanana kadar 2 saat boyunca 70 ° C'lik bir fırına koyun. Petri kabını fırından çıkarın ve soğumasını bekleyin.
- Bir neşter kullanarak cihazları kalıptan kesin. Cihazları ana kalıptan yavaşça ayırın. Giriş ve çıkıştan delikler açmak için biyopsi zımbasını (1,5 mm çapında) kullanın.
- Maskeleme bandını kullanarak PDMS cihazlarından ve cam kızaklardan tozları temizleyin ve cam kızakları ve cihazları bir plazma temizleme odasına yerleştirin. Plazma işlemini 400 mTorr'un altındaki hava basıncıyla 45 s (oda mora döndüğünde başlayarak) gerçekleştirin. Slaytları ve cihazları odadan çıkarın, cihazı cam slaytların üzerine yerleştirin ve hafif bir basınç uygulayın. Yapıştırmayı arttırmak için cihazı 70 ° C fırında 30 dakika bekletin.
- Kanal yüzeyini florofilik hale getirmek için cihazları mühendislik sıvısında trikloro(1H,1H,2H,2H-perflorooktil)silan (F-silan, %2 v/v) ile doldurun. F-silan çözeltisini prizden enjekte edin ve tüm cihazların açıkta olduğundan emin olun. 5-10 dakika bekleyin.
NOT: F-silan taze olarak hazırlanmalıdır. Ek olarak, F-silan uzun süre havaya maruz bırakılmamalıdır. - F-silan çözeltisini sulu çözelti girişinden cihazdan dışarı aspire edin. Mühendislik sıvısını kullanarak cihazı iki kez yıkayın ve tekrar aspire edin. Kalan yağı buharlaştırmak için cihazı 70 °C fırında 30 dakika bekletin.
- Damlacık oluşumu ve GelMA mikrojel imalatı
- Bir fotobaşlatıcı (PI) çözeltisi (% 0,1 w / v) hazırlamak için 10 mL DPBS'ye 10 mg lityum fenil-2,4,6-trimetilbenzoilfosfinat (LAP) ekleyin. Çözeltiyi alüminyum folyoya sararak ışıktan koruyun.
- İstenilen miktarda GelMA'yı PI çözeltisi içinde çözün ve berrak bir çözelti elde edilene kadar 1 saat boyunca 37 °C fırında bekletin. Alüminyum folyoya sararak çözeltiyi ışıktan koruyun.
- Yağ fazını hazırlamak için, mühendislik sıvısında% 2 v / v biyouyumlu yüzey aktif madde çözeltisi yapın.
- Tygon borusunu PDMS cihazının giriş ve çıkışlarına takın. Girişler için Tygon borusunun diğer ucuna 25 G künt bir iğne yerleştirin. Mümkün olan minimum boru uzunluğunu kullanın.
- Cihazı mikroskop altına yerleştirin. Bir saç kurutma makinesi ve / veya bir alan ısıtıcı kullanarak ortamı sıcak tutun (~ 40 ° C).
- Sulu ve yağ çözeltilerini cihaza bağlı ayrı şırıngalara yükleyin. Şırınga pompalarını, yağ (sürekli) ve sulu (dağınık) fazlar için sırasıyla 160 ve 80 μL/dak akış hızlarıyla çalıştırın.
NOT: Önce yağ fazını başlatın; Yağın kanalı doldurduğundan emin olun, ardından sulu fazı başlatın. - Damlacıkları bir kapta toplayın ve optik mikroskopi görüntüleme ile görüntüleme odasında değerlendirin.
- GelMA HMP fiziksel çapraz bağlamayı başlatmak için damlacıkları gece boyunca 4 ° C'ye yerleştirin ve damlacıkları 4 ° C'de kararlı mikrojellere dönüştürün.
3. Mikro mühendislik ürünü emülsiyon-to-toz (MEtoP) teknolojisi ile mikrojellerin yeniden askıya alınabilir toza dönüştürülmesi
NOT: Su içinde yağ emülsiyonu bazlı HMP'leri, yeniden askıya alınabilirlik, şekil, boyut ve montaj gibi korunmuş özelliklere sahip mikropartikül tozuna (mikro-aerojeller) dönüştürmek için MEtoP teknolojisi geliştirilmiştir.
- MEtoP'yi uygulamak için, termal olarak dayanıklı mikrosantrifüj tüpleri veya kriyovyaller kullanarak mühendislik sıvısında fiziksel olarak çapraz bağlı HMP'leri toplayın. Tüp kapaklarını açın ve bir laboratuvar mendili ve bandı ile kapatın.
- Fiziksel olarak çapraz bağlı HMP'leri sıvı azotta (-196 ° C) 10 dakika boyunca derin dondurun.
- Flaş dondurulmuş tüpleri bir dondurarak kurutucu cihaza aktarın. Toz elde etmek için tüpleri düşük basınçta (örneğin, 0,06 mbar) en az 6 saat boyunca liyofilize edin.
NOT: Liyofilizasyon döngüsü bittiğinde, tozun kaybolmaması için basıncı yavaşça kırın. - Mikrojel süspansiyonları yapmak için toza 1 mL soğutulmuş PI çözeltisi (% 0,1 w / s, 4 ° C) ekleyin. 5 sn boyunca vorteks, daha sonra 15 s için 3.000 × g'da santrifüj. Supernatan'ı atın.
- Paketlenmiş mikrojel süspansiyonunu pozitif deplasmanlı bir pipet kullanarak bir kalıba aktarın, ardından GHS oluşturmak için 60 sn boyunca 15 mW/cm2 yoğunluğa sahip 400 nm dalga boyunda UV ışığına maruz bırakın.

Resim 2: MEtoP teknolojisi ile GelMA mikropartikül tozu hazırlama. (A) MEtoP teknolojisinden veya HMP'nin konvansiyonel liyofilizasyonundan elde edilen GelMA tozunun görüntüleri. MEtoP teknolojisinde veya konvansiyonel liyofilizasyonda, HMP'ler sırasıyla yağ-yüzey aktif madde veya sulu ortamda askıya alınır. Mühendislik sıvısı, dağınık fazı (HMP'ler) agregasyondan korur ve liyofilizasyon sırasında GelMA mikropartiküllerinin fizyokimyasal özelliklerini korur. (B) MEtoP aracılığıyla hazırlanan kurutulmuş HMP'lerin sulu bir ortamda geleneksel olarak liyofilize HMP ile karşılaştırıldığında şematik gösterimi. (C) MEtoP aracılığıyla hazırlanan kurutulmuş GelMA mikropartiküllerinin SEM görüntüleri, geleneksel liyofilizasyon ile karşılaştırıldığında. Ölçek çubukları = 2 mm (sol; A), 500 μm (sağda; A), 10 μm (solda; C) ve 200 μm (sağda; C). Bu şekil Şeyhi ve ark.26 Kısaltmaların izniyle değiştirilmiştir: GelMA = jelatin metakriloil; DPBS = Dulbecco'nun fosfat tamponlu salini; MEtoP = mikromühendislik ürünü emülsiyondan toza; HMP = hidrojel mikropartikül; SEM = taramalı elektron mikroskobu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. GelMA GHS oluşumu
NOT: Bu protokol 400 μL mikrojel süspansiyonu hazırlamak içindir. Daha büyük miktarlar için ölçek büyütme gereklidir. GelMA HMP'leri fiziksel olarak çapraz bağlı tutmak için, mikrojel kapları buzlu su kovasına yerleştirerek tüm adımlar yaklaşık 4 ° C'de gerçekleştirilmelidir.
- Fiziksel olarak çapraz bağlı GelMA HMP'lere mühendislik sıvısında 400 μL 1H, 1H-perfloro-1-oktanol (PFO) çözeltisi (% 20 v / v) ekleyin. Daha sonra, 5 s vorteks ve 300 × g'da 15 s santrifüj.
NOT: Mühendislik sıvısındaki PFO çözeltisi taze olarak hazırlanmalı ve buharlaşmayı önlemek için kapalı bir kapta saklanmalıdır. - Yağ fazını pipetleme yoluyla GelMA HMP'lerden çıkarın.
- Mikrojel süspansiyonuna 4 °C'de 400 μL PI çözeltisi (%0,1 w/v) ekleyin. Daha sonra, 5 s için vorteks ve 15 s için 300 × g'da santrifüj. Daha sonra yağı atın.
- Önceki adımı tekrarlayın, ancak 3.000 × g'da santrifüj yapın. Paketlenmiş GelMA HMP'lerin süpernatantını pipetleme yoluyla çıkarın.
- Paketlenmiş GelMA HMP'leri pozitif yer değiştirmeli bir pipet kullanarak bir kalıba aktarın, ardından UV ışığına maruz bırakın (dalga boyu = 400 nm, yoğunluk = 15 mW/cm2, pozlama süresi = 60 sn).
5. Korunmuş mikroporoziteye sahip GHS'nin 3D biyobaskısı için nanomühendislik granüler biyomürekkepler (NGB)
- Bir nanopartikül dispersiyonu oluşturmak için 3 mL 4 °C ultra saf suya 100 mg nanoplatelet tozu ekleyin (% 3.33 w / v). Aksi takdirde toplanmış nanopartikülleri pul pul dökmek için dispersiyonu 4 ° C'lik bir buzdolabında 15 dakika boyunca kuvvetli bir şekilde vorteksleyin. Düzgün pul pul dökülmüş nanopartiküller net bir dağılım sağlar.
- Bir stok PI çözeltisi hazırlamak için 50 mg LAP'yi 5 mL 4 °C ultra saf suda çözün (% 1 w / v).
- Pul pul dökülmüş nanopartikül dispersiyonuna 333 μL PI çözeltisi (% 1 w / v) ekleyin. Ortam ışığına karşı korumak için alüminyum folyoya sarın. Nanopartikül dispersiyonu ve PI'yi karıştırmak için 1 dakika boyunca vorteks. Son kil ve PI konsantrasyonları sırasıyla% 3 w / v ve% 0.1 w / v'dir.
- Fiziksel olarak çapraz bağlı GelMA HMP'lere 1:1 hacim oranında mühendislik sıvısında PFO %20 v/v (4 °C) ekleyin. 5 s boyunca iyice vorteks. Daha sonra, 15 s boyunca 300 × g'da santrifüj yapın ve yüzey aktif maddeyi içeren yağ fazını atın.
- LAP takviyeli nanopartikül dispersiyonunu (4 °C) yıkanmış GelMA HMP'lere ekleyin. 15 s için vorteks, 15 s için 3.000 × g'da santrifüj yapın ve altta kalan yağı ve süpernatant dispersiyonu atın.
- Süspansiyonu 4 ° C'de saklayın ve 1 gün boyunca alüminyum folyo kullanarak ışıktan koruyun. Bu adımın ürünü GelMA NGB'dir.
- NGB'yi 3 mL'lik bir şırıngaya yükleyin, yüklü şırıngayı bir kapak ve parafilmle kapatın ve sıkışmış havayı gidermek için 200 × g'da santrifüj darbesi santrifüjü yapın. Dişi Luer-Lok konektörünü kullanarak biyomürekkebi 3 mL'lik bir kartuşa aktarın. Sıkışan havayı gidermek için kartuşu tekrar 200 × g'da kısa bir süre santrifüj edin. NGB'yi kullanmadan önce buzdolabında 4 °C'de saklayın.
- Hücre yüklü biyomürekkep preparatından önce, 100 μL hücre kültürü ortamında ~ 24 milyon hücre içeren konsantre bir hücre süspansiyonu (örneğin, NIH / 3T3 murin fibroblast hücreleri) hazırlayın. Hücre süspansiyonunu 3 mL'lik bir şırıngaya yükleyin, RGB yüklü şırıngayı ve hücre yüklü şırıngayı dişi-dişi Luer-Lok konektörü kullanarak birleştirin ve hücreleri ve NGB'yi 40x ileri geri iterek yavaşça karıştırın.
- NGB veya hücre yüklü NGB'yi, standart konik nozullu uygun bir biyoyazıcı kullanarak yazdırın. Püskürtme ucunu 3 mL yazıcı kafasına takın. Baskı yatağı sıcaklığını 10 °C'nin altında tutun. Yazdırmadan önce hız ve geri basınç gibi yazdırma parametrelerini optimize edin.
- Alt tabaka ve nozul tipini seçin (standart konik nozul ile donatılmış pnömatik 3 mL şırınga), cihaz yönergelerini kullanarak biyoyazıcıyı kalibre edin, istediğiniz gcode veya STL dosyasını seçin ve yazdırmaya başlayın.
NOT: Hücre yüklü biyobaskı yapılırken, kontaminasyonu en aza indirmek için tüm malzemeler ve cihazlar biyolojik güvenlik kabini altında tutulmalıdır. - Baskıdan sonra, fotoçapraz bağlantı için yapıyı UV ışığına maruz bırakın (dalga boyu = 400 nm, yoğunluk = 15 mW /cm2, pozlama süresi = 60 sn).
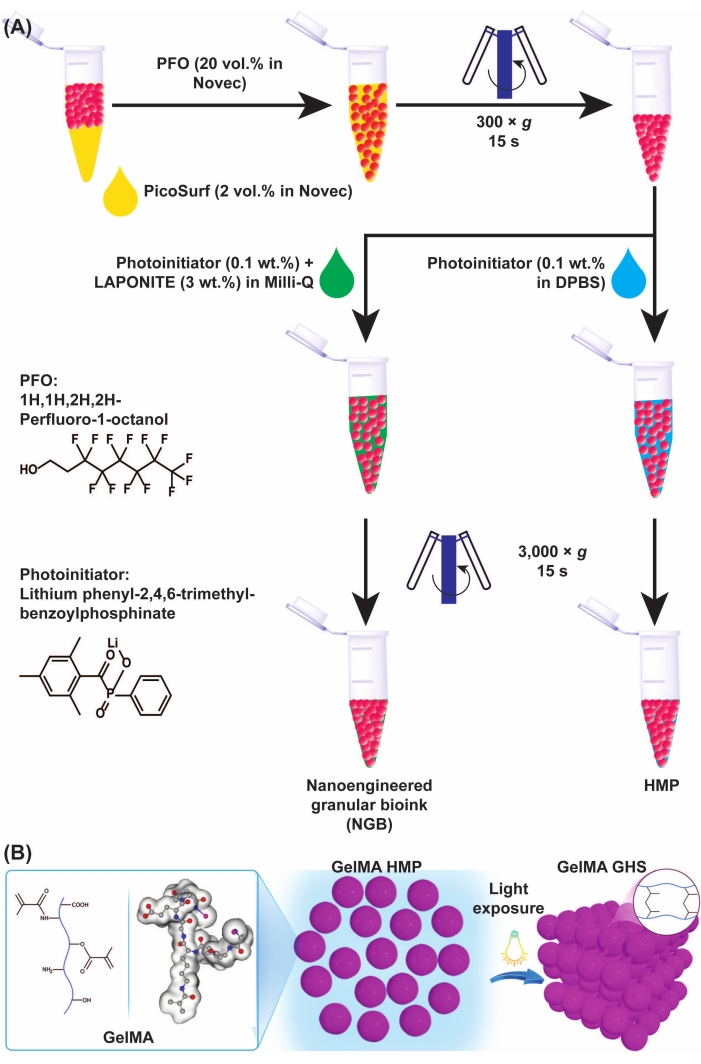
Şekil 3: GelMA mikrojel şemaları ve GHS oluşumu . (A) GelMA mikrojelinin yağdan ayrılması ve NGB preparatının şemaları. PFO (mühendislik sıvısında% 20 v / v), GelMA mikrojel-yağ emülsiyonuna 1: 1 hacimsel bir oranda eklendi, ardından 15 s boyunca 300 × g'da vorteks ve santrifüjleme yapıldı. GelMA GHS'yi üretmek için, GelMA HMP'lere PI çözeltisi (DPBS'de LAP% 0.1 w / v) eklendi, ardından 15 s için 3.000 × g'da vorteks ve santrifüjleme yapıldı. NGB'yi hazırlamak için, GelMA HMP süspansiyonuna PI çözeltisi (ultra saf suda LAP% 0.1 w / v) ve nanoplatelet dispersiyonu (ultra saf suda% 3 w / v) eklendi, ardından 15 s için 3.000 × g'da vorteksleme ve santrifüjleme yapıldı. Şekil 3A , Ataie, Z. ve ark.11 (B) Paketlenmiş GelMA HMP'lerin ışık verimine maruz bırakılması GHS'nin izniyle değiştirilmiştir. Şekil 3B , Sheikhi et al.15 Kısaltmalar: GelMA = jelatin metakriloil; GHS = granüler hidrojel iskele; NGB = nanomühendislik ürünü granüler biyomürekkep; PFO = 1H,1H-perfloro-1-oktanol; PI = fotobaşlatıcı; LAP = lityum fenil-2,4,6-trimetilbenzoilfosfinat; HMP = hidrojel mikropartikül; DPBS = Dulbecco'nun fosfat tamponlu salini. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
GelMA, Şekil 1A'da gösterildiği gibi jelatinin MA ile reaksiyonu yoluyla sentezlendi. MA konsantrasyonu gibi reaksiyon koşullarını uyarlayarak, farklı derecelerde MA ikamesi elde edildi. MA ikame derecesini ölçmek için, GelMA 1H NMR spektroskopisi ile değerlendirildi (Şekil 1B). ~ 5-6 ppm'lik kimyasal kaymalarda temsili zirvelere sahip vinil fonksiyonel gruplar, jelatinden başarılı GelMA sentezini doğruladı. Diyaliz ve steri...
Tartışmalar
Jelatin ve türevleri, HMP üretimi için en yaygın kullanılan protein bazlı biyomalzemelerdir. Verim ve partikül boyutu monodispersite dengesi zorluğu, kademeli emülsifikasyon mikroakışkan cihazları kullanılarak aşılabilir. Bu cihazlar saatte 40 milyondan fazla damlacık oluşturabilir ve varyasyon katsayısı %5'ten az27'dir. Bu makalede, GelMA çözeltileri içeren damlacıkların mikrofabrikasyonunu tartıştık ve ardından bunları GelMA HMP'lere, toza, GHS'ye ve NGB'ye dönüşt...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, Pennsylvania Eyalet Üniversitesi (Penn State) Kimya Mühendisliği Bölümü'nde araştırma destek uzmanı olan T. Pond'a, Penn State'teki Nanofabrikasyon Laboratuvarı personeline ve Partillion Bioscience'dan Dr. J. de Rutte'ye nanofabrikasyon süreçleriyle ilgili yardım ve tartışmalar için teşekkür eder. A. Sheikhi, Malzeme Araştırma Enstitüsü (MRI) ve İnsan Düzeyinde Mühendislik Malzemeleri Önemlidir Koleji'nin tohum hibelerini, Yaşayan Çok İşlevli Malzeme Sistemleri için Yakınsama Merkezi'nin (LiMC2) ve Mükemmellik Kümesi Yaşayan, Uyarlanabilir ve Enerji-Otonom Malzeme Sistemleri (livMatS) Yaşayan Çok İşlevli Malzemeler İşbirlikçi Araştırma Tohum Hibe Programı'nın ve Penn State'in başlangıç fonunun desteğini kabul eder. Bu yayında bildirilen araştırmalar, Ulusal Sağlık Enstitüleri'nin (NIH) Ulusal Biyomedikal Görüntüleme ve Biyomühendislik Enstitüsü (NIBIB) tarafından R56EB032672 ödül numarası altında kısmen desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Referanslar
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394 (2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115 (2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122 (2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076 (2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390 (2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644 (2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071 (2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076 (2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır