Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Andamios de hidrogel granular de metacriloilo de gelatina: fabricación de microgel de alto rendimiento, liofilización, ensamblaje químico y bioimpresión 3D
En este artículo
Resumen
Este artículo describe los protocolos para la fabricación de microgel de metacriloilo de gelatina de alto rendimiento utilizando dispositivos microfluídicos, la conversión de microgeles en polvo resuspendible (micro-aerogeles), el ensamblaje químico de microgeles para formar andamios de hidrogel granular y el desarrollo de biotintas de hidrogel granular con microporosidad preservada para bioimpresión 3D.
Resumen
La aparición de andamios de hidrogel granular (GHS), fabricados mediante el ensamblaje de micropartículas de hidrogel (HMP), ha permitido la formación de andamios microporosos in situ. A diferencia de los hidrogeles a granel convencionales, los poros interconectados a microescala en GHS facilitan la infiltración celular independiente de la degradación, así como la transferencia de oxígeno, nutrientes y subproductos celulares. La gelatina modificada con metacriloilo (GelMA), un biopolímero a base de proteínas (foto)químicamente reticulado que contiene adhesivo celular y restos biodegradables, se ha utilizado ampliamente como biomaterial instructivo / sensible a las células. La conversión de GelMA a granel a GHS puede abrir una gran cantidad de oportunidades para la ingeniería y regeneración de tejidos. En este artículo, demostramos los procedimientos de fabricación de microgel GelMA de alto rendimiento, conversión a microgeles secos resuspendibles (micro-aerogeles), formación de GHS a través del ensamblaje químico de microgeles y fabricación de biotinta granular para bioimpresión por extrusión. Mostramos cómo un tratamiento fisicoquímico secuencial a través de enfriamiento y fotoreticulación permite la formación de GHS mecánicamente robusto. Cuando la luz es inaccesible (por ejemplo, durante la inyección de tejido profundo), los HMP de GelMA reticulados individualmente pueden ensamblarse bioortogonalmente a través de la reticulación enzimática utilizando transglutaminasas. Finalmente, la bioimpresión tridimensional (3D) de GHS microporoso a baja densidad de empaquetamiento HMP se demuestra a través del autoensamblaje interfacial de nanopartículas cargadas heterogéneamente.
Introducción
El ensamblaje de bloques de construcción HMP para formar andamios de ingeniería de tejidos ha ganado una gran atención en los últimos años1. GHS, fabricado a través del ensamblaje HMP, tiene propiedades únicas en comparación con sus contrapartes a granel, incluida la microporosidad a escala celular que se origina en los espacios vacíos entre los bloques de construcción discretos. Las propiedades adicionales, como la inyectabilidad, la modularidad y la rigidez desacoplada de la porosidad, hacen de GHS una plataforma prometedora para mejorar la reparación y regeneración de tejidos2. Se han utilizado diferentes biomateriales para la fabricación de GHS, incluidos polímeros sintéticos basados en PEG3,4 y polisacáridos, como el alginato5 y el ácido hialurónico 6,7. Entre los polímeros de origen natural, el biopolímero a base de proteínas más común para la fabricación de GHS es GelMA 8,9,10,11, un biomaterial reticulado, biocompatible, bioadhesivo y biodegradable 12,13.
Los HMP pueden fabricarse mediante emulsificación por lotes8, dispositivos microfluídicos de concentración de flujo 14,15 o emulsificación escalonada9,11, mezcla 16 o coacervación compleja17,18. Por lo general, existe una compensación entre el rendimiento de fabricación y la monodispersión de HMP. Por ejemplo, la técnica de mezcla produce HMP de forma irregular y altamente polidispersos. La emulsificación por lotes o la coacervación compleja permiten la producción de grandes volúmenes de HMP esféricas polidispersas. Los dispositivos microfluídicos de enfoque de flujo se han utilizado para fabricar gotas altamente monodispersas con un coeficiente de variación del <5%, sin embargo, el rendimiento es significativamente bajo. En los dispositivos microfluídicos de emulsificación escalonada, los pasos altamente paralelizados permiten la fabricación de alto rendimiento de HMP monodispersos19.
Los bloques de construcción HMP de gelatina modificada con metacriloilo (GelMA) son termosensibles y (foto) reticulables químicamente, lo que permite una fácil fabricación GHS20. Al enfriarse por debajo de la temperatura superior de la solución crítica (UCST)21 (por ejemplo, a 4 °C), las gotas que contienen una solución de GelMA se convierten en HMP reticuladas físicamente. Estos bloques de construcción de HMP se empaquetan utilizando fuerzas externas (por ejemplo, mediante centrifugación) para producir suspensiones de microgel atascadas. Los enlaces entre partículas se establecen entre HMP adyacentes a través de reticulación (foto)química para formar GHS14 mecánicamente robusto. Una de las propiedades más importantes del GHS es la microporosidad, lo que permite una fácil penetración celular in vitro11 y un mayor crecimiento tisular in vivo22. La bioimpresión tridimensional (3D) de HMP se realiza convencionalmente utilizando suspensiones de microgel apretadas, comprometiendo la microporosidad23.
Recientemente hemos desarrollado una nueva clase de biotintas granulares basadas en la nanoingeniería interfacial de microgeles GelMA a través de la adsorción de nanopartículas cargadas heterogéneamente, seguidas de autoensamblaje reversible de nanopartículas. Esta estrategia hace que los microgeles sueltos producidos por cizallamiento y extrusión sean bioimprimibles en 3D, lo que preserva la porosidad a microescala del GHS11 fabricado aditivamente. Este artículo presenta los métodos para la fabricación de gotas GelMA de alto rendimiento, la conversión de estas gotas en HMP reticuladas físicamente, la fabricación de HMP GelMA utilizando polvo resuspendible, la formación de GelMA GHS, la preparación de biotinta granular (NGB) de nanoingeniería GelMA y la bioimpresión 3D.
Protocolo
NOTA: Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, instrumentos y reactivos utilizados en este protocolo.
1. Síntesis de GelMA
NOTA: La síntesis de GelMA debe realizarse en una campana extractora de humos químicos, y se debe usar el equipo de protección personal (EPP) adecuado todo el tiempo.
- Añadir 200 ml de solución salina tamponada con fosfato de Dulbecco (DPBS, 1x) a un erlenmeyer y calentar la solución hasta que alcance los 50 °C. Cubrir el matraz con papel de aluminio para evitar la evaporación.
- Añadir 20 g de gelatina en polvo a la solución DPBS a 50 °C agitando a 240 rpm hasta que el polvo se disuelva por completo.
- Agregue 16, 2.5 o 0.5 ml de anhídrido de metacrilato (MA) a la solución de gelatina gota a gota a través de una pipeta de vidrio Pasteur para sintetizar GelMA con un grado alto, medio o bajo de sustitución de metacriloilo, respectivamente.
PRECAUCIÓN: MA es un material peligroso. Se debe usar el EPP adecuado cuando se trabaja con MA. MA también es sensible a la luz, así que proteja la reacción de la luz envolviendo el matraz con papel de aluminio. - Después de 2 h, añadir 400 ml de DPBS a 50 °C para detener la reacción. Dejar que la agitación continúe a 50 °C durante 10 min.
- Vierta la solución en un tubo de membrana de diálisis con un límite de peso molecular de 12-14 kDa, y luego coloque el tubo en un vaso de precipitados de 5 L lleno de agua ultrapura a 40 °C. Revuelva el agua a 240 rpm y 40 °C.
- Dialice la solución contra agua ultrapura durante 10 días y cambie el agua 2 veces al día para eliminar el anhídrido de metacrilato sin reaccionar, los subproductos y otras impurezas.
- Después de 10 días, añadir 400 ml de agua ultrapura a 40 °C a la solución de GelMA. Revuelva la solución a 240 rpm durante 15 min.
- Filtrar la solución dos veces con filtros de café, seguido de filtración al vacío a través de una unidad de filtración al vacío de 0,2 μm.
- Verter 25 ml de la solución filtrada en tubos de centrífuga de 50 ml y congelarlos a -80 °C, colocando los tubos horizontalmente.
- Después de 2 días, retire las tapas y cubra los tubos de la centrífuga con toallitas de laboratorio. Use cinta adhesiva o una banda elástica para sujetar las toallitas con fuerza.
- Liofilizar la solución congelada de GelMA para producir GelMA sólido blanco.
- Para realizar la espectroscopia de resonancia magnética nuclear de protones (RMN1 H), añadir por separado 30 mg de gelatina en polvo (control) o GelMA liofilizado en 1 ml de óxido de deuterio (D2O) y mantener las muestras a 37 °C hasta que la gelatina en polvo o GelMA se disuelva por completo.
- Obtenga los espectros de RMN 1H y determine el grado de sustitución de metacriloilo integrando los picos de protones de ácidos aromáticos y lisina metileno a cambios químicos de ~ 6.5-7.5 y ~ 3.0 ppm, respectivamente. Utilice el pico de ácidos aromáticos como referencia y determine el grado de sustitución (DS) utilizando picos de lisina metileno basados en la ecuación (1):
DS (%) = [1 - (Área de lisina metileno en GelMA / Área de lisina metileno en gelatina)] × 100 (1)
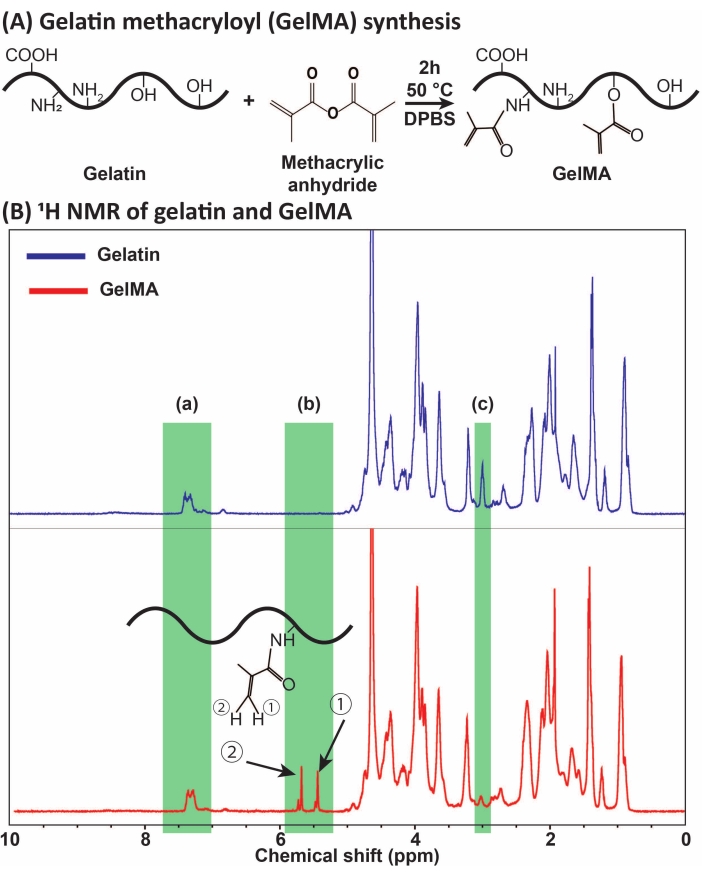
Figura 1: Síntesis y caracterización de GelMA. (A) Reacción de síntesis de GelMA. La gelatina se modifica con anhídrido metacrílico a 50 °C durante 2 h. (B) Los espectros de resonancia magnética nuclear de protones (RMN 1H) de gelatina y GelMA: (a) el pico para los ácidos aromáticos, que se selecciona como referencia para la calibración, (b) los picos del grupo funcional del vinilo después de la modificación MA de la gelatina, y (c) el pico para las proteínas de lisina. En este ejemplo, el grado de sustitución de MA fue de 71% ± 3% (n = 3). Esta cifra ha sido modificada con permiso de Ataie et al.11 Abreviaturas: GelMA = gelatina metacriloyl; DPBS = solución salina tamponada con fosfato de Dulbecco; MA = metacriloiloilo. Haga clic aquí para ver una versión más grande de esta figura.
2. Fabricación de microgel GelMA de alto rendimiento
- Microfabricación de moldes maestros de dispositivos
NOTA: Los moldes maestros pueden ser microfabricados a través de litografía blanda utilizando la serie19 de fotorresistencia negativa KMPR 1000.- Descongele KMPR 1025 y 1035 durante la noche. Evite cualquier exposición a la luz.
- Para recubrir la primera capa de la oblea, agregue KMPR 1025 directamente al centro de la oblea para hacer un círculo de fotorresistencia de aproximadamente 5 cm. Ejecute la recubrida de centrifugado a 3.000 rpm durante 30 s.
- Hornear suavemente durante 12 min en una placa calefactora a 100 °C. Luego, enfríe en la placa de enfriamiento durante 5 minutos.
- Conecte la máscara de la primera capa a la cal sódica en blanco, luego exponga la oblea recubierta a la luz UV usando un alineador de máscara para 645 mJ / cm2 de dosis.
- Vuelva a hornear durante 3 minutos en una placa calefactora a 100 °C. Enfriar en la placa de refrigeración durante 5 min.
NOTA: No desarrolle después de este paso. Desarrollar sólo una vez al final del proceso. - Espée la capa de la oblea con el KMPR 1035. Hacer funcionar la recubridora de centrifugado a 1.000 rpm durante 30 s.
- Hornear suavemente durante 30 min en una placa calefactora a 100 °C. Enfriar en la placa de refrigeración durante 5 min.
- Fije la máscara de la segunda capa a la cal sodada en blanco y alinee la segunda máscara con el alineador a través de signos de alineación estándar. Exponer a la luz UV utilizando un alineador de máscara de hasta 2.000 mJ/cm2.
- Vuelva a hornear durante 5 minutos en una placa de cocción a 100 °C.
- Desarrollar durante >6 min en el desarrollador SU-8.
NOTA: Si la oblea se ve lechosa, el desarrollo debe continuarse durante más tiempo. Use un desarrollador nuevo cada vez y en el medio para obtener un mejor resultado. - Rocíe con isopropanol. Asegúrese de que la oblea esté clara, sin residuos lechosos. Seque bien la oblea con gas nitrógeno (N2).
- Fabricación de dispositivos microfluídicos
- Vierta 50 g de la parte base del polidimetilsiloxano (PDMS) en un vaso de plástico transparente. Luego, agregue 5 g del reticulante al vaso de plástico. Mezclar la base y el reticulante utilizando una espátula vigorosamente hasta obtener una textura cremosa.
- Desgasifique al vacío la mezcla con un desecador durante 20 minutos hasta que se aclare. Vierta la mezcla en el molde maestro, que se coloca dentro y se pega con cinta adhesiva a una placa de Petri.
NOTA: Asegúrese de que el grosor (altura) del PDMS vertido sea de ≤8 mm. - Coloque la placa de Petri en el desecador y desgasifique al vacío la mezcla PDMS nuevamente durante 20 minutos hasta que se eliminen todas las burbujas. Colocar la placa de Petri en un horno a 70 °C durante 2 h hasta que el PDMS esté reticulado. Saque la placa de Petri del horno y deje que se enfríe.
- Cortar los dispositivos del molde con un bisturí. Separe los dispositivos lentamente del molde maestro. Use el punzón de biopsia (1,5 mm de diámetro) para cortar orificios a través de las entradas y la salida.
- Retire cualquier polvo de los dispositivos PDMS y las diapositivas de vidrio con cinta adhesiva, y coloque las diapositivas de vidrio y los dispositivos en una cámara de limpieza de plasma. Realizar el tratamiento de plasma durante 45 s (comenzando cuando la cámara se vuelve púrpura) con presión de aire inferior a 400 mTorr. Retire los portaobjetos y dispositivos de la cámara, coloque el dispositivo sobre los portaobjetos de vidrio y aplique una ligera presión. Coloque el dispositivo en el horno a 70 °C durante 30 minutos para mejorar la unión.
- Llene los dispositivos con tricloro (1H, 1H, 2H, 2H-perfluorooctil) silano (F-silano, 2% v / v) en el fluido diseñado para hacer que la superficie del canal sea fluorofílica. Inyecte la solución de F-silano a través de la salida y asegúrese de que todos los dispositivos estén expuestos. Espere 5-10 min.
NOTA: El F-silano debe prepararse fresco. Además, el F-silano no debe exponerse al aire durante mucho tiempo. - Aspire la solución de F-silano fuera del dispositivo a través de la entrada de solución acuosa. Lave el dispositivo dos veces con el líquido de ingeniería y aspire nuevamente. Coloque el dispositivo en el horno a 70 °C durante 30 minutos para evaporar el aceite restante.
- Formación de gotitas y fabricación de microgel GelMA
- Añadir 10 mg de fenil-2,4,6-trimetilbenzoilofinato de litio (LAP) a 10 ml de DPBS para preparar una solución fotoiniciadora (PI) (0,1% p/v). Proteja la solución de la luz envolviéndola en papel de aluminio.
- Disolver la cantidad deseada de GelMA en la solución PI y colocarla en el horno a 37 °C durante 1 h hasta obtener una solución transparente. Proteja la solución de la luz envolviéndola en papel de aluminio.
- Para preparar la fase oleosa, haga un 2% v/v de solución de surfactante biocompatible en el fluido de ingeniería.
- Inserte el tubo Tygon en las entradas y salidas del dispositivo PDMS. Inserte una aguja roma de 25 G en el otro extremo del tubo Tygon para entradas. Utilice la longitud mínima posible del tubo.
- Coloque el dispositivo bajo el microscopio. Mantenga el ambiente cálido (~ 40 ° C) usando un secador de pelo y / o un calentador de espacio.
- Cargue las soluciones acuosa y de aceite en jeringas separadas, conectadas al dispositivo. Arranque las bombas de jeringa con caudales de 160 y 80 μL/min para las fases de aceite (continua) y acuosa (dispersa), respectivamente.
NOTA: Comience primero la fase de aceite; Asegúrese de que el aceite llene el canal, luego comience la fase acuosa. - Recoja las gotitas en un recipiente y evalúelas en la cámara de imágenes mediante imágenes de microscopía óptica.
- Coloque las gotitas a 4 °C durante la noche mientras las protege de la luz para iniciar la reticulación física de GelMA HMP y convertir las gotitas en microgeles estables a 4 °C.
3. Conversión de microgeles en polvo resuspendible a través de la tecnología de emulsión a polvo de microingeniería (MEtoP)
NOTA: Se ha desarrollado la tecnología MEtoP para convertir los HMP a base de emulsión de aceite de agua en polvo de micropartículas (micro-aerogeles) con propiedades preservadas, como resuspirabilidad, forma, tamaño y ensamblaje.
- Para implementar el MEtoP, recoja los HMP reticulados físicamente en el fluido de ingeniería utilizando tubos de microcentrífuga o crioviales térmicamente duraderos. Abra las tapas de los tubos y ciérrelas con una toallita de laboratorio y cinta adhesiva.
- Congelar los HMP reticulados físicamente en nitrógeno líquido (-196 °C) durante 10 min.
- Transfiera los tubos congelados rápidamente a un instrumento liofilizador. Liofilizar los tubos a baja presión (por ejemplo, 0,06 mbar) durante al menos 6 h para producir polvo.
NOTA: Cuando termine el ciclo de liofilización, rompa la presión lentamente para que el polvo no se pierda. - Añadir 1 ml de solución PI enfriada (0,1% p/v, 4 °C) al polvo para hacer suspensiones de microgel. Vórtice durante 5 s, luego centrifugar a 3.000 × g durante 15 s. Deseche el sobrenadante.
- Transfiera la suspensión de microgel empaquetada a un molde utilizando una pipeta de desplazamiento positivo, seguida de una exposición a la luz UV a una longitud de onda de 400 nm con una intensidad de 15 mW / cm2 durante 60 s para formar GHS.

Figura 2: Preparación de polvo de micropartículas GelMA mediante tecnología MEtoP. (A) Imágenes de polvo GelMA obtenidas de la tecnología MEtoP o liofilización convencional de HMP. En la tecnología MEtoP o liofilización convencional, los HMP se suspenden en surfactante de aceite o medios acuosos, respectivamente. El fluido de ingeniería protege la fase dispersa (HMP) de la agregación y preserva las propiedades fisicoquímicas de las micropartículas GelMA durante la liofilización. (B) Ilustración esquemática de HMP secos preparados a través del MEtoP en comparación con HMP liofilizado convencionalmente en un medio acuoso. (C) Imágenes SEM de micropartículas secas de GelMA preparadas a través del MEtoP en comparación con la liofilización convencional. Barras de escala = 2 mm (izquierda; A), 500 μm (derecha; A), 10 μm (izquierda; C), y 200 μm (derecha; C). Esta cifra fue modificada con permiso de Sheikhi et al.26 Abreviaturas: GelMA = gelatina metacriloyl; DPBS = solución salina tamponada con fosfato de Dulbecco; MEtoP = emulsión a polvo de microingeniería; HMP = micropartícula de hidrogel; SEM = microscopía electrónica de barrido. Haga clic aquí para ver una versión más grande de esta figura.
4. Formación de GelMA GHS
NOTA: Este protocolo es para preparar 400 μL de suspensión de microgel. Para cantidades mayores, se necesita escalado. Para mantener los HMP de GelMA físicamente entrecruzados, todos los pasos deben realizarse a aproximadamente 4 °C colocando los recipientes de microgel en un cubo de agua helada.
- Agregue 400 μL de solución de 1H,1H-perfluoro-1-octanol (PFO) en el fluido de ingeniería (20% v/v) a los HMP GelMA reticulados físicamente. Luego, vórtice durante 5 s y centrifugadora durante 15 s a 300 × g.
NOTA: La solución de FOP en el fluido de ingeniería debe prepararse recién y almacenarse en un recipiente cerrado para evitar la evaporación. - Retire la fase oleosa de los HMP GelMA mediante pipeteo.
- Añadir 400 μL de solución PI (0,1% p/v) a 4 °C a la suspensión de microgel. Luego, vórtice durante 5 s y centrifugación a 300 × g durante 15 s. Deseche el aceite después.
- Repita el paso anterior pero centrifugar a 3.000 × g. Retire el sobrenadante de los HMP GelMA envasados mediante pipeteo.
- Transfiera los HMP GelMA envasados a un molde utilizando una pipeta de desplazamiento positivo, seguida de exposición a la luz UV (longitud de onda = 400 nm, intensidad = 15 mW/cm2, tiempo de exposición = 60 s).
5. Biotintas granulares de nanoingeniería (NGB) para la bioimpresión 3D de GHS con microporosidad preservada
- Añadir 100 mg de polvo de nanoplaquetas a 3 ml de agua ultrapura a 4 °C para formar una dispersión de nanopartículas (3,33% p/v). Vaporizar la dispersión vigorosamente dentro de un refrigerador a 4 ° C durante 15 minutos para exfoliar las nanopartículas agregadas. Las nanopartículas correctamente exfoliadas producen una clara dispersión.
- Disolver 50 mg de LAP en 5 ml de agua ultrapura a 4 °C para preparar una solución madre de PI (1% p/v).
- Añadir 333 μL de solución PI (1% p/v) a la dispersión de nanopartículas exfoliadas. Envuélvalo en papel de aluminio para protegerlo contra la luz ambiental. Vórtice durante 1 min para mezclar la dispersión de nanopartículas y PI. Las concentraciones finales de arcilla y PI son 3% p/v y 0,1% p/v, respectivamente.
- Agregue PFO 20% v/v en fluido de ingeniería (4 °C) a los HMP GelMA reticulados físicamente a una relación de volumen de 1:1. Vórtice a fondo durante 5 s. A continuación, centrifugar a 300 × g durante 15 s y desechar la fase oleosa que contiene el tensioactivo.
- Añadir la dispersión de nanopartículas suplementada con LAP (4 °C) a los HMP de GelMA lavados. Vórtice durante 15 s, centrifugar a 3.000 × g durante 15 s y desechar el aceite restante en el fondo, así como la dispersión sobrenadante.
- Guarde la suspensión a 4 °C mientras la protege de la luz con papel de aluminio durante 1 día. El producto de este paso es el GelMA NGB.
- Cargue el NGB en una jeringa de 3 ml, selle la jeringa cargada con una tapa y una parapelícula, y centrifugar de pulso a 200 × g para eliminar el aire atrapado. Transfiera la biotinta a un cartucho de 3 ml utilizando un conector Luer-Lok hembra-hembra. Centrifugar el cartucho brevemente a 200 × g de nuevo para eliminar el aire atrapado. Conservar el NGB a 4 °C en nevera antes de usarlo.
- Antes de preparar la biotinta cargada de células, prepare una suspensión celular concentrada (por ejemplo, células de fibroblastos murinos NIH/3T3), que contenga ~ 24 millones de células en 100 μL de medio de cultivo celular. Cargue la suspensión celular en una jeringa de 3 ml, acople la jeringa cargada con NGB y la jeringa cargada con células usando un conector Luer-Lok hembra-hembra, y mezcle las células y el NGB suavemente empujando hacia adelante y hacia atrás 40x.
- Imprima el NGB o NGB cargado de células utilizando una bioimpresora adecuada con una boquilla cónica estándar. Cargue la boquilla en el cabezal de impresión de 3 ml. Mantenga la temperatura de la cama de impresión por debajo de 10 °C. Optimice los parámetros de impresión, como la velocidad y la contrapresión , antes de imprimir.
- Seleccione el sustrato y el tipo de boquilla (jeringa neumática de 3 ml equipada con boquilla cónica estándar), calibre la bioimpresora siguiendo las directrices del dispositivo, seleccione el archivo gcode o STL deseado y comience a imprimir.
NOTA: Al realizar bioimpresión cargada de células, todos los materiales y dispositivos deben mantenerse debajo del gabinete de seguridad biológica para minimizar la contaminación. - Después de la impresión, exponga el constructo a la luz UV para la reticulación (longitud de onda = 400 nm, intensidad = 15 mW/cm2, tiempo de exposición = 60 s).
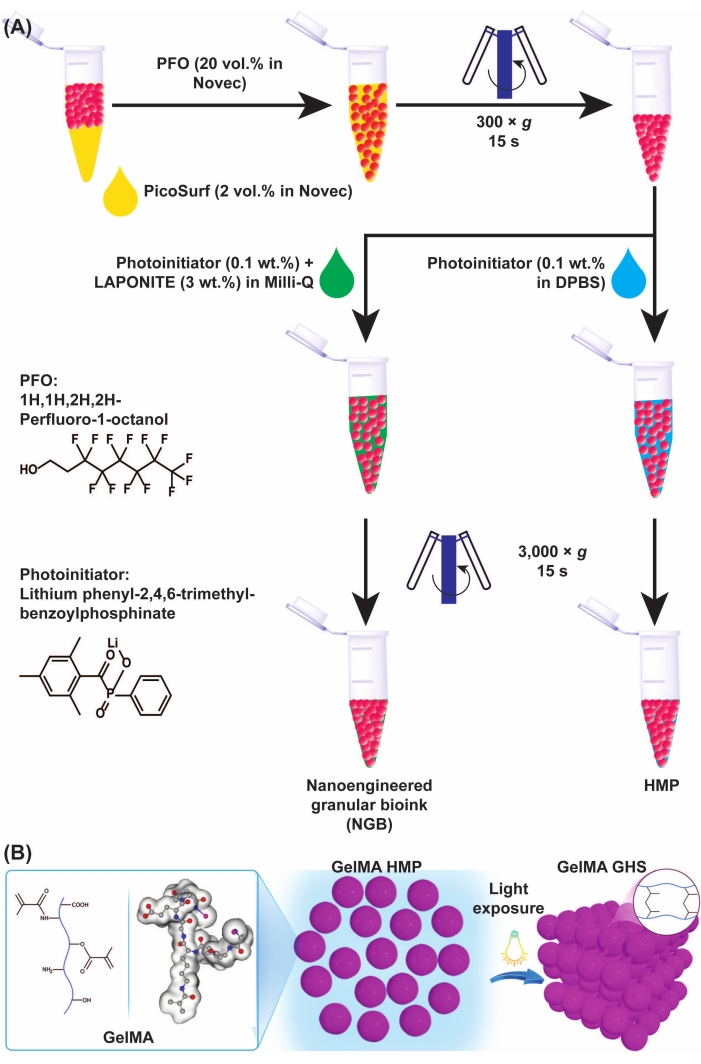
Figura 3: Esquemas de la formación de microgel GelMA y GHS. (A) Esquemas de separación de microgel GelMA de la preparación de aceite y NGB. Se añadió PFO (20% v/v en fluido de ingeniería) a la emulsión de microgel-aceite GelMA en una relación volumétrica de 1:1, seguida de vórtice y centrifugación a 300 × g durante 15 s. Para fabricar GelMA GHS, la solución PI (LAP 0.1% p/v en DPBS) se agregó a los HMP GelMA, seguida de vórtice y centrifugación a 3,000 × g durante 15 s. Para la preparación del NGB, la solución PI (LAP 0,1% p/v en agua ultrapura) y la dispersión nanoplaquetaria (3% p/v en agua ultrapura) se añadieron a la suspensión GelMA HMP, seguida de vórtice y centrifugación a 3.000 × g durante 15 s. La Figura 3A fue modificada con permiso de Ataie, Z. et al.11 (B) Exponiendo HMPs GelMA empaquetados a ligeros produce GHS. La figura 3B fue modificada con permiso de Sheikhi et al.15 Abreviaturas: GelMA = gelatina metacriloyl; SGA = andamio de hidrogel granular; NGB = biotinta granular nanodiseñada; FOP = 1H,1H-perfluoro-1-octanol; PI = fotoiniciador; LAP = fenil-2,4,6-trimetilbenzoilofinato de litio; HMP = micropartícula de hidrogel; DPBS = solución salina tamponada con fosfato de Dulbecco. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
GelMA se sintetizó a través de la reacción de gelatina con MA, como se presenta en la Figura 1A. Al adaptar las condiciones de reacción, como la concentración de MA, se obtuvieron diferentes grados de sustitución de MA. Para cuantificar el grado de sustitución de MA, se evaluó GelMA mediante espectroscopia de RMN 1H (Figura 1B). Los grupos funcionales de vinilo con picos representativos en los cambios químicos de ~ 5-6 ppm confirmar...
Discusión
La gelatina y sus derivados son los biomateriales a base de proteínas más utilizados para la fabricación de HMP. El desafío del equilibrio entre el rendimiento y la monodispersidad del tamaño de partícula se puede superar utilizando dispositivos microfluídicos de emulsificación escalonada. Estos dispositivos son capaces de formar más de 40 millones de gotas por hora, con un coeficiente de variación inferior al 5%27. En este artículo, discutimos la microfabricación de gotas que contiene...
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Los autores desean agradecer a T. Pond, especialista en apoyo a la investigación en el Departamento de Ingeniería Química de la Universidad Estatal de Pensilvania (Penn State), al personal del Laboratorio de Nanofabricación de Penn State y al Dr. J. de Rutte de Partillion Bioscience por la ayuda y la discusión sobre los procesos de nanofabricación. A. Sheikhi reconoce el apoyo de las subvenciones iniciales del Instituto de Investigación de Materiales (MRI) y la Facultad de Ingeniería de Materiales Materiales Materia a Nivel Humano, el Centro de Convergencia para Sistemas de Materiales Multifuncionales Vivos (LiMC2) y el Programa de Subvenciones de Investigación Colaborativa de Materiales Vivos, Adaptativos y Energéticamente Autónomos del Clúster de Excelencia (livMatS) y el fondo de inicio de Penn State. La investigación reportada en esta publicación fue parcialmente apoyada por el Instituto Nacional de Imágenes Biomédicas y Bioingeniería (NIBIB) de los Institutos Nacionales de Salud (NIH) bajo el número de premio R56EB032672.
Materiales
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Referencias
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394 (2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115 (2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122 (2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076 (2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390 (2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644 (2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071 (2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076 (2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados