このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ゼラチンメタクリロイル粒状ヒドロゲル足場:ハイスループットミクロゲル製造、凍結乾燥、化学アセンブリ、および3Dバイオプリンティング
要約
この記事では、マイクロ流体デバイスを使用したハイスループットゼラチンメタクリロイルミクロゲル製造、ミクロゲルの再懸濁可能な粉末(マイクロエアロゲル)への変換、粒状ヒドロゲル足場を形成するためのミクロゲルの化学集合、および3Dバイオプリンティング用のマイクロ多孔性が保存された粒状ヒドロゲルバイオインクの開発のプロトコルについて説明します。
要約
ヒドロゲル微粒子(HMP)を組み立て ることによって 製造された粒状ヒドロゲル足場(GHS)の出現により、 その場での微多孔性足場の形成が可能になりました。従来のバルクヒドロゲルとは異なり、GHSの相互接続されたマイクロスケールの細孔は、分解に依存しない細胞浸潤、ならびに酸素、栄養素、および細胞の副産物の移動を促進します。メタクリロイル修飾ゼラチン(GelMA)は、細胞接着性および生分解性部分を含む(光)化学的に架橋可能なタンパク質ベースの生体ポリマーであり、細胞応答性/有益な生体材料として広く使用されています。バルクGelMAをGHSに変換すると、組織工学と再生のための多くの機会が開かれる可能性があります。本稿では、ハイスループットGelMAミクロゲル作製、再懸濁乾燥ミクロゲル(マイクロエアロゲル)への変換、ミクロゲルの化学集合 体による GHS形成、および押出バイオプリンティングのための顆粒バイオインク作製の手順を示す。冷却と光架橋 による 逐次物理化学的処理により、機械的に堅牢なGHSの形成がどのように可能になるかを示します。光にアクセスできない場合(例えば、深部組織注入中)、個別に架橋されたGelMA HMPは、トランスグルタミナーゼを用いた酵素架橋 を介して 生物学的に直交的に組み立てることができます。最後に、低HMP充填密度での微多孔性GHSの3次元(3D)バイオプリンティングは、不均一に荷電したナノ粒子の界面自己組織化 を介して 実証される。
概要
HMPビルディングブロックを組み立てて組織工学の足場を形成することは、過去数年間で大きな注目を集めています1。HMPアセンブリを介して製造されたGHSは、個別のビルディングブロック間のボイドスペースに由来するセルスケールのマイクロ多孔性など、バルク対応物と比較して独自の特性を持っています。注入性、モジュール性、多孔性から分離された剛性などの追加の特性により、GHSは組織の修復と再生を強化するための有望なプラットフォームとなっています2。合成PEGベースのポリマー3,4およびアルギン酸5およびヒアルロン酸6,7などの多糖類を含む、異なる生体材料がGHS製造に使用されている。天然由来のポリマーの中で、GHS製造のための最も一般的なタンパク質ベースのバイオポリマーは、架橋性、生体適合性、生体接着性、および生分解性の生体材料であるGelMA 8,9,10,11です12,13。
HMPsは、バッチ乳化8、フローフォーカシング14、15またはステップ乳化9、11マイクロ流体デバイス、ブレンド16、または複雑なコアセルベーション17、18を介して作製することができる。通常、製造スループットとHMP単分散度の間にはトレードオフがあります。例えば、ブレンド技術により、不規則な形状で高度に分散したHMPが得られます。 バッチ乳化または複雑なコアセルベーションにより、大量の多分散球状HMPの製造が可能になります。 フローフォーカシングマイクロ流体デバイスは、変動係数が<5%の高度に単分散した液滴を製造するために使用されてきましたが、スループットは大幅に低くなっています。ステップ乳化マイクロ流体デバイスにおいて、高度に並列化されたステップにより、単分散HMP19のハイスループット製造が可能になる。
メタクリロイル修飾ゼラチン(GelMA)HMPビルディングブロックは、温度応答性および(光)化学的に架橋可能であり、容易なGHS製造を可能にする20。上限臨界溶解温度(UCST)21未満(例えば、4°C)に冷却すると、GelMA溶液を含む液滴は物理的に架橋されたHMPに変換されます。次に、これらのHMPビルディングブロックを外力(遠心分離など)を使用して充填し、詰まったミクロゲル懸濁液を生成します。隣接するHMP間に(光)化学的架橋を介して粒子間結合が確立され、機械的に堅牢なGHS14が形成されます。GHSの最も重要な特性の1つは、マイクロ多孔性であり、in vitroでの容易な細胞浸透11およびin vivoでの組織内殖の増強を可能にする22。HMPの三次元(3D)バイオプリンティングは、従来、密に充填されたミクロゲル懸濁液を用いて行われ、微多孔性を損なう23。
我々は最近、不均一に荷電したナノ粒子の吸着とそれに続くナノ粒子の可逆的自己組織化 を介した GelMAミクロゲルの界面ナノエンジニアリングに基づく新しいクラスの粒状バイオインクを開発しました。この戦略により、緩く充填されたミクロゲルのせん断収量と押出3Dバイオプリントが可能になり、積層造形されたGHS11のマイクロスケールの多孔性が維持されます。本稿では、ハイスループットのGelMA液滴作製、これらの液滴を物理的に架橋されたHMPに変換する方法、再懸濁可能な粉末を用いたGelMA HMPの作製、GelMA GHS形成、GelMAナノエンジニアリング粒状バイオインク(NGB)調製、および3Dバイオプリンティングの方法を紹介します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注:このプロトコルで使用されるすべての材料、機器、および試薬に関連する詳細については、 材料の表 を参照してください。
1. ゲルマ合成
注意: GelMA合成は化学ヒュームフードで行い、適切な個人用保護具(PPE)を常に使用する必要があります。
- 200 mLのダルベッコリン酸緩衝生理食塩水(DPBS、1x)を三角フラスコに加え、50°Cに達するまで溶液を加熱します。 蒸発を防ぐためにフラスコをアルミホイルで覆います。
- DPBS溶液にゼラチン粉末20gを加え、粉末が完全に溶解するまで240rpmで攪拌しながら50°Cで。
- 16、2.5、または0.5 mLの無水メタクリレート(MA)をガラスパスツールピペット を介して ゼラチン溶液に滴下し、それぞれ高、中、または低のメタクリロイル置換度を持つGelMAを合成します。
注意: MAは危険物です。MAを使用する場合は、適切なPPEを使用する必要があります。MAも光に敏感なので、フラスコをアルミホイルで包んで反応を光から保護します。 - 2時間後、50°Cで400 mLのDPBSを加えて反応を停止します。50°Cで10分間攪拌を継続します。
- 分子量カットオフが12〜14 kDaの透析膜チューブに溶液を注ぎ、40°Cの超純水で満たされた5 Lビーカーにチューブを置きます。240rpmと40°Cで水をかき混ぜます。
- 超純水に対して10日間透析し、水を1日2回交換して、未反応のメタクリル酸無水物、副生成物、その他の不純物を除去します。
- 10日後、GelMA溶液に40°Cの超純水400mLを加えます。溶液を240rpmで15分間攪拌する。
- コーヒーフィルターを使用して溶液を2回ろ過した後、0.2μmの真空ろ過ユニット で 真空ろ過します。
- ろ過した溶液25 mLを50 mLの遠沈管に注ぎ、-80°Cで凍結し、チューブを水平に置きます。
- 2日後、キャップを外し、遠心チューブを実験用ワイプで覆います。テープまたは輪ゴムを使用して、ワイプをしっかりと保持します。
- 凍結したGelMA溶液を凍結乾燥して、白色固体のGelMAを得た。
- プロトン核磁気共鳴(1HNMR)分光法を実施するには、1 mLの酸化重水素(D2O)に30 mgのゼラチン粉末(コントロール)または凍結乾燥GelMAを別途加え、ゼラチン粉末またはGelMAが完全に溶解するまでサンプルを37°Cに維持します。
- 1HNMRスペクトルを取得し、芳香族酸とリジンメチレンプロトンピークをそれぞれ~6.5-7.5および~3.0ppmの化学シフトで積分することにより、メタクリロイル置換度を決定します。芳香族酸ピークを基準として使用し、式(1)に基づいてリジンメチレンピークを用いて置換度(DS)を求めます。
DS(%)=[1-(GelMA中のリジンメチレンの面積/ゼラチン中のリジンメチレンの面積)]×100 (1)
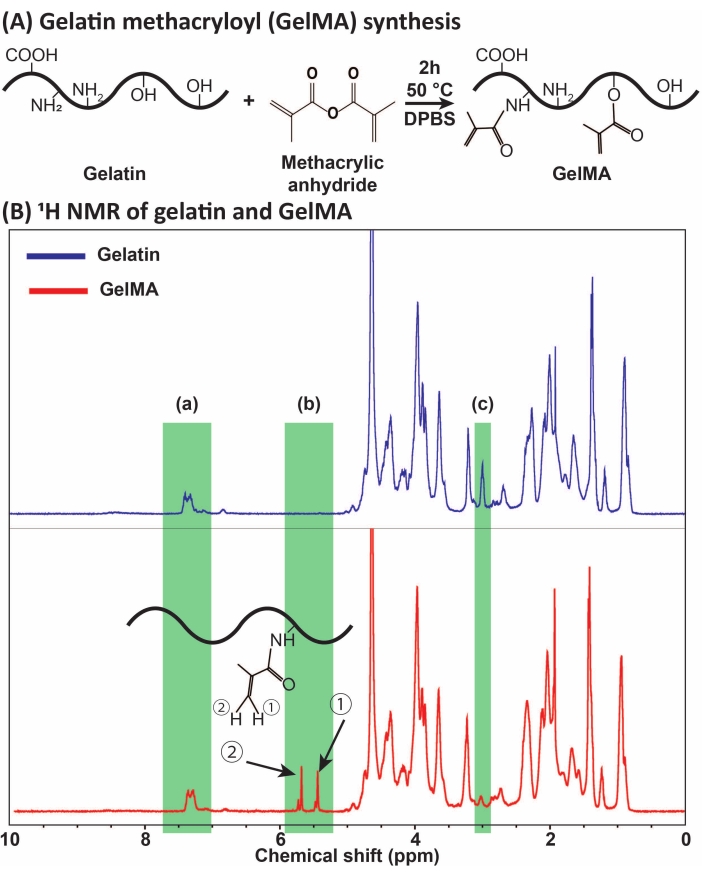
図1:ゲルMAの合成と特性評価。 (a)ゲルMA合成反応。ゼラチンを無水メタクリル酸で50°Cで2時間修飾する。 (b)ゼラチンおよびGelMAのプロトン核磁気共鳴(1HNMR)スペクトル:(a)較正の基準として選択された芳香族酸のピーク、(b)ゼラチンのMA修飾後のビニル官能基ピーク、および(c)リジンタンパク質のピーク。本実施例において、MA置換度は71%±3%であった(n=3)。この図は、Ataieらの許可を得て修正されています11 略語:GelMA =ゼラチンメタクリロイル;DPBS = ダルベッコのリン酸緩衝生理食塩水;MA=メタクリロイル。この図の拡大版を表示するには、ここをクリックしてください。
2. ハイスループットGelMAミクロゲル作製
- デバイスマスターモールド微細加工
注:マスターモールドは、KMPR 1000ネガフォトレジストシリーズ19を使用したソフトリソグラフィーによって微細加工できます。- KMPR 1025と1035を一晩解凍します。光への露出を避けてください。
- ウェーハの最初の層をコーティングするには、KMPR 1025をウェーハの中央に直接追加して、約5cmのフォトレジストの円を作ります。スピンコーターを3,000rpmで30秒間運転します。
- 100°Cのホットプレートで12分間ソフトベイクします。次に、冷却プレートで5分間冷却します。
- 最初の層マスクをブランクソーダライムに取り付け、次にマスクアライナーを使用して645 mJ / cm2 の投与量でコーティングされたウェーハをUV光にさらします。
- 100°Cのホットプレートで3分間ポストベークします。冷却プレートで5分間冷却します。
注: この手順の後に開発しないでください。プロセスの最後に一度だけ開発します。 - KMPR 1035を使用してウェーハ上の第2層をスピンコートします。スピンコーターを1,000rpmで30秒間運転します。
- 100°Cのホットプレートで30分間ソフトベイクします。冷却プレートで5分間冷却します。
- 2番目のレイヤーマスクをブランクソーダライムに取り付け、標準のアライメントサインを介してアライナーを使用して2番目のマスクを位置合わせします。2,000mJ/cm2までのマスクアライナーを使用してUV光に露光します。
- 100°Cのホットプレートで5分間ポストベークします。
- SU-8現像液で>6分間現像します。
注:ウェーハが乳白色に見える場合は、開発を長期間継続する必要があります。より良い結果を得るために、毎回およびその間に新鮮な開発者を使用してください。 - イソプロパノールをスプレーします。ウェーハが透明で、乳白色の残留物がないことを確認してください。窒素(N2)ガスを用いてウェーハを完全に乾燥させる。
- マイクロ流体デバイス作製
- 50 gのポリジメチルシロキサン(PDMS)ベース部分を透明なプラスチックカップに注ぎます。次に、5 gの架橋剤をプラスチックカップに追加します。クリーミーな食感が得られるまで、スパチュラを使用してベースと架橋剤を激しく混合します。
- 透明になるまでデシケーターを使用して混合物を20分間真空脱気します。混合物をマスターモールドに注ぎ、マスターモールドを内側に配置し、ペトリ皿にテープで留めます。
注意: 注ぐPDMSの厚さ(高さ)が≤8mmであることを確認してください。 - ペトリ皿をデシケーターに入れ、すべての気泡が除去されるまでPDMS混合物を20分間真空脱気します。PDMSが架橋されるまで、ペトリ皿を70°Cのオーブンに2時間入れます。ペトリ皿をオーブンから取り出し、冷まします。
- メスを使用して金型からデバイスを切り取ります。デバイスをマスターモールドからゆっくりと取り外します。生検パンチ(直径1.5 mm)を使用して、入口と出口に穴を開けます。
- マスキングテープを使用してPDMSデバイスとスライドガラスからほこりを取り除き、スライドガラスとデバイスをプラズマクリーナーチャンバーに入れます。400mTorr未満の空気圧で45秒間(チャンバーが紫色に変わったときに開始)プラズマ処理を実行します。スライドとデバイスをチャンバーから取り外し、デバイスをスライドガラスの上に置き、わずかな圧力をかけます。デバイスを70°Cのオーブンに30分間入れて、接着を強化します。
- チャネル表面を蛍光性にするために、設計された流体にトリクロロ(1H、1H、2H、2H-パーフルオロオクチル)シラン(F-シラン、2%v / v)を充填します。F-silane溶液を出口から注入し、すべてのデバイスが露出していることを確認します。5〜10分待ちます。
注:F-シランは新たに調製する必要があります。さらに、F-シランは長時間空気にさらされるべきではありません。 - F-silane溶液を水溶液入口から装置から吸引します。エンジニアリング液を使用してデバイスを2回洗浄し、再度吸引します。デバイスを70°Cのオーブンに30分間置き、残りのオイルを蒸発させます。
- 液滴形成とGelMAミクロゲル作製
- 10 mgのフェニル-2,4,6-トリメチルベンゾイルホスフィン酸リチウム(LAP)を10 mLのDPBSに加え、光開始剤(PI)溶液(0.1%w/v)を調製します。溶液をアルミホイルで包んで光から保護します。
- 必要量のGelMAをPI溶液に溶解し、透明な溶液が得られるまで37°Cのオーブンに1時間入れます。アルミホイルで包んで溶液を光から保護します。
- 油相を調製するには、エンジニアリング流体中に2%v/vの生体適合性界面活性剤溶液を作ります。
- PDMSデバイスの入口と出口にタイゴンチューブを挿入します。インレット用のタイゴンチューブのもう一方の端に25Gの鈍い針を挿入します。可能な限り最小のチューブ長を使用してください。
- デバイスを顕微鏡の下に置きます。ヘアドライヤーおよび/またはスペースヒーターを使用して環境を暖かく(~40°C)保ちます。
- 水溶液と油溶液を別々のシリンジに入れ、装置に接続します。シリンジポンプは、油相(連続)相と水性(分散)相でそれぞれ160μL/minと80 μL/minの流量で始動します。
注意: 最初に油相を開始します。オイルがチャネルを満たしていることを確認してから、水相を開始します。 - 液滴を容器に集め、光学顕微鏡イメージング によって イメージングチャンバー内で評価します。
- 液滴を光から保護しながら4°Cで一晩置き、GelMA HMPの物理的架橋を開始し、液滴を4°Cで安定したミクロゲルに変換します。
3.マイクロエンジニアリングされたエマルジョンから粉末(MEtoP)技術 による ミクロゲルの再懸濁可能な粉末への変換
注:水中油エマルジョンベースのHMPを、再懸濁性、形状、サイズ、組み立てなどの特性が保存された微粒子粉末(マイクロエアロゲル)に変換するMEtoP技術が開発されました。
- MEtoPを実装するには、熱的に耐久性のあるマイクロ遠心チューブまたはクライオバイアルを使用して、エンジニアリング流体中の物理的に架橋されたHMPを収集します。チューブキャップを開き、実験室用ワイプとテープで密封します。
- 物理的に架橋されたHMPを液体窒素(-196°C)中で10分間急速凍結します。
- 瞬間凍結チューブを凍結乾燥機装置に移します。チューブを低圧(0.06 mbarなど)で少なくとも6時間凍結乾燥して、粉末を生成します。
注意: 凍結乾燥サイクルが終了したら、粉末が失われないようにゆっくりと圧力を下げます。 - 1 mLの冷却PI溶液(0.1%w/v、4°C)を粉末に加え、ミクロゲル懸濁液を作ります。ボルテックスを5秒間、次に3,000 × g で15秒間遠心分離します。上澄み液を捨てる。
- 容積式ピペットを使用して充填したミクロゲル懸濁液を型に移し、続いて波長400nm、強度15mW/cm2 のUV光を60秒間露光してGHSを形成します。

図2:MEtoP技術によるGelMA微粒子粉末調製。 (A)MEtoP技術またはHMPの従来の凍結乾燥から得られたGelMA粉末の画像。MEtoP技術または従来の凍結乾燥では、HMPはそれぞれ油性界面活性剤または水性媒体に懸濁されます。エンジニアリング液は、分散相(HMP)を凝集から保護し、凍結乾燥中のGelMA微粒子の物理化学的特性を維持します。(B)MEtoPを介して調製された乾燥HMPを水性媒体中で従来の凍結乾燥HMPと比較した模式図。(C)MEtoPを介して調製された乾燥GelMA微粒子のSEM画像と従来の凍結乾燥の比較。スケールバー = 2 mm (左;A)、500 μm(右;A)、10 μm(左;C)、および200μm(右;この図は、Sheikhiらの許可を得て修正されました26略語:GelMA =ゼラチンメタクリロイル;DPBS = ダルベッコのリン酸緩衝生理食塩水;MEtoP =マイクロエンジニアリングされたエマルジョンから粉末へ。HMP = ヒドロゲル微粒子;SEM = 走査型電子顕微鏡。この図の拡大版を表示するには、ここをクリックしてください。
4. ゲルマGHS形成
注:このプロトコルは、400μLのミクロゲル懸濁液を調製するためのものです。大量の場合は、スケールアップが必要です。GelMA HMPを物理的に架橋した状態に保つには、ミクロゲル容器を氷水バケツに入れて、すべてのステップを約4°Cで実行する必要があります。
- エンジニアリング液中の400 μLの1H,1H-パーフルオロ-1-オクタノール(PFO)溶液(20%v/v)を物理的に架橋されたGelMA HMPに加えます。その後、300 × gで5秒間渦巻きし、15秒間遠心分離します。
注意: エンジニアリング液中のPFO溶液は、蒸発を防ぐために、新たに調製し、密閉容器に保管する必要があります。 - ピペッティング で GelMA HMPから油相を除去します。
- 4°Cで400 μLのPI溶液(0.1% w/v)をミクロゲル懸濁液に加えます。その後、5秒間渦巻き、300 × g で15秒間遠心分離します。その後、オイルを廃棄してください。
- 前の手順を繰り返しますが、3,000 × gで遠心分離します。充填されたGelMA HMPの上清をピペッティング で 除去します。
- 容積式ピペットを使用して充填されたGelMA HMPを型に移し、続いてUV光露光を行います(波長= 400 nm、強度= 15 mW/cm2、露光時間= 60秒)。
5.保存されたマイクロ多孔性を有するGHSの3Dバイオプリンティングのためのナノエンジニアリング粒状バイオインク(NGB)
- 4°Cの超純水3mLにナノプレートレット粉末100mgを加え、ナノ粒子分散液(3.33%w/v)を形成します。分散液を4°Cの冷蔵庫内で15分間激しくボルテックスし、凝集したナノ粒子を剥離します。適切に剥離されたナノ粒子は、透明な分散液を生成する。
- 50 mgのLAPを5 mLの4°C超純水に溶解し、ストックPI溶液(1% w/v)を調製しました。
- 剥離ナノ粒子分散液に333 μLのPI溶液(1% w/v)を加えます。周囲光から保護するためにアルミホイルで包みます。1分間ボルテックスし、ナノ粒子分散液とPIを混合する。最終的な粘土濃度とPI濃度はそれぞれ3%w / vと0.1%w / vです。
- エンジニアリング流体(4°C)中のPFO 20% v/vを物理的に架橋されたGelMA HMPに1:1の体積比で添加します。5秒間徹底的に渦巻きます。その後、300× g で15秒間遠心分離し、界面活性剤を含む油相を廃棄する。
- 洗浄したGelMA HMPsにLAP添加ナノ粒子分散液(4°C)を加えます。 ボルテックスで15秒間、3,000 × g で15秒間遠心分離し、底部に残っている油と上清分散液を廃棄します。
- 懸濁液をアルミホイルで光から保護しながら4°Cで1日間保存します。このステップの生成物が ゲルマNGBです。
- NGBを3 mLシリンジにセットし、ロードしたシリンジをキャップとパラフィルムで密封し、200 × g でパルス遠心分離して閉じ込められた空気を除去します。雌-雌Luer-Lokコネクタを使用して、バイオインクを3 mLカートリッジに移します。カートリッジを再び200 × g で短時間遠心分離して、閉じ込められた空気を取り除きます。NGBは冷蔵庫で4°Cで保管してからご使用ください。
- 細胞を含んだバイオインク調製の前に、100 μLの細胞培養培地に~2,400万個の細胞を含む濃縮細胞懸濁液(NIH/3T3マウス線維芽細胞など)を調製してください。細胞懸濁液を3 mLシリンジにロードし、雌-雌Luer-Lokコネクターを使用してNGB装填シリンジと細胞装填シリンジを結合し、細胞とNGBを40倍前後に押して穏やかに混合します。
- 標準的な円錐形ノズルを備えた適切なバイオプリンターを使用して、NGBまたは細胞を含んだNGBを印刷します。ノズルを3 mLプリントヘッドにセットします。印刷ベッドの温度を10°C未満に保ちます。 印刷前に 速度 や 背圧 などの印刷パラメータを最適化します。
- 基板とノズルのタイプ(標準の円錐形ノズルを備えた空気圧式3mLシリンジ)を選択し、デバイスガイドラインを使用してバイオプリンターを校正し、目的のgcodeまたはSTLファイルを選択して、印刷を開始します。
注:細胞を含んだバイオプリンティングを行う場合、汚染を最小限に抑えるために、すべての材料とデバイスを生物学的安全キャビネットの下に維持する必要があります。 - 印刷後、光架橋のためにコンストラクトをUV光にさらします(波長= 400 nm、強度= 15 mW / cm2、露光時間= 60秒)。
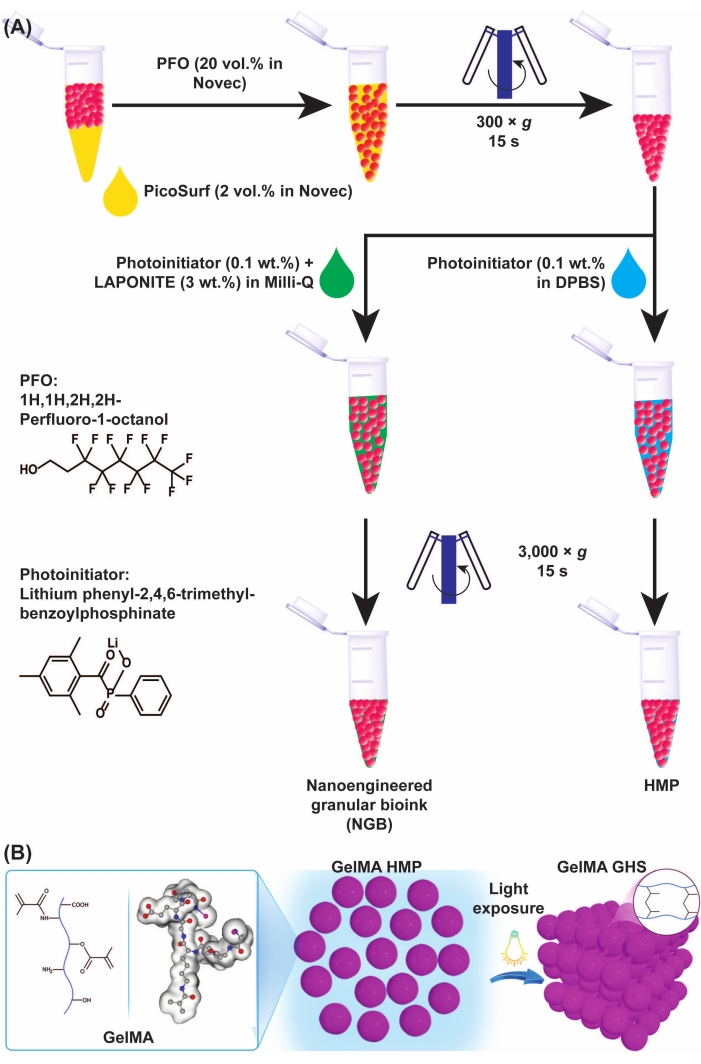
図3:GelMAミクロゲルとGHS形成の概略図。 (A)GelMAミクロゲルの油およびNGB調製物からの分離の概略図。PFO(エンジニアリング液中の20%v/v)をGelMAミクロゲル-オイルエマルジョンに1:1の体積比で添加し、続いて300 × gで15秒間ボルテックスおよび遠心分離を行った。GelMA GHSを作製するために、PI溶液(DPBS中のLAP 0.1% w/v)をGelMA HMPに添加し、続いて3,000 × gで15秒間ボルテックスおよび遠心分離を行った。NGBを調製するために、PI溶液(超純水中のLAP 0.1% w/v)およびナノプレートレット分散液(超純水中の3% w/v)をGelMA HMP懸濁液に添加し、続いてボルテックスおよび遠心分離を3,000 × gで15秒間行った。 図3Aは、Ataie, Z. et al.11(B)充填されたGelMA HMPを光にさらすとGHSが得られる。図3Bは、Sheikhiらの許可を得て改変した15略語:GelMA=ゼラチンメタクリロイル;GHS =粒状ヒドロゲル足場;NGB =ナノエンジニアリングされた粒状バイオインク;PFO = 1H,1H-パーフルオロ-1-オクタノール;PI =光開始剤;LAP = フェニル-2,4,6-トリメチルベンゾイルホスフィン酸リチウム;HMP = ヒドロゲル微粒子;DPBS = ダルベッコのリン酸緩衝生理食塩水。この図の拡大版を表示するには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
GelMAは、図1Aに示すように、ゼラチンとMAの反応によって合成されました。MA濃度などの反応条件を調整することにより、異なる程度のMA置換が得られた。MA置換の程度を定量化するために、GelMAを1H NMR分光法を介して評価した(図1B)。~5-6 ppmの化学シフトに代表的なピークを持つビニル官能基は、ゼラチンからのGelMA合成の成功を確認し?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ゼラチンとその誘導体は、HMP製造に最も一般的に使用されるタンパク質ベースの生体材料です。スループットと粒子サイズの単分散性のトレードオフの課題は、ステップ乳化マイクロ流体デバイスを使用して克服できます。これらのデバイスは、変動係数が5%未満で、毎時4,000万個以上の液滴を形成することができます27。本稿では、GelMA溶液を含む液滴を微細加工し、その?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は利益相反を宣言しません。
謝辞
著者らは、ペンシルベニア州立大学(ペンシルベニア州立大学)の化学工学科の研究支援スペシャリストであるT.ポンド、ペンシルベニア州立大学のナノファブリケーションラボのスタッフ、およびナノファブリケーションプロセスに関する支援と議論を提供してくれたPartillion BioscienceのJ.デルッテ博士に感謝します。A. Sheikhiは、材料研究所(MRI)と工学部の人間レベルの材料問題シード助成金、生活多機能材料システムのためのコンバージェンスセンター(LiMC2)とクラスターオブエクセレンスリビング、適応およびエネルギー自律材料システム(livMatS)リビング多機能材料共同研究シード助成プログラム、およびペンシルベニア州立大学からのスタートアップ基金の支援を認めています。この出版物で報告された研究は、国立衛生研究所(NIH)の国立生物医学画像生物工学研究所(NIBIB)によって、賞番号R56EB032672で部分的にサポートされました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
参考文献
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394(2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115(2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122(2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076(2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390(2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , 17/279,283 (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644(2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194(2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076(2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , 17/425,027 (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved