A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימור קריוגני והערכה ביואנרגטית של תאים חד-גרעיניים בדם היקפי אנושי
In This Article
Summary
תאי דם חד-גרעיניים היקפיים מבודדים יכולים לשמש לניתוח של תפקודים והפרעות חיסוניות, מחלות מטבוליות או תפקודים מיטוכונדריאליים. בעבודה זו, אנו מתארים שיטה סטנדרטית להכנת PBMCs מדם שלם ושימור בהקפאה לאחר מכן. שימור בהקפאה הופך את הזמן והמקום הזה לעצמאיים.
Abstract
התפקודים הפיזיולוגיים של תאים אאוקריוטים מסתמכים על אנרגיה המסופקת בעיקר על ידי מיטוכונדריה. תפקוד לקוי של המיטוכונדריה קשור למחלות מטבוליות ולהזדקנות. זרחן חמצוני משחק תפקיד מכריע, שכן הוא חיוני לשמירה על הומאוסטזיס אנרגטי. PBMCs זוהו כמדגם זעיר פולשני למדידת תפקוד המיטוכונדריה והוכחו כמשקפים מצבי מחלה. עם זאת, מדידת התפקוד הביו-אנרגטי של המיטוכונדריה יכולה להיות מוגבלת על ידי מספר גורמים בדגימות אנושיות. המגבלות הן כמות הדגימות שנלקחו, זמן הדגימה, אשר לעתים קרובות מפוזר על פני מספר ימים, ומיקומים. שימור בהקפאה של הדגימות שנאספו יכול להבטיח איסוף ומדידה עקביים של דגימות. יש להקפיד על כך שהפרמטרים שנמדדו דומים בין תאים משומרים בהקפאה לבין תאים טריים. במאמר זה אנו מתארים שיטות לבידוד ושימור PBMCs בהקפאה מדגימות דם אנושיות כדי לנתח את התפקוד הביו-אנרגטי של המיטוכונדריה בתאים אלה. PBMC נשמר בהקפאה על פי הפרוטוקול המתואר כאן מראה רק הבדלים קלים במספר התאים וביכולת הכדאיות, ברמות אדנוזין טריפוספט ובפעילות שרשרת הנשימה שנמדדה בהשוואה לתאים שזה עתה נקטפו. רק 8-24 מ"ל של דם אנושי נדרש עבור ההכנות המתוארות, מה שמאפשר לאסוף דגימות במהלך מחקרים קליניים multicentral ולקבוע bioenergetics שלהם באתר.
Introduction
תאי דם חד-גרעיניים היקפיים אנושיים (PBMCs) משמשים ליישומים שונים בתחומים מדעיים רבים, כולל חקר נושאים אימונולוגיים וביו-אנרגטיים, כגון אלה הקשורים לתהליכי הזדקנות או מחלות ניווניות 1,2. PBMCs הם הטרוגניים בהרכבם ומורכבים מלימפוציטים (תאי B, תאי T ותאי NK), מונוציטים ותאים דנדריטיים. התאים מראים לפעמים הבדלים אינדיבידואליים גדולים ווריאציות בתוך נושא, ולכן נדרשים נהלים סטנדרטיים לטיפול בתאים אלה. פרמטרים חשובים כמו כדאיות וטוהר הבידוד הם הדרישות הבסיסיות לטיפול בו ומושפעים גם מגורמים סביבתיים כמו זמן האיסוף, רמת המלטונין, האם הנבדק בצום ועוד 3,4.
בהתבסס על מחקרים על ביו-אנרגטיקה של PBMCs, אנו מתארים כאן שיטה לבידוד, שימור הקפאה וטיפוח של PBMCs המתאימה גם לשיטות אחרות. בעוד שביופסיה של שריר נחשבת לתקן הזהב למטבוליזם של אנרגיה מיטוכונדריאלית5, בדיקת תאי הדם היא הליך מהיר וזעיר פולשני. בנוסף לכך, יותר ויותר מחקרים מצביעים על כך שהשינויים בתפקוד המיטוכונדריה בהזדקנות ובאלצהיימר מתרחשים לא רק במוח אלא גם בפריפריה 6,7,8,9,10. השיטה מאפשרת גם חקירות של מצבים ומחלות אחרות, כולל סוכרת והשמנת יתר 11,12,13. ניתן לנתח דפוסי ביטוי גנים בחולי טרשת נפוצה, או תפקוד מערכת החיסון והשפעותיו עליה באופן כללי 14,15,16.
PBMCs בדרך כלל מסתמכים על זרחן חמצוני (OXPHOS) כדי לייצר אדנוזין טריפוספט (ATP)17,18. לכן, PBMCs מכסים מגוון רחב של יישומים כפונדקאיות. בדוחות קודמים, חילוף החומרים האנרגטי של PBMCs שימש לטיפול בתפקוד לקוי של איברים, כגון אי ספיקת לב מוקדמת19, הלם ספטי20 או הבדלים הקשורים למין4 בתפקוד המיטוכונדריה. לשיטה כללית לבידוד הקפאה וטיפוח של PBMCs יהיו יתרונות בהשוואת התוצאות המתקבלות במכונים שונים. קיימת שונות רבה בפרוטוקולים עבור כל שלב21,22, מטרת שיטה זו היא לספק קו מנחה למדידות ביו-אנרגטיות במרכזיות.
במאמר זה נתאר שיטה למדידת פרמטרים ביו-אנרגטיים במרכזיות. אנו מסבירים את השיטות לבידוד, שימור ומדידה של ביו-אנרגטיקה של PBMCs מדם אנושי. שיטה זו יכולה לשמש כדי לקבוע פרמטרים ביו-אנרגטיים בחולים ולהעריך אותם בהקשר קליני. כדי ליישם מדידות אלה, החוקרים זקוקים לגישה לאוכלוסיית חולים שממנה ניתן לקבל דגימות דם טריות.
Protocol
כל הפרוטוקולים המתוארים בכתב יד זה לאיסוף, בידוד וניתוח דם נבדקו ואושרו על ידי מועצת הביקורת המוסדית באוניברסיטת גיסן, גרמניה. התקבלה הסכמת החולים לכלול את הדגימות שלהם במחקר. כל שלבי הבידוד ותרבית התאים מתבצעים תחת ארון בטיחות ביולוגי.
1. דיקור
- הכינו את כל הציוד הדרוש לאיסוף הדם כולל תרסיס חיטוי, מטוש סטרילי, צינורית איסוף דם עם צינור 80 מ"מ ורב-מתאם, חוסם עורקים/שרוול לחץ דם, מונובט 9 מ"ל ליתיום-הפרין.
הערה: EDTA כנוגד קרישה יעיל גם הוא. - לאסוף דם מן הווריד הזרוע המתאים ביותר, בדרך כלל vena mediana cubiti או vena cephalica.
- יש למרוח חוסם עורקים/לחץ דם בלחץ קל, בסביבות 80 מ"מ/כספית.
- יש לחטא את הכפפות ולנקב את האתר בתרסיס חיטוי המכיל אלכוהול. הניחו לאתר הניקוב שעבר חיטוי להתייבש באוויר.
- הוורידים בולטים בגלל הלחץ של שרוול הלחץ. הכנס את המחט (קוטר קנולה (חיצוני) 21G / 0.8 מ"מ, אורך 19 מ"מ) בזווית של 15°-20° של הווריד בניסיון למנוע טראומה ולמזער את החיטוט.
- קח דם עם מערכת מתאימה, 4 צינורות המכילים 9 מ"ל דם (יותר מ 7-8 צינורות בעייתיים עבור נסיין אחד לבודד כראוי).
- לאחר איסוף הדם, הניחו את צינורות האיסוף בחושך למשך 5 דקות כדי להבטיח נוגדי קרישה אחידים.
2. בידוד PBMC
- הכינו את כל הפתרונות הדרושים כמתואר להלן.
- הביאו את תמיסת המלח המאוזנת של דולבקו (DPBS; ריכוז 1x) ואת מדיום בידוד הלימפוציטים (1.077 גרם/מ"ל) לטמפרטורת החדר (20-25 מעלות צלזיוס).
- הכינו סרום בקר עוברי (FBS) בטמפרטורת החדר ושמרו צינור חרוטי סטרילי אחד של 50 מ"ל עם FBS על קרח. עבור כל דגימת דם, 2 מ"ל של FBS נדרש.
- יש לאחסן מיכל הקפאה ב-4°C ו-precool cryotubes ב-4°C.
- תרבית תאים חמה בינונית עד 37 מעלות צלזיוס, המדיום מורכב RPMI 1640 עם 50 מ"ל של FBS ופניצילין 50 U/mL סטרפטומיצין 50 U/mL. פתרון זה ניתן לאחסן ב 3 °C עד חודשיים.
- הוסף 8 מ"ל של DPBS בצינורות חרוטיים סטריליים של 50 מ"ל. הוסף 15 מ"ל של מדיום בידוד לימפוציטים בצינור חרוטי סטרילי 50 מ"ל (בינוני רגיש לאור, הוסף אותו לפני תחילת הבידוד).
- מוסיפים 8 מ"ל דם ל 8 מ"ל של DPBS, ובזהירות מערבבים עוד עם פיפטה פלסטיק פסטר 3 מ"ל.
- יש לערבב בעדינות את הדם/DPBS עם פיפטת פסטר פלסטיק בנפח 3 מ"ל על גבי מדיום בידוד הלימפוציטים. כדי להחיל את השכבה הראשונה על המדיום, הטה את הצינור 20°-30°, מה שיביא לפחות חדירה של תערובת הדם-PBS לתוך השכבה הבינונית.
- הניחו את תערובת הדם-PBS בזהירות על הדופן הצדדית של הצינור על מדיום בידוד הלימפוציטים. השתמש במהירות קבועה כדי לשמור על זרימת דם קבועה.
- בשלב הבא, להביא את הצינור לאט למצב זקוף, הדם הנותר הוא שכבות בזהירות על הקיר הצדדי של הצינור על שכבת הדם.
- צנטריפוגה למשך 10 דקות ב 1000 x גרם בטמפרטורת החדר בצנטריפוגה עם רוטור דלי מתנדנד עם בלמים כבויים. לאחר הצנטריפוגה, תערובת הדם/PBMC מופרדת לארבע שכבות. השכבה העליונה מורכבת מפלזמה וטסיות דם, השכבה השנייה היא שכבת PBMC, ואחריה שכבה בינונית לבידוד לימפוציטים, ולבסוף, אריתרוציטים וגרנולוציטים בשכבה התחתונה. השכבות השונות מוצגות באיור 1.
- מוציאים 2/3 משכבת הפלזמה בעזרת פיפטת פסטר מפלסטיק.
- באמצעות פיפטה של 1 מ"ל, לאסוף את PBMCs על שכבת בידוד לימפוציטים בינונית תוך הקפדה לא לקבל שום מדיום בדגימה.
- מקם את הקצה 1 מ"מ מעל שכבת PBMC. אין לנקב את שכבת PBMC, אחרת התווך יזרום על פני התאים. היניקה של פיפטה מושכת את PBMCs לנקודה זו כך שניתן לאסוף אותם מספר פעמים בשלב זה.
הערה: כדי למקסם את מספר PBMCs שנאספו, בסוף ההליך לחפש את השאר על פני השטח ולנסות לאסוף את התאים גם שם. כדי לייצב את ההליך, הצינור יכול להיות ממוקם על משטח. - העבירו את מרכזיות המרכזיות, צעד אחר צעד, לצינור חדש של 50 מ"ל עד לקצירת השכבה במלואה. הוסף DPBS עד סימן 25 מ"ל, לשטוף את מדיום בידוד הלימפוציטים ושאריות אחרות.
- צנטריפוגה למשך 10 דקות ב 100 x גרם בטמפרטורת החדר עם בלמים פועלים. הסר את supernatant עם משאבת ואקום או דומה, יש להקפיד לא לפגוע בכדורית התא.
- השהה מחדש את הגלולה ב- 1 מ"ל של DPBS והוסף DPBS לסימן 25 מ"ל. יש לחזור על הכביסה פעם נוספת ולאחר מכן להשהות מחדש במדיום המתאים לשלבים הבאים.
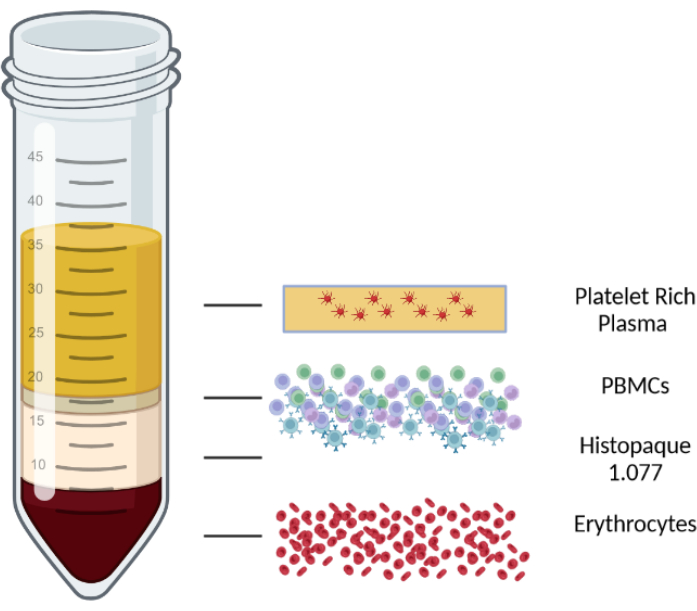
איור 1: ייצוג סכמטי של צנטריפוגת שיפוע צפיפות כדי להמחיש את השכבות השונות. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. שימור בהקפאה
- מצננים מיכל הקפאה ל-4°C, מצננים FBS על קרח.
- להשעות מחדש PBMC גלולה ב 1 מ"ל של FBS עם פיפטה 1 מ"ל, FBS צריך להיות בטמפרטורת החדר.
- מערבבים DMSO עם FBS מקורר מראש על קרח 1:5, ריכוז סופי 20% DMSO ואז מחזירים את תערובת FBS: DMSO לקרח. תמיד להכין את הפתרון טרי.
- העבר את מתלה תאי PBMC ב- FBS לצינורות קריו-צינוריות 2 מ"ל מסומנים היטב. השתמש בצינור קריו-צינור אחד לכל צינור איסוף. התאם את מספר התאים בין 1 x 107 ו- 5 x 107 למ"ל. השתמש במונה תאים אוטומטי כדי לקבוע את ספירת התאים ואת הכדאיות.
- הוסף 1 מ"ל של FBS: תערובת DMSO טיפה עם פיפטה 1 מ"ל, כ 1-2 טיפות לשנייה, לתוך הצינור. התוספת הטיפתית מובילה לערבוב רציף ועקבי.
- מניחים את הצינורות במיכל ההקפאה המקורר מראש. הכניסו את מיכל ההקפאה למקפיא בטמפרטורה של -80°C למשך 24 שעות. מיכל ההקפאה מספק קירור מבוקר של -1 °C לדקה.
- מוציאים את הצינורות מהמקפיא בטמפרטורה של -80°C. לאחר ההסרה מהמקפיא לאחסן את הצינורות בשלב הגז של חנקן נוזלי. תעד את המקום של כל דגימה.
4. הפשרה
- הכינו את כל הפתרונות הדרושים: תרבית תאים בסל"ד בינוני 1640 עם 50 מ"ל FBS ופניצילין 50 U/mL, סטרפטומיצין 50 U/mL. ניתן לאחסן תמיסה זו בטמפרטורה של 3°C למשך עד חודשיים.
- תרבית תאים טרום חמה בינונית עד 37 מעלות צלזיוס. הוסף 3 מ"ל של מדיום תרבית תאים טרום חם לתוך צינורות חרוטי סטריליים 50 מ"ל.
- יש להסיר דגימה ממיכל חנקן נוזלי. הפשירו דגימות באמבט מים בטמפרטורה של 37°C למשך כ-3.5 דקות, הסירו מאמבט המים ברגע שהקרח האחרון נמס. חתיכת קרח בגודל ראש סיכה עדיין צריכה להיות גלויה בצינור.
הערה: DMSO מזיק לעבודה של PBMCs מהר ככל האפשר. - הסר את התא: FBS:DMSO לערבב עם פיפטה 1 מ"ל מן cryotube. מערבבים את דגימות PBMC עם מדיום תרבית התאים בצינורות 50 מ"ל מוכנים. לשטוף את הצינורות עם 5 מ"ל של מדיום תרבית בשלושה שלבים של 2 מ"ל, 2 מ"ל, ו 1 מ"ל.
- מעבירים את המדיום לתוך הצינורות. פעולה זו מבוצעת כדי להעביר שאריות תאים אפשריות. צנטריפוגה למשך 10 דקות ב 100 x גרם בטמפרטורת החדר.
- יש להשליך את הסופרנאטנט ולהוסיף 1 מ"ל מדיום המתאים לשימוש מתוכנן. התאים מוכנים לניסויים הבאים.
הערה: עם זאת, עם בדיקות פונקציונליות על תאים טריים או קפואים, תקופת מנוחה באינקובטור (בדרך כלל לילה) מומלצת לעתים קרובות לאחר בידוד לימפוציטים על בסיס בינוני או הפשרת תאים.
5. תרבית תאים
- לאחר בידוד או הפשרה תאי תרבית לילה ב 37 ° C ב 5% CO2/95% אוויר.
- להשהות מחדש את התאים ב 1 מ"ל של מדיום RPMI בתוספת 10% FBS, פניצילין 50 U/mL, סטרפטומיצין 50 U/mL. לשימוש נוסף ישנן אפשרויות רבות, לטפל בתאים לפי הצורך עבור הבדיקות.
- לאחסון כללי יש להשתמש בצלחות סטריליות של 6 בארות לתרבית תאים ובתאי קציר לאחר תקופת המנוחה. מעבירים 1 מ"ל של תרחיף תאים עם פיפטה 1 מ"ל לבאר ומוסיפים 4 מ"ל של מדיום תרבית תאים.
הערה: כמות PBMCs מבודדים משתנה מאוד בין אנשים, באר אחת עם 5 מ"ל של מדיום תרבית תאים מספיקה לכל 8 מ"ל של דם מבודד. עם זאת, כאשר מבודדים PBMCs ממעילי באפי, כמות PBMCs גבוהה משמעותית מאשר בדגימות דם שלמות ולכן יש לחלק את התאים למספר בארות. - תנו לתאים לנוח 24 שעות באטמוספירה לחה בתוספת 5% CO2 ב-37°C. דגירה זו מבוצעת עבור תאים מבודדים טריים, כמו גם עבור תאים cryopreserve.
6. בדיקת ATP
- PBMCs מופשרים ב 1 מ"ל של מדיום RPMI בתוספת 10% FBS, פניצילין 50 U/mL, סטרפטומיצין 50 U/mL.
- קח דגימה וקבע את ספירת התאים, ולאחר מכן בצע אפליה חיה עם כחול טריפאן. קח 10 μL מהתאים המרחפים מחדש וערבב עם מדיום תרבית תאים 90 μL. לאחר מכן לקחת 10 μL ולערבב עם 10 μL של כחול trypan. מקם את התאים בתא ספירת תאים או מונה תאים אוטומטי וקבע את מספר התאים החיים/מתים.
- צלחת 100 μL של תאים בצפיפות של 1 x 105 תאים / 100 μL לכל באר בלוח פוליסטירן לבן 96 באר.
- תנו לתאים לנוח במשך 24 שעות באטמוספירה לחה בתוספת 5% CO2 ב-37°C.
- קבע את ריכוזי ה- ATP באמצעות בדיקת ATP.
- השתמש פליטת אור המתרחשת כאשר ATP משולב עם לוציפרין. ניתן להעריך את האור הנפלט באמצעות קורא לוחות. מוציאים את הצלחות כדי שהאינקובטור יתקרר לטמפרטורת החדר למשך 15 דקות. מניחים את התאים ומשאירים אותם למשך 5 דקות. לאחר מכן להחיל מגיב ניטור על התאים ולמדוד על פי הוראות היצרן. תקן פנימי משמש לקביעת רמת ה- ATP.
7. רספירומטריה ברזולוציה גבוהה
- הפעל את האוקסיגרף ברזולוציה גבוהה ותן לו להתחמם במשך 30 דקות.
- טפלו בתאים בהתאם לפרוטוקול המתואר באיור 1. הכינו את כל המלאי הדרוש כמו בטבלה 1.
- פיפטה 2.1 מ"ל של חיץ נשימה (טבלה 1) לשני תאי אוקסיגרף ברזולוציה גבוהה ומערבבים את החיץ ברציפות באמצעות מוט ערבוב מגנטי הקיים בתאים (750 סל"ד) ב-37°C למשך 30 דקות עד לקבלת אות שטף חמצן יציב של חיישן החמצן הפולרוגרפי.
הערה: בתאי האוקסיגרף נמדדות צריכת החמצן בזמן אמת (שטף) וריווי החמצן של התא בעזרת אלקטרודות חמצן פולרוגרפיות. יש לבצע כיול רקע כדי למנוע רעשי רקע ולהבטיח תוצאות אמינות. - בצע כיול אוויר של חיישן החמצן הפולרוגרפי בהתאם לפרוטוקולי היצרן23.
- השהה מחדש PBMCs מבודדים ב- 1 מ"ל של מדיום נשימה מיטוכונדריאלי (MIR05, ההרכב מוצג בטבלה 1) ודילול ל- 8 x 106 תאים/מ"ל.
- לאחר כיול האוויר, יש לשאוף את מדיום הנשימה מתא האוקסיגרף ולהוסיף 2.1 מ"ל של תרחיף תאים בכל קמבר של הרספירומטר. אם יש צורך במהלך המדידה לחמצן מחדש את התאים (ראו פתיחה בנקודה h באיור 2), ריווי החמצן של התאים לא אמור לרדת מתחת ל-100 מיקרומטר.
- סגור את התאים על ידי הכנסת הפקקים, התאים מתוכננים להחזיק נפח 2.0 מ"ל. שאפו את השעיית התא המתהווה.
- ערבבו ברציפות את מתלה התא בטמפרטורה של 37°C עם מערבל מגנטי (750 סל"ד) הממוקם בתא. המתן כ-20 דקות עד לקבלת אות יציב. קבעו נשימה אנדוגנית ((a) באיור 2).
- כדי לקבוע את הפעילויות המורכבות השונות של שרשרת הנשימה, הזריקו את המצע והמעכבים לנשימה מיטוכונדריאלית דרך יציאות הזרקת הטיטניום של הפקקים. השתמש בריכוז הסופי הבא בתא.
- כדי לשבש את קרום התא, הוסיפו 5 μL של 8.1 מילימטר דיגיטונין, דרך פתח הזרקת הטיטניום של פקק התא, כדי להסיר מצעים נאיביים (b) באיור 2 בזמן שקרומי המיטוכונדריה נשארים שלמים.
- הוסף מצעים 2 M גלוטמט ו 800 mM malate דרך יציאת ההזרקה של פקק התא להקליט נשימה עד לקבלת אות יציב. האות מתייצב לאחר 2-4 דקות.
הערה: ניתן גם להשתמש במצעים נוספים כמו פירובט. - הוסף 8 μL של 500 mM אדנוזין דיפוספט (ADP) דרך יציאת ההזרקה של פקק התא ולהקליט נשימה עד להשגת אות יציב. האות מתייצב לאחר 2-4 דקות (d) באיור 2.
- הוסף 20 μL של 1 M succinate דרך יציאת ההזרקה של פקק התא להקליט נשימה עד אות יציב מושגת. האות מתייצב לאחר 2-4 דקות (e) באיור 2.
- טיטראט 1 M קרבוניל ציאניד p-trifluoromethoxy phenylhydrazone (FCCP) בהדרגה ב 0.5 μL עד לנקודה שבה לא מתרחשת עלייה נוספת. המתינו 2-4 דקות עד שהאות יתייצב (f) באיור 2. כאשר אין עלייה נוספת בנשימה, המשך לשלב הבא.
אזהרה: היזהר בעת טיפול ב-FCCP מכיוון שיש בו סיכונים בריאותיים לבני אדם. - הוסף 5 μL של 0.1 mM rotenone דרך יציאת ההזרקה של פקק התא ולהקליט נשימה עד להשגת אות יציב. האות מתייצב לאחר 2-4 דקות (g) באיור 2.
זהירות: היזהר בעת טיפול rotenone כפי שיש סיכונים בריאותיים עבור בני אדם. - הוסף 1 μL של 4 מ"ג / מ"ל אוליגומיצין דרך יציאת ההזרקה של פקק התא ולהקליט נשימה עד להשגת אות יציב. האות מתייצב לאחר 2-4 דקות (שעה) באיור 2.
זהירות: היזהר בעת טיפול באוליגומיצין מכיוון שהוא רעל המהווה סיכון בריאותי לבני אדם. - הוסף 1 μL של 5 mM antimycin A דרך יציאת ההזרקה של פקק התא ולהקליט נשימה עד להשגת אות יציב. האות מתייצב לאחר 2-4 דקות (i) באיור 2.
זהירות: היזהר בעת טיפול באנטימיצין A מכיוון שהוא רעל המהווה סיכון בריאותי לבני אדם. - בעת הערכת הריצה כדי להוציא את צריכת החמצן של אנזימים שאינם מעורבים בזרחון חמצוני, יש להפחית את ערכי האנטימיצין A מכל הערכים הנמדדים האחרים.
- הוסף 200 mM N,N,N',N'-tetramethyl-p-phenylenediamine dihydrochloride (TMPD; תורם אלקטרונים) ו 800 mM ascorbate כדי לשמור על TMPD במצב מופחת. יש להזריק את המצעים דרך פתח ההזרקה של פקק התא ולהקליט נשימה עד לקבלת אות יציב. האות מתייצב לאחר 2-4 דקות (j) באיור 2.
- TMPD כפוף לחמצון עצמי, לכן יש להפחית את צריכת החמצן המתקבלת מהערך הנמדד בקומפלקס IV.
- הוסף NaN3 ≥ 100 mM דרך יציאת ההזרקה של פקק התא ולהקליט נשימה עד להשגת אות יציב. האות מתייצב לאחר 2-4 דקות כדי לעכב פעילות IV מורכבת, רק חמצון אוטומטי TMPD נשאר.
זהירות: היזהר בעת טיפול בנתרן אזיד מכיוון שהוא מהווה רעל המהווה סיכון בריאותי לבני אדם.
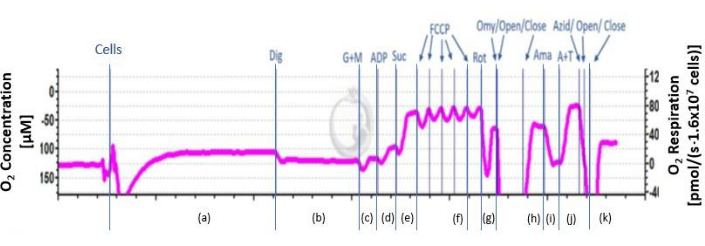
איור 2: מהלך סכמטי של שטף O2 . המהלך הסכמטי של שטף החמצן מוצג. העקומה מחולקת לשלבים השונים לאחר הוספת מעכבים ומצעים מ a-k. A: נשימה אנדוגנית; ב: תאים חדירים; ג: קומפלקס לא מצומד I נשימה; ד: מורכב מצומד I נשימה; ה: אוקספוס ; f: פעילות בלתי מצומדת מקסימלית של CI ו- CII ; ז: נשימה לא מצומדת של קומפלקס II; ח: נשימה דולפת; I: נשימה שיורית; j: CIV(U) נשימה לא מצומדת וחמצון עצמי של TMPD; k: חמצון עצמי של TMPD. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
8. פעילות ציטראט סינתאז
- למדוד את פעילות ציטראט סינתאז כפרמטר נפרד ולהשתמש בו כדי לנרמל את המדידות של oxygraph ברזולוציה גבוהה.
- השהה מחדש PBMC מבודד ב 1 מ"ל של תווך נשימה מיטוכונדריאלי (MIR05) ומדולל ל 8 x 106 תאים / מ"ל.
- יש להקפיא בחנקן נוזלי ולאחסן בטמפרטורה של -80°C עד לביצוע ניסויים או למדידת תאים טריים.
- הכינו את כל הפתרונות הדרושים: 0.1 M triethanolamine HCl buffer pH 8.0, 1.0 M Tris-HCl buffer pH=8.1, 10% Triton X-100, 10 mM Oxalacetate in 0.1 M triethanolamine HCl buffer pH 8.0, 1.01 mM DTNB in 1.0 M Tris-HCl buffer pH=8.1, Acetyl-CoA 12.2 mM in double distilled H2O.
- הכינו מדיום תגובה (טבלה 1) המכיל 5,5'-dithio-bis-(2-nitrobezoic acid) (DTNB; 0.1 mM), אצטיל קואנזים A (0.31 mM), EDTA (50 μM), triethanolamine HCl (5 mM) ו-Tris HCl (0.1 M).
- הכינו מגיב התחלתי (טבלה 1) עם 0.5 mM oxaloacetate מומס בזיקוק כפול H2O.
- הפשירו את הדגימות על קרח מכיוון שסינתאז ציטראט אינו יציב אם מופשר מהר מדי.
- הוסף 40 μL של הדגימות לצלחת 96 באר על קרח לפני הוספת 110 μL של מדיום תגובה עם multipipette.
- תווך תגובה חם ודגימה באינקובטור ל 30 מעלות צלזיוס למשך 5 דקות. מגיב התחלה חם באמבט מים ל 30 ° C במשך 5 דקות.
- הוסף 50 μL של מגיב מתחיל עם multipipette לכל באר. מדוד ספיגה ב-30°C באורך גל של 412 ננומטר למשך 20 דקות באמצעות קורא לוחות.
תוצאות
כדאיות התא ומספרו;
כדי להשיג בידוד מוצלח ושימור בהקפאה, ספירת התאים והכדאיות צריכות להיות גבוהות ככל האפשר. לפני ואחרי שימור בהקפאה, התאים נספרים, ויכולת הקיום שלהם נקבעת כדי להבטיח את בריאותם ואיכותם של התאים. איור 3 הוא המחשה מייצגת של PBMCs לפני ואחרי שימור בהקפא...
Discussion
פרוטוקול זה מספק אמצעי לבידוד ושימור בהקפאה של תאי דם חד-גרעיניים היקפיים (PBMCs) מדם אנושי באופן המתאים לאנליזות ביו-אנרגטיות. השיטה המתוארת מציעה אפשרות לבודד PBMCs בעדינות ובכמויות גדולות, עם כדאיות גבוהה ותאים מספיקים למדידות ביו-אנרגטיות. יש לו את החיסרון כי אפילו עם הפרעות מינימליות, ביד?...
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
ברצוננו להודות לצוות הקליני של בית החולים האוניברסיטאי גיסן-מרבורג על איסוף הדם. עבודה זו מומנה על ידי אוניברסיטת יוסטוס ליביג.
Materials
| Name | Company | Catalog Number | Comments |
| 0.1 M Triethanolamine-HCl-Buffer (pH = 8,0) | Self-prepared | - | |
| 0.5 M Triethanolamine-HCl-Buffer | Self-prepared | - | |
| 1.0 M Tris-HCl-Buffer (pH = 8,1) | Self-prepared | - | |
| 1.01 mM DTBB | Self-prepared | - | |
| 10 % Triton X-100 | Self-prepared | - | |
| 10 mM Oxalacetat | Self-prepared | - | |
| 14–20 G sterile blood draw needles Multi Adapter Sarstedt Safety-Multifly | Sarstedt | 156353_v | |
| 37% HCl | Carl Roth GmbH & Co. KG | - | |
| 70% Ethanol (EtOH) | Self-prepared | - | |
| Acetyl-CoA | Pancreac Applichem | A3753 | |
| ADP | Sigma-Aldrich | A5285 | |
| Alcohol wipes | (70% isopropyl alcohol) | ||
| Antimycin A | Sigma-Aldrich | A8674 | |
| Aqua (bidest.) | With MilliQ Academic (self-made) | - | |
| Ascorbate | Sigma-Aldrich | A4034 | |
| ATP-Standard | Sigma-Aldrich | 6016949 | |
| Biocoll Seperating Solution | Biochrom | 6115 | |
| Biological safty cabinet MSC Advantage | Thermo Fisher Scientific Inc. | ||
| Carbonylcyanid-p-trifluoromethoxy-phenylhydrazon (FCCP) | Sigma-Aldrich | C2920 | |
| Cell counter TC20 Automated Cell Counter | Bio-Rad | ||
| Centrifuge Heraeus Megafuge 16 R | Thermo Fisher Scientific Inc. | ||
| Counting slides, dual chamber for cell counter | Bio-Rad | 1450016 | |
| Cryotube Cryo.S | Grainer Bio-One | 126263-2DG | |
| Digitonin | Sigma-Aldrich | 37008 | |
| Dimethylsulfoxid (DMSO) | Merck | 102952 | |
| Disinfection spray | |||
| Disposable gloves latex, rubber, or vinyl. | |||
| Distrips (12.5 ml) DistriTips | Gilson | F164150 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS; 10x) | Gibco (Thermo Scientific) | 15217168 | |
| Ethanol (EtOH 100%) | Carl ROTH GmbH & Co. KG | 9065.3 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F9665 | |
| Frezer (-80°C) | Thermo Fisher Scientific Inc. | ||
| Glutamate | Sigma-Aldrich | G1626 | |
| Holder/adapter | |||
| Incubator Midi 40 CO2 | Thermo Fisher Scientific Inc. | ||
| Injection syringe | Hamilton | ||
| Malate | Sigma-Aldrich | M-1000 | |
| MIR05 | Self-prepared | - | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific Inc. | 10110051 | |
| Multireader CLARIOstar | BMG Labtech | ||
| Nitrogen tank Locator 6 plus | Thermo Fisher Scientific Inc. | ||
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxalacetate | Sigma-Aldrich | - | |
| Oxygraph-2k | Orobororus Instruments | ||
| Penicillin-Streptomycin | PAA | 15140122 | |
| Pipettes Performance Pipettor 10 μL, 100 μL, 1000 μL | VWR | ||
| Roswell-Park. Memorial-Institute-Medium (RPMI-1640) | Gibco (Thermo Scientific) | 11530586 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Saccharose | Carl ROTH GmbH & Co. KG | 9286.2 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Succinate | Sigma-Aldrich | S2378 | |
| Tetramethylphenylendiamin (TMPD) | Sigma-Aldrich | T3134 | |
| Tourniquet/ Blood pressure cuff | |||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 108382 | |
| Triton X-100 | Sigma-Aldrich | 108643 | |
| Trypanblau | Biochrom | T6146 | |
| Vacuum pump | Vaccubrand GmbH & Co. | ||
| ViewPlate-96 | Perkin Elmer | 6005181 | |
| Water bath WNB22 | Memmert GmbH & Co. KG |
References
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int J Alzheimers Dis. 2009, 951548 (2009).
- Haas, R. H. Mitochondrial dysfunction in aging and diseases of aging. Biology. 8 (2), 48 (2019).
- Kleiveland, C. R., Verhoeckx, K., Cotter, P., Lopez-Exposito, I., et al. Peripheral blood mononuclear cells. The Impact of Food Bioactives on Health. In Vitro and Ex Vivo Models. , (2015).
- Silaidos, C., et al. Sex-associated differences in mitochondrial function in human peripheral blood mononuclear cells (PBMCs) and brain. Biol Sex Differ. 9 (1), 34 (2018).
- Acin-Perez, R., Benincá, C., Shabane, B., Shirihai, O. S., Stiles, L. Utilization of human samples for assessment of mitochondrial bioenergetics: Gold standards, limitations, and future perspectives. Life. 11 (9), 949 (2021).
- Schindowski, K., et al. Impact of aging. NeuroMol Med. 4 (3), 161-177 (2003).
- Migliore, L., et al. Searching for the role and the most suitable biomarkers of oxidative stress in Alzheimer's disease and in other neurodegenerative diseases. Neurobiol Aging. 26 (5), 587-595 (2005).
- Leutz, S., et al. Reduction of trophic support enhances apoptosis in PC12 cells expressing Alzheimer’s APP mutation and sensitizes cells to staurosporine-induced cell death. J Mol Neurosci. 18 (3), 189-201 (2002).
- Leuner, K., et al. Peripheral mitochondrial dysfunction in Alzheimer’s disease: Focus on lymphocytes. Mol Neurobiol. 46 (1), 194-204 (2012).
- Leuner, K., et al. Enhanced apoptosis, oxidative stress and mitochondrial dysfunction in lymphocytes as potential biomarkers for Alzheimer’s disease. J Neural Transm Suppl. 2007 (72), 207-215 (2007).
- Kartika, R., Wibowo, H., Purnamasari, D., Pradipta, S., Larasati, R. A. Altered Indoleamine 2,3-Dioxygenase production and its association to inflammatory cytokines in peripheral blood mononuclear cells culture of type 2 diabetes mellitus. Int J Tryptophan Res. 13, 1178646920978236 (2020).
- Cortez-Espinosa, N., et al. CD39 expression on Treg and Th17 cells is associated with metabolic factors in patients with type 2 diabetes. Hum Immunol. 76 (9), 622-630 (2015).
- Mahmoud, F., et al. Effect of Diabetea tea ™ consumption on inflammatory cytokines and metabolic biomarkers in type 2 diabetes patients. J Ethnopharmacol. 194, 1069-1077 (2016).
- Volman, J. J., Ramakers, J. D., Plat, J. Dietary modulation of immune function by β-glucans. Physiol Behav. 94 (2), 276-284 (2008).
- Reddy, M., Eirikis, E., Davis, C., Davis, H. M., Prabhakar, U. Comparative analysis of lymphocyte activation marker expression and cytokine secretion profile in stimulated human peripheral blood mononuclear cell cultures: an in vitro model to monitor cellular immune function. J Immunol Methods. 293 (1), 127-142 (2004).
- Otaegui, D., et al. Differential micro RNA expression in PBMC from multiple sclerosis patients. PLoS One. 4 (7), e6309 (2009).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Fox, C. J., Hammerman, P. S., Thompson, C. B. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol. 5 (11), 844-852 (2005).
- Li, P., et al. Mitochondrial respiratory dysfunctions of blood mononuclear cells link with cardiac disturbance in patients with early-stage heart failure. Sci Rep. 5, 10229 (2015).
- Weiss, S. L., et al. Mitochondrial dysfunction in peripheral blood mononuclear cells in pediatric septic shock. Pediatr Crit Care Med. 16 (1), e4-e12 (2015).
- Higdon, L. E., Lee, K., Tang, Q., Maltzman, J. S. Virtual global transplant laboratory standard operating procedures for blood collection, PBMC isolation, and storage. Transplant Direct. 2 (9), e101 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7, 17-27 (2019).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer’s disease: recent advances. Mol Neurodegener. 15 (1), 30 (2020).
- Chaturvedi, R. K., Flint Beal, M. Mitochondrial diseases of the brain. Free Radic Biol Med. 63, 1-29 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved