Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Kryokonservierung und bioenergetische Bewertung von mononukleären Zellen des menschlichen peripheren Blutes
In diesem Artikel
Zusammenfassung
Isolierte mononukleäre Zellen des peripheren Blutes können für die Analyse von Immunfunktionen und -störungen, Stoffwechselerkrankungen oder mitochondrialen Funktionen verwendet werden. In dieser Arbeit beschreiben wir eine standardisierte Methode zur Herstellung von PBMCs aus Vollblut und der anschließenden Kryokonservierung. Die Kryokonservierung macht diese Zeit und diesen Ort unabhängig.
Zusammenfassung
Die physiologischen Funktionen eukaryotischer Zellen beruhen auf Energie, die hauptsächlich von den Mitochondrien bereitgestellt wird. Mitochondriale Dysfunktion ist mit Stoffwechselerkrankungen und Alterung verbunden. Die oxidative Phosphorylierung spielt dabei eine entscheidende Rolle, da sie für die Aufrechterhaltung der energetischen Homöostase entscheidend ist. PBMCs wurden als minimalinvasive Probe zur Messung der mitochondrialen Funktion identifiziert und spiegeln nachweislich Krankheitszustände wider. Die Messung der mitochondrialen bioenergetischen Funktion kann jedoch durch mehrere Faktoren in menschlichen Proben eingeschränkt sein. Einschränkungen sind die Anzahl der entnommenen Proben, die Probenahmezeit, die oft über mehrere Tage verteilt ist, und die Standorte. Die Kryokonservierung der entnommenen Proben kann eine konsistente Entnahme und Messung der Proben gewährleisten. Es sollte darauf geachtet werden, dass die gemessenen Parameter zwischen kryokonservierten und frisch präparierten Zellen vergleichbar sind. Hier beschreiben wir Methoden zur Isolierung und Kryokonservierung von PBMCs aus menschlichen Blutproben, um die bioenergetische Funktion der Mitochondrien in diesen Zellen zu analysieren. PBMC, die nach dem hier beschriebenen Protokoll kryokonserviert wurden, zeigen im Vergleich zu frisch geernteten Zellen nur geringfügige Unterschiede in der Zellzahl und Lebensfähigkeit, dem Adenosintriphosphatspiegel und der gemessenen Atmungskettenaktivität. Für die beschriebenen Präparate werden nur 8-24 mL menschliches Blut benötigt, wodurch es möglich ist, Proben während klinischer Studien multizentral zu entnehmen und deren Bioenergetik vor Ort zu bestimmen.
Einleitung
Humane periphere mononukleäre Blutzellen (PBMCs) werden für verschiedene Anwendungen in vielen wissenschaftlichen Bereichen verwendet, einschließlich der Untersuchung immunologischer und bioenergetischer Probleme, z. B. im Zusammenhang mit Alterungsprozessen oder degenerativen Erkrankungen 1,2. PBMCs sind heterogen aufgebaut und bestehen aus Lymphozyten (B-Zellen, T-Zellen und NK-Zellen), Monozyten und dendritischen Zellen. Die Zellen weisen zum Teil große individuelle Unterschiede und Variationen innerhalb eines Probanden auf, so dass standardisierte Verfahren für den Umgang mit diesen Zellen erforderlich sind. Wichtige Parameter wie Viabilität und Reinheit der Isolierung sind die Grundvoraussetzungen für ihre Handhabung und werden zusätzlich von Umweltfaktoren wie dem Zeitpunkt der Entnahme, dem Melatoninspiegel, ob der Proband nüchtern ist, und anderen beeinflusst 3,4.
Basierend auf Untersuchungen zur Bioenergetik von PBMCs beschreiben wir hier eine Methode zur Isolierung, Kryokonservierung und Kultivierung von PBMCs, die auch für andere Methoden geeignet ist. Während die Muskelbiopsie als Goldstandard für den mitochondrialen Energiestoffwechsel gilt5, ist die Untersuchung von Blutzellen ein schnelles, minimalinvasives Verfahren. Darüber hinaus deuten immer mehr Studien darauf hin, dass die Veränderungen der mitochondrialen Funktion im Alter und bei der Alzheimer-Krankheit (AD) nicht nur im Gehirn, sondern auch in der Peripherie auftreten 6,7,8,9,10. Die Methode ermöglicht auch die Untersuchung anderer Zustände und Krankheiten, einschließlich Diabetes mellitus und Adipositas 11,12,13. Genexpressionsmuster bei Multiple-Sklerose-Patienten können analysiert werden, oder die Immunfunktion und deren Einflüsse im Allgemeinen 14,15,16.
PBMCs beruhen im Allgemeinen auf oxidativer Phosphorylierung (OXPHOS), um Adenosintriphosphat (ATP) zu erzeugen17,18. Daher decken PBMCs als Surrogate ein breites Anwendungsspektrum ab. In früheren Berichten wurde der Energiestoffwechsel von PBMCs verwendet, um Organdysfunktionen zu behandeln, wie z. B. bei früher Herzinsuffizienz19, septischem Schock20 oder geschlechtsassoziierten Unterschieden4 in der mitochondrialen Funktion. Eine verallgemeinerte Methode zur Kryokonservierung, Isolierung und Kultivierung von PBMCs hätte Vorteile in der Vergleichbarkeit der an verschiedenen Instituten erzielten Ergebnisse. Es gibt eine große Variation in den Protokollen für jeden Schritt21,22, das Ziel dieser Methode ist es, einen Leitfaden für bioenergetische Messungen in PBMCs bereitzustellen.
In diesem Artikel beschreiben wir eine Methode zur Messung bioenergetischer Parameter in PBMCs. Wir erläutern die Methoden zur Isolierung, Kryokonservierung und Messung der Bioenergetik von PBMCs aus menschlichem Blut. Mit dieser Methode können bioenergetische Parameter bei Patienten bestimmt und im klinischen Kontext ausgewertet werden. Um diese Messungen durchführen zu können, benötigen die Forscher Zugang zu einer Patientenpopulation, aus der frische Blutproben entnommen werden können.
Protokoll
Alle in diesem Manuskript beschriebenen Protokolle für die Blutentnahme, -isolierung und -analyse wurden vom Institutional Review Board der Universität Gießen geprüft und genehmigt. Das Einverständnis der Patienten, ihre Proben in die Studie aufzunehmen, wurde eingeholt. Alle Schritte zur Isolierung und Zellkultur werden unter einer biologischen Sicherheitswerkbank durchgeführt.
1. Venenpunktion
- Bereiten Sie alle für die Blutentnahme erforderlichen Geräte vor, einschließlich Desinfektionsspray, steriler Tupfer, Blutentnahmekanüle mit 80-mm-Schlauch und Multiadapter, Tourniquet/Blutdruckmanschette, Monovette 9 ml Lithium-Heparin.
HINWEIS: EDTA als Antikoagulans ist ebenfalls wirksam. - Entnehmen Sie Blut aus der am besten geeigneten Armvene, in der Regel Vena mediana cubiti oder Vena cephalica.
- Legen Sie eine Tourniquet-/Blutdruckmanschette mit leichtem Druck an, etwa 80 mm/Hg.
- Handschuhe und Einstichstelle mit alkoholhaltigem Desinfektionsspray desinfizieren. Lassen Sie die desinfizierte Einstichstelle an der Luft trocknen.
- Die Venen treten durch den Druck der Druckmanschette hervor. Führen Sie die Nadel (Kanülendurchmesser (außen) 21G / 0,8 mm, Länge 19 mm) in einem Winkel von 15°-20° der Vene ein, um ein Trauma zu vermeiden und die Sondierung zu minimieren.
- Blut mit einem geeigneten System entnehmen, 4 Röhrchen mit 9 ml Blut (mehr als 7-8 Röhrchen sind für einen Versuchsleiter problematisch, um sie richtig zu isolieren).
- Legen Sie die Entnahmeröhrchen nach der Blutentnahme 5 Minuten lang im Dunkeln, um eine gleichmäßige Antikoagulation zu gewährleisten.
2. PBMC-Isolierung
- Bereiten Sie alle erforderlichen Lösungen wie unten beschrieben vor.
- Die ausgewogene Salzlösung (DPBS; Konzentration 1x) und das Lymphozyten-Isolationsmedium (1,077 g/ml) von Dulbecco auf Raumtemperatur (20-25 °C) bringen.
- Bereiten Sie fötales Kälberserum (FBS) bei Raumtemperatur vor und bewahren Sie ein steriles konisches 50-ml-Röhrchen mit FBS auf Eis auf. Für jede Blutprobe sind 2 ml FBS erforderlich.
- Gefrierbehälter bei 4 °C lagern und Kryoröhrchen bei 4 °C vorkühlen.
- Erwärmen Sie das Zellkulturmedium auf 37 °C, das Medium besteht aus RPMI 1640 mit 50 mL FBS und Penicillin 50 U/mL Streptomycin 50 U/mL. Diese Lösung kann bei 3 °C bis zu 2 Monate gelagert werden.
- 8 ml DPBS in sterile konische 50-ml-Röhrchen geben. Geben Sie 15 ml Lymphozyten-Isolationsmedium in ein steriles konisches 50-ml-Röhrchen (das Medium ist lichtempfindlich, geben Sie es vor Beginn der Isolierung hinzu).
- 8 ml Blut zu 8 ml DPBS geben und vorsichtig mit einer 3-ml-Pasteurpipette aus Kunststoff mischen.
- Tragen Sie die Blut-/DPBS-Mischung vorsichtig mit einer 3-ml-Pasteurpipette aus Kunststoff auf das Lymphozyten-Isolationsmedium. Um die erste Schicht auf das Medium aufzutragen, kippen Sie das Röhrchen um 20°-30°, was zu einem geringeren Eindringen des Blut-PBS-Gemisches in die Mediumschicht führt.
- Tragen Sie das Blut-PBS-Gemisch vorsichtig über die Seitenwand des Röhrchens auf das Lymphozyten-Isolationsmedium. Verwenden Sie eine gleichmäßige Geschwindigkeit, um den Blutfluss konstant zu halten.
- Im nächsten Schritt bringen Sie den Schlauch langsam in eine aufrechte Position, das restliche Blut wird vorsichtig über die Seitenwand des Schlauches auf die Blutschicht geschichtet.
- 10 min bei 1000 x g bei Raumtemperatur in einer Zentrifuge mit schwingendem Rotor bei ausgeschalteten Bremsen zentrifugieren. Nach der Zentrifugation wird das Blut/PBMC-Gemisch in vier Schichten getrennt. Die oberste Schicht besteht aus Plasma und Blutplättchen, die zweite Schicht ist die PBMC-Schicht, gefolgt von einer Lymphozyten-Isolationsmedium-Schicht und schließlich Erythrozyten und Granulozyten in der unteren Schicht. Die verschiedenen Layer sind in Abbildung 1 dargestellt.
- Entfernen Sie 2/3 der Plasmaschicht mit einer Pasteurpipette aus Kunststoff.
- Sammeln Sie mit einer 1-ml-Pipette die PBMCs auf der Schicht des Lymphozyten-Isolationsmediums und achten Sie darauf, dass kein Medium in die Probe gelangt.
- Platzieren Sie die Spitze 1 mm über der PBMC-Schicht. Die PBMC-Schicht sollte nicht durchstochen werden, da sonst das Medium über die Zellen fließt. Durch das Ansaugen der Pipette werden die PBMCs an diesen Punkt gezogen, so dass sie an dieser Stelle mehrfach aufgefangen werden können.
HINWEIS: Um die Anzahl der gesammelten PBMCs zu maximieren, suchen Sie am Ende des Verfahrens nach dem Rest auf der Oberfläche und versuchen Sie, die Zellen auch dort zu sammeln. Um das Verfahren zu stabilisieren, kann das Röhrchen auf eine Oberfläche gelegt werden. - Übertragen Sie die PBMCs Schritt für Schritt in ein neues 50-ml-Röhrchen, bis die Schicht vollständig geerntet ist. Fügen Sie DPBS bis zur 25-ml-Markierung hinzu, waschen Sie das Lymphozyten-Isolationsmedium und andere Rückstände weg.
- 10 min bei 100 x g bei Raumtemperatur bei angezogenen Bremsen zentrifugieren. Entfernen Sie den Überstand mit einer Vakuumpumpe o.ä., achten Sie darauf, das Zellpellet nicht zu beschädigen.
- Resuspendieren Sie das Pellet in 1 ml DPBS und addieren Sie DPBS zur 25-ml-Markierung. Wiederholen Sie das Waschen noch einmal und resuspendieren Sie es dann in einem für die nächsten Schritte geeigneten Medium.
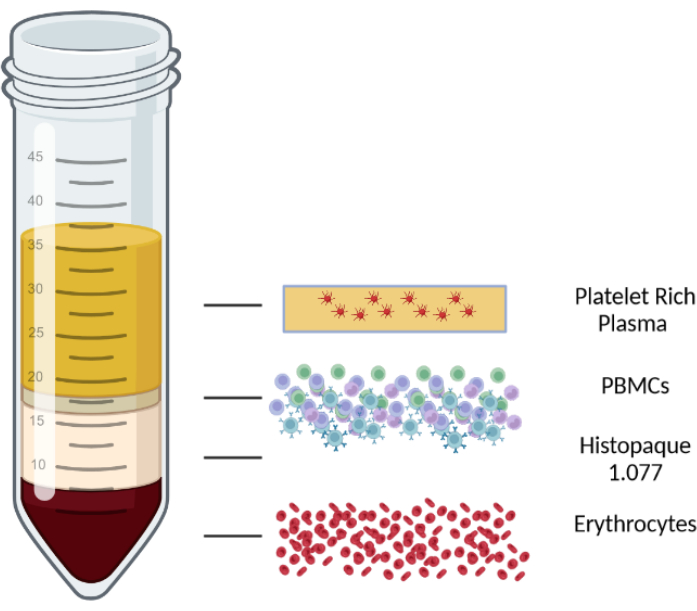
Abbildung 1: Schematische Darstellung einer Dichtegradientenzentrifugation zur Veranschaulichung der verschiedenen Schichten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Kryokonservierung
- Gefrierbehälter auf 4 °C abkühlen, FBS auf Eis abkühlen.
- Resuspendieren Sie PBMC-Pellets in 1 ml FBS mit einer 1-ml-Pipette, die FBS sollte Raumtemperatur haben.
- Mischen Sie DMSO mit vorgekühltem FBS auf Eis 1:5, Endkonzentration 20% DMSO, dann geben Sie das FBS: DMSO-Gemisch wieder auf Eis. Bereiten Sie die Lösung immer frisch zu.
- Die PBMC-Zellsuspension in FBS wird in gut markierte 2-ml-Kryoröhrchen überführt. Verwenden Sie ein Kryoröhrchen pro Sammelröhrchen. Stellen Sie die Anzahl der Zellen zwischen 1 x 107 und 5 x 107 pro ml ein. Verwenden Sie einen automatisierten Zellzähler, um die Zellzahl und Lebensfähigkeit zu bestimmen.
- Geben Sie 1 ml FBS: DMSO-Mischung tropfenweise mit einer 1-ml-Pipette, etwa 1-2 Tropfen pro s, in das Röhrchen. Die tropfenweise Zugabe führt zu einer kontinuierlichen und gleichmäßigen Durchmischung.
- Legen Sie die Röhrchen in den vorgekühlten Gefrierbehälter. Stellen Sie den Gefrierbehälter für 24 h in einen Gefrierschrank bei -80 °C. Der Gefrierbehälter sorgt für eine kontrollierte Kühlung von -1 °C pro Minute.
- Nehmen Sie die Röhrchen aus dem Gefrierschrank bei -80 °C. Lagern Sie die Röhrchen nach der Entnahme aus dem Gefrierschrank in der Gasphase von flüssigem Stickstoff. Dokumentieren Sie den Ort jeder Probe.
4. Auftauen
- Bereiten Sie alle benötigten Lösungen vor: Zellkulturmedium RPMI 1640 mit 50 ml FBS und Penicillin 50 U/ml, Streptomycin 50 U/ml. Diese Lösung kann bei 3°C bis zu 2 Monate gelagert werden.
- Zellkulturmedium auf 37 °C vorwärmen. Geben Sie 3 ml vorgewärmtes Zellkulturmedium in sterile konische 50-ml-Röhrchen.
- Entnehmen Sie die Probe aus dem Flüssigstickstofftank. Proben im Wasserbad bei 37 °C ca. 3,5 min auftauen, aus dem Wasserbad nehmen, sobald das letzte Eis schmilzt. Ein stecknadelkopfgroßes Stück Eis sollte noch in der Röhre zu sehen sein.
HINWEIS: DMSO ist schädlich für PBMCs, die so schnell wie möglich arbeiten. - Entfernen Sie die Zelle:FBS:DMSO-Mischung mit einer 1-ml-Pipette aus dem Kryoröhrchen. Mischen Sie die PBMC-Proben mit dem Zellkulturmedium in den vorbereiteten 50-ml-Röhrchen. Waschen Sie die Röhrchen mit 5 ml Nährmedium in drei Schritten von 2 ml, 2 ml und 1 ml aus.
- Füllen Sie das Medium in die Röhrchen um. Dies wird durchgeführt, um mögliche Zellreste zu übertragen. 10 min bei 100 x g bei Raumtemperatur zentrifugieren.
- Verwerfen Sie den Überstand und fügen Sie 1 ml Medium hinzu, das für den geplanten Gebrauch geeignet ist. Die Zellen sind bereit für weitere Experimente.
HINWEIS: Bei Funktionstests an frischen oder gefrorenen Zellen wird jedoch häufig eine Ruhezeit in einem Inkubator (in der Regel über Nacht) nach der Isolierung von Lymphozyten oder dem Auftauen von Zellen empfohlen.
5. Zellkultur
- Nach Isolierung oder Auftauen der Kulturzellen über Nacht bei 37 °C in 5 % CO2/95 % Luft.
- Resuspendieren Sie die Zellen in 1 ml RPMI-Medium, ergänzt mit 10% FBS, Penicilin 50 U/ml, Streptomycin 50 U/ml. Für die weitere Verwendung gibt es viele Möglichkeiten, Zellen nach Bedarf für die Assays zu behandeln.
- Für die allgemeine Lagerung sterile 6-Well-Zellkulturplatten verwenden und Zellen nach der Ruhezeit ernten. 1 ml Zellsuspension mit einer 1-ml-Pipette in eine Vertiefung überführen und 4 ml Zellkulturmedium hinzufügen.
HINWEIS: Die Menge der isolierten PBMCs variiert stark von Person zu Person, eine Vertiefung mit 5 ml Zellkulturmedium ist ausreichend für jeweils 8 ml isoliertes Blut. Bei der Isolierung von PBMCs aus Buffy Coats ist die Menge an PBMCs jedoch deutlich höher als in Vollblutproben und die Zellen sollten daher in mehrere Vertiefungen aufgeteilt werden. - Lassen Sie die Zellen 24 Stunden in einer befeuchteten Atmosphäre ruhen, die mit 5 % CO2 bei 37 °C angereichert ist. Diese Inkubation wird sowohl für frisch isolierte Zellen als auch für kryokonservierte Zellen durchgeführt.
6. ATP-Bestimmung
- Resuspendieren Sie aufgetaute PBMCs in 1 ml RPMI-Medium, ergänzt mit 10% FBS, Penicillin 50 U/ml, Streptomycin 50 U/ml.
- Entnehmen Sie eine Probe und bestimmen Sie die Zellzahl, dann führen Sie eine Lebend-Tot-Unterscheidung mit Trypanblau durch. Entnehmen Sie 10 μl aus den resuspendierten Zellen und mischen Sie sie mit 90 μl Zellkulturmedium. Nehmen Sie dann 10 μl und mischen Sie es mit 10 μl Trypanblau. Legen Sie die Zellen entweder in eine Zellzählkammer oder einen automatischen Zellzähler und bestimmen Sie die Anzahl der lebenden/toten Zellen.
- Platte 100 μl Zellen mit einer Dichte von 1 x 105 Zellen/100 μl pro Well in einer 96-Well-Platte aus weißem Polystyrol.
- Lassen Sie die Zellen 24 Stunden lang in einer befeuchteten Atmosphäre ruhen, die mit 5 % CO2 bei 37 °C angereichert ist.
- Bestimmen Sie die ATP-Konzentrationen mit einem ATP-Assay.
- Verwenden Sie Lichtemissionen, die auftreten, wenn ATP mit Luciferin kombiniert wird. Das emittierte Licht kann mit einem Plattenleser ausgewertet werden. Entfernen Sie die Platten, damit der Inkubator 15 Minuten lang auf Raumtemperatur abkühlen kann. Lysieren Sie die Zellen und lassen Sie sie 5 Minuten einwirken. Tragen Sie dann das Überwachungsreagenz auf die Zellen auf und messen Sie gemäß den Anweisungen des Herstellers. Zur Ermittlung des ATP-Levels wird ein interner Standard verwendet.
7. Hochauflösende Respirometrie
- Schalten Sie den hochauflösenden Oxygraphen ein und lassen Sie ihn 30 Minuten lang aufwärmen.
- Behandeln Sie die Zellen gemäß einem in Abbildung 1 beschriebenen Protokoll. Bereiten Sie alle benötigten Vorräte wie in Tabelle 1 vor.
- Pipettieren Sie 2,1 ml Atmungspuffer (Tabelle 1) in beide hochauflösenden Oxygraphenkammern und rühren Sie den Puffer kontinuierlich mit einem in den Kammern vorhandenen magnetischen Rührstab (750 U/min) bei 37 °C für 30 Minuten um, bis ein stabiles Sauerstoffflusssignal des polarographischen Sauerstoffsensors erhalten wird.
HINWEIS: In den Kammern des Oxygraphen werden der Sauerstoffverbrauch in Echtzeit (Fluss) und die Sauerstoffsättigung der Kammer mit Hilfe von polarographischen Sauerstoffelektroden gemessen. Eine Hintergrundkalibrierung muss durchgeführt werden, um Hintergrundgeräusche zu vermeiden und zuverlässige Ergebnisse zu gewährleisten. - Eine Luftkalibrierung des polarographischen Sauerstoffsensors gemäß den Protokollen des Herstellers23 durchführen.
- Isolierte PBMCs werden in 1 ml mitochondrialem Atmungsmedium (MIR05, die Zusammensetzung ist in Tabelle 1 dargestellt) resuspendiert und auf 8 x 106 Zellen/ml verdünnt.
- Nach der Luftkalibrierung wird das Beatmungsmedium aus der Oxygraphenkammer abgesaugt und 2,1 ml Zellsuspension in jede Wölbung des Respirometers gegeben. Falls während der Messung die Kammern mit Sauerstoff versorgen (siehe Öffnen an Punkt h in Abbildung 2), sollte die Sauerstoffsättigung der Kammern nicht unter 100 μM fallen.
- Verschließen Sie die Kammern durch Einsetzen der Stopfen, die Kammern sind für ein Volumen von 2,0 ml ausgelegt. Saugen Sie die entstehende Zellsuspension ab.
- Die Zellsuspension wird kontinuierlich bei 37 °C mit einem Magnetrührer (750 U/min) in der Kammer gemischt. Warten Sie ca. 20 Minuten, bis ein stabiles Signal empfangen wird. Bestimmung der endogenen Atmung ((a) in Abbildung 2).
- Um die verschiedenen komplexen Aktivitäten der Atmungskette zu bestimmen, injizieren Sie die Substrate und Inhibitoren für die mitochondriale Atmung durch die Titan-Injektionsöffnungen der Stopfen. Verwenden Sie die folgende Endkonzentration in der Kammer.
- Um die Zellmembranen aufzubrechen, fügen Sie 5 μl 8,1 mM Digitonin durch die Titan-Injektionsöffnung des Kammerstopfens hinzu, um naive Substrate (b) in Abbildung 2 zu entfernen, während die mitochondrialen Membranen intakt bleiben.
- Die Substrate 2 M Glutamat und 800 mM Malat werden durch die Injektionsöffnung des Kammerstopfens zugegeben und die Atmung aufgezeichnet, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min.
HINWEIS: Es ist auch möglich, zusätzliche Substrate wie Pyruvat zu verwenden. - Geben Sie 8 μl 500 mM Adenosindiphosphat (ADP) durch die Injektionsöffnung des Kammerstopfens und zeichnen Sie die Atmung auf, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min (d) in Abbildung 2.
- Geben Sie 20 μl 1 M Succinat durch die Injektionsöffnung des Kammerstopfens hinzu und zeichnen Sie die Atmung auf, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min (e) in Abbildung 2.
- Titrieren Sie 1 M Carbonylcyanid-p-Trifluormethoxyphenylhydrazon (FCCP) schrittweise bei 0,5 μl bis zu dem Punkt, an dem kein weiterer Anstieg auftritt. Warten Sie 2-4 Minuten, bis sich das Signal stabilisiert hat (f) in Abbildung 2. Wenn die Atmung nicht weiter ansteigt, fahren Sie mit dem nächsten Schritt fort.
VORSICHT: Seien Sie vorsichtig beim Umgang mit FCCP, da es Gesundheitsrisiken für den Menschen birgt. - Geben Sie 5 μl 0,1 mM Rotenon durch die Injektionsöffnung des Kammerstopfens und zeichnen Sie die Atmung auf, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min (g) in Abbildung 2.
VORSICHT: Seien Sie vorsichtig beim Umgang mit Rotenon, da es gesundheitliche Risiken für den Menschen birgt. - Geben Sie 1 μl 4 mg/ml Oligomycin durch die Injektionsöffnung des Kammerstopfens und zeichnen Sie die Atmung auf, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min (h) in Abbildung 2.
VORSICHT: Seien Sie vorsichtig beim Umgang mit Oligomycin, da es sich um ein Gift handelt, das ein Gesundheitsrisiko für den Menschen darstellt. - Geben Sie 1 μl 5 mM Antimycin A durch die Injektionsöffnung des Kammerstopfens und zeichnen Sie die Atmung auf, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min (i) in Abbildung 2.
VORSICHT: Seien Sie vorsichtig beim Umgang mit Antimycin A, da es sich um ein Gift handelt, das ein Gesundheitsrisiko für den Menschen darstellt. - Bei der Auswertung des Laufs zum Ausschluss des Sauerstoffverbrauchs von Enzymen, die nicht an der oxidativen Phosphorylierung beteiligt sind, werden die Antimycin-A-Werte von allen anderen Messwerten abgezogen.
- Zugabe von 200 mM N,N,N',N'-Tetramethyl-p-phenylendiamindihydrochlorid (TMPD; Elektronendonator) und 800 mM Ascorbat, um TMPD in einem reduzierten Zustand zu halten. Injizieren Sie die Substrate durch die Injektionsöffnung des Kammerstopfens und zeichnen Sie die Atmung auf, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 min (j) in Abbildung 2.
- TMPD unterliegt der Autooxidation, daher subtrahieren Sie den resultierenden Sauerstoffverbrauch vom Messwert bei Komplex IV.
- NaN3 ≥ 100 mM durch die Injektionsöffnung des Kammerstopfens zugeben und die Atmung aufzeichnen, bis ein stabiles Signal erreicht ist. Das Signal stabilisiert sich nach 2-4 Minuten, um die komplexe IV-Aktivität zu hemmen, nur die TMPD-Autooxidation bleibt übrig.
VORSICHT: Seien Sie vorsichtig beim Umgang mit Natriumazid, da es sich um ein Gift handelt, das ein Gesundheitsrisiko für den Menschen darstellt.
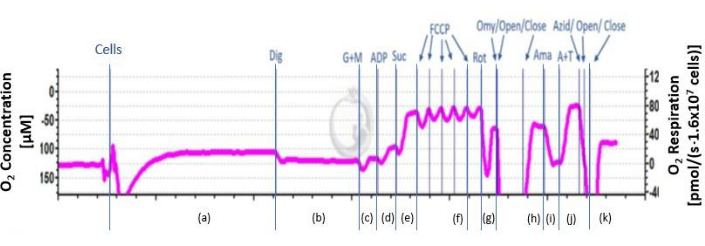
Abbildung 2: Schematischer Verlauf desO2-Flusses . Der schematische Verlauf des Sauerstoffflusses ist dargestellt. Die Kurve wird nach Zugabe von Inhibitoren und Substraten von a-k in die verschiedenen Phasen unterteilt. A: endogene Atmung; b: permeabilisierte Zellen; c: entkoppelte Komplex-I-Atmung; d: gekoppelte Komplex-I-Atmung; e: OXPHOS ; f: maximale entkoppelte Aktivität von CI und CII ; g: entkoppelte Atmung des Komplexes II; H: Leckage-Atmung; I: Restatmung; j: CIV(U)- entkoppelte Atmung und Autooxidation von TMPD; k: Autooxidation von TMPD. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
8. Citrat-Synthase-Aktivität
- Messen Sie die Citratsynthase-Aktivität als separaten Parameter und verwenden Sie sie, um die Messungen des hochauflösenden Oxygraphen zu normalisieren.
- Isoliertes PBMC in 1 ml mitochondrialem Atmungsmedium (MIR05) resuspendieren und auf 8 x 106 Zellen/ml verdünnen.
- In flüssigem Stickstoff einfrieren und bei −80 °C lagern, bis Experimente durchgeführt oder frische Zellen gemessen werden.
- Bereiten Sie alle benötigten Lösungen vor: 0,1 M Triethanolamin-HCl-Puffer pH 8,0, 1,0 M Tris-HCl-Puffer pH = 8,1, 10 % Triton X-100, 10 mM Oxalacetat in 0,1 M Triethanolamin HCl-Puffer pH 8,0, 1,01 mM DTNB in 1,0 M Tris-HCl-Puffer pH = 8,1, Acetyl-CoA 12,2 mM in doppelt destilliertemH2O.
- Es wird ein Reaktionsmedium (Tabelle 1) hergestellt, das 5,5'-Dithio-bis-(2-nitrobezoesäure) (DTNB; 0,1 mM), Acetyl-Coenzym A (0,31 mM), EDTA (50 μM), Triethanolamin-HCl (5 mM) und Tris-HCl (0,1 mM) enthält.
- Das Ausgangsreagenz (Tabelle 1) wird mit 0,5 mM Oxalacetat, gelöst in doppelt destilliertemH2O, hergestellt.
- Tauen Sie die Proben auf Eis auf, da die Citratsynthase instabil ist, wenn sie zu schnell aufgetaut wird.
- Geben Sie 40 μl der Proben auf eine 96-Well-Platte auf Eis, bevor Sie 110 μl Reaktionsmedium mit einer Multipipette hinzufügen.
- Reaktionsmedium und Probe in einem Inkubator 5 min auf 30 °C erwärmen. Startreagenz im Wasserbad auf 30 °C für 5 min erwärmen.
- Geben Sie 50 μl des Ausgangsreagenzes mit einer Multipipette in jede Vertiefung. Messung der Absorption bei 30 °C bei einer Wellenlänge von 412 nm für 20 min mit einem Plattenleser.
Ergebnisse
Lebensfähigkeit und Anzahl der Zellen
Um eine erfolgreiche Isolierung und Kryokonservierung zu erreichen, sollten Zellzahl und Viabilität so hoch wie möglich sein. Vor und nach der Kryokonservierung werden die Zellen gezählt und ihre Lebensfähigkeit bestimmt, um die Gesundheit und Qualität der Zellen zu gewährleisten. Abbildung 3 ist eine repräsentative Darstellung von PBMCs vor und nach der Kryokonservierung, Zellzahl und Viabilität unterscheiden sich kaum. Dies...
Diskussion
Dieses Protokoll bietet eine Möglichkeit zur Isolierung und Kryokonservierung von mononukleären Zellen des peripheren Blutes (PBMCs) aus menschlichem Blut in einer Weise, die für bioenergetische Analysen geeignet ist. Die beschriebene Methode bietet die Möglichkeit, PBMCs schonend und in großen Mengen zu isolieren, mit hoher Viabilität und ausreichend Zellen für bioenergetische Messungen. Sie hat den Nachteil, dass es schon bei minimalen Unterbrechungen zu langen Isolationen kommt, die anschließende Kryokonservie...
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Wir bedanken uns beim Klinikteam des Universitätsklinikums Gießen-Marburg für die Blutentnahme. Diese Arbeit wurde von der Justus-Liebig-Universität gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1 M Triethanolamine-HCl-Buffer (pH = 8,0) | Self-prepared | - | |
| 0.5 M Triethanolamine-HCl-Buffer | Self-prepared | - | |
| 1.0 M Tris-HCl-Buffer (pH = 8,1) | Self-prepared | - | |
| 1.01 mM DTBB | Self-prepared | - | |
| 10 % Triton X-100 | Self-prepared | - | |
| 10 mM Oxalacetat | Self-prepared | - | |
| 14–20 G sterile blood draw needles Multi Adapter Sarstedt Safety-Multifly | Sarstedt | 156353_v | |
| 37% HCl | Carl Roth GmbH & Co. KG | - | |
| 70% Ethanol (EtOH) | Self-prepared | - | |
| Acetyl-CoA | Pancreac Applichem | A3753 | |
| ADP | Sigma-Aldrich | A5285 | |
| Alcohol wipes | (70% isopropyl alcohol) | ||
| Antimycin A | Sigma-Aldrich | A8674 | |
| Aqua (bidest.) | With MilliQ Academic (self-made) | - | |
| Ascorbate | Sigma-Aldrich | A4034 | |
| ATP-Standard | Sigma-Aldrich | 6016949 | |
| Biocoll Seperating Solution | Biochrom | 6115 | |
| Biological safty cabinet MSC Advantage | Thermo Fisher Scientific Inc. | ||
| Carbonylcyanid-p-trifluoromethoxy-phenylhydrazon (FCCP) | Sigma-Aldrich | C2920 | |
| Cell counter TC20 Automated Cell Counter | Bio-Rad | ||
| Centrifuge Heraeus Megafuge 16 R | Thermo Fisher Scientific Inc. | ||
| Counting slides, dual chamber for cell counter | Bio-Rad | 1450016 | |
| Cryotube Cryo.S | Grainer Bio-One | 126263-2DG | |
| Digitonin | Sigma-Aldrich | 37008 | |
| Dimethylsulfoxid (DMSO) | Merck | 102952 | |
| Disinfection spray | |||
| Disposable gloves latex, rubber, or vinyl. | |||
| Distrips (12.5 ml) DistriTips | Gilson | F164150 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS; 10x) | Gibco (Thermo Scientific) | 15217168 | |
| Ethanol (EtOH 100%) | Carl ROTH GmbH & Co. KG | 9065.3 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F9665 | |
| Frezer (-80°C) | Thermo Fisher Scientific Inc. | ||
| Glutamate | Sigma-Aldrich | G1626 | |
| Holder/adapter | |||
| Incubator Midi 40 CO2 | Thermo Fisher Scientific Inc. | ||
| Injection syringe | Hamilton | ||
| Malate | Sigma-Aldrich | M-1000 | |
| MIR05 | Self-prepared | - | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific Inc. | 10110051 | |
| Multireader CLARIOstar | BMG Labtech | ||
| Nitrogen tank Locator 6 plus | Thermo Fisher Scientific Inc. | ||
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxalacetate | Sigma-Aldrich | - | |
| Oxygraph-2k | Orobororus Instruments | ||
| Penicillin-Streptomycin | PAA | 15140122 | |
| Pipettes Performance Pipettor 10 μL, 100 μL, 1000 μL | VWR | ||
| Roswell-Park. Memorial-Institute-Medium (RPMI-1640) | Gibco (Thermo Scientific) | 11530586 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Saccharose | Carl ROTH GmbH & Co. KG | 9286.2 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Succinate | Sigma-Aldrich | S2378 | |
| Tetramethylphenylendiamin (TMPD) | Sigma-Aldrich | T3134 | |
| Tourniquet/ Blood pressure cuff | |||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 108382 | |
| Triton X-100 | Sigma-Aldrich | 108643 | |
| Trypanblau | Biochrom | T6146 | |
| Vacuum pump | Vaccubrand GmbH & Co. | ||
| ViewPlate-96 | Perkin Elmer | 6005181 | |
| Water bath WNB22 | Memmert GmbH & Co. KG |
Referenzen
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int J Alzheimers Dis. 2009, 951548 (2009).
- Haas, R. H. Mitochondrial dysfunction in aging and diseases of aging. Biology. 8 (2), 48 (2019).
- Kleiveland, C. R., Verhoeckx, K., Cotter, P., Lopez-Exposito, I., et al. Peripheral blood mononuclear cells. The Impact of Food Bioactives on Health. In Vitro and Ex Vivo Models. , (2015).
- Silaidos, C., et al. Sex-associated differences in mitochondrial function in human peripheral blood mononuclear cells (PBMCs) and brain. Biol Sex Differ. 9 (1), 34 (2018).
- Acin-Perez, R., Benincá, C., Shabane, B., Shirihai, O. S., Stiles, L. Utilization of human samples for assessment of mitochondrial bioenergetics: Gold standards, limitations, and future perspectives. Life. 11 (9), 949 (2021).
- Schindowski, K., et al. Impact of aging. NeuroMol Med. 4 (3), 161-177 (2003).
- Migliore, L., et al. Searching for the role and the most suitable biomarkers of oxidative stress in Alzheimer's disease and in other neurodegenerative diseases. Neurobiol Aging. 26 (5), 587-595 (2005).
- Leutz, S., et al. Reduction of trophic support enhances apoptosis in PC12 cells expressing Alzheimer’s APP mutation and sensitizes cells to staurosporine-induced cell death. J Mol Neurosci. 18 (3), 189-201 (2002).
- Leuner, K., et al. Peripheral mitochondrial dysfunction in Alzheimer’s disease: Focus on lymphocytes. Mol Neurobiol. 46 (1), 194-204 (2012).
- Leuner, K., et al. Enhanced apoptosis, oxidative stress and mitochondrial dysfunction in lymphocytes as potential biomarkers for Alzheimer’s disease. J Neural Transm Suppl. 2007 (72), 207-215 (2007).
- Kartika, R., Wibowo, H., Purnamasari, D., Pradipta, S., Larasati, R. A. Altered Indoleamine 2,3-Dioxygenase production and its association to inflammatory cytokines in peripheral blood mononuclear cells culture of type 2 diabetes mellitus. Int J Tryptophan Res. 13, 1178646920978236 (2020).
- Cortez-Espinosa, N., et al. CD39 expression on Treg and Th17 cells is associated with metabolic factors in patients with type 2 diabetes. Hum Immunol. 76 (9), 622-630 (2015).
- Mahmoud, F., et al. Effect of Diabetea tea ™ consumption on inflammatory cytokines and metabolic biomarkers in type 2 diabetes patients. J Ethnopharmacol. 194, 1069-1077 (2016).
- Volman, J. J., Ramakers, J. D., Plat, J. Dietary modulation of immune function by β-glucans. Physiol Behav. 94 (2), 276-284 (2008).
- Reddy, M., Eirikis, E., Davis, C., Davis, H. M., Prabhakar, U. Comparative analysis of lymphocyte activation marker expression and cytokine secretion profile in stimulated human peripheral blood mononuclear cell cultures: an in vitro model to monitor cellular immune function. J Immunol Methods. 293 (1), 127-142 (2004).
- Otaegui, D., et al. Differential micro RNA expression in PBMC from multiple sclerosis patients. PLoS One. 4 (7), e6309 (2009).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Fox, C. J., Hammerman, P. S., Thompson, C. B. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol. 5 (11), 844-852 (2005).
- Li, P., et al. Mitochondrial respiratory dysfunctions of blood mononuclear cells link with cardiac disturbance in patients with early-stage heart failure. Sci Rep. 5, 10229 (2015).
- Weiss, S. L., et al. Mitochondrial dysfunction in peripheral blood mononuclear cells in pediatric septic shock. Pediatr Crit Care Med. 16 (1), e4-e12 (2015).
- Higdon, L. E., Lee, K., Tang, Q., Maltzman, J. S. Virtual global transplant laboratory standard operating procedures for blood collection, PBMC isolation, and storage. Transplant Direct. 2 (9), e101 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7, 17-27 (2019).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer’s disease: recent advances. Mol Neurodegener. 15 (1), 30 (2020).
- Chaturvedi, R. K., Flint Beal, M. Mitochondrial diseases of the brain. Free Radic Biol Med. 63, 1-29 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten