Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Periferik Kan Mononükleer Hücrelerinin Kriyoprezervasyonu ve Biyoenerjetik Değerlendirmesi
Bu Makalede
Özet
İzole edilmiş periferik kan mononükleer hücreleri, bağışıklık fonksiyonlarının ve bozukluklarının, metabolik hastalıkların veya mitokondriyal fonksiyonların analizi için kullanılabilir. Bu çalışmada, PBMC'lerin tam kandan hazırlanması ve ardından kriyoprezervasyon için standartlaştırılmış bir yöntem tanımlanmıştır. Kriyoprezervasyon bu zaman ve mekandan bağımsız hale getirir.
Özet
Ökaryotik hücrelerin fizyolojik işlevleri, esas olarak mitokondri tarafından sağlanan enerjiye dayanır. Mitokondriyal disfonksiyon, metabolik hastalıklar ve yaşlanma ile bağlantılıdır. Oksidatif fosforilasyon, enerjik homeostazın korunması için çok önemli olduğu için belirleyici bir rol oynar. PBMC'ler, mitokondriyal fonksiyonu ölçmek için minimal invaziv bir örnek olarak tanımlanmıştır ve hastalık koşullarını yansıttığı gösterilmiştir. Bununla birlikte, mitokondriyal biyoenerjetik fonksiyonun ölçümü, insan örneklerinde çeşitli faktörlerle sınırlandırılabilir. Sınırlamalar, alınan numune miktarı, genellikle birkaç güne yayılan numune alma süresi ve konumlardır. Toplanan numunelerin dondurularak saklanması, numunelerin tutarlı bir şekilde toplanmasını ve ölçülmesini sağlayabilir. Ölçülen parametrelerin dondurularak saklanmış ve taze hazırlanmış hücreler arasında karşılaştırılabilir olmasına dikkat edilmelidir. Burada, bu hücrelerdeki mitokondrinin biyoenerjetik işlevini analiz etmek için insan kan örneklerinden PBMC'leri izole etme ve dondurarak saklama yöntemlerini açıklıyoruz. Burada açıklanan protokole göre dondurularak saklanan PBMC, yeni hasat edilmiş hücrelere kıyasla hücre sayısı ve canlılığı, adenozin trifosfat seviyeleri ve ölçülen solunum zinciri aktivitesinde yalnızca küçük farklılıklar gösterir. Tarif edilen preparatlar için sadece 8-24 mL insan kanına ihtiyaç vardır, bu da klinik çalışmalar sırasında numunelerin çok merkezli olarak toplanmasını ve biyoenerjetik değerlerinin yerinde belirlenmesini mümkün kılar.
Giriş
İnsan periferik kan mononükleer hücreleri (PBMC'ler), yaşlanma süreçleri veya dejeneratif hastalıklarla ilgili olanlar gibi immünolojik ve biyoenerjetik konuların incelenmesi de dahil olmak üzere birçok bilimsel alanda çeşitli uygulamalar için kullanılmaktadır 1,2. PBMC'ler bileşim olarak heterojendir ve lenfositler (B hücreleri, T hücreleri ve NK hücreleri), monositler ve dendritik hücrelerden oluşur. Hücreler bazen bir denek içinde büyük bireysel farklılıklar ve farklılıklar gösterir, bu nedenle bu hücreleri işlemek için standartlaştırılmış prosedürler gereklidir. İzolasyonun canlılığı ve saflığı gibi önemli parametreler, kullanımı için temel gerekliliklerdir ve ayrıca toplama zamanı, melatonin seviyesi, deneğin aç olup olmadığı ve diğerleri gibi çevresel faktörlerden etkilenir 3,4.
PBMC'lerin biyoenerjetik üzerine yapılan çalışmalara dayanarak, burada PBMC'lerin izolasyonu, kriyoprezervasyonu ve yetiştirilmesi için diğer yöntemler için de uygun olan bir yöntem açıklıyoruz. Kas biyopsisi mitokondriyal enerji metabolizmasıiçin altın standart olarak kabul edilirken5, kan hücrelerinin incelenmesi hızlı, minimal invaziv bir prosedürdür. Buna ek olarak, giderek daha fazla çalışma, yaşlanma ve Alzheimer hastalığında (AD) mitokondriyal fonksiyondaki değişikliklerin sadece beyinde değil, aynı zamanda periferde de meydana geldiğini göstermektedir 6,7,8,9,10. Yöntem ayrıca diabetes mellitus ve obezite dahil olmak üzere diğer durum ve hastalıkların araştırılmasına da izin verir 11,12,13. Multipl skleroz hastalarında gen ekspresyon paternleri analiz edilebilir veya genel olarak bağışıklık fonksiyonu ve etkileri 14,15,16.
PBMC'ler genellikle adenozin trifosfat (ATP) üretmek için oksidatif fosforilasyona (OXPHOS) güvenir17,18. Bu nedenle, PBMC'ler vekil olarak geniş bir uygulama yelpazesini kapsar. Önceki raporlarda, PBMC'lerin enerji metabolizması, erken kalp yetmezliği19, septik şok20 veya mitokondriyal fonksiyonda cinsiyetle ilişkili farklılıklar4 gibi organ işlev bozukluklarını ele almak için kullanılmıştır. PBMC'lerin kriyoprezervasyonu, izolasyonu ve kültivasyonu için genelleştirilmiş bir yöntem, farklı enstitülerde elde edilen sonuçların karşılaştırılabilirliğinde avantajlara sahip olacaktır. Her adım21,22 için protokollerde büyük farklılıklar vardır, bu yöntemin amacı PBMC'lerde biyoenerjetik ölçümler için bir kılavuz sağlamaktır.
Bu makalede, PBMC'lerde biyoenerjetik parametreleri ölçmek için bir yöntem açıklıyoruz. PBMC'lerin biyoenerjetik maddelerinin insan kanından izole edilmesi, dondurularak saklanması ve ölçülmesi yöntemlerini açıklıyoruz. Bu yöntem, hastalarda biyoenerjetik parametrelerin belirlenmesi ve klinik bağlamda değerlendirilmesi için kullanılabilir. Bu ölçümleri uygulamak için, araştırmacıların taze kan örneklerinin alınabileceği bir hasta popülasyonuna erişmeleri gerekir.
Protokol
Bu yazıda kan alma, izolasyon ve analiz için açıklanan tüm protokoller, Almanya'daki Giessen Üniversitesi'ndeki Kurumsal İnceleme Kurulu tarafından gözden geçirilmiş ve onaylanmıştır. Hastaların örneklerini çalışmaya dahil etmek için rızaları alındı. İzolasyon ve hücre kültürü için tüm adımlar biyolojik bir güvenlik kabini altında gerçekleştirilir.
1. Damar delinmesi
- Dezenfeksiyon spreyi, steril çubuk, 80 mm tüplü ve çoklu adaptörlü kan alma kanülü, turnike/tansiyon manşeti, Monovette 9 mL lityum-heparin dahil olmak üzere kan alma için gerekli tüm ekipmanları hazırlayın.
NOT: Bir antikoagülan olarak EDTA da etkilidir. - En uygun kol damarından, genellikle vena mediana cubiti veya vena cephalica'dan kan toplayın.
- Yaklaşık 80 mm/Hg hafif basınçlı bir turnike/tansiyon manşonu uygulayın.
- Eldivenleri ve delinme bölgesini alkol içeren dezenfektan sprey ile dezenfekte edin. Dezenfekte edilmiş delinme bölgesinin kurumasına izin verin.
- Damarlar, basınç manşetinin basıncı nedeniyle dışarı çıkar. İğneyi (Kanül çapı (dış) 21G / 0.8 mm, uzunluk 19 mm) damarın 15 ° -20 ° açısına sokarak travmayı önlemeye ve sondalamayı en aza indirmeye çalışın.
- Uygun sistemle, 9 mL kan içeren 4 tüple kan alın (bir deneycinin uygun şekilde izole etmesi için 7-8 tüpten fazlası sorunludur).
- Kan alındıktan sonra, homojen antikoagülasyon sağlamak için toplama tüplerini 5 dakika karanlıkta bırakın.
2. PBMC izolasyonu
- Gerekli tüm çözümleri aşağıda açıklandığı gibi hazırlayın.
- Dulbecco'nun dengeli tuz çözeltisini (DPBS; konsantrasyon 1x) ve lenfosit izolasyon ortamını (1.077 g/mL) oda sıcaklığına (20-25 °C) getirin.
- Fetal sığır serumunu (FBS) oda sıcaklığında hazırlayın ve FBS'li bir steril 50 mL konik tüpü buz üzerinde tutun. Her kan örneği için 2 mL FBS gereklidir.
- Dondurma kabını 4 °C'de saklayın ve kriyotüpleri 4 °C'de önceden soğutun.
- 37 ° C'ye kadar sıcak hücre kültürü ortamı, ortam 50 mL FBS ve penisilin 50 U / mL streptomisin 50 U / mL ile RPMI 1640'tan oluşur. Bu çözelti 3 °C'de 2 aya kadar saklanabilir.
- Steril 50 mL konik tüplere 8 mL DPBS ekleyin. Steril 50 mL konik tüpe 15 mL lenfosit izolasyon ortamı ekleyin (Ortam ışığa duyarlıdır, izolasyona başlamadan önce ekleyin).
- 8 mL DPBS'ye 8 mL kan ekleyin ve 3 mL plastik Pasteur pipeti ile dikkatlice karıştırın.
- Kan / DPBS karışımını lenfosit izolasyon ortamının üzerine 3 mL plastik Pasteur pipeti ile nazikçe katmanlayın. İlk katmanı ortama uygulamak için, tüpü 20 ° -30 ° eğin, bu da kan-PBS karışımının orta katmana daha az nüfuz etmesine neden olur.
- Kan-PBS karışımını tüpün yan duvarının üzerine dikkatlice lenfosit izolasyon ortamı üzerine yerleştirin. Kan akışını sabit tutmak için sabit bir hız kullanın.
- Bir sonraki adımda, tüpü yavaşça dik konuma getirin, kalan kan, tüpün yan duvarından kan tabakasına dikkatlice yerleştirilir.
- Frenleri kapalı sallanan kova rotorlu bir santrifüjde oda sıcaklığında 1000 x g'da 10 dakika santrifüjleyin. Santrifüjlemeden sonra kan/PBMC karışımı dört katmana ayrılır. Üst tabaka plazma ve trombositlerden oluşur, ikinci tabaka PBMC tabakasıdır, ardından bir lenfosit izolasyon orta tabakası ve son olarak alt tabakada eritrositler ve granülositler gelir. Farklı katmanlar Şekil 1'de gösterilmektedir.
- Plazmatabakasının 2 / 3'ünü plastik bir Pasteur pipeti ile çıkarın.
- 1 mL'lik bir pipet kullanarak, numuneye herhangi bir ortam girmemesine dikkat ederek PBMC'leri lenfosit izolasyon orta tabakasında toplayın.
- Ucu PBMC katmanının 1 mm yukarısına yerleştirin. PBMC tabakası delinmemelidir, aksi takdirde ortam hücrelerin üzerinden akacaktır. Pipetin emilmesi, PBMC'leri bu noktaya çeker, böylece bu noktada birkaç kez toplanabilirler.
NOT: Toplanan PBMC sayısını en üst düzeye çıkarmak için, prosedürün sonunda yüzeydeki geri kalanı arayın ve hücreleri orada da toplamaya çalışın. Prosedürü stabilize etmek için, tüp bir yüzeye yerleştirilebilir. - Katman tamamen hasat edilene kadar PBMC'leri adım adım 50 mL'lik yeni bir tüpe aktarın. DPBS'yi 25 mL işaretine kadar ekleyin, lenfosit izolasyon ortamını ve diğer kalıntıları yıkayın.
- Frenler açıkken oda sıcaklığında 100 x g'da 10 dakika santrifüjleyin. Süpernatanı bir vakum pompası veya benzeri bir şeyle çıkarın, hücre peletine zarar vermemeye dikkat edin.
- Peleti 1 mL DPBS'de yeniden süspanse edin ve DPBS'yi 25 mL işaretine ekleyin. Yıkamayı bir kez daha tekrarlayın ve ardından sonraki adımlar için uygun ortamda yeniden süspanse edin.
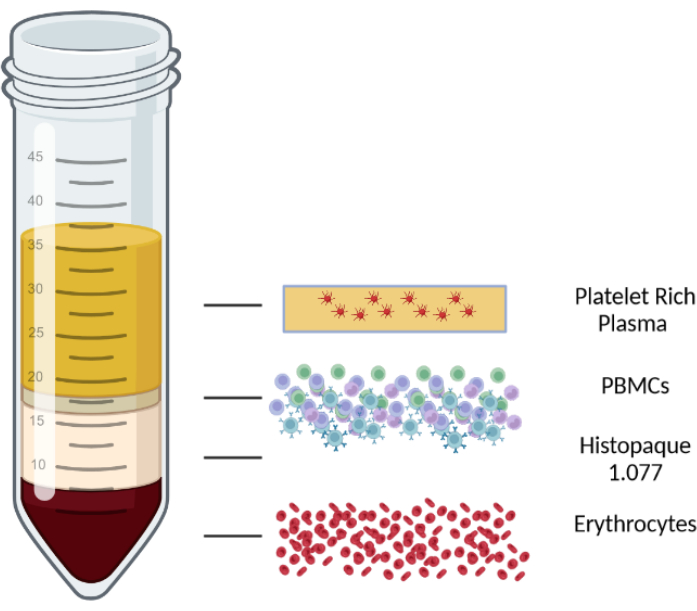
Şekil 1: Farklı katmanları göstermek için bir yoğunluk gradyanlı santrifüjlemenin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Kriyoprezervasyon
- Dondurucu bir kabı 4 °C'ye soğutun, FBS'yi buz üzerinde soğutun.
- PBMC peletini 1 mL FBS'de 1 mL'lik bir pipetle yeniden süspanse edin, FBS oda sıcaklığında olmalıdır.
- DMSO'yu önceden soğutulmuş FBS ile 1:5 buzda, son konsantrasyon %20 DMSO üzerinde karıştırın ve ardından FBS: DMSO karışımını tekrar buza koyun. Çözeltiyi her zaman taze hazırlayın.
- FBS'deki PBMC hücre süspansiyonunu iyi etiketlenmiş 2 mL kriyotüplere aktarın. Toplama tüpü başına bir kriyotüp kullanın. Hücre sayısını mL başına 1 x 107 ve 5 x 107 arasında ayarlayın. Hücre sayısını ve canlılığını belirlemek için otomatik bir hücre sayacı kullanın.
- 1 mL FBS: DMSO karışımını 1 mL'lik bir pipetle damla damlasına, saniyede yaklaşık 1-2 damla tüpe ekleyin. Damla damla ekleme, sürekli ve tutarlı karıştırmaya yol açar.
- Tüpleri önceden soğutulmuş dondurma kabına yerleştirin. Dondurma kabını 24 saat boyunca -80 °C'lik bir dondurucuya koyun. Dondurma kabı, dakikada -1 °C'lik kontrollü bir soğutma sağlar.
- Tüpleri -80 °C dondurucudan çıkarın. Dondurucudan çıkarıldıktan sonra, tüpleri sıvı azotun gaz fazında saklayın. Her numunenin yerini belgeleyin.
4. Çözülme
- Gerekli tüm çözeltileri hazırlayın: 50 mL FBS ve penisilin 50 U/mL, streptomisin 50 U/mL içeren hücre kültürü ortamı RPMI 1640. Bu çözelti 3°C'de 2 aya kadar saklanabilir.
- Hücre kültürü ortamını 37 °C'ye önceden ısıtın. Steril 50 mL konik tüplere 3 mL ön sıcak hücre kültürü ortamı ekleyin.
- Numuneyi sıvı nitrojen tankından çıkarın. Numuneleri 37 °C'de bir su banyosunda yaklaşık 3,5 dakika çözdürün, son buz eridiğinde su banyosundan çıkarın. Tüpte toplu iğne başı büyüklüğünde bir buz parçası hala görünür olmalıdır.
NOT: DMSO, PBMC'lerin mümkün olduğunca çabuk çalışması için zararlıdır. - Hücreyi çıkarın: FBS: DMSO kriyotüpten 1 mL'lik bir pipetle karıştırın. PBMC numunelerini hazırlanan 50 mL'lik tüplerde hücre kültürü ortamı ile karıştırın. Tüpleri 5 mL kültür ortamı ile 2 mL, 2 mL ve 1 mL'lik üç adımda yıkayın.
- Ortamı tüplere aktarın. Bu, olası hücre kalıntılarını transfer etmek için gerçekleştirilir. Oda sıcaklığında 100 x g'da 10 dakika santrifüjleyin.
- Süpernatanı atın ve planlanan kullanıma uygun 1 mL ortam ekleyin. Hücreler sonraki deneyler için hazırdır.
NOT: Bununla birlikte, taze veya donmuş hücreler üzerinde yapılan fonksiyonel testlerle, lenfosit izolasyon ortamı bazlı izolasyon veya hücre çözdürme işleminden sonra genellikle bir inkübatörde (tipik olarak gece boyunca) bir dinlenme süresi önerilir.
5. Hücre kültürü
- İzolasyondan veya çözüldükten sonra, kültür hücreleri gece boyunca 37 °C'de% 5 CO2/95% havada.
- Hücreleri% 10 FBS, penisilin 50 U / mL, streptomisin 50 U / mL ile desteklenmiş 1 mL RPMI ortamında yeniden süspanse edin. Daha fazla kullanım için birçok olasılık vardır, hücreleri tahliller için gerektiği gibi tedavi edin.
- Genel depolama için steril 6 oyuklu hücre kültürü plakaları kullanın ve dinlenme süresinden sonra hücreleri hasat edin. 1 mL hücre süspansiyonunu 1 mL'lik bir pipetle bir kuyucuğa aktarın ve 4 mL hücre kültürü ortamı ekleyin.
NOT: İzole edilen PBMC'lerin miktarı bireyler arasında büyük farklılıklar gösterir, izole edilen her 8 mL kan için 5 mL hücre kültürü ortamı içeren bir kuyucuk yeterlidir. Bununla birlikte, PBMC'leri buffy coats'tan izole ederken, PBMC'lerin miktarı tam kan örneklerinden önemli ölçüde daha yüksektir ve bu nedenle hücreler birkaç oyuğa bölünmelidir. - Hücrelerin 37 °C'de %5CO2 ile desteklenmiş nemlendirilmiş bir atmosferde 24 saat dinlenmesine izin verin. Bu inkübasyon, yeni izole edilmiş hücrelerin yanı sıra kriyoprezervasyon hücreler için de gerçekleştirilir.
6. ATP testi
- Çözülmüş PBMC'leri% 10 FBS, penisilin 50 U / mL, streptomisin 50 U / mL ile desteklenmiş 1 mL RPMI ortamında yeniden süspanse edin.
- Bir örnek alın ve hücre sayısını belirleyin, ardından tripan mavisi ile canlı-ölü ayrımı yapın. Yeniden süspanse edilmiş hücrelerden 10 μL alın ve 90 μL hücre kültürü ortamı ile karıştırın. Sonra 10 μL alın ve 10 μL tripan mavisi ile karıştırın. Hücreleri bir hücre sayma odasına veya otomatik bir hücre sayacına yerleştirin ve canlı/ölü hücrelerin sayısını belirleyin.
- 96 oyuklu beyaz polistiren plakada oyuk başına 1 x 105 hücre/100 μL yoğunlukta 100 μL hücre plakası.
- Hücreleri, 37 °C'de %5CO2 ile desteklenmiş nemlendirilmiş bir atmosferde 24 saat dinlendirin.
- ATP konsantrasyonlarını bir ATP testi ile belirleyin.
- ATP, lusiferin ile birleştirildiğinde oluşan ışık emisyonunu kullanın. Yayılan ışık bir plaka okuyucu ile değerlendirilebilir. İnkübatörün 15 dakika oda sıcaklığına soğuması için plakaları çıkarın. Hücreleri parçalayın ve 5 dakika bekletin. Ardından hücrelere izleme reaktifi uygulayın ve üreticinin talimatlarına göre ölçün. ATP seviyesini belirlemek için dahili bir standart kullanılır.
7. Yüksek çözünürlüklü respirometri
- Yüksek çözünürlüklü oksigrafı AÇIN ve 30 dakika ısınmasına izin verin.
- Hücreleri Şekil 1'de açıklanan bir protokole göre tedavi edin. İhtiyaç duyulan tüm stokları Tablo 1'deki gibi hazırlayın.
- 2,1 mL solunum tamponunu (Tablo 1) her iki yüksek çözünürlüklü oksigraf odasına pipetleyin ve polarografik oksijen sensörünün kararlı bir oksijen akısı sinyali elde edilene kadar 37 °C'de 30 dakika boyunca odalarda bulunan bir manyetik karıştırma çubuğunu (750 rpm) kullanarak tamponu sürekli olarak karıştırın.
NOT: Oksigraf odalarında, gerçek zamanlı oksijen tüketimi (akı) ve odanın oksijen doygunluğu polarografik oksijen elektrotları yardımıyla ölçülür. Arka plan gürültüsünü önlemek ve güvenilir sonuçlar elde etmek için arka plan kalibrasyonu yapılmalıdır. - Polarografik oksijen sensörünün hava kalibrasyonunu üreticinin protokollerinegöre gerçekleştirin 23.
- İzole edilmiş PBMC'leri 1 mL mitokondriyal solunum ortamında (MIR05, bileşim Tablo 1'de gösterilmiştir) yeniden süspanse edin ve 8 x 106 hücre / mL'ye seyreltin.
- Hava kalibrasyonundan sonra, solunum ortamını oksigraf odasından aspire edin ve respirometrenin her bir kamberine 2.1 mL hücre süspansiyonu ekleyin. Ölçüm sırasında gerekirse odaları yeniden oksijenlendirin ( bkz. Şekil 2'deki h noktasında açık), odaların oksijen doygunluğu 100 μM'nin altına düşmemelidir.
- Tıpaları yerleştirerek hazneleri kapatın, hazneler 2.0 mL hacim tutacak şekilde tasarlanmıştır. Ortaya çıkan hücre süspansiyonunu aspire edin.
- Hücre süspansiyonunu 37 °C'de haznede bulunan manyetik bir karıştırıcı (750 rpm) ile sürekli olarak karıştırın. Sabit bir sinyal elde edilene kadar yaklaşık 20 dakika bekleyin. Endojen solunumu belirleyin ((a) Şekil 2'de).
- Solunum zincirinin farklı karmaşık aktivitelerini belirlemek için, mitokondriyal solunum için substratları ve inhibitörleri tıpaların titanyum enjeksiyon portlarından enjekte edin. Haznede aşağıdaki son konsantrasyonu kullanın.
- Hücre zarlarını bozmak için, mitokondriyal zarlar bozulmadan kalırken Şekil 2'deki saf substratları (b) çıkarmak için oda durdurucunun titanyum enjeksiyon portundan 5 μL 8.1 mM digitonin ekleyin.
- Hazne durdurucunun enjeksiyon portundan 2 M glutamat ve 800 mM malat substratları ekleyin ve stabil bir sinyal elde edilene kadar solunumu kaydedin. Sinyal 2-4 dakika sonra stabilize olur.
NOT: Piruvat gibi ek substratların kullanılması da mümkündür. - Hazne durdurucunun enjeksiyon portundan 8 μL 500 mM adenozin difosfat (ADP) ekleyin ve kararlı bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, Şekil 2'de 2-4 dakika (d) sonra stabilize olur.
- Hazne durdurucunun enjeksiyon portundan 20 μL 1 M süksinat ekleyin ve stabil bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, Şekil 2'de 4-2 dakika (e) sonra stabilize olur.
- 1 M karbonil siyanür p-triflorometoksi fenilhidrazonu (FCCP) 0,5 μL'de kademeli olarak daha fazla artışın meydana gelmediği noktaya kadar titre edin. Şekil 2'de sinyal stabilize olana kadar (f) 2-4 dakika bekleyin. Solunumda daha fazla artış olmadığında bir sonraki adıma devam edin.
DİKKAT: İnsanlar için sağlık riskleri taşıdığından FCCP'yi kullanırken dikkatli olun. - Hazne durdurucunun enjeksiyon portundan 5 μL 0.1 mM rotenon ekleyin ve stabil bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, Şekil 2'de 2-4 dakika (g) sonra stabilize olur.
DİKKAT: İnsanlar için sağlık riskleri taşıdığından rotenon kullanırken dikkatli olun. - Hazne durdurucunun enjeksiyon portundan 1 μL 4 mg / mL oligomisin ekleyin ve stabil bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, Şekil 2'de 2-4 dakika (h) sonra stabilize olur.
DİKKAT: İnsanlar için sağlık riski oluşturan bir zehir olduğu için oligomisin kullanırken dikkatli olun. - Hazne durdurucunun enjeksiyon portundan 1 μL 5 mM antimisin A ekleyin ve stabil bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, Şekil 2'de 2-4 dakika (i) sonra stabilize olur.
DİKKAT: Antimisin A'yı kullanırken dikkatli olun, çünkü insanlar için sağlık riskleri oluşturan bir zehirdir. - Oksidatif fosforilasyonda yer almayan enzimlerin oksijen tüketimini hariç tutmak için çalışmayı değerlendirirken, antimisin A değerlerini diğer tüm ölçülen değerlerden çıkarın.
- TMPD'yi indirgenmiş durumda tutmak için 200 mM N, N, N', N'-tetrametil-p-fenilendiamin dihidroklorür (TMPD; elektron verici) ve 800 mM askorbat ekleyin. Alt tabakaları hazne durdurucunun enjeksiyon portundan enjekte edin ve stabil bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, Şekil 2'de 2-4 dakika (j) sonra stabilize olur.
- TMPD otooksidasyona maruz kalır, bu nedenle ortaya çıkan oksijen tüketimini Kompleks IV'te ölçülen değerden çıkarın.
- Hazne durdurucunun enjeksiyon portundan NaN3 ≥ 100 mM ekleyin ve kararlı bir sinyal elde edilene kadar solunumu kaydedin. Sinyal, karmaşık IV aktivitesini inhibe etmek için 2-4 dakika sonra stabilize olur, sadece TMPD otooksidasyonu kalır.
DİKKAT: İnsanlar için sağlık riski oluşturan bir zehir olduğu için sodyum azid ile çalışırken dikkatli olun.
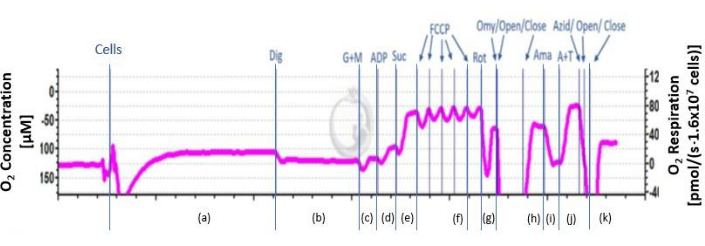
Şekil 2:O2 akısının şematik seyri. Oksijen akısının şematik seyri gösterilmiştir. Eğri, ak'den inhibitörlerin ve substratların eklenmesinden sonra farklı fazlara bölünür. A: endojen solunum; b: geçirgen hücreler; c: bağlanmamış kompleks I solunum; d: birleştirilmiş kompleks I solunum; e: OXPHOS; f: CI ve CII'nin maksimum ayrılmamış aktivitesi; g: kompleks II'nin bağlanmamış solunum; h: kaçak solunum; I: rezidüel solunum; j: CIV (U) bağlanmamış solunum ve TMPD'nin otooksidasyonu; k: TMPD'nin otooksidasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
8. Sitrat sentaz aktivitesi
- Sitrat sentaz aktivitesini ayrı bir parametre olarak ölçün ve bunu yüksek çözünürlüklü oksigrafın ölçümlerini normalleştirmek için kullanın.
- İzole edilmiş PBMC'yi 1 mL mitokondriyal solunum ortamında (MIR05) yeniden süspanse edin ve 8 x 106 hücre / mL'ye seyreltin.
- Sıvı nitrojen içinde dondurun ve deneyler yapılana veya taze hücreleri ölçene kadar −80 °C'de saklayın.
- Gerekli tüm çözeltileri hazırlayın: 0.1 M trietanolamin HCl tamponu pH 8.0, 1.0 M Tris-HCl tamponu pH=8.1, %10 Triton X-100, 0.1 M trietanolamin HCl tamponu pH 8.0 içinde 10 mM Oksalasetat, 1.0 M Tris-HCl tamponunda 1.01 mM DTNB pH=8.1, Asetil-CoA 12.2 mM çift damıtılmışH2O'da.
- 5,5'-ditio-bis-(2-nitrobezoik asit) (DTNB; 0.1 mM), asetil koenzim A (0.31 mM), EDTA (50 μM), trietanolamin HCl (5 mM) ve Tris HCl (0.1 M) içeren reaksiyon ortamı (Tablo 1) hazırlayın.
- Çift damıtılmışH2Oiçinde çözünmüş 0.5 mM oksaloasetat ile başlangıç reaktifini (Tablo 1) hazırlayın.
- Sitrat sentaz çok hızlı çözülürse kararsız olduğu için numuneleri buz üzerinde çözdürün.
- Bir multipipet ile 110 μL reaksiyon ortamı eklemeden önce buz üzerinde 96 oyuklu bir plakaya 40 μL numune ekleyin.
- Reaksiyon ortamını ısıtın ve numuneyi bir inkübatörde 5 dakika boyunca 30 °C'ye ısıtın. Su banyosunda 5 dakika boyunca 30 °C'ye kadar ısıtın.
- Her bir oyuğa bir multipipet ile 50 μL başlangıç reaktifi ekleyin. Plaka okuyucu ile 20 dakika boyunca 412 nm dalga boyunda 30 °C'de absorbansı ölçün.
Sonuçlar
Hücre canlılığı ve sayısı
Başarılı bir izolasyon ve kriyoprezervasyon elde etmek için hücre sayısı ve canlılığı mümkün olduğunca yüksek olmalıdır. Kriyoprezervasyondan önce ve sonra, hücreler sayılır ve hücrelerin sağlığını ve kalitesini sağlamak için canlılıkları belirlenir. Şekil 3 , kriyoprezervasyondan önce ve sonra PBMC'lerin temsili bir örneğidir, hücre sayısı ve canlılık neredeyse hiç farklılık göstermez. Bu, PBMC...
Tartışmalar
Bu protokol, periferik kan mononükleer hücrelerinin (PBMC'ler) biyoenerjetik analizler için uygun bir şekilde insan kanından izole edilmesi ve dondurularak saklanması için bir araç sağlar. Açıklanan yöntem, PBMC'leri nazikçe ve büyük miktarlarda, yüksek canlılık ve biyoenerjetik ölçümler için yeterli hücrelerle izole etme imkanı sunar. Minimum kesintilerle bile uzun izolasyonların meydana gelmesi dezavantajına sahiptir, ancak daha sonra kriyoprezervasyon, biyoenerjetik enerjinin zamandan bağım...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmezler.
Teşekkürler
Kan alımı için Giessen-Marburg Üniversite Hastanesi'nin klinik ekibine teşekkür ederiz. Bu çalışma Justus Liebig üniversitesi tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.1 M Triethanolamine-HCl-Buffer (pH = 8,0) | Self-prepared | - | |
| 0.5 M Triethanolamine-HCl-Buffer | Self-prepared | - | |
| 1.0 M Tris-HCl-Buffer (pH = 8,1) | Self-prepared | - | |
| 1.01 mM DTBB | Self-prepared | - | |
| 10 % Triton X-100 | Self-prepared | - | |
| 10 mM Oxalacetat | Self-prepared | - | |
| 14–20 G sterile blood draw needles Multi Adapter Sarstedt Safety-Multifly | Sarstedt | 156353_v | |
| 37% HCl | Carl Roth GmbH & Co. KG | - | |
| 70% Ethanol (EtOH) | Self-prepared | - | |
| Acetyl-CoA | Pancreac Applichem | A3753 | |
| ADP | Sigma-Aldrich | A5285 | |
| Alcohol wipes | (70% isopropyl alcohol) | ||
| Antimycin A | Sigma-Aldrich | A8674 | |
| Aqua (bidest.) | With MilliQ Academic (self-made) | - | |
| Ascorbate | Sigma-Aldrich | A4034 | |
| ATP-Standard | Sigma-Aldrich | 6016949 | |
| Biocoll Seperating Solution | Biochrom | 6115 | |
| Biological safty cabinet MSC Advantage | Thermo Fisher Scientific Inc. | ||
| Carbonylcyanid-p-trifluoromethoxy-phenylhydrazon (FCCP) | Sigma-Aldrich | C2920 | |
| Cell counter TC20 Automated Cell Counter | Bio-Rad | ||
| Centrifuge Heraeus Megafuge 16 R | Thermo Fisher Scientific Inc. | ||
| Counting slides, dual chamber for cell counter | Bio-Rad | 1450016 | |
| Cryotube Cryo.S | Grainer Bio-One | 126263-2DG | |
| Digitonin | Sigma-Aldrich | 37008 | |
| Dimethylsulfoxid (DMSO) | Merck | 102952 | |
| Disinfection spray | |||
| Disposable gloves latex, rubber, or vinyl. | |||
| Distrips (12.5 ml) DistriTips | Gilson | F164150 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS; 10x) | Gibco (Thermo Scientific) | 15217168 | |
| Ethanol (EtOH 100%) | Carl ROTH GmbH & Co. KG | 9065.3 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F9665 | |
| Frezer (-80°C) | Thermo Fisher Scientific Inc. | ||
| Glutamate | Sigma-Aldrich | G1626 | |
| Holder/adapter | |||
| Incubator Midi 40 CO2 | Thermo Fisher Scientific Inc. | ||
| Injection syringe | Hamilton | ||
| Malate | Sigma-Aldrich | M-1000 | |
| MIR05 | Self-prepared | - | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific Inc. | 10110051 | |
| Multireader CLARIOstar | BMG Labtech | ||
| Nitrogen tank Locator 6 plus | Thermo Fisher Scientific Inc. | ||
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxalacetate | Sigma-Aldrich | - | |
| Oxygraph-2k | Orobororus Instruments | ||
| Penicillin-Streptomycin | PAA | 15140122 | |
| Pipettes Performance Pipettor 10 μL, 100 μL, 1000 μL | VWR | ||
| Roswell-Park. Memorial-Institute-Medium (RPMI-1640) | Gibco (Thermo Scientific) | 11530586 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Saccharose | Carl ROTH GmbH & Co. KG | 9286.2 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Succinate | Sigma-Aldrich | S2378 | |
| Tetramethylphenylendiamin (TMPD) | Sigma-Aldrich | T3134 | |
| Tourniquet/ Blood pressure cuff | |||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 108382 | |
| Triton X-100 | Sigma-Aldrich | 108643 | |
| Trypanblau | Biochrom | T6146 | |
| Vacuum pump | Vaccubrand GmbH & Co. | ||
| ViewPlate-96 | Perkin Elmer | 6005181 | |
| Water bath WNB22 | Memmert GmbH & Co. KG |
Referanslar
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int J Alzheimers Dis. 2009, 951548 (2009).
- Haas, R. H. Mitochondrial dysfunction in aging and diseases of aging. Biology. 8 (2), 48 (2019).
- Kleiveland, C. R., Verhoeckx, K., Cotter, P., Lopez-Exposito, I., et al. Peripheral blood mononuclear cells. The Impact of Food Bioactives on Health. In Vitro and Ex Vivo Models. , (2015).
- Silaidos, C., et al. Sex-associated differences in mitochondrial function in human peripheral blood mononuclear cells (PBMCs) and brain. Biol Sex Differ. 9 (1), 34 (2018).
- Acin-Perez, R., Benincá, C., Shabane, B., Shirihai, O. S., Stiles, L. Utilization of human samples for assessment of mitochondrial bioenergetics: Gold standards, limitations, and future perspectives. Life. 11 (9), 949 (2021).
- Schindowski, K., et al. Impact of aging. NeuroMol Med. 4 (3), 161-177 (2003).
- Migliore, L., et al. Searching for the role and the most suitable biomarkers of oxidative stress in Alzheimer's disease and in other neurodegenerative diseases. Neurobiol Aging. 26 (5), 587-595 (2005).
- Leutz, S., et al. Reduction of trophic support enhances apoptosis in PC12 cells expressing Alzheimer’s APP mutation and sensitizes cells to staurosporine-induced cell death. J Mol Neurosci. 18 (3), 189-201 (2002).
- Leuner, K., et al. Peripheral mitochondrial dysfunction in Alzheimer’s disease: Focus on lymphocytes. Mol Neurobiol. 46 (1), 194-204 (2012).
- Leuner, K., et al. Enhanced apoptosis, oxidative stress and mitochondrial dysfunction in lymphocytes as potential biomarkers for Alzheimer’s disease. J Neural Transm Suppl. 2007 (72), 207-215 (2007).
- Kartika, R., Wibowo, H., Purnamasari, D., Pradipta, S., Larasati, R. A. Altered Indoleamine 2,3-Dioxygenase production and its association to inflammatory cytokines in peripheral blood mononuclear cells culture of type 2 diabetes mellitus. Int J Tryptophan Res. 13, 1178646920978236 (2020).
- Cortez-Espinosa, N., et al. CD39 expression on Treg and Th17 cells is associated with metabolic factors in patients with type 2 diabetes. Hum Immunol. 76 (9), 622-630 (2015).
- Mahmoud, F., et al. Effect of Diabetea tea ™ consumption on inflammatory cytokines and metabolic biomarkers in type 2 diabetes patients. J Ethnopharmacol. 194, 1069-1077 (2016).
- Volman, J. J., Ramakers, J. D., Plat, J. Dietary modulation of immune function by β-glucans. Physiol Behav. 94 (2), 276-284 (2008).
- Reddy, M., Eirikis, E., Davis, C., Davis, H. M., Prabhakar, U. Comparative analysis of lymphocyte activation marker expression and cytokine secretion profile in stimulated human peripheral blood mononuclear cell cultures: an in vitro model to monitor cellular immune function. J Immunol Methods. 293 (1), 127-142 (2004).
- Otaegui, D., et al. Differential micro RNA expression in PBMC from multiple sclerosis patients. PLoS One. 4 (7), e6309 (2009).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Fox, C. J., Hammerman, P. S., Thompson, C. B. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol. 5 (11), 844-852 (2005).
- Li, P., et al. Mitochondrial respiratory dysfunctions of blood mononuclear cells link with cardiac disturbance in patients with early-stage heart failure. Sci Rep. 5, 10229 (2015).
- Weiss, S. L., et al. Mitochondrial dysfunction in peripheral blood mononuclear cells in pediatric septic shock. Pediatr Crit Care Med. 16 (1), e4-e12 (2015).
- Higdon, L. E., Lee, K., Tang, Q., Maltzman, J. S. Virtual global transplant laboratory standard operating procedures for blood collection, PBMC isolation, and storage. Transplant Direct. 2 (9), e101 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7, 17-27 (2019).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer’s disease: recent advances. Mol Neurodegener. 15 (1), 30 (2020).
- Chaturvedi, R. K., Flint Beal, M. Mitochondrial diseases of the brain. Free Radic Biol Med. 63, 1-29 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır