JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
인간 말초 혈액 단핵 세포의 냉동 보존 및 생체 에너지 평가
요약
분리된 말초 혈액 단핵 세포는 면역 기능 및 장애, 대사 질환 또는 미토콘드리아 기능의 분석에 사용할 수 있습니다. 이 연구에서는 전혈에서 PBMC를 준비하고 후속 냉동 보존을 위한 표준화된 방법을 설명합니다. 냉동 보존은 이 시간과 장소를 독립적으로 만듭니다.
초록
진핵 세포의 생리적 기능은 주로 미토콘드리아가 제공하는 에너지에 의존합니다. 미토콘드리아 기능 장애는 대사 질환 및 노화와 관련이 있습니다. 산화적 인산화는 에너지 항상성 유지에 중요하기 때문에 결정적인 역할을 합니다. PBMC는 미토콘드리아 기능을 측정하기 위한 최소 침습 샘플로 확인되었으며 질병 상태를 반영하는 것으로 나타났습니다. 그러나 미토콘드리아 생체 에너지 기능의 측정은 인간 샘플의 여러 요인에 의해 제한될 수 있습니다. 제한 사항은 채취한 샘플의 양, 종종 며칠에 걸쳐 분산되는 샘플링 시간 및 위치입니다. 수집된 샘플의 냉동 보존은 샘플의 일관된 수집 및 측정을 보장할 수 있습니다. 측정된 매개변수가 냉동 보존된 세포와 새로 준비된 세포 간에 비교할 수 있도록 주의해야 합니다. 여기에서는 이러한 세포에서 미토콘드리아의 생체 에너지 기능을 분석하기 위해 인간 혈액 샘플에서 PBMC를 분리하고 냉동 보존하는 방법을 설명합니다. 여기에 설명된 프로토콜에 따라 동결 보존된 PBMC는 갓 수확한 세포와 비교하여 세포 수 및 생존력, 아데노신 삼인산 수치 및 측정된 호흡 사슬 활성에서 약간의 차이만 보여줍니다. 설명된 제제에는 8-24mL의 인간 혈액만 필요하므로 임상 연구 중에 다중앙에서 샘플을 수집하고 현장에서 생체 에너지를 측정할 수 있습니다.
서문
인간 말초 혈액 단핵 세포(PBMC)는 노화 과정이나 퇴행성 질환과 관련된 면역 및 생체 에너지 문제 연구를 포함하여 많은 과학 분야의 다양한 응용 분야에 사용됩니다 1,2. PBMC는 구성이 이질적이며 림프구(B 세포, T 세포 및 NK 세포), 단핵구 및 수지상 세포로 구성됩니다. 세포는 때때로 피험자 내에서 큰 개인차와 편차를 보이기 때문에 이러한 세포를 다루기 위한 표준화된 절차가 필요합니다. 분리물의 생존력 및 순도와 같은 중요한 매개변수는 취급을 위한 기본 요구 사항이며 수집 시간, 멜라토닌 수치, 피험자의 공복 여부 등과 같은 환경 요인의 영향을 추가로 받습니다 3,4.
PBMC의 생체 에너지학에 대한 연구를 바탕으로 여기서는 다른 방법에도 적합한 PBMC의 분리, 동결 보존 및 배양 방법을 설명합니다. 근육 생검은 미토콘드리아 에너지 대사의 황금 표준으로 간주되지만5 혈액 세포 검사는 빠르고 최소 침습적인 절차입니다. 이 외에도 점점 더 많은 연구에서 노화와 알츠하이머병(AD)의 미토콘드리아 기능 변화가 뇌뿐만 아니라 말초에서도 발생한다는 것을 시사합니다 6,7,8,9,10. 이 방법은 또한 당뇨병 및 비만을 포함한 다른 상태 및 질병에 대한 조사를 가능하게 한다 11,12,13. 다발성 경화증 환자의 유전자 발현 패턴은 일반적으로 면역 기능 및 영향을 분석할 수 있습니다 14,15,16.
PBMC는 일반적으로 산화적 인산화(OXPHOS)에 의존하여 아데노신 삼인산(ATP)17,18을 생성합니다. 따라서 PBMC는 대리자로서 광범위한 응용 분야를 포괄합니다. 이전 보고에서, PBMC의 에너지 대사는 미토콘드리아 기능의 초기 심부전19, 패혈성 쇼크20 또는 성별 관련 차이4와 같은 장기 기능 장애를 해결하는 데 사용되었다. PBMC의 동결 보존 분리 및 배양을 위한 일반화된 방법은 다른 기관에서 얻은 결과의 비교 가능성에 이점이 있습니다. 각 단계(21,22)에 대한 프로토콜에는 많은 변이가 있으며, 이 방법의 목표는 PBMC에서 생체 에너지 측정에 대한 지침을 제공하는 것이다.
이 기사에서는 PBMC에서 생체 에너지 파라미터를 측정하는 방법에 대해 설명합니다. 인간 혈액에서 PBMC의 생체 에너지를 분리, 동결 보존 및 측정하는 방법을 설명합니다. 이 방법은 환자의 생체 에너지 매개변수를 결정하고 임상 맥락에서 평가하는 데 사용할 수 있습니다. 이러한 측정을 적용하기 위해 연구자들은 신선한 혈액 샘플을 얻을 수 있는 환자 집단에 접근할 수 있어야 합니다.
프로토콜
이 원고에 설명된 혈액 수집, 분리 및 분석에 대한 모든 프로토콜은 독일 기센 대학의 기관 검토 위원회에서 검토 및 승인했습니다. 연구에 샘플을 포함하는 것에 대한 환자의 동의를 얻었습니다. 분리 및 세포 배양을 위한 모든 단계는 생물 안전 작업대에서 수행됩니다.
1. 정맥 천자
- 소독 스프레이, 멸균 면봉, 80mm 튜브 및 다중 어댑터가 있는 채혈 캐뉼라, 지혈대/혈압 커프, 모노베트 9mL 리튬-헤파린을 포함하여 채혈에 필요한 모든 장비를 준비합니다.
참고: 항응고제로서의 EDTA도 효과적입니다. - 가장 적절한 팔 정맥, 일반적으로 vena mediana cubiti 또는 vena cephalica에서 혈액을 채취합니다.
- 약 80mm/Hg의 가벼운 압력으로 지혈대/혈압 커프를 적용합니다.
- 장갑을 소독하고 알코올이 함유 된 소독 스프레이로 부위를 뚫습니다. 소독된 펑크 부위를 자연 건조시키십시오.
- 압력 커프의 압력으로 인해 정맥이 돌출됩니다. 외상을 피하고 프로빙을 최소화하기 위해 바늘(캐뉼라 직경(바깥쪽) 21G/0.8mm, 길이 19mm)을 정맥의 15°-20° 각도로 삽입합니다.
- 9mL의 혈액이 들어있는 4 개의 튜브로 적절한 시스템으로 혈액을 채취하십시오 (7-8 개 이상의 튜브는 한 명의 실험자가 적절하게 분리하는 데 문제가 있습니다).
- 채혈 후 채혈 튜브를 어두운 곳에 5분 동안 두어 균일한 항응고를 보장합니다.
2. PBMC 절연
- 아래 설명된 대로 필요한 모든 솔루션을 준비합니다.
- Dulbecco의 균형 염 용액(DPBS, 농도 1x)과 림프구 분리 배지(1.077g/mL)를 실온(20-25°C)으로 가져옵니다.
- 실온에서 소 태아 혈청(FBS)을 준비하고 FBS가 있는 멸균 50mL 원뿔형 튜브 1개를 얼음 위에 보관합니다. 각 혈액 샘플에 대해 2mL의 FBS가 필요합니다.
- 냉동 용기는 4 °C에서 보관하고 cryotube는 4 °C에서 사전 냉각하여 보관하십시오.
- 세포 배양 배지를 37°C로 데우고, 배지는 50mL의 FBS와 페니실린 50U/mL의 스트렙토마이신 50U/mL가 포함된 RPMI 1640으로 구성됩니다. 이 용액은 3°C에서 최대 2개월 동안 보관할 수 있습니다.
- 멸균 50mL 코니컬 튜브에 8mL의 DPBS를 추가합니다. 멸균 50mL 코니컬 튜브에 15mL의 림프구 분리 배지를 추가합니다(배지는 빛에 민감하므로 분리를 시작하기 전에 추가).
- 8mL의 DPBS에 8mL의 혈액을 추가하고 3mL 플라스틱 파스퇴르 피펫과 조심스럽게 더 섞습니다.
- 림프구 분리 배지 위에 3mL 플라스틱 파스퇴르 피펫으로 혈액/DPBS 혼합물을 부드럽게 레이어링합니다. 첫 번째 층을 배지에 적용하려면 튜브를 20°-30° 기울이면 혈액-PBS 혼합물이 중간 층으로 덜 침투합니다.
- 혈액-PBS 혼합물을 튜브의 측벽 위에 림프구 분리 배지에 조심스럽게 겹쳐 놓습니다. 혈류를 일정하게 유지하기 위해 일정한 속도를 사용하십시오.
- 다음 단계에서 튜브를 천천히 똑바로 세우고 남은 혈액을 튜브 측벽을 통해 혈액층에 조심스럽게 층을 이룹니다.
- 브레이크를 끈 스윙 버켓 로터가 있는 원심분리기에서 실온의 1000 x g 에서 10분 동안 원심분리합니다. 원심분리 후 혈액/PBMC 혼합물을 4개의 층으로 분리합니다. 맨 위 층은 혈장과 혈소판으로 구성되고, 두 번째 층은 PBMC 층, 림프구 분리 중간 층, 마지막으로 맨 아래 층에는 적혈구와 과립구가 있습니다. 그림 1에는 다양한 레이어가 표시되어 있습니다.
- 플라스틱 파스퇴르 피펫으로 플라즈마 층의 2/3를 제거합니다.
- 1mL 피펫을 사용하여 샘플에 배지가 들어가지 않도록 주의하면서 림프구 분리 배지 층에서 PBMC를 수집합니다.
- 팁을 PBMC 층 위로 1mm 위에 놓습니다. PBMC 층에 구멍이 뚫리지 않아야 하며, 그렇지 않으면 매체가 셀 위로 흐릅니다. 피펫의 흡입은 PBMC를 이 지점으로 당겨 이 지점에서 여러 번 수집할 수 있습니다.
참고: 수집된 PBMC 수를 최대화하려면 절차가 끝날 때 표면에서 나머지를 검색하고 해당 표면에서도 셀을 수집해 보십시오. 절차를 안정화하기 위해 튜브를 표면에 놓을 수 있습니다. - 층이 완전히 수확될 때까지 PBMC를 새 50mL 튜브로 단계별로 옮깁니다. DPBS를 최대 25mL 표시까지 추가하고 림프구 분리 배지 및 기타 잔류물을 씻어냅니다.
- 브레이크를 켠 상태에서 실온에서 100 x g 에서 10분 동안 원심분리합니다. 진공 펌프 또는 이와 유사한 것으로 상층액을 제거하고 셀 펠릿이 손상되지 않도록 주의하십시오.
- 펠릿을 1mL의 DPBS에 재현탁시키고 DPBS를 25mL 표시까지 합산합니다. 다시 한 번 세척을 반복한 다음 다음 단계에 적합한 매체에 다시 현탁시킵니다.
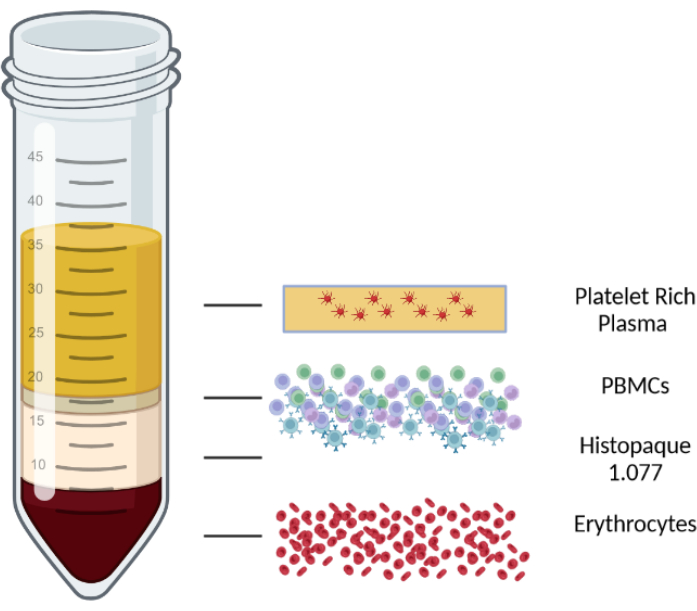
그림 1: 다양한 층을 설명하기 위한 밀도 구배 원심분리의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 냉동 보존
- 냉동 용기를 4°C로 식히고 FBS를 얼음 위에서 식힙니다.
- PBMC 펠릿을 FBS 1mL에 재현탁하여 1mL 피펫으로 FBS는 실온에 있어야 합니다.
- DMSO를 얼음 1:5, 최종 농도 20% DMSO에서 사전 냉각된 FBS와 혼합한 다음 FBS: DMSO 혼합물을 다시 얼음 위에 놓습니다. 항상 용액을 신선하게 준비하십시오.
- FBS의 PBMC 세포 현탁액을 라벨이 잘 부착된 2mL 극저온 튜브로 옮깁니다. 수집 튜브당 하나의 cryotube를 사용하십시오. mL당 1 x 107 과 5 x 107 사이의 세포 수를 조정합니다. 자동화된 세포 계수기를 사용하여 세포 수와 생존율을 측정하십시오.
- FBS: DMSO 혼합물 1mL를 1mL 피펫과 함께 s당 약 1-2방울씩 튜브에 적가합니다. 적하 첨가는 지속적이고 일관된 혼합으로 이어집니다.
- 예냉된 냉동 용기에 튜브를 넣습니다. 냉동 용기를 -80°C 냉동실에 24시간 동안 넣습니다. 냉동 용기는 분당 -1°C의 제어된 냉각을 제공합니다.
- -80°C 냉동실에서 튜브를 꺼냅니다. 냉동실에서 꺼낸 후 액체 질소의 기체 상태에 튜브를 보관하십시오. 각 샘플의 위치를 문서화합니다.
4. 해동
- 필요한 모든 용액 준비: 50mL의 FBS 및 페니실린 50U/mL, 스트렙토마이신 50U/mL가 포함된 세포 배양 배지 RPMI 1640. 이 용액은 3°C에서 최대 2개월 동안 보관할 수 있습니다.
- 세포 배양 배지를 37°C로 예열합니다. 3mL의 예열 세포 배양 배지를 멸균 50mL 코니컬 튜브에 추가합니다.
- 액체 질소 탱크에서 샘플을 제거합니다. 37°C의 수조에서 샘플을 약 3.5분 동안 해동하고 마지막 얼음이 녹는 즉시 수조에서 제거합니다. 핀헤드 크기의 얼음 조각이 튜브에 여전히 보여야 합니다.
참고: DMSO는 PBMC가 가능한 한 빨리 작동하는 데 해롭습니다. - cell:FBS:DMSO 혼합물을 1mL 피펫과 함께 cryotube에서 제거합니다. 준비된 50mL 튜브에서 PBMC 샘플을 세포 배양 배지와 혼합합니다. 5mL의 배양 배지로 2mL, 2mL, 1mL의 3단계로 튜브를 세척합니다.
- 배지를 튜브로 옮깁니다. 이것은 가능한 세포 잔기를 전달하기 위해 수행됩니다. 실온에서 100 x g 에서 10분 동안 원심분리합니다.
- 상층액을 버리고 계획된 사용에 적합한 배지 1mL를 추가합니다. 세포는 후속 실험을 위한 준비가 되었습니다.
참고: 그러나 신선 또는 냉동 세포에 대한 기능 테스트의 경우 림프구 분리 배지 기반 분리 또는 세포 해동 후 인큐베이터에서 휴지기(일반적으로 하룻밤)가 권장되는 경우가 많습니다.
5. 세포 배양
- 분리 또는 해동 후 배양 세포를 37°C에서 밤새 5% CO2/95% 공기에서 해동합니다.
- 10% FBS, 페니실린 50U/mL, 스트렙토마이신 50U/mL가 보충된 RPMI 배지 1mL에 세포를 재현탁시킵니다. 추가 사용을 위해 많은 가능성이 있으며 분석에 필요한 세포를 처리하십시오.
- 일반 보관의 경우 멸균 6웰 세포 배양 플레이트를 사용하고 휴식 기간 후 세포를 수확합니다. 1mL 피펫과 함께 1mL의 세포 현탁액을 웰에 옮기고 4mL의 세포 배양 배지를 추가합니다.
참고: 분리된 PBMC의 양은 개인마다 크게 다르며, 5mL의 세포 배양 배지가 있는 웰 1개면 분리된 혈액 8mL당 충분합니다. 그러나 버피 코트에서 PBMC를 분리할 때 PBMC의 양은 전혈 샘플보다 훨씬 많으므로 세포를 여러 개의 웰로 나누어야 합니다. - 세포를 37 ° C에서 5 % CO2 가 보충 된 가습 된 분위기에서 24 시간 동안 그대로 두십시오. 이 배양은 갓 분리된 세포와 냉동 보존된 세포에 대해 수행됩니다.
6. ATP 분석
- 10% FBS, 페니실린 50U/mL, 스트렙토마이신 50U/mL가 보충된 RPMI 배지 1mL에 해동된 PBMC를 재현탁시킵니다.
- 샘플을 채취하여 세포 수를 결정한 다음 트리판 블루로 생사체를 감별합니다. 재현탁 세포에서 10μL를 추출하여 90μL 세포 배양 배지와 혼합합니다. 그런 다음 10μL를 트리판 블루 10μL와 섞습니다. 세포를 세포 계수 챔버 또는 자동 세포 카운터에 놓고 살아있는/죽은 세포의 수를 결정합니다.
- 웰당 1 x 105 cells/100 μL의 밀도로 100 μL의 세포를 96웰 백색 폴리스티렌 플레이트에 플레이트합니다.
- 세포를 37 ° C에서 5 % CO2 가 보충 된 가습 된 분위기에서 24 시간 동안 그대로 두십시오.
- ATP 분석으로 ATP 농도를 측정합니다.
- ATP와 루시페린이 결합할 때 발생하는 발광을 사용합니다. 방출된 빛은 플레이트 리더로 평가할 수 있습니다. 인큐베이터용 플레이트를 제거하여 실온으로 15분 동안 식힙니다. 세포를 용해하고 5분 동안 그대로 둡니다. 그런 다음 세포에 모니터링 시약을 바르고 제조업체의 지침에 따라 측정합니다. ATP 수준을 결정하기 위해 내부 표준이 사용됩니다.
7. 고해상도 호흡 측정
- 고해상도 산소 그래프를 켜고 30분 동안 예열합니다.
- 그림 1에 설명된 프로토콜에 따라 세포를 처리합니다. 표 1과 같이 필요한 모든 재고를 준비합니다.
- 2.1mL의 호흡 완충액(표 1)을 두 고분해능 산소 그래프 챔버에 피펫팅하고 37°C에서 챔버(750rpm)에 있는 자석 교반 막대를 사용하여 폴라로그래픽 산소 센서의 안정적인 산소 플럭스 신호가 얻어질 때까지 30분 동안 완충액을 계속 교반합니다.
알림: 산소 그래프의 챔버에서 실시간 산소 소비량(플럭스)과 챔버의 산소 포화도는 폴라로그래픽 산소 전극을 사용하여 측정됩니다. 배경 소음을 방지하고 신뢰할 수 있는 결과를 보장하기 위해 배경 보정을 수행해야 합니다. - 제조업체의 프로토콜23에 따라 폴라로그래픽 산소 센서의 공기 보정을 수행합니다.
- 분리된 PBMC를 1mL의 미토콘드리아 호흡 배지(MIR05, 조성물이 표 1에 나타냄)에 재현탁시키고, 8 x 106 cells/mL로 희석한다.
- 공기 보정 후 산소 그래프 챔버에서 호흡 배지를 흡입하고 호흡계의 각 캠버에 2.1mL의 세포 현탁액을 추가합니다. 측정 중에 챔버를 재산소화하는 데 필요한 경우( 그림 2의 h 지점에서 개방 참조) 챔버의 산소 포화도가 100μM 아래로 떨어지지 않아야 합니다.
- 스토퍼를 삽입하여 챔버를 닫으면 챔버는 2.0mL 용량을 담을 수 있도록 설계되었습니다. 떠오르는 세포 현탁액을 흡인합니다.
- 37°C에서 챔버에 있는 자석 교반기(750rpm)와 셀 현탁액을 지속적으로 혼합합니다. 안정적인 신호가 나올 때까지 약 20분 동안 기다리십시오. 내인성 호흡을 결정합니다( 그림 2의 (a)).
- 호흡 사슬의 다양한 복잡한 활동을 확인하려면 스토퍼의 티타늄 주입 포트를 통해 미토콘드리아 호흡을 위한 기질과 억제제를 주입합니다. 챔버에서 다음 최종 농도를 사용하십시오.
- 세포막을 파괴하려면 챔버 스토퍼의 티타늄 주입 포트를 통해 5μL의 8.1mM 디지토닌을 추가하여 미토콘드리아 막이 손상되지 않은 상태에서 그림 2 의 미성숙한 기질(b)을 제거합니다.
- 챔버 스토퍼의 주입 포트를 통해 2M 글루타메이트 기질과 800mM 말레이트를 추가하고 안정적인 신호에 도달할 때까지 호흡을 기록합니다. 신호는 2-4분 후에 안정화됩니다.
알림: 피루브산과 같은 추가 기질을 사용할 수도 있습니다. - 챔버 스토퍼의 주입 포트를 통해 8μL의 500mM 아데노신 이인산염(ADP)을 추가하고 안정적인 신호에 도달할 때까지 호흡을 기록합니다. 신호는 그림 2에서 2-4분(d) 후에 안정화됩니다.
- 챔버 스토퍼의 주입 포트를 통해 20μL의 1M 숙시네이트를 추가하고 안정적인 신호에 도달할 때까지 호흡을 기록합니다. 신호는 그림 2에서 2-4분(e) 후에 안정화됩니다.
- 적정 1M 카르보닐 시안화물 p-트리플루오로메톡시 페닐히드라존(FCCP)을 0.5μL에서 더 이상 증가하지 않는 지점까지 단계적으로 적정합니다. 그림 2의 신호(f)가 안정화될 때까지(f) 2-2분 동안 기다립니다. 호흡이 더 이상 증가하지 않으면 다음 단계를 계속하십시오.
주의 : FCCP는 인체에 대한 건강상의 위험이 있으므로 취급할 때 주의하십시오. - 챔버 스토퍼의 주입 포트를 통해 5μL의 0.1mM 로테논을 추가하고 안정적인 신호에 도달할 때까지 호흡을 기록합니다. 신호는 그림 2에서 2-4분(g) 후에 안정화됩니다.
주의 : 로테논은 인간의 건강에 위험이 있으므로 취급 시 주의하십시오. - 챔버 스토퍼의 주입 포트를 통해 1μL의 4mg/mL 올리고마이신을 추가하고 안정적인 신호가 나올 때까지 호흡을 기록합니다. 신호는 그림 2에서 2-4분(h) 후에 안정화됩니다.
주의: 올리고마이신은 인체에 위험을 초래하는 독극물이므로 취급 시 주의하십시오. - 챔버 스토퍼의 주입 포트를 통해 5mM 안티마이신 A 1μL를 추가하고 안정적인 신호가 나올 때까지 호흡을 기록합니다. 신호는 그림 2에서 2-4분(i) 후에 안정화됩니다.
주의: 항마이신 A는 인체에 위험을 초래하는 독극물이므로 취급할 때 주의하십시오. - 산화적 인산화에 관여하지 않는 효소의 산소 소비량을 배제하기 위해 실행을 평가할 때 다른 모든 측정값에서 항마이신 A 값을 뺍니다.
- 200mM N,N,N',N'-테트라메틸-p-페닐렌디아민 디하이드로클로라이드(TMPD, 전자 공여체)와 800mM 아스코르브산염을 첨가하여 TMPD를 환원 상태로 유지합니다. 챔버 스토퍼의 주입 포트를 통해 기판을 주입하고 안정적인 신호에 도달할 때까지 호흡을 기록합니다. 신호는 그림 2에서 2-4분(j) 후에 안정화됩니다.
- TMPD는 자동 산화될 수 있으므로 복합체 IV의 측정값에서 결과 산소 소비량을 뺍니다.
- 챔버 스토퍼의 주입 포트를 통해 NaN3 ≥ 100mM을 추가하고 안정적인 신호에 도달할 때까지 호흡을 기록합니다. 신호는 복잡한 IV 활성을 억제하기 위해 2-4분 후에 안정화되며 TMPD 자가산화만 남습니다.
주의 : 아지드화나트륨은 인체에 위험을 초래하는 독극물이므로 취급 시 주의하십시오.
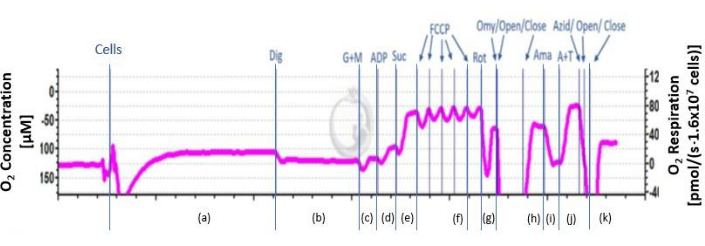
그림 2: O2 플럭스의 개략도. 산소 플럭스의 개략도가 표시됩니다. 곡선은 a-k에서 억제제와 기질을 첨가한 후 여러 단계로 나뉩니다. A: 내인성 호흡; b: 투과화된 세포; c: 결합되지 않은 복합체 I 호흡; d: 결합 복합체 I 호흡; e: 옥스포스 ; f: CI 및 CII의 최대 비결합 활성; g: 복합체 II의 결합되지 않은 호흡; H: 누출 호흡; i: 잔류 호흡; j: TMPD의 CIV(U) 비결합 호흡 및 자가산화; k: TMPD의 자가산화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 구연산염 합성 효소 활동
- 시트레이트 합성효소 활성을 별도의 파라미터로 측정하고 이를 사용하여 고분해능 산소 그래프의 측정값을 정규화합니다.
- 분리된 PBMC를 1mL의 미토콘드리아 호흡 배지(MIR05)에 재현탁시키고 8 x 106 cells/mL로 희석합니다.
- 액체 질소에서 얼린 후 실험이 수행되거나 신선한 세포를 측정할 때까지 -80°C에서 보관합니다.
- 필요한 모든 용액을 준비하십시오 : 0.1 M 트리에탄올 아민 HCl 완충액 pH 8.0, 1.0 M Tris-HCl 완충액 pH = 8.1, 10 % Triton X-100, 10 M 트리에탄올 아민 HCl 완충액 pH 8.0의 10 mM 옥살 아세테이트, 1.01 M Tris-HCl 완충액 pH = 8.1의 1.0 mM DTNB, 이중 증류 된 H2O의 아세틸 -CoA 12.2 mM.
- 5,5'-디티오-비스-(2-니트로베조산)(DTNB; 0.1 mM), 아세틸 코엔자임 A(0.31 mM), EDTA(50 μM), 트리에탄올아민 HCl(5 mM) 및 트리스 HCl(0.1 M)을 함유하는 반응 배지(표 1)를 제조한다.
- 이중 증류된H2O에 용해된 0.5mM 옥살로아세테이트로 시작 시약(표 1)을 준비합니다.
- 시트레이트 합성효소가 너무 빨리 해동되면 불안정하므로 샘플을 얼음에서 해동하십시오.
- 40μL의 샘플을 얼음 위의 96웰 플레이트에 추가한 후 멀티피펫으로 110μL의 반응 배지를 추가합니다.
- 반응 배지를 데우고 인큐베이터에서 30°C로 5분 동안 시료를 채취합니다. 수조에서 시약을 30°C로 5분 동안 데웁니다.
- 멀티피펫을 사용하여 시작 시약 50μL를 각 웰에 추가합니다. 플레이트 리더를 통해 412nm 파장의 30°C에서 20분 동안 흡광도를 측정합니다.
결과
세포 생존율 및 수
성공적인 분리 및 동결 보존을 달성하려면 세포 수와 생존율이 최대한 높아야 합니다. 냉동 보존 전후에 세포를 계수하고 세포의 건강과 품질을 보장하기 위해 생존율을 결정합니다. 그림 3 은 냉동 보존 전과 후의 PBMC를 대표적으로 나타낸 것으로, 세포 수와 생존율은 거의 차이가 없습니다. 이는 PBMC의 성공적인 격리 및 보존을 나타냅니다....
토론
이 프로토콜은 생체 에너지 분석에 적합한 방식으로 인간 혈액에서 말초 혈액 단핵 세포(PBMC)를 분리하고 동결 보존하는 수단을 제공합니다. 설명된 방법은 PBMC를 부드럽게 대량으로 분리할 수 있는 가능성을 제공하며, 높은 생존율과 생체 에너지 측정을 위한 충분한 세포를 제공합니다. 최소한의 중단에도 긴 분리가 발생하지만 후속 동결 보존을 통해 생체 에너지학의 시간 독립적인 측정이 가능...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
혈액 채취에 대해 Giessen-Marburg 대학병원의 임상팀에 감사드립니다. 이 작업은 Justus Liebig 대학에서 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.1 M Triethanolamine-HCl-Buffer (pH = 8,0) | Self-prepared | - | |
| 0.5 M Triethanolamine-HCl-Buffer | Self-prepared | - | |
| 1.0 M Tris-HCl-Buffer (pH = 8,1) | Self-prepared | - | |
| 1.01 mM DTBB | Self-prepared | - | |
| 10 % Triton X-100 | Self-prepared | - | |
| 10 mM Oxalacetat | Self-prepared | - | |
| 14–20 G sterile blood draw needles Multi Adapter Sarstedt Safety-Multifly | Sarstedt | 156353_v | |
| 37% HCl | Carl Roth GmbH & Co. KG | - | |
| 70% Ethanol (EtOH) | Self-prepared | - | |
| Acetyl-CoA | Pancreac Applichem | A3753 | |
| ADP | Sigma-Aldrich | A5285 | |
| Alcohol wipes | (70% isopropyl alcohol) | ||
| Antimycin A | Sigma-Aldrich | A8674 | |
| Aqua (bidest.) | With MilliQ Academic (self-made) | - | |
| Ascorbate | Sigma-Aldrich | A4034 | |
| ATP-Standard | Sigma-Aldrich | 6016949 | |
| Biocoll Seperating Solution | Biochrom | 6115 | |
| Biological safty cabinet MSC Advantage | Thermo Fisher Scientific Inc. | ||
| Carbonylcyanid-p-trifluoromethoxy-phenylhydrazon (FCCP) | Sigma-Aldrich | C2920 | |
| Cell counter TC20 Automated Cell Counter | Bio-Rad | ||
| Centrifuge Heraeus Megafuge 16 R | Thermo Fisher Scientific Inc. | ||
| Counting slides, dual chamber for cell counter | Bio-Rad | 1450016 | |
| Cryotube Cryo.S | Grainer Bio-One | 126263-2DG | |
| Digitonin | Sigma-Aldrich | 37008 | |
| Dimethylsulfoxid (DMSO) | Merck | 102952 | |
| Disinfection spray | |||
| Disposable gloves latex, rubber, or vinyl. | |||
| Distrips (12.5 ml) DistriTips | Gilson | F164150 | |
| Dulbecco’s Phosphate Buffered Saline (DPBS; 10x) | Gibco (Thermo Scientific) | 15217168 | |
| Ethanol (EtOH 100%) | Carl ROTH GmbH & Co. KG | 9065.3 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F9665 | |
| Frezer (-80°C) | Thermo Fisher Scientific Inc. | ||
| Glutamate | Sigma-Aldrich | G1626 | |
| Holder/adapter | |||
| Incubator Midi 40 CO2 | Thermo Fisher Scientific Inc. | ||
| Injection syringe | Hamilton | ||
| Malate | Sigma-Aldrich | M-1000 | |
| MIR05 | Self-prepared | - | |
| Mr. Frosty Freezing Container | Thermo Fisher Scientific Inc. | 10110051 | |
| Multireader CLARIOstar | BMG Labtech | ||
| Nitrogen tank Locator 6 plus | Thermo Fisher Scientific Inc. | ||
| Oligomycin | Sigma-Aldrich | O4876 | |
| Oxalacetate | Sigma-Aldrich | - | |
| Oxygraph-2k | Orobororus Instruments | ||
| Penicillin-Streptomycin | PAA | 15140122 | |
| Pipettes Performance Pipettor 10 μL, 100 μL, 1000 μL | VWR | ||
| Roswell-Park. Memorial-Institute-Medium (RPMI-1640) | Gibco (Thermo Scientific) | 11530586 | |
| Rotenone | Sigma-Aldrich | R8875 | |
| Saccharose | Carl ROTH GmbH & Co. KG | 9286.2 | |
| Sodium azide | Sigma-Aldrich | S2002 | |
| Succinate | Sigma-Aldrich | S2378 | |
| Tetramethylphenylendiamin (TMPD) | Sigma-Aldrich | T3134 | |
| Tourniquet/ Blood pressure cuff | |||
| Tris(hydroxymethyl)amino-methane | Sigma-Aldrich | 108382 | |
| Triton X-100 | Sigma-Aldrich | 108643 | |
| Trypanblau | Biochrom | T6146 | |
| Vacuum pump | Vaccubrand GmbH & Co. | ||
| ViewPlate-96 | Perkin Elmer | 6005181 | |
| Water bath WNB22 | Memmert GmbH & Co. KG |
참고문헌
- Mancuso, M., et al. Mitochondria, cognitive impairment, and Alzheimer's disease. Int J Alzheimers Dis. 2009, 951548 (2009).
- Haas, R. H. Mitochondrial dysfunction in aging and diseases of aging. Biology. 8 (2), 48 (2019).
- Kleiveland, C. R., Verhoeckx, K., Cotter, P., Lopez-Exposito, I., et al. Peripheral blood mononuclear cells. The Impact of Food Bioactives on Health. In Vitro and Ex Vivo Models. , (2015).
- Silaidos, C., et al. Sex-associated differences in mitochondrial function in human peripheral blood mononuclear cells (PBMCs) and brain. Biol Sex Differ. 9 (1), 34 (2018).
- Acin-Perez, R., Benincá, C., Shabane, B., Shirihai, O. S., Stiles, L. Utilization of human samples for assessment of mitochondrial bioenergetics: Gold standards, limitations, and future perspectives. Life. 11 (9), 949 (2021).
- Schindowski, K., et al. Impact of aging. NeuroMol Med. 4 (3), 161-177 (2003).
- Migliore, L., et al. Searching for the role and the most suitable biomarkers of oxidative stress in Alzheimer's disease and in other neurodegenerative diseases. Neurobiol Aging. 26 (5), 587-595 (2005).
- Leutz, S., et al. Reduction of trophic support enhances apoptosis in PC12 cells expressing Alzheimer’s APP mutation and sensitizes cells to staurosporine-induced cell death. J Mol Neurosci. 18 (3), 189-201 (2002).
- Leuner, K., et al. Peripheral mitochondrial dysfunction in Alzheimer’s disease: Focus on lymphocytes. Mol Neurobiol. 46 (1), 194-204 (2012).
- Leuner, K., et al. Enhanced apoptosis, oxidative stress and mitochondrial dysfunction in lymphocytes as potential biomarkers for Alzheimer’s disease. J Neural Transm Suppl. 2007 (72), 207-215 (2007).
- Kartika, R., Wibowo, H., Purnamasari, D., Pradipta, S., Larasati, R. A. Altered Indoleamine 2,3-Dioxygenase production and its association to inflammatory cytokines in peripheral blood mononuclear cells culture of type 2 diabetes mellitus. Int J Tryptophan Res. 13, 1178646920978236 (2020).
- Cortez-Espinosa, N., et al. CD39 expression on Treg and Th17 cells is associated with metabolic factors in patients with type 2 diabetes. Hum Immunol. 76 (9), 622-630 (2015).
- Mahmoud, F., et al. Effect of Diabetea tea ™ consumption on inflammatory cytokines and metabolic biomarkers in type 2 diabetes patients. J Ethnopharmacol. 194, 1069-1077 (2016).
- Volman, J. J., Ramakers, J. D., Plat, J. Dietary modulation of immune function by β-glucans. Physiol Behav. 94 (2), 276-284 (2008).
- Reddy, M., Eirikis, E., Davis, C., Davis, H. M., Prabhakar, U. Comparative analysis of lymphocyte activation marker expression and cytokine secretion profile in stimulated human peripheral blood mononuclear cell cultures: an in vitro model to monitor cellular immune function. J Immunol Methods. 293 (1), 127-142 (2004).
- Otaegui, D., et al. Differential micro RNA expression in PBMC from multiple sclerosis patients. PLoS One. 4 (7), e6309 (2009).
- Geltink, R. I. K., Kyle, R. L., Pearce, E. L. Unraveling the complex interplay between T cell metabolism and function. Annu Rev Immunol. 36, 461-488 (2018).
- Fox, C. J., Hammerman, P. S., Thompson, C. B. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol. 5 (11), 844-852 (2005).
- Li, P., et al. Mitochondrial respiratory dysfunctions of blood mononuclear cells link with cardiac disturbance in patients with early-stage heart failure. Sci Rep. 5, 10229 (2015).
- Weiss, S. L., et al. Mitochondrial dysfunction in peripheral blood mononuclear cells in pediatric septic shock. Pediatr Crit Care Med. 16 (1), e4-e12 (2015).
- Higdon, L. E., Lee, K., Tang, Q., Maltzman, J. S. Virtual global transplant laboratory standard operating procedures for blood collection, PBMC isolation, and storage. Transplant Direct. 2 (9), e101 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Curr Pathobiol Rep. 7, 17-27 (2019).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer’s disease: recent advances. Mol Neurodegener. 15 (1), 30 (2020).
- Chaturvedi, R. K., Flint Beal, M. Mitochondrial diseases of the brain. Free Radic Biol Med. 63, 1-29 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유