Method Article
חקירת אינטראקציות חיידקיות-פטרייתיות באמצעות עמודות כביש מהיר פטרייתיות בסביבות ומצעים מגוונים
In This Article
Summary
פרוטוקול זה מספק הוראות מפורטות כיצד לבנות, לעקר, להרכיב, לנצל ולעשות שימוש חוזר בעמודי הכביש המהיר הפטרייתי כדי להעשיר זוגות חיידקים-פטריות המקיימים אינטראקציה דרך כבישים מהירים פטרייתיים ממצעים סביבתיים מגוונים.
Abstract
אינטראקציות חיידקיות-פטרייתיות (BFIs) ממלאות תפקיד אינטגרלי בעיצוב הרכב הקהילה המיקרוביאלית, פונקציות ביוגיאוכימיות, דינמיקה מרחבית ופיזור מיקרוביאלי. רשתות תפטירים שנוצרו על ידי פטריות חוטיות או מיקרואורגניזמים חוטיים אחרים (למשל, Oomycetes) פועלות כ'כבישים מהירים פטרייתיים' שיכולים לשמש חיידקים להובלה בסביבות הטרוגניות, מה שמקל מאוד על הניידות שלהם ומעניק להם גישה לאזורים שעשויים להיות מאתגרים או בלתי אפשריים להגיע אליהם בעצמם (למשל, בגלל כיסי אוויר בתוך האדמה). מספר מכשירים ופרוטוקולים ניסיוניים נוצרו כדי לחקור את הכבישים המהירים הפטרייתיים האלה, כולל עמודי כבישים מהירים פטרייתיים. עמוד הכביש המהיר הפטרייתי שתוכנן על ידי הקבוצה שלנו יכול לשמש למגוון יישומים באתרם או במבחנה , כמו גם עם סוגי דגימות סביבתיים ומארחים. כאן אנו מתארים את השיטות לביצוע ניסויים בעמודות אלו, כולל תכנון, הדפסה, עיקור והכנת המכשירים. האפשרויות לניתוח נתונים המתקבלים מהשימוש במכשירים אלה נדונות גם כאן, ומוצע ייעוץ לפתרון בעיות לגבי מלכודות פוטנציאליות הקשורות לניסויים באמצעות עמודי כביש מהיר פטרייתיים. ניתן להשתמש במכשירים אלה כדי להשיג הבנה מקיפה יותר של המגוון, המנגנונים והדינמיקה של BFIs בכבישים מהירים פטרייתיים כדי לספק תובנות חשובות לגבי הדינמיקה המבנית והתפקודית בסביבות מורכבות (למשל, קרקעות) ועל פני בתי גידול מגוונים שבהם חיידקים ופטריות מתקיימים זה לצד זה.
Introduction
אינטראקציות חיידקיות-פטרייתיות (BFIs) חשובות ביותר בעיצוב התכונות המבניות, המרחביות והתפקודיות של מיקרוביום סביבתי. לדוגמה, צמיחה והתרחבות של פטריות חוטיות או מיקרואורגניזמים חוטיים אחרים דמויי פטריות יוצרת רשת ביולוגית שיכולה לתפקד כ'כביש מהיר' כדי להקל על תנועתם של מיקרואורגניזמים אחרים, כגון חיידקים. הטרוגניות ורוויה לא עקבית בתוך מצעים סביבתיים עלולים לעכב את תנועתיות החיידקים; עם זאת, חיידקים יכולים להשתמש בכבישים המהירים האלה כדי להקל על הגישה לאזורים נוספים בסביבה 1,2. אינטראקציות אלו הן קריטיות להבנת הדינמיקה המרחבית של קהילות מיקרוביאליות. מספר טכניקות ושיטות שימשו לבחינת כבישים מהירים פטרייתיים, אולם הם מוגבלים במידה רבה לחקירות מבוססות מעבדה 3,4.
בשיטה אחת מבוססת צלחת, קטע גדול של אגר מוסר מאמצע צלחת הפטרי, ויוצר פער בין שני איי אגר. קורים פטרייתיים יכולים לחצות את הפער הזה, ולספק את האמצעים לחיידקים תואמים לעבור מאי אגר אחדלמשנהו. שיטות אחרות של צלחת פטרי מותאמות כוללות צלחות הפוכות שבהן אדמה מונחת במכסה כך שקורים פטרייתיים יכולים לצמוח אנכית וליישב את המדיה ללא מגע ישיר, ומספקים את האמצעים להובלת חיידקים 5,6. ניתן להשתמש בשיטה מבוססת טיפות מצע גידול שפותחה לאחרונה כדי להעריך הובלה סלקטיבית של חיידקים לעבר פרופילים תזונתיים מסוימים7. מכשירי גשר ושבילים חיידקיים שימשו גם כדי לחקור את ההשפעה של גורמים אביוטיים על תנועת חיידקים8. למרות שנעשה שימוש במספר שיטות וטכניקות לחקירת כבישים מהירים פטרייתיים, נותר צורך במכשירים סטנדרטיים השומרים על מיקרו-סביבה סטרילית תוך קידום הקמת כבישים מהירים פטרייתיים ממצעים סביבתיים מורכבים כגון גללים, אדמה וריזוספרות.
הקבוצה שלנו עיצבה גרסה מודפסת בתלת-ממד של עמודי כבישים מהירים פטרייתיים שבהם פטריות יכולות להעביר חיידקים מקצה אחדלקצה השני. התקנים אלה מורכבים מארבעה רכיבים מודפסים: העמוד עצמו עם צורת שעון חול ומבנה סריג פנימי מורכב, טבעת הברגה ושני מכסים (מכסה גדול וכובע קטן), כמו גם חתיכת רשת ניילון מעוקרת (איור 1). העמוד המורכב מתווסף ישירות למצע הסביבתי הרצוי. לאחר מכן העמודה מאפשרת לחיידקים ליישב פקק מדיום גידול אגר המכונה תקע המדיה 'פיתיון' שנמצא בתחתית העמודה ובמגע עם המצע הסביבתי דרך הרשת. פיסת רשת ניילון זו אינה כוללת שוכני אדמה אחרים שיכולים להעביר חיידקים, ובכך להגביל את תנועת החיידקים בתוך העמודים לכבישים מהירים פטרייתיים. לאחר שהפקק הזה התיישב, פטריות חוטיות יכולות להתרחב ולצמוח דרך הסריג הפנימי במרכז העמוד שנועד ליצור מערכת בלתי רוויה הדומה לאדמה (או מדיה בלתי רוויה אחרת) ולמזער זיהום פוטנציאלי ממדיום הפיתיון. לאחר מכן הפטריות גדלות לעבר פקק מדיום המטרה בחלק העליון של העמוד ומתיישבות בו. ניתן לחסן עמודות עם מבודדים פטרייתיים ספציפיים כדי לבחון את יכולתן להעביר חיידקים, או להשאיר אותן ללא חיסון כדי לזהות אילו פטריות מהמצע מסוגלות להעביר חיידקים. אורגניזמים המגיעים למדיום היעד יכולים לעבור תרבית נוספת, לבודד ולעבור ניתוחי ריצוף (מתרבויות טהורות או מקהילות מעורבות המשתמשות בגישות ריצוף אמפליקון או מטגנומי). בסך הכל, העמודות מספקות שיטה סטנדרטית, ניתנת לשחזור, לשימוש חוזר ואינטואיטיבית לחקירת כבישים מהירים פטרייתיים במצעים מגוונים. מכשירים אלה יכולים לשמש למחקר וככלי הוראה בכיתה, וכאן אנו מספקים שלבי הוראה לשימוש בהם על סמך ניסויים שבוצעו בעבר. למרות ששיטה זו מקלה על סטנדרטיזציה של פרוטוקולים, ניתן לשנות את התכנון והבנייה של ההתקנים עבור יישומים אחרים ומצעים נוספים.
Protocol
פרטי הריאגנטים והציוד המשמש במחקר מפורטים בטבלת החומרים.
1. שינוי עיצוב העמודה, החומרים והפרמטרים
- הורד את עיצובי העמודות הזמינים לציבור9 והשתמש בהם כפי שהם או שנה את עיצובי העמודות בתוכנת עיצוב בעזרת מחשב (CAD) תואמת.
- השג שרף מדריך כירורגי שיניים או בחר חומר הדפסת תלת מימד חלופי, כגון שרפים שקופים רגישים לאור אחרים.
- התאם את מפרט העמודה לפי הצורך אם מדפסת התלת מימד שנבחרה, טכנולוגיית הדפסת תלת מימד או חומר הדפסת תלת מימד משתנים ממה ששימש בעבר9.
2. 3D הדפסת העמודות
- הגדר את פרמטרי ההדפסה לשימוש בעובי פרוסה של 0.05 מ"מ וזמן חשיפה של 0.8 שניות, או התאם את פרמטרי ההדפסה בהתאם למדפסת, לחומר ההדפסה ולתוכנת ההדפסה שנבחרו.
- הדפיסו את עמודי הכבישים המהירים של הפטרייה, את טבעות ההברגה ואת המכסים באמצעות מדפסת תלת-ממד תואמת (איור 1).

איור 1: רכיבים של עמודת הכביש המהיר של הפטרייה. (A,B) מבט עליון וצדדי של הכובע הקטן, טבעת ההברגה והכובע הגדול (משמאל לימין). (ג,ד) מבט למעלה ולצדדים של הכובע הקטן. (ה,ו) מבט למעלה ולצדדים של טבעת הברגה. (ז,ה) מבט למעלה ולצדדים של הכובע הגדול. (I) חתיכת מסנן רשת ניילון (25 מיקרומטר) המונחת בקצה העמודה, ומוכנסת לתוך המצע הסביבתי כדי למנוע כניסת מיקרופאונה לעמודה. (י) טור לא מורכב. (K) עמודה מורכבת: קצה ה'פיתיון' נכנס לתוך המצע, וקצה ה'מטרה' נשאר חשוף ומחוץ למצע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
3. ניקוי רכיבי העמודה המודפסים בתלת מימד
- טבלו את העמודים, הכובעים והטבעות המושחלות המודפסות ב-99% אלכוהול איזופרופיל בטמפרטורת החדר למשך 15 דקות וערבבו על ידי הזזת האמבטיה קדימה ואחורה ביד למשך 10-15 שניות בכל דקה כדי להסיר עודפי שרף.
- העבירו את הרכיבים לאמבט אלכוהול איזופרופיל טרי 99%. טבלו למשך 5 דקות וערבבו ביד באותו אופן כמו בשלב 3.1.
- העבירו את הרכיבים למכשיר ניקוי קולי מלא במים טהורים, טבלו את הרכיבים וערבבו במשך 2 דקות במהירות בינונית. אין לחמם את המים. הסר את הרכיבים.
- יבש את כל הרכיבים באוויר למשך 30 דקות לפחות.
- כדי לבצע ריפוי לאחר השרף, חשוף את כל הרכיבים המודפסים בתלת מימד לאור של 405 ננומטר למשך 30 דקות ב-60 מעלות צלזיוס.
4. עיקור העמודים
- אם החומר הנבחר ניתן לחיטוי, בצע חיטוי של העמודים, טבעות הברגה, הכובעים והיריעות של מסנן רשת ניילון 25 מיקרומטר בנפרד או בתוך גדולה יותר למשך 20-30 דקות בטמפרטורה של 121 מעלות צלזיוס, 1 אטמוספירה.
הערה: רכיבי העמודה עשויים לשנות צורה וצבע לאחר חיטוי, אך הם ישמרו על תכונות החומר הרצויות. הגודל, הצורה והצבע הסופיים של רכיבי העמודה לאחר חיטוי מוצגים באיור 1.
5. הכנת מדיה לטורים
- הכינו צלחות פטרי 90 מ"מ של מדיה מבוססת אגר מעוקרת: מדיום נתרן קרבוקסימתיל צלולוז (CMC), אגר תמצית מאלט (MEA), אגר דקסטרוז תפוחי אדמה (PDA), או אגר 2A של Reasoner (R2A)9,10. הכן את המדיה בהתאם להוראות היצרן.
- עקרו את המדיה על ידי חיטוי למשך 21 דקות או הזמן המומלץ על ידי היצרן ב-121 מעלות צלזיוס, 1 אטמוספירה, ושפכו לתוך צלחות פטרי 90 מ"מ עד שהאגר קרוב לחלק העליון של דפנות צלחות הפטרי (איור 2). בצע שלב זה בארון בטיחות ביולוגי כדי להגביר את הסטריליות.
- אפשר לאגר להתמצק ולהתייבש על פי הוראות היצרן.

איור 2: תהליך הרכבה עבור עמודי הכביש המהיר של הפטרייה. באמצעות קצה פתוח של העמודה עצמה, חותכים ומכניסים תקע, והחוקר מסובב את העמודה כשהיא מוסרת מהמדיה כדי להבטיח שהתקע יישאר בקצה העמודה. הקצה הזה מכוסה בחתיכת הכובע הקטן. לאחר מכן מתווסף תקע מדיה לקצה השני של העמודה באותו אופן. לאחר מכן מניחים את חתיכת הרשת מעל קצה זה ומאובטחים בעזרת טבעת ההברגה. לאחר מכן משתמשים במכסה הגדול בקצה ה'פיתיון' הזה מעל טבעת ההברגה. הצד עם הרשת יונח במצע הסביבתי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
6. הכנת עמודי הכביש המהיר הפטרייתי
הערה: יש לבצע שלב זה בארון בטיחות ביולוגי כדי לשמור על סטריליות רכיבי העמודה והמדיה. איור 2 ממחיש את תהליך ההרכבה של עמוד הכביש המהיר הפטרייתי.
- השתמש בקצה העמודה עצמו (ללא מכסים עליו) כדי לחלץ תקע מדיה שמתאים היטב לקצה אחד של העמודה. השתמש בתנועת פיתול כאשר העמוד מורם מהמדיה כך שהאגר נשאר בקצה העמוד. לחלופין, השתמש בקצה העמודה כתבנית, חצב את המדיה והעביר אותה לעמודה באמצעות קצה פיפטה.
- לאחר הוספת התקע הראשון לסוף העמודה, הוסף את המכסה הקטן לקצה זה כדי לשמור על מיקרו-סביבה סטרילית עבור מדיית היעד.
- הפוך את העמודה וחזור על שלב 6.1 עבור הקצה השני של העמודה.
- חותכים חתיכה עגולה בקוטר 2~ ס"מ של רשת הניילון האוטוקלאבית (גודל נקבוביות של 25 מיקרומטר) באמצעות מספריים מעוקרים (איור 1). הניחו את הרשת מעל הקצה החשוף של העמוד. סובב את טבעת ההברגה על קצה אמצעי הפיתיון הזה של העמוד תוך אבטחת הרשת בתוך החוטים.
- הנח את הכובע הגדול בתחתית העמוד מעל הרשת והקצה השני של טבעת ההברגה, והשאר את המכסה הזה דולק בעת אחסון או הובלה של העמוד.
7. חיסון מראש של המצע או אמצעי הפיתיון בפטרייה מעניינת
הערה: שלב זה הוא אופציונלי.
- לחסן פטרייה מעניינת (למשל, פטרייה הידועה כיוצרת כבישים מהירים פטרייתיים) על המצע הרצוי על ידי גידול הפטרייה תחילה על מצע גידול פטרייתי מוצק (למשל, MEA, PDA; מוכן כמתואר בשלב 5) בתוך צלחת פטרי והעברת קטע קטן (~1 ס"מ) של אגר עם גידול פטרייתי גלוי למצע.
הערה: ניסויים קודמים9 השתמשו במצע גללים טרום-קולוניאלי עם Coprinopsis cinerea במשך 10 ימים לפני הוספת העמודות למצע הטרום-קולוניזציה. - במקום ליישב מראש את המצע, הוסף פטריית פיתיון לצלחת פטרי או ישירות לתחתית אמצעי הפיתיון בתוך העמודה באמצעות כמות קטנה של תפטיר פטרייתי (למשל, מהחלקה של לולאה סטרילית).
- עבור צלחת הפטרי, המתינו עד שיהיה גידול נראה לעין המכסה חלק גדול מצלחת הפטרי (בסביבות 50%-75% מהצלחת המכוסה), ואז חתמו את קטע אמצעי הפיתיון ישירות מצלחת הפטרי המושבת הקרובה ביותר לקצה החיצוני של גידול הפטרייה (כמתואר בשלב 6.1).
- בעת התיישבות ישירה מראש של אמצעי הפיתיון, המתן עד שתהיה צמיחה ברורה בכל אמצעי הפיתיון לפני הוספת העמודה למצע (סביר להניח שזה ייקח מספר ימים).
הערה: ניסויים קודמים9 השתמשו במדיה בת 14 יום שהוכנסה מראש ל-C. cinerea כאמצעי הפיתיון; זמני טרום הקולוניזציה ישתנו בהתאם לקצב הגידול של הפטרייה, סוג המדיה ותנאי הדגירה.
8. הכנת טיפולי הבקרה והשכפולים
- הכן עמודות בקרה שליליות (כמתואר בשלבים 1-6), ואל תחסן אותן ואל תניח את העמודות הללו במצע. השתמש בהם כדי לספק בסיס לניתוחים הבאים ולהעריך כל זיהום בתהליך ההכנה.
- כלול לפחות שלושה שכפולים של עמודות עבור כל ניסוי.
9. הוספת העמודה למצע
- הגדר מיקרוקוסמוס מעבדתי (למשל, אדמה בתוך קופסה, עציץ או צינור; איור 3A) או הבא את העמודות לאתר שדה מעניין.
- הסר את הכובע הגדול מתחתית העמוד כדי לחשוף את טבעת הברגה והרשת.
- הוסף את העמודה למצע המעניין (איור 3) בהתאם לשיקולים הספציפיים עבור כל סוג מצע המתוארים להלן. במידת הצורך, וכדי למזער את הנזק לרשת, צור שקע במצע באמצעות יד עטויה כפפה או כלי קטן (למשל, כף קטנה) לפני הכנסת העמוד למצע.
- גללים: העמודים שימשו בעבר בהצלחה בזבל סוסים טרי. אחסן את הגללים בטמפרטורה של 4 מעלות צלזיוס לפני השימוש והוסף לתאים, כגון קופסאות מגנטה, לפני הוספת העמודות. הכנס את העמודה למצע כדי לכסות 1-2 ס"מ מגובה העמודה הכולל.
- אדמה: הכניסו את העמודים כך שכל החלק התחתון יהיה בתוך האדמה (~1-2 ס"מ של עומק אדמה) (איור 3B). העמודים יכולים לנוח על החלק העליון של האדמה או להיקבר ממש מתחת לכובע הקטן בצד המטרה.
- ריזוספרה: הכניסו את העמודות לאדמה שמקיפה את שורשי הצמחים לפי ההוראות בשלב 9.3.2 תוך כדי זווית והצבת העמוד קרוב לשורשים מסוימים כדי להגדיל את הסיכויים ללכוד מיקרואורגניזמים בריזוספרה (איור 3C).
- מצעים בתוך צינורות: הוסף ~10 מ"ל של מצע מעניין לצינור חרוטי של 50 מ"ל או דומה והרטיב את המצע במידת הצורך (למשל, בסביבות לחות נמוכה מאוד) באמצעות מים טהורים. הכנס את העמוד לתוך הצינור כך שהתחתית תהיה קבורה ולא נראים חלקים של טבעת הברגה או הרשת (איור 3A). הברג את המכסה של צינור 50 מ"ל סגור והנח אותו במתלה צינור של 50 מ"ל כדי לשמור אותו זקוף.
10. השארת עמודה במצע
- השאירו את העמודה במצע למשך 3-21 יום.
הערה: משך הזמן שצריך להשאיר את העמודות במצעים שלהן תלוי בקצב הגידול של כל פטריות הפיתיון המשמשות, בקצב הגידול של פטריות המאכלסות את אמצעי הפיתיון ובתנאי הסביבה (למשל, תנאים יבשים מובילים לייבוש מדיה מהיר יותר ולכן לא ניתן להשתמש בהם לאורך זמן). - קבע מחזור אור/חושך רצוי לניסוי; ניסויים קודמים שמרו על העמודים בתוך המעבדה בחושך, בעוד שהעמודים בשטח היו נתונים לתנאי היום/לילה המקומיים9.
11. הוצאת העמוד מהמצע
- לאחר שהעמוד היה במגע עם המצע למשך הזמן הרצוי, הסר את העמוד, נער בזהירות את כל המצע העודף והוסף את המכסה הגדול בחזרה לתחתית העמודה מתחת לרשת כדי להעביר את העמוד.
- הניחו את העמוד בכוס סטרילית או בצינור של 50 מ"ל להובלה. שמור על העמוד זקוף במהלך ההובלה.
12. תרבית מבודדים ממדיום היעד של העמוד
- בסביבה סטרילית כגון ארון בטיחות ביולוגי, הסר את המכסה הגדול של אמצעי הפיתיון, את טבעת ההברגה ואת הרשת. השליכו את הרשת.
הערה: אם חוקר מעוניין באילו אורגניזמים התיישבו במדיום הפיתיון, בצע את שלבים 12.3-12.4 עם תקע מדיום הפיתיון בנוסף לתקע מדיום המטרה. - הסר את המכסה הקטן מקצה העמודה המכיל את מדיום היעד.
- הוצא את תקע מדיום המטרה על ידי היפוך העמוד כדי לאפשר לתקע המטרה ליפול מהעמוד, או על ידי שימוש במלקחיים מעוקרים או קצות פיפטה כדי לחלץ את התקע. הנח את תקע מדיום המטרה ישירות במרכז צלחת פטרי 90 מ"מ מלאה במדיום אגר לבחירה (כפי שהוכן בשלב 5).
הערה: ניתן להשתמש כאן במדיה פטרייתית או ספציפית לחיידקים כדי לשפר את הצמיחה של חברים משתי הממלכות; ניתן גם לחלק את התקע לשני חלקים או יותר באמצעות מספריים מעוקרים או קצה פיפטה, המאפשרים ציפוי על מספר סוגי מדיה ו/או שימור אמצעי יעד למיצוי DNA (ראה שלב 14). - דגרו את צלחת הפטרי המחוסנת בתקע המטרה הבינוני למשך 72 שעות לפחות בטמפרטורה של 25 מעלות צלזיוס בחושך.
13. תת-תרבות לבידוד מיקרואורגניזמים
הערה: שלב זה הוא אופציונלי.
- לחיידקים: באמצעות לולאת חיסון סטרילית, החלק על פני מושבה אחת מעניינת תוך מזעור המגע עם אזורים אחרים בצלחת הפטרי. פס את המושבה על צלחת פטרי טרייה בקוטר 90 מ"מ המכילה את המדיום החיידקי המועדף, כגון R2A (כפי שהוכן בשלב 5), תוך שימוש בכל שיטה המאפשרת היווצרות מושבות בודדות (למשל, פסים לארבעה אזורים). דגרו על צלחת הפטרי למשך 24-72 שעות בטמפרטורה של 25-37 מעלות צלזיוס, ובדקו אם יש צמיחת מושבה.
- לפטריות: בעזרת לולאת חיסון סטרילית, סכין גילוח סטרילי או קצה פיפטה סטרילי, חצבו קטע מינימלי (1 מ"מ2) של אגר המכיל צמיחת קור. מניחים את חתיכת האגר הקטנה על צלחת פטרי טרייה בגודל 90 מ"מ המכילה את המדיום הפטרייתי המועדף, כגון MEA או PDA, כפי שהוכן בשלב 5. דגרו על צלחת הפטרי עד שבוע בטמפרטורה של 25 מעלות צלזיוס בחושך, ובדקו מדי יום כדי למנוע צמיחת יתר.
- חזור על שלב 1 או שלב 2 לפי הצורך עד שהמורפולוגיה של האורגניזם תהיה אחידה.
14. חילוץ DNA מהצלחת או ישירות ממדיום היעד
- הקפיאו את כל פקקי האגר (מטרה ו/או פיתיון) או את החלקים שנבחרו מהעמודים בצינורות צנטריפוגה של 1.5 מ"ל בטמפרטורה של -20 מעלות צלזיוס או טבלו חלקים מהתקעים בחומר משמר בצינור צנטריפוגה של 1.5 מ"ל לפני החילוץ אם המיצוי לא יתבצע באופן מיידי.
- אם בוצעה תרבית מהמטרה ו/או מאמצעי הפיתיון, ואם ננקטו צעדי תת-תרבות עוקבים, יש להחתים או לחצוב חתיכת אגר באורך ~1 ס"מ עם גידול פטרייתי או חיידקי (או שילוב של שניהם אם לא ננקטו צעדי בידוד עוקבים).
- למיצוי מושבות חיידקים מבודדות, החלק מושבה מהצלחת באמצעות לולאת חיסון סטרילית וסובב ישירות במאגר המיצוי הקשור לערכת מיצוי ה-DNA המסחרית (שלב 14.4).
- טוחנים את נתחי האגר בנפרד בחנקן נוזלי בעזרת מכתש ועלי ומעבירים רקמת קרקע לצינורות מיצוי.
- השתמש בערכת מיצוי DNA מסחרית המותאמת לאדמה או לחיידקים ופטריות, ופעל לפי הוראות היצרן כדי לחלץ את ה-DNA (ראה טבלת חומרים).
- כמת את ה-DNA המתקבל באמצעות פלואורומטר או מערכת דומה.
15. הערכת המגוון הטקסונומי המיקרוביאלי באמצעי המטרה ו/או הפיתיון באמצעות גישות ריצוף אמפליקון או מטגנומיות
- בצע ריצוף אמפליקון (16S ו/או מרווח מתומלל פנימי [ITS]) או ריצוף מטאגנומי לפי השלבים הבאים:
- ריצוף Amplicon: הגביר את אזור הגן V3-V4 16S rRNA באמצעות הפריימרים Bakt 341F (5′-CCT ACG GGN GGC WGC AG-3′) ו-Bakt 805R (5′-GAC TAC HVG GGT ATC TAA TCC-3′). להגביר את אזור הפטרייה ITS2 באמצעות הפריימרים ITS3 KYO2 (5′-GAT GAA GAA CGY AGY RAA-3′) ו-ITS4 (5′-TCC TCC GCT TAT TGA TAT GC-3′)9.
- הכן ספריות אמפליקון באמצעות ערכות הכנת ספריות מסחריות התואמות לסיקוונסר הנבחר. רצף את המגברים באמצעות רצף קריאה קצרה כדי ליצור 150 או 250 קריאות קצה זוגיות של זוגות בסיסים עם כיסוי מספיק על ידי ביצוע הוראות יצרן פלטפורמת הריצוף לריכוז הטעינה.
- ריצוף מטאגנומי: צור ספרייה מטאגנומית מה-DNA שחולץ באמצעות ערכת הכנת ספרייה מטאגנומית זמינה מסחרית התואמת לרצף הנבחר. רצף את ספריית המטא-גנום באמצעות רצף קריאה קצרה שנקבע כדי ליצור 150 או 250 קריאות קצה זוגיות של זוגות בסיסים עם כיסוי מספיק (~10-20 Gb לכל מטא-גנום) על ידי ביצוע הוראות יצרן פלטפורמת הריצוף לריכוז הטעינה.
16. ניתוח נתוני הריצוף
- ניתוח נתוני אמפליקון: השתמש בפלטפורמת QIIME2 11 עם DADA212 כדי לנתח נתוני אמפליקון לפני הדמיית תוצאות13. בצע את השלבים הבאים כדי להפעיל את QIIME2 בפלטפורמת הביואינפורמטיקה מבוססת האינטרנט Empowering the Development of Genomics Expertise (EDGE)14. ניתן להפעיל את QIIME2 גם באמצעות מדריכים זמינים לציבור כגון המדריך "תמונות נעות" המסופק באינטרנט (https://docs.qiime2.org/2024.2/tutorials/moving-pictures/).
- נווט אל https://edgebioinformatics.org/ והתחבר או צור חשבון.
- בחר RUN QIIME2 מדף הבית. בחר העלה קבצים בשורת התפריטים השמאלית כדי להעלות קבצים מריצת רצף המגיפה.
- צור קובץ מיפוי מטא נתונים באמצעות ההוראות המסופקות כאשר ה-'i' ליד 'קובץ מיפוי מטא נתונים' מרחף מעל.
- הוסף את כל המידע הנדרש (שם פרויקט/הפעלה, סוג קריאה, פרמטרים וכו') ובחר את נתוני הקלט הנכונים שהועלו. ודא ש-DADA2 נבחר כשיטת בקרת האיכות12; ניתן להשאיר פרמטרים אחרים כערכי ברירת המחדל שלהם, אלא אם כן רוצים שינויים אחרים.
- בחר את סוג האמפליקון כ-16S Greengenes (http://greengenes.lbl.gov) עבור אמפליקונים חיידקיים או ITS פטרייתי עבור המגברים הפטרייתיים. נתח נתוני חיידקים (16S) ופטריות (ITS) באופן עצמאי.
- לחץ על שלח והמתן לסיום הריצה כדי להציג את התוצאות.
- צור תצוגות חזותיות של נתוני amplicon (אופציונלי): בצע ניתוחים נוספים של נתוני קהילה ב-R באמצעות חבילות נפוצות כגון phyloseq (https://github.com/joey711/phyloseq), VEGAN (https://github.com/vegandevs/vegan) ו-APE (https://emmanuelparadis.github.io/) בהתאם להנחיות המסופקות ב-GitHub ודרך חבילת R עזרה הזמינה ב-R Studio על ידי ניווט לתפריט חבילות , לחיצה על החבילה שהורדת והצגת התיעוד.
- ניתוח נתונים מטאגנומיים
- נווט אל אתר NMDC EDGE 15 (https://nmdc-edge.org/home) והיכנס באמצעות חשבון ORCiD (https://orcid.org/).
- בחר העלה קבצים בשורת התפריטים בצד שמאל של המסך וגרור ושחרר או אתר את קבצי ה-FASTQ הנכונים.
- בחר Metagenomics ולאחר מכן את האפשרות הפעל זרימות עבודה מרובות בשורת התפריטים בצד ימין של המסך, והגדר את כל זרימות העבודה למצב מופעל. הוסף שם פרויקט ותיאור אופציונלי.
- בחר את קבצי הקריאה הגולמיים (fastq) שהועלו ובחר את פורמט הקובץ המתאים (משולב או מזווג).
- התחל את הריצה על ידי לחיצה על שלח והצגת טבלאות הסיכום וההדמיות לאחר השלמת ההפעלה על ידי בחירת הפרויקט בכרטיסייה הפרויקטים שלי בחלק העליון של המסך.
17. יצירת הדמיות נוספות של נתוני טקסונומיה מתוצאות אמפליקון ו/או מטאגנומיות
- צור קלדוגרמות מעגליות באמצעות חבילת GraPhlan (https://github.com/biobakery/graphlan) בהתאם להוראות המופיעות ב-GitHub.
הערה: ניתן להשיג מזהי טקסונומיה (https://www.ncbi.nlm.nih.gov/taxonomy) של המרכז הלאומי למידע ביוטכנולוגי (NCBI) מהקצאות רצף מייצגות ולהעביר אותם לתוכנית 'eftech' של Entrez Direct E-utilities כדי לאסוף מידע על סיכום טקסונומיה הנדרש על ידי GraPhlAn16.
18. שימוש חוזר בעמודות
- אם העמודים עדיין מורכבים, פתח והסר את המכסים, טבעת הברגה והרשת. השליכו את הרשת. הסר את כל תקעי האגר שנותרו, שטוף את העמודים ב-99% אלכוהול איזופרופיל ומים מטוהרים, ונקה וייבש את הרכיבים כמתואר בשלבים 3.1-3.4.
- הכן יריעות חדשות של רשת ניילון לחיטוי.
- בצע אוטוקלאב של הרכיבים בהתאם להנחיות המפורטות בשלב 4.1.
תוצאות
עמוד הכביש המהיר הפטרייתי המורכב במלואו הוא באורך של כ-5 ס"מ (איור 1). אין לשבור את העמוד בשום אזור, והכובעים וטבעת ההברגה צריכים להתאים זה לזה בקלות ובחוזקה כדי ליצור מיקרו-סביבות בתוך העמודה. רשת המסנן יכולה להתרחב מעבר לטבעת ההברגה (כפי שמוצג באיור 1 ובאיור 2), או שניתן לקצץ אותה במספריים מעוקרים. תקעי האגר צריכים להתאים היטב בכל קצה העמוד. כאשר מכניסים אותה למצע, רשת המסנן צריכה לבוא במגע עם המצע, ואין לקבור את העמוד לחלוטין.
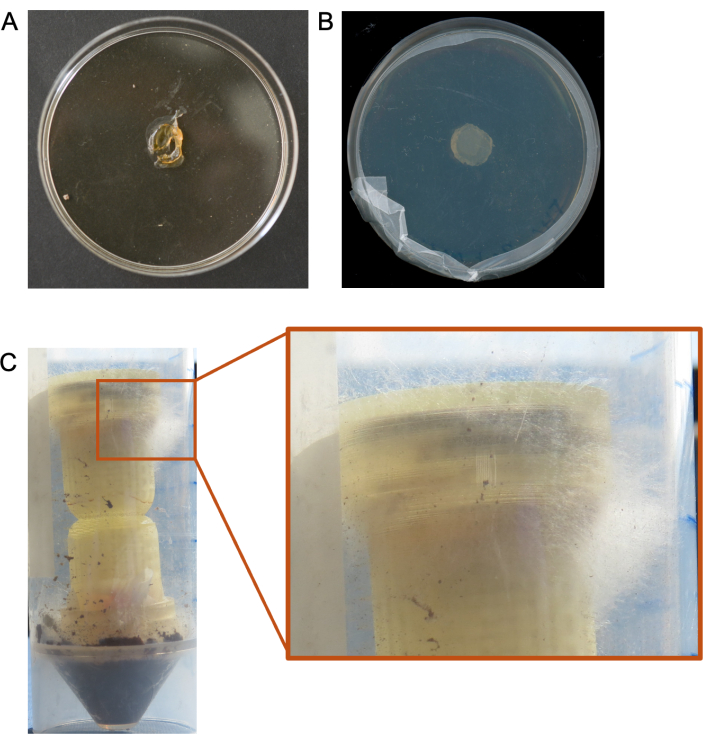
עמודות נבדקו בעבר בזבל סוסים9. העמודים הוצבו גם באדמה בתפזורת ובאדמת ריזוספרה באתר שדה מחקר, כמו גם בכמויות קטנות של אדמה בצינורות של 50 מ"ל במעבדה (איור 3). לאחר שעמודי הכביש המהיר הפטרייתיים הוסרו מהמצע ופורקו, גידול מיקרוביאלי נראה גם על הפיתיון וגם על תקעי מדיית המטרה (דוגמאות מוצגות באיור 4A). חיידקים ופטריות בודדו מאמצעי מטרה ופיתיון באמצעות טכניקות תת-תרבות (איור 4B), והמיקרובים שהיו על תקעי המדיה זוהו טקסונומית באמצעות ריצוף אמפליקונים (איור 4C,D). איור 4C,D מתאר את התוצאות המשולבות של ריצוף האמפליקון על פני ניסויים מרובים, ומראה אילו חיידקים הצליחו להגיע לתקע המדיה היעד מעמודות שנוספו לגללי סוסים9. הדמיות של נתוני חיידקים ופטריות אלה נוצרו כמתואר בשלב 17. התוצאות עשויות להיות מוצגות גם כשפע יחסי של טקסונים.
תוצאות לא אופטימליות הושגו במקרים שבהם העמודות נוספו לסביבות לחות נמוכות במיוחד, ותקעי המדיה התייבשו לחלוטין תוך ימים ספורים, מה שהוביל לאי התאוששות של מיקרובים מושבים (איור 5A). ראינו גם מקרים שבהם מיקרובים פשוט לא גדלים מתקע מדיית היעד (איור 5B), ומקרים שבהם איננו משחזרים מספיק נתוני ריצוף מתקע מדיית היעד לניתוחים משמעותיים. מקרים אחרים שבהם פטריות צומחות יתר על המידה מתוך העמודות גרמו גם לצורך לבצע מחדש את הניסויים (איור 5C).

איור 3: דוגמאות לעמודות שהוצבו בדגימות סביבתיות בסביבות מעבדה ובשטח. (A) עמודה הממוקמת בתוך שפופרת של 50 מ"ל עם אדמה לחה בסביבת מעבדה. מוצג גם עם סרגל לקנה מידה. (ב) עמוד שהונח באדמה בשדה. (C) עמודה שמונחת ברשת השורשים של צמח בשדה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
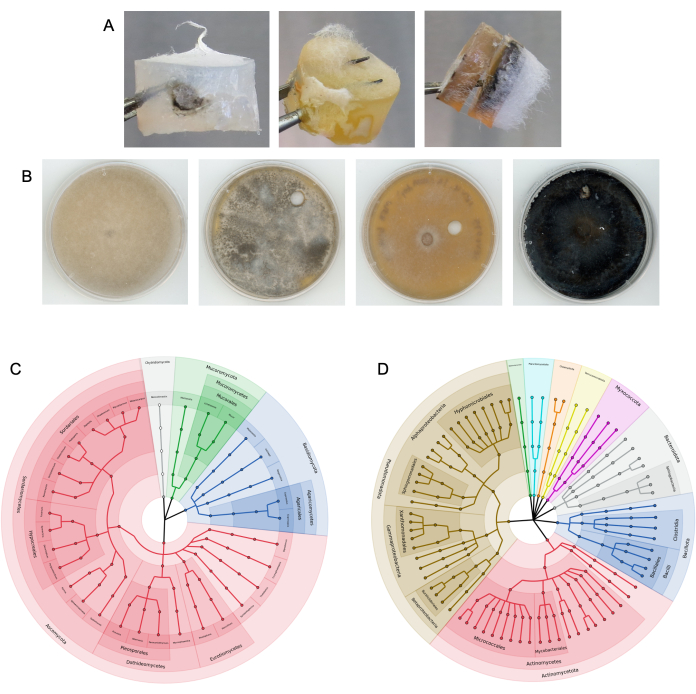
איור 4: תוצאות מייצגות מניסויי עמודות מוצלחים. (A) דוגמאות של תקעי מדיה מושבים שחולצו מעמודות. (B) דוגמאות לבודדים פטרייתיים שעברו תת-תרבית מאמצעי המטרה. המצע היה אדמה. רצף ITS עליון NCBI BLAST זהות משמאל לימין: Rhizopus azygosporous, Aspergillus novofumigatus, Curvularia subpapendorfii ו-Phaeomycocentrospora cantuariensis. (C,D) קלדוגרמות מעגליות המציגות את המגוון הפילוגנטי של (C) רצפי ITS פטרייתיים ו-(D) חיידקים 16S שהתאוששו מאמצעי המטרה לאחר ניסויים מרובים בכביש מהיר פטרייתי באמצעות גללי סוסים. החתכים צבועים ומסומנים לפי פילום, כאשר צמתי קצה מייצגים סוגים ייחודיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 5. תוצאות לא אופטימליות מניסויי עמודות. (A) דוגמה לתקע מדיה מיובש הנובע מתנאי סביבה של לחות נמוכה. (B) דוגמה לחוסר גידול מיקרוביאלי מתקע מדיה עמודתי. (C) דוגמה לצמיחת יתר של הפטרייה דרך החלק העליון (מדיום המטרה) של העמודה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
בעת יצירת רכיבי העמודה, ניתן לשנות את הבחירה של מדפסת תלת מימד וחומר הדפסה על סמך זמינות ותכונות חומר רצויות17,18. התאימות הביולוגית, מרקם פני השטח, יכולת החיטוי, היכולת להדפיס פרטים בקנה מידה עדין ושקיפות יחסית נלקחו בחשבון בבחירת החומרים של הקבוצה שלנו. יש לקחת בחשבון גם תכונות אחרות, כגון נקבוביות, הידרופוביות, פרמטרי הדפסה וכו'. שרפים שונים נבדקו (ראה טבלת חומרים) לפני הבחירה הסופית, וחומרים ביו-תואמים רבים יעבדו להדפסת עמודות אלה. החומר שנבחר לבניית רכיבי העמוד יקבע באילו גישות ניקוי, לאחר ריפוי ועיקור יש להשתמש. לא כל החומרים יהיו ניתנים לחיטוי, וייתכן שיידרשו אור אולטרה סגול, אקונומיקה או טכניקות עיקור אחרות, בהתאם להוראות יצרן החומר. טכניקות עיקור או ניקוי מסוימות עלולות גם לפגוע או לא להיות תואמות לחומר הנבחר, ולכן יש להקדיש תשומת לב מיוחדת למידע זה מיצרן החומר. עבור מדפסות תלת מימד, חלק מהשיקולים כוללים זמן הדפסה, תאימות חומרים, גודל פלטפורמת בנייה, טכנולוגיית הדפסה ועלות19. הרכיבים המודפסים בתלת מימד של העמודים עלולים להיות שבירים ועלולים להישבר אם מטפלים בהם בעוצמה רבה מדי. ייתכן שההברגה של הטבעת והמכסים לא תמיד מיושרים במדויק, לכן אנו ממליצים להדפיס ולעקר רכיבים נוספים לפני שלב ההרכבה, או לבצע הדפסה מקדימה כדי לבדוק כיצד הפרמטרים והחומר שנבחרו משפיעים על ההברגה. ייתכן שיהיה צורך להתאים את מפרט העיצוב עבור ההברגה בתוך הכובעים והטבעת בהתאם לחומר הדפסת התלת מימד שנבחר. ניתן לשנות את הממדים, מורכבות הסריג ותכונות פיזיות אחרות בתוכנת עיצוב CAD לפני ההדפסה. כפי שתוכנן, גובה העמוד עצמו הוא 4 ס"מ, ולמבנה הסריג במרכז העמוד יש תא יחידה בגודל 2 מ"מ, קוטר תמוכות של 0.5 מ"מ, וגובה הסריג כולו הוא 22 מ"מ9. ניתן להתאים פרמטרים אלה אם חוקר רוצה, למשל, מבנה סריג גדול או מורכב יותר. בסך הכל, הייצור המודפס בתלת מימד של מכשירים אלה מאפשר גמישות עיצובית תוך הבטחה שניתן להשתמש בעיצוב יחיד בצורה סטנדרטית בין ארגונים וקבוצות, ואף להשתמש בו ככלי הוראה בכיתה9.
מספר שלבים בפרוטוקול עשויים לדרוש פתרון בעיות בהתאם לסביבה או להגדרה הניסיונית. עמודות הכביש המהיר של הפטריות אינן יעילות במיוחד בתנאי לחות נמוכה, מאחר שפקקי המדיה מתייבשים במהירות לפני שהם מאפשרים גדילה פטרייתית, מה שיכול להגביל את משך הניסויים בסביבות האלה (איור 5A). טכניקות ששיפרו את יעילות העמודים בסביבות עם לחות נמוכה כוללות העלאה מלאכותית של הלחות באמצעות הוספת לחות למצע ו/או איטום העמוד והמצע במיכל משני עם מקור מים (למשל, מיכל קטן של מים טהורים). צורת שעון החול ומבנה הסריג שולבו כדי למנוע תנועת חיידקים בלבד (ללא הקמת כביש מהיר פטרייתי) אם ייווצר עיבוי בסביבות לחות גבוהה. פטריות שגדלות במהירות עשויות לגדול מעל שטח הפנים של המטרה ושל אמצעי הפיתיון ולהתפשט החוצה מהחלק העליון או התחתון של העמודה (איור 5C). הפחתת זמן הדגירה של פטריית הפיתיון או משך הניסוי יכולה למזער או לחסל את צמיחת היתר הזו. בנוסף, מגבלה של מכשירים אלה היא שפטריות הגדלות במהירות במצע המעניין עשויות להגביל את ההתיישבות של פיתיון ואמצעי מטרה על ידי פטריות הגדלות לאט, מה שעלול להטות את האינטראקציות הנצפות בכביש המהיר. פטריות מסוימות, במיוחד פטריות שגדלות לאט יותר, עשויות שלא ליישב את אמצעי הפיתיון באופן המאפשר להן לצמוח דרך פקק האגר ולתוך מבנה הסריג. אם יש מספיק לחות בסביבה, ניתן להשתמש בתקעי אגר דקים יותר כדי לעודד צמיחה לתוך הסריג לאחר התיישבות פקק אגר הפיתיון. ניתן לבחור מדיה על סמך אם חוקר רוצה לבחור גידול פטרייתי או חיידק, אך זה יכול גם להגביל את תת-התרבות לאורגניזמים המעדיפים את סוג המדיה20. אם לא נראה גידול באמצעי המטרה, ייתכן שיהיה צורך לחסן את מדיום הפיתיון או המצע בפטרייה הידועה כיוצרת כבישים מהירים פטרייתיים.
ניתן לבצע ריצוף מטאגנומי או אמפליקוני כחלק מניסויים אלה, ושתי האסטרטגיות הללו מקנות מגבלות וחוזקות משלהן21. ריצוף מטאגנומי אידיאלי להשגת מידע גנומי נוסף על החיידקים. עם זאת, הכמות הניתנת לשחזור של חומצות גרעין ישירות מאמצעי המטרה יכולה להיות נמוכה מאוד, מה שעשוי לדרוש שימוש בריצוף אמפליקון או שיטות הגברה אחרות לפני הריצוף. יש להכין ספריות ריצוף Amplicon בנפרד (16S ו-ITS), ושיטה זו חסרה רזולוציה טקסונומית ומגבילה כל הערכות לגבי תכונות הגנום או הפוטנציאל התפקודי שניתן להשיג באמצעות ריצוף מטגנומי. שיטות ריצוף ישיר מהתקעים עשויות להיות עדיפות במקרים בהם חיידקים אינם מסוגלים לעבור תת-תרבית. מומלץ לפצל את התקעים למספר חלקים כדי לאפשר גישות תרבית ורצף כאחד.
היתרון של מכשירים אלה הוא שניתן להשתמש בהם גם במעבדה וגם בשטח. יש להקפיד במיוחד על כך שהעמודים בשטח יוכלו להישאר זקופים ומוגנים מפני בעלי חיים והפרעות סביבתיות העלולות להפריע למיקומם. העמודים עדיין לא נבדקו במצב אופקי, במצב שבו הם מכוסים במלואם על ידי מצע, והם לא נבדקו בסביבות החשופות לגשמים או לשלג משמעותיים. כפי שצוין לעיל, מבנה הסריג תוכנן כדי למזער את ההסתברות שחיידקים יוכלו לנוע למדיום המטרה בסביבות לחות גבוהה. עם זאת, ייתכן שאם העמוד היה חשוף לכמויות גדולות יותר של מים ומים אלה היו רווים את העמוד במלואו, תנועת החיידקים הייתה מתאפשרת בכל העמוד ללא תלות בכבישים המהירים הפטרייתיים הקיימים. עבור ניסויים מבוססי מעבדה, ניתן להשתמש בעמודות בתוך צינורות חרוטיים של 50 מ"ל, מיקרוקוסמוס קטן של מצעים, באדמה המקיפה עציצים, בקופסאות או בתוך מערכות ניסוי מבוקרות אחרות. העמודים נוצלו בהצלחה באדמה, ריזוספרות וגללים, וניתן להרחיב את התועלת שלהם למצעים אחרים, כולל פסולת עלים, בוצה, חול, שלג, קומפוסט וכו'.
עמודות הכביש המהיר של הפטריות מאפשרות מספר השוואות להבנת פנוטיפ BFI זה בתוך סוגי מדגם מגוונים. השוואת הרכב הקהילה בין הפיתיון לאמצעי המטרה יכולה להצביע על אילו חיידקים יכולים להשתמש בכבישים מהירים פטרייתיים ואילו פטריות יכולות לשמש ככבישים מהירים פוטנציאליים9. אם נעשה שימוש בריצוף מטאגנום, ניתן לבחון גם מאפיינים גנומיים המבדילים בין אורגניזמים מהפיתיון לעומת אמצעי המטרה. אפשר גם להשוות את אמצעי המטרה מעמודים המונחים במצעים שונים (למשל, אדמה לעומת גללים) או המונחים באותו מצע בתנאים שונים (למשל, טמפרטורה או לחות). בסך הכל, עמודות הכביש המהיר של הפטריות מרחיבות את היכולות של שיטות קודמות לחקירת צורה זו של BFI ומאפשרות בחינות מקיפות של אינטראקציות אלה המעצבות את הדינמיקה המרחבית של מיקרוביום סביבתי מורכב.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
מחקר זה נתמך על ידי מענק תחום מיקוד מדעי ממשרד האנרגיה של ארה"ב (DOE), מחקר ביולוגי וסביבתי (BER), חטיבת מדעי המערכת הביולוגית (BSSD) תחת מענק מספר LANLF59T.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mL tubes | Greiner BIO-ONE | 5622-7261 | 50 mL tubes for performing column experiments in the lab |
| 90 mm Petri dishes | Thermo Scientific Nunc | 08-757-099 | Petri dishes for preparation of agar and for microbial growth |
| Asiga Freeform Pico Plus 39 digital light processing (DLP) 3D printer | Asiga Germany | Freeform Pico Plus 39 | 3D printer used to generate batches of the columns; other 3D printers can be used |
| Autoclave | Fisher Scientific | LS40F20 | Benchtop autoclave to sterilize the column components |
| Beaker | Fisher Scientific | FB100600 | 600 mL beaker for various uses throughout the protocol |
| Dental LT Clear Resin V2 | Formlabs | RS-F2-DLCL-02 | Alternative resin for 3D printing that was tested |
| Dental Surgical Guide Resin | Formlabs | RS-F2-SGAM-01 | Was used to generate the columns discussed in manuscript; Other photosensitive resins can be used in place of this material |
| DNA Low Bind 1.5 mL tubes | Eppendorf | 13-698-791 | Tubes used for various preparations including nucleic acid extractions |
| DNA/RNA shield preservative | Zymo Research | R1100-50 | Preservative used prior to nucleic acid extractions |
| EDGE Bioinformatics | Open source; Developed by the Los Alamos National Laboratory (LANL) | n/a | Bioinformatics platform for processing amplicon data |
| FastDNA spin kit for soil | MP Biomedicals LLC | 116560200-CF | DNA extraction kit option for soil |
| Forceps | Fisher Scientific | 10-300 | Forceps that can be sterilized |
| Formlabs BioMed Clear Resin | Formlabs | RS-F2-BMCL-01 | Alternative resin for 3D printing that was tested |
| Formlabs Form 3B+ stereolithography (SLA) 3D printer | Formlabs | Form 3B+ | Alternative 3D printer |
| Formlabs IBT Resin | Formlabs | RS-F2-IBCL-01 | Alternative resin for 3D printing that was tested |
| Inoculating Loops | Fisher Scientific | 22-363-598 | Used to isolate/transfer microbes |
| Malt Extract Agar (MEA) | Criterion | 89405-654 | A media type used in columns |
| MiSeq sequencer + MiSeq sequencing kit | Illumina | SY-410-1003 | Can use other sequencers |
| Mortar & Pestle | Fisher Scientific | FB961K; FB961A | Can use any common mortar & pestle that can be sterilized between uses |
| NEBNext Ultra II DNA Library Prep Kit for Illumina | New England Biolabs | E7805S | Library prep kit for metagenomic sequencing |
| Nextera XT DNA Library Preparation Kit (24 samples) | Illumina | FC-131-1024 | Library prep kit for amplicon sequencing |
| NMDC EDGE | Open source: Developed by the National Microbiome Data Collaborative (NMDC) | n/a | Bioinformatics platform for processing metagenomic data |
| Nylon mesh | Sefar | 03-25/19 | The mesh used as part of the column construction |
| Pipette tips | Rainin | 30807966 | Can use many different sterilized pipette tips for the protocol steps |
| Potato Dextrose Agar | Cole Parmer | EW-14200-28 | A media type used in columns |
| QIIME2 | Open source | n/a | Software for processing amplicon data |
| Qubit dsDNA HS assay kit | Thermo Fisher Scientific | Q32851 | Used to quantify DNA after extractions |
| Qubit Fluorometer | Thermo Fisher Scientific | Q33238 | Used to quantify DNA after extractions |
| Quick-DNA Fungal/Bacterial Miniprep Kit | Zymo Research | D6005 | DNA extraction kit option that works with both bacteria and fungi |
| R2A agar | BD Difco | 218263 | A media type used in columns (bacterial media) |
| Rack for 50 mL tubes | Fisher Scientific | 03-448-11 | Rack to hold 50 mL tubes upright |
| Scissors | Fisher Scientific | 12-000-155 | Fine precision scissors that can be sterilized |
| Sodium carboxymethyl cellulose medium | Aldrich | 419273-100G | A media type used in columns |
| SolidWorks CAD software | SolidWorks | n/a | Software used to design the columns |
| Trowel scoop | Fisher Scientific | S41701 | To make a depression in the substrate prior to adding the column |
| UltraPure DNase/RNase-Free Distilled Water | Invitrogen: ThermoFisher Scientific | 10977015 | Water for the ultrasonicator water bath |
| Ultrasonicator | Fisher Scientific | FB-11201 | Ultrasonicator for cleaning the columns |
References
- Or, D., Smets, B. F., Wraith, J. M., Dechesne, A., Friedman, S. P. Physical constraints affecting bacterial habitats and activity in unsaturated porous media - A review. Adv Water Resour. 30 (6), 1505-1527 (2007).
- Kohlmeier, S., et al. Taking the fungal highway: Mobilization of pollutant-degrading bacteria by fungi. Environ Sci Technol. 39 (12), 4640-4646 (2005).
- Simon, A., Hervé, V., Al-Dourobi, A., Verrecchia, E., Junier, P. An in situ inventory of fungi and their associated migrating bacteria in forest soils using fungal highway columns. FEMS Microbiol Ecol. 93 (1), 217(2017).
- Wick, L. Y., et al. Effect of fungal hyphae on the access of bacteria to phenanthrene in soil. Environ Sci Technol. 41 (2), 500-505 (2007).
- Bravo, D., et al. Isolation of oxalotrophic bacteria able to disperse on fungal mycelium. FEMS Microbiol Lett. 348 (2), 157-166 (2013).
- Furuno, S., Remer, R., Chatzinotas, A., Harms, H., Wick, L. Y. Use of mycelia as paths for the isolation of contaminant-degrading bacteria from soil. Microb Biotechnol. 5 (1), 142-148 (2012).
- Buffi, M., et al. Fungal drops: A novel approach for macro- and microscopic analyses of fungal mycelial growth. Microlife. 4, 042(2023).
- Kuhn, T., et al. Design and construction of 3D printed devices to investigate active and passive bacterial dispersal on hydrated surfaces. BMC Biol. 20 (1), 203(2022).
- Junier, P., et al. Democratization of fungal highway columns as a tool to investigate bacteria associated with soil fungi. FEMS Microbiol Ecol. 97 (2), 003(2021).
- Reasoner, D. J., Geldreich, E. E. A new medium for the enumeration and subculture of bacteria from potable water. Appl Environ Microbiol. 49 (1), 1-7 (1985).
- Bolyen, E., et al. Reproducible, interactive, scalable, and extensible microbiome data science using QIIME 2. Nat Biotechnol. 37 (8), 852-857 (2019).
- Callahan, B. J., et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nat Methods. 13 (7), 581-583 (2016).
- Vázquez-Baeza, Y., Pirrung, M., Gonzalez, A., Knight, R. EMPeror: A tool for visualizing high-throughput microbial community data. Gigascience. 2 (1), 16(2013).
- Li, P. -E., et al. Enabling the democratization of the genomics revolution with a fully integrated web-based bioinformatics platform. Nucleic Acids Res. 45 (1), 67-80 (2017).
- Eloe-Fadrosh, E. A., et al. The National Microbiome Data Collaborative Data Portal: An integrated multi-omics microbiome data resource. Nucleic Acids Res. 50 (1), D828-D836 (2022).
- Kans, J. Entrez Direct: E-utilities on the Unix Command Line. Entrez Programming Utilities Help. , Available from: https://www.ncbi.nlm.nih.gov/books/NBK179288/ (2024).
- Palmara, G., Frascella, F., Roppolo, I., Chiappone, A., Chiadò, A. Functional 3D printing: Approaches and bioapplications. Biosens Bioelectron. 175, 112849(2021).
- Guttridge, C., Shannon, A., O'Sullivan, A., O'Sullivan, K. J., O'Sullivan, L. W. Biocompatible 3D printing resins for medical applications: A review of marketed intended use, biocompatibility certification, and post-processing guidance. Ann 3D Print Med. 5, 100044(2022).
- Yao, L., et al. Comparison of accuracy and precision of various types of photo-curing printing technology. J Phys Conf Ser. 1549 (3), 032151(2020).
- Basu, S., et al. Evolution of bacterial and fungal growth media. Bioinformation. 11 (4), 182-184 (2015).
- Liu, Y. -X., et al. A practical guide to amplicon and metagenomic analysis of microbiome data. Protein Cell. 12 (5), 315-330 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved