A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אסטרטגיה חלופית לניתוח פלישת תאי מבחנה לתרביות תלת ממדיות
In This Article
Summary
פלישה היא תופעה ביולוגית מרכזית בהתפתחות והתקדמות סרטן. תהליך זה מושפע מתאים שאינם ניאופלסטיים ומרכיבי המיקרו-סביבה של הגידול. מטרת מחקר זה היא לתאר שיטה חלופית לניתוח פלישת תאי גידול במבחנה באמצעות תרביות תלת ממדיות (3D).
Abstract
תרבית ספרואידית היא מודל תלת-ממדי המספק שכפול משופר של המיקרו-סביבה in vivo בהשוואה לתרבויות דו-ממדיות מסורתיות (2D). פלישה היא תוצאה תאית בעלת עניין רב ביותר בביולוגיה של סרטן. בפרוטוקול זה, פיתחנו אסטרטגיה חלופית להערכת פלישה של תאים סרטניים במבחנה, תוך שימוש בהטרוספרואידים המורכבים מקרצינומה של תאי קשקש אוראליים (OSCC), פיברובלסטים הקשורים לסרטן (CAF) ומונוציטים. הטרוספרואידים אלה נועדו לחקות את המיקרו-סביבה של הגידול (TME), כולל שני סוגי תאים רלוונטיים שאינם ניאופלסטיים לצד התאים הסרטניים. כל סוג תא סומן בסמנים פלואורסצנטיים חיוניים הנפלטים באורכי גל נפרדים לפני היווצרות הספרואידים. לאחר שנוצרו, הטרוספרואידים נזרעו על שכבה של מטריצה חוץ-תאית אנושית שמקורה בליומיומה בתא העליון של קרום מיקרו-נקבובי. הפלישה הוערכה בציר z באמצעות מיקרוסקופ קונפוקלי. תמונות דיגיטליות התקבלו בתעלות הפלואורסצנטיות המתאימות במרווחים של 10 מיקרומטר, המכסות עומק של 90 מיקרומטר בציר z. הניתוח בוצע באמצעות תוכנת תמונה חופשית על ידי חישוב עוצמת הפלואורסצנטיות המשולבת בכל תמונה וערוץ פלואורסצנטי. גישה זו מאפשרת ניתוח דינמי יותר של דפוסי פלישה לתאים בהקשר רב-שכבתי, כמו גם בחינה של קו-לוקליזציה מרחבית של סוגי תאים שונים במהלך פלישה.
Introduction
פלישה היא תהליך שבו תאים ניאופלסטיים נודדים דרך המטריצה החוץ תאיתלתוך הרקמה הסובבת 1,2. ככל שהגידול מתקדם, תאים ניאופלסטיים נחשפים למיקרו-סביבות מורכבות יותר ויותר. המיקרו-סביבה של הגידול כוללת רכיבים שונים של המטריצה החוץ תאית וסוגי תאים שאינם ניאופלסטיים. תאי סטרומה, כולל פיברובלסטים ומקרופאגים מקומיים, מעצבים מחדש את המיקרו-סביבה על ידי הפרשת רכיבי מטריצה חוץ-תאיים וגורמי גדילה, וציטוקינים, אשר בתורם משפיעים על תפקודי התא הניאופלסטי3. תאי סטרומה ותאי לויקוציטים חודרים גם אינטראקציה ישירה עם תאים ניאופלסטיים, זה עם זה, ועם המטריצה החוץ תאית במיקרו-סביבה תלת מימדית. בסך הכל, הרכב TME משפיע על היעילות והדפוס של פלישת תאים ניאופלסטיים4.
האופי המורכב של המיקרו-סביבה של הגידול דורש יישום מתודולוגיות יעילות להבנת אינטראקציות בין-תאיות בתוך רקמת הגידול. רוב מבחני המבחנה המשמשים להערכת פלישה נערכו בעיקר במודלים דו-ממדיים מסורתיים ו / או תרביות מסוג תא יחיד 5,6,7,8, אשר מפשט יתר על המידה את התהליך המורכב של הפלישה ויש לו מגבלות מרובות, כגון היעדר ארכיטקטורת רקמות, רכיבי סטרומה, ושחזור in vivo. תרביות ספרואידים מייצגות מודל אחד של תרביות תלת-ממדיות במבחנה המחקה את מורפולוגיית מסת הגידול, ומאפשר אינטראקציות תא-תא ומטריצת תאים המערבות תכונות פיזיקליות וביוכימיות9. השימוש במודלים של תרביות תלת-ממדיות גדל בעשורים האחרונים, ויש ראיות לכך שתוצאות ביולוגיות שונות, כגון תגובה לטיפול, מורפולוגיה של התא וביטוי גנים, שונות בהשוואה למודל הדו-ממדי 9,10.
פרוטוקול זה מדגים שיטה להערכת פלישה חוץ גופית במטריצה חוץ-תאית אנושית באמצעות תרבית תאים ספרואידית תלת-ממדית. יתר על כן, השתמשנו בהטרוספרואידים המורכבים מתאים ניאופלסטיים, פיברובלסטים ומונוציטים כדי לחקות את המיקרו-סביבה של הגידול עם שני סוגי תאים רלוונטיים שאינם ניאופלסטיים. הדמיה של תאים במיקרוסקופ קונפוקלי לאורך מישורי פלישה שונים לעבר קרום מיקרו-נקבובי מאפשרת הדמיה של תהליך זה בהקשר דינמי ורב-שכבתי יותר.
Protocol
השימוש בתאים אנושיים ראשוניים אושר על ידי ועדת האתיקה המוסדית למחקר אנושי (CAAE 57895822.0.0000.5416) של בית הספר לרפואת שיניים בארארקוארה - UNESP. פרטי הריאגנטים והציוד ששימש במחקר מפורטים בטבלת החומרים.
1. הכנת תאים לתרבית תאים תלת ממדית
הערה: יש לבצע את כל השלבים בסעיף זה בתוך מכסה מנוע של זרימה למינרית.
- להשיג השעיות תא יחיד של התאים שייצרו את ההטרוספרואידים.
הערה: בניסוי זה יצרנו ספרואידים (ראו שלב 2) המורכבים מקו תאי OSCC (SCC9), פיברובלסטים (פיברובלסטים ראשוניים הקשורים לסרטן מביופסיות של סרטן הלשון) ומונוציטים (מונוציטים ראשוניים מתורמים בריאים). בחר את סוג התאים בהתאם לתחומי עניין ניסיוניים. - בדוק את מספר התא ואת הכדאיות באמצעות hemocytometer ו trypan כתמים כחולים.
הערה: יחס התאים בפרוטוקול זה הוא 5:3:2 (5,000 ניאופלסטיק: 3,000 פיברובלסטים: 2,000 מונוציטים), בסך הכל 10,000 תאים לכל ספרואיד. מטב את היחס ואת מספר התאים הכולל בהתאם לתחומי העניין של הניסוי. - לדלל בנפרד תאים בצינורות של 1.5 מ"ל עם תווך ללא תוספת המתאים לכל סוג תא (למשל, עבור תאים ניאופלסטיים - DMEM/F12; עבור פיברובלסטים - DMEM; עבור מונוציטים - RPMI) כדי להשיג צפיפות זריעה מתאימה של 5,000 תאים ניאופלסטיים לבאר, 3,000 פיברובלסטים לבאר, ו -2,000 מונוציטים לבאר, או 500,000 תאים למיליליטר.
הערה: כדי להבטיח מספר מתאים של תאים לניסוי, השתמש ב-20% יותר מהסכום הכולל הנדרש, בהתחשב בהפסדים פוטנציאליים במהלך שלבי הצביעה והצנטריפוגה. - תייגו את סוגי התאים השונים בנפרד באמצעות כתמים חיוניים פלואורסצנטיים מובהקים שנותרו בתאים חיים במשך כמה דורות. הוסף ריכוזים אופטימליים של צבע פלואורסצנטי לתאים המכילים בתווך (למשל, ניאופלסטיק: CFSE - צבע ירוק; פיברובלסט: CMTPX - צבע אדום; מונוציט, סגול BMQC - צבע כחול) ודגור ב 37 ° C למשך 20 דקות.
הערה: בחר גשושיות פלואורסצנטיות עם ספקטרום עירור ופליטה שונה כדי למנוע חפיפה ספקטרלית בהתאם למפרט המיקרוסקופ הקונפוקלי שישמש. - צנטריפוגה את התאים ב 400 x גרם במשך 5 דקות בטמפרטורת החדר כדי ליצור גלולה התא. שאפו את המדיום באמצעות פיפטה של 200 מיקרוליטר והשהו מחדש ב 1 מ"ל של 1x PBS.
- צנטריפוגה ב 400 x גרם במשך 5 דקות כדי ליצור גלולה התא ולהשהות מחדש את המספר הכולל של תאים ב 1 מ"ל של מדיום תרבית בתוספת בהתאם לסוג התא / קו התא בשימוש (למשל, ניאופלסטי - 100 מיקרוגרם / מ"ל סטרפטומיצין, 100 IU / מ"ל פניצילין, 10% (vol) FBS, ו 400 מיקרוגרם / מ"ל הידרוקורטיזון; פיברובלסט ומונוציטים - 100 מיקרוגרם / מ"ל סטרפטומיצין, 100 IU/מ"ל פניצילין, 10% (vol) FBS). בדקו את עוצמת הפלואורסצנטיות במיקרוסקופ וספרו את התאים עם כתמים כחולים טריפאן.
2. 3D תרבית תאים
הערה: מחקר זה השתמש בשיטת השדה המגנטי11 להדפסה ביולוגית כדי ליצור הטרוספרואידים. כאן, תאים ממוגנטים באמצעות ננו-חלקיקים מגנטיים תואמים ביולוגית ונתונים לכוחות מגנטיים עדינים. מטב את היחס בין ננו-חלקיקים לתאים בהתאם לסוג התא. ניתן להשתמש גם בשיטות חלופיות להקמת תרביות ספרואידים. בצע את השלבים בסעיף זה במכסה מנוע זרימה למינרית.
- הוסף ננו-חלקיקים מגנטיים ביחס של 1 מיקרוליטר של ננו-חלקיקים ל-20,000 תאים, והשהה מחדש ביסודיות על ידי ערבוב 10 פעמים.
- צנטריפוגו את התאים בטמפרטורה של 400 x גרם, בטמפרטורת החדר, למשך 5 דקות, והשהו מחדש על ידי ערבוב 10 פעמים. חזור על מחזור זה של צנטריפוגה/מתלה פעמיים נוספות.
הערה: תאים ממוגנטים ייצרו גלולה בצבע חום. - לאחר השלמת מחזור הצנטריפוגה האחרון, שאפו את התווך והשהו מחדש את התאים ב-34 מיקרוליטר לבאר (34 מיקרוליטר/5,000 תאים ניאופלסטיים; 34 מיקרוליטר/3,000 תאים פיברובלסטים; 34 מיקרוליטר/2,000 תאי מונוציטים) של מדיום תרבית בתוספת (DMEM/F12 המכיל 100 מיקרוגרם/מ"ל סטרפטומיצין, 100 IU/מ"ל פניצילין ו-5% (כרך) FBS) עבור התאים הניאופלסטיים.
הערה: חשב את עוצמת הקול בהתבסס על גודל הבאר. פרוטוקול זה השתמש בלוחות של 96 בארות, בסך הכל 100 מיקרוליטר של תווך לכל באר. - ערבבו את כל התאים לתוך צינור חדש לתרבית משותפת, ולאחר מכן השהו מחדש.
- העבירו 100 μL של תאים בתרבית משותפת לכל באר של צלחת חיבור נמוכה במיוחד.
- הכנס את השדה המגנטי של כונן הספרואיד מתחת ללוח כדי לגרום לצבירה והיווצרות ספרואידים, ומקם אותו באינקובטור (5% CO2, 37 ° C) למשך 3 שעות.
הערה: זמן החשיפה לשדה המגנטי יכול להשתנות בהתאם לגודל הספרואיד או הרכבו. - הסר את השדה המגנטי והנח את הצלחת באינקובטור (5% CO2, 37 ° C) למשך 24 שעות לפחות כדי לאפשר ייצור חלבוני מטריצה חוץ-תאיים ואינטראקציות בין תא לתא/תא למטריצה.
3. הכנת קרום מיקרונקבובי מצופה מטריצה חוץ-תאית
הערה: בצע את השלבים בסעיף זה במכסה מנוע זרימה למינרית.
- הוסף 50 μL של מטריצה חוץ-תאית הזמינה מסחרית למרכז קרום מיקרו-נקבובי של 24 בארות באמצעות קצה של 200 μL.
הערה: שמור את המטריצה החוץ תאית על קרח רטוב. אין לגעת בקרום המיקרונקבובי בעת הנחת המטריצה על גבי. - הסר בועות באמצעות מחט סטרילית וודא שהמטריצה מכסה את כל שטח הממברנה.
- מניחים את הממברנה באינקובטור (37 מעלות צלזיוס) למשך שעה אחת כדי לאפשר היווצרות ג'ל של המטריצה החוץ תאית.
4. מבחן הפלישה
הערה: בצע את השלבים בסעיף זה במכסה מנוע זרימה למינרית.
- הוסף 500 μL של מדיום תרבית DMEM/F12 בתוספת 10% נסיוב בקר עוברי לתא התחתון של הממברנה המיקרונקבובית כמושך כימואטרקט.
- הסר בזהירות את המדיום מהספרואידים שנוצרו והוסף בעדינות 50 μL / well של מדיום DMEM/F12 טרי ללא תוספת מעל ההטרוספרואידים.
הערה: ניתן לבצע שלב זה באמצעות כונן החזקה עבור שיטת השדה המגנטי להדפסה ביולוגית. - חותכים את הקצה של קצה 200 μL עם מספריים סטריליים.
הערה: גודל החוד יהיה תלוי בגודל הספרואיד. - לאסוף את הספרואיד ו 50 μL של בינוני עם קצה שימור נמוך.
הערה: בצע שלב זה לאט ובזהירות כדי למנוע פירוק של הספרואיד. - הניחו את הספרואיד בעדינות על גבי המטריצה החוץ תאית.
הערה: אין לגעת במטריצה החוץ-תאית המצומצמת. - יש להוסיף בזהירות 150 μL של DMEM/F12 ללא תוספת טיפה אחר טיפה כדי להגיע לנפח כולל של 200 μL.
- מניחים את הצלחת באינקובטור (5% CO2, 37 ° C) במשך 48 שעות.
הערה: זמן הדגירה עשוי להשתנות בהתאם לקו התא או לפרוטוקול.
5. רכישת תמונות
- השתמש במיקרוסקופ קונפוקלי להדמיה.
- הגדר את המיקרוסקופ בהתבסס על מאפייני העירור והפליטה של כתמים פלואורסצנטיים חיוניים המשמשים (למשל, צבע CFSE, לייזר 488 ננומטר ואורך גל גילוי 520 ננומטר; פיברובלסט: צבע CMTPX, לייזר 561 ננומטר ואורך גל גילוי 610 ננומטר; מונוציט, צבע BMQC סגול, לייזר 405 ננומטר ואורך גל גילוי 516 ננומטר).
- העמיסו את הצלחת על במת המיקרוסקופ.
- אתר ספרואידים/תאים באמצעות השדה הבהיר בהגדלה של פי 10.
- כוונן את הזום להגדלה של 40x.
- הגדר עוצמת לייזר ורווח גלאי עבור כל ערוץ פלואורסצנטי.
- זהה את נקודת ההתחלה של Z-Stack כמישור המוקד של הממברנה על ידי איתור נקבוביות הממברנה באמצעות השדה הבהיר.
- צלם שלוש תמונות מתחת וחמש עד שמונה תמונות מעל הממברנה לאורך ציר z עבור כל ערוץ, כולל השדה הבהיר. ודא מרווחים של 10 מיקרומטר בין תמונות, המכסים עומק כולל של 90-120 מיקרומטר בציר z.
- שמור את הפרויקט כקובץ סיומת .czi לאחר יצירת התמונות.
6. חילוץ תמונות
הערה: השימוש בתוכנת תמונות מוסבר להלן.
- פתח את קובץ ה- .czi באמצעות התוכנה לעריכת תמונות (ראה טבלת חומרים).
- לחץ על עיבוד בפינה השמאלית העליונה ולאחר מכן בחר יחיד. לאחר מכן, לחץ על שיטה ובחר ייצוא תמונה.
- בחר את הקובץ תחת קלט.
- לחץ על כפתור הפרמטרים ולאחר מכן בחר את ההגדרות הבאות: סוג קובץ (Tagged Image File Format - . TIFF), דחיסה (LZM), שינוי גודל (100%), החלת עקומת תצוגה וצבע ערוץ, תמונות ערוצים בודדות, שימוש בשמות ערוצים, הגדרת תת-ערכות (ערוץ, בחירת כל הערוצים), מיקום Z (חילוץ הכל), אזור (מלא), אריחים (ייצוא אריחים שנבחרו) וייצוא אל (בחירת קובץ היעד).
הערה: כדי לחלץ תמונות ערוץ ממוזגות, בחר בהגדרות הבאות: סוג קובץ (Tagged Image File Format - . TIFF), דחיסה (LZM), שינוי גודל (100%), החלת עקומת תצוגה וצבע ערוץ, מיזוג ערוץ תמונה, שימוש בשמות ערוצים, הגדרת תת-ערכות (ערוץ, בחירת ערוצים ספציפיים לכיסוי), מיקום Z (חילוץ הכל), אזור (מלא), אריחים (ייצוא אריחים שנבחרו) וייצוא אל (בחירת קובץ היעד). - לחץ על סמל החל הממוקם בפינה השמאלית העליונה.
הערה: שלב זה ייצא בו-זמנית תמונות מהערוצים השונים.
7. ניתוח תמונות
הערה: השימוש בתוכנה חופשית מוסבר בשלב זה.
- לחץ על קובץ בפינה השמאלית העליונה, בחר פתח, בחר את התמונה ולאחר מכן לחץ על אישור.
- לחץ על נתח, לאחר מכן הגדר מדידות, ובחר אזור, צפיפות משולבת ותווית תצוגה. לחץ על אישור.
- לחץ על נתח ולאחר מכן מדוד.
הערה: ודא שהאזור של כל התמונות זהה. "צפיפות משולבת" מציגה שני ערכים: (1) דחיסות משולבת גולמית (RawIntDen): סכום כל ערכי הפיקסלים בתמונה; (2) צפיפות משולבת (IntDen): מכפלה של ערך אפור ממוצע ושטח. מאחר שצבע התמונה הוא RGB והשטח של כל התמונות זהה, שקלו להשתמש ב- RawIntDen כערך מדידת פלואורסצנטיות. הבדלים בערכי הפלואורסצנטיות (עוצמה וכמות) בין תמונות עשויים להצביע על שינויים בפלישה ובעוצמת ההתפשטות של תאים. שיטה נוספת לנרמל את דפוס הפלישה במטריצה החוץ תאית לכיוון הממברנה המיקרו-נקבובית באמצעות תרביות משותפות של סוגי תאים שונים היא לחשב את היחס בין ערכי RawIntDen:
יחס RawIntDen =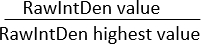
יחס של 1 מייצג את התמונה/מיקום לאורך ציר z עם הפלישה/לוקליזציה הגבוהה ביותר של תאים עבור סוג תא ספציפי זה.
תוצאות
מחקר זה מציג שיטה חלופית להערכת פלישת תאים במבחנה באמצעות ספרואידים המורכבים מסוגי תאים שונים. הוא מאפשר ניתוח של דפוסי פלישה לתאים בהקשר רב-שכבתי ובחינה של דינמיקה של לוקליזציה משותפת של תאים במהלך פלישה (איור 1).
תמונות השדה הבהיר מייצגות לוקליזציה של...
Discussion
תרביות ספרואידים תלת-ממדיות הן גישה רבת עוצמה לחקר היבטים שונים של ביולוגיה של התא. במחקר זה, אנו מדווחים על פרוטוקול להערכת פלישת תאים ניאופלסטיים באמצעות הטרוספרואידים המחקים את המיקרו-סביבה של הגידול בגישה רב-שכבתית ודינמית יותר. שיטה זו מאפשרת הערכה של לוקליזציה משותפת ודפוסי פלישה ב...
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
עבודה זו נתמכה על ידי קרן המחקר של סאו פאולו (FAPESP 20/10544-1 ו- 20/10664-7). חלק מהתמונות נוצרו באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 96 Well Bioprinting Kit | Greiner Bio-one | 655840 | Spheroid drive magnetic field. Holding drive. 96 well microplate, cell-repellent surface |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen, ThermoFisher Scientific | C34554 | |
| CellTracker Red CMTPX | Invitrogen, ThermoFisher Scientific | C34552 | |
| CellTracker Violet BMQC Dye | Invitrogen, Thermo Fisher | C10094 | |
| DMEM | Gibco, ThermoFisher Scientific | 31600-034 | |
| DMEM/F12 | Gibco, ThermoFisher Scientific | 12400-024 | |
| Extracellular matrix with Myogel | doi: 10.1186/s12885-015-1944-z | Mix composed of myogel (2.4 mg/mL), collagen (0.8 mg/mL) and non-supplemented medium of neoplastic cell | |
| FBS | Gibco, ThermoFisher Scientific | 12657-029 | |
| Hydrocortisone | Sigma | H088 | |
| ImageJ | National Institutes of Health | Software | |
| Nanoshuttle-PL | Greiner Bio-one | 657841 | Magnetic nanoparticles |
| Needle 23 G | Medix | AHMD004 | 25 x 0.60 mm (23 G x 1) |
| PBS pH 7.2 (1x) | Gibco, ThermoFisher Scientific | 2012-027 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco, ThermoFisher Scientific | 15070063 | |
| Pipet Tips | Axygen, Corning Inc. | TF-200-L-R-S | Pipet tip with barrier (filter), 200 µL Low Retention Filter, short, maximum recovery |
| RPMI | Gibco, ThermoFisher Scientific | 31800-022 | |
| TransWell 24 well | Costar, Corning Inc. | 3422 | Transwell Permeable Supports 6.5 mm Insert, 24 well plate; 0.8 µm Polycarbonate Membrane |
| Zen 3.4 (blue edition) | Zeiss Group | Software |
References
- Steeg, P. S. Tumor metastasis: Mechanistic insights and clinical challenges. Nat Med. 12 (8), 895-904 (2006).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3, 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: Plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Transl Oncol. 14 (1), 100899 (2021).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Front Cell Dev Biol. 7, 1-16 (2019).
- Nagy, &. #. 1. 9. 3. ;. G., Székács, I., Bonyár, A., Horvath, R. Simple and automatic monitoring of cancer cell invasion into an epithelial monolayer using label-free holographic microscopy. Sci Rep. 12 (1), 1-13 (2022).
- Kramer, N., et al. In vitro cell migration and invasion assays. Mutat Res Rev Mutat Res. 752 (1), 10-24 (2013).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. J Vis Exp. (88), e51046 (2014).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - A comparison of different. Arch Med Sci. 14 (4), 910-919 (2016).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 1-15 (2022).
- Trindade, J., et al. Magnetic 3D cell culture State of the art and current advances. Life Sci. 286, 1-8 (2021).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 1-19 (2021).
- Lin, Y. N., et al. Monitoring cancer cell invasion and T-cell cytotoxicity in 3D culture. J Vis Exp. (160), e61392 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved