JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
3D 배양의 In vitro 세포 침입을 분석하기 위한 대안 전략
요약
침습은 암의 발병과 진행에 있어 중요한 생물학적 현상입니다. 이 과정은 비종양 세포와 종양 미세환경의 구성 요소에 의해 영향을 받습니다. 이 연구의 목적은 3차원(3D) 배양을 사용하여 종양 세포 침입을 in vitro 분석하는 대체 방법을 설명하는 것입니다.
초록
스페로이드 배양은 기존의 2차원(2D) 배양에 비해 생체 내 미세환경의 향상된 복제를 제공하는 3D 모델입니다. 침습은 암 생물학에서 가장 큰 관심을 끄는 세포의 결과입니다. 이 프로토콜에서는 구강 편평 세포 암종(OSCC), 암 관련 섬유아세포(CAF) 및 단핵구로 구성된 헤테로이드를 사용하여 시험관 내 암세포 침입을 평가하기 위한 대체 전략을 고안했습니다. 이러한 헤테로스페로이드는 암세포와 함께 두 가지 관련 비종양 세포 유형을 포함하여 종양 미세환경(TME)을 모방하는 것을 목표로 합니다. 각 세포 유형은 스페로이드가 형성되기 전에 뚜렷한 파장에서 방출되는 중요한 형광 마커로 표지되었습니다. 일단 형성되면, 헤테로페로이드는 미세 다공성 막의 상부 구획에 있는 인간 평활근종 유래 세포외 기질층의 층에 파종되었습니다. 침습은 컨포칼 현미경을 사용하여 z축에서 평가되었습니다. 디지털 이미지는 z축에서 90μm 깊이를 커버하는 10μm 간격으로 해당 형광 채널에서 획득되었습니다. 분석은 프리웨어 이미지 소프트웨어를 사용하여 각 이미지 및 형광 채널의 통합 형광 강도를 계산하여 수행되었습니다. 이 접근 방식을 사용하면 다층적 맥락에서 세포 침입 패턴을 보다 동적으로 분석할 수 있을 뿐만 아니라 침입 중 다양한 세포 유형의 공간적 공동 국소화를 검사할 수 있습니다.
서문
침습은 종양 세포가 세포외 기질을 통해 주변 조직 1,2로 이동하는 과정입니다. 종양이 진행됨에 따라 종양 세포는 점점 더 복잡한 미세환경에 노출됩니다. 종양 미세환경에는 세포외 기질과 비종양 세포 유형의 다양한 구성 요소가 포함됩니다. 섬유아세포(fibroblast)와 상주대식세포(resident macrophage)를 포함한 기질세포(stromal cell)는 세포외 기질 성분과 성장 인자, 사이토카인(cytokine)을 분비하여 미세환경을 리모델링하며, 이는 다시 종양세포 기능에 영향을 미친다3. 기질 및 침윤 백혈구 세포는 또한 3차원 미세환경에서 종양 세포와 직접 상호 작용하고 서로 상호 작용하며 세포외 기질과 상호 작용합니다. 전체적으로, TME 조성은 종양 세포 침습의 효능과 패턴에 영향을 미친다4.
종양 미세환경의 복잡한 특성으로 인해 종양 조직 내 세포 간 상호 작용을 이해하기 위한 효과적인 방법론의 구현이 필요합니다. 침습을 평가하는 데 사용되는 대부분의 in vitro assay는 주로 전통적인 2D 모델 및/또는 단일 세포 유형 배양(5,6,7,8)에서 수행되었는데, 이는 복잡한 침습 과정을 과도하게 단순화하고 조직 구조, 기질 구성 요소 및 생체 내 재현성의 부족과 같은 여러 가지 제한 사항이 있습니다. 스페로이드 배양은 종양 종괴 형태를 모방하는 체외 3D 배양의 한 모델로, 물리적 및 생화학적 특징과 관련된 세포-세포 및 세포-기질 상호작용을 가능하게 한다9. 3D 배양 모델의 사용은 지난 수십 년 동안 증가해 왔으며 치료에 대한 반응, 세포 형태 및 유전자 발현과 같은 다양한 생물학적 결과가 2D 모델 9,10과 비교하여 다르다는 증거가 있습니다.
이 프로토콜은 3D 스페로이드 세포 배양을 사용하여 인간 세포외 기질에서 시험관 내 침습을 평가하는 방법을 보여줍니다. 또한, 종양 세포, 섬유아세포 및 단핵구로 구성된 헤테로스페로이드를 사용하여 두 가지 관련 비종양 세포 유형으로 종양 미세환경을 모방했습니다. 미세 다공성 멤브레인을 향한 다양한 침입 평면을 따라 컨포칼 현미경으로 세포를 이미징하면 이 과정을 보다 역동적이고 다층적인 맥락에서 시각화할 수 있습니다.
프로토콜
1차 인간 세포의 사용은 UNESP(Araquara at Araquara School of Dentistry)의 기관 인간 연구 윤리 위원회(CAAE 57895822.0.0000.5416)의 승인을 받았습니다. 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. 3D 세포 배양을 위한 세포 준비
알림: 이 섹션의 모든 단계는 층류 후드 내에서 수행해야 합니다.
- 헤테로스페로이드를 형성할 세포의 단세포 현탁액을 얻습니다.
참고: 이 실험에서는 OSCC 세포주(SCC9), 섬유아세포(설암 생검에서 얻은 원발성 암 관련 섬유아세포) 및 단핵구(건강한 기증자의 일차 단핵구)로 구성된 스페로이드(2단계 참조)를 생성했습니다. 실험적 관심도에 따라 세포 유형을 선택합니다. - 혈구측정기와 trypan blue 염색을 사용하여 세포 수와 생존율을 확인합니다.
참고: 이 프로토콜의 세포 비율은 5:3:2(신생물 5,000개: 섬유아세포 3,000개: 단핵구 2,000개)이며, 스페로이드당 총 10,000개의 세포입니다. 실험적 관심사에 따라 세포의 비율과 총 수를 최적화합니다. - 1.5mL 튜브의 세포를 각 세포 유형(예: 종양 세포의 경우 - DMEM/F12, 섬유아세포의 경우 - DMEM, 단핵구의 경우 - RPMI)에 적합한 보충되지 않은 배지로 별도로 희석하여 웰당 5,000개의 종양 세포, 웰당 3,000개의 섬유아세포, 웰당 2,000개의 단핵구 또는 밀리리터당 500,000개의 세포의 적절한 파종 밀도를 달성합니다.
참고: 실험에 적합한 세포 수를 확보하려면 염색 및 원심분리 단계 중 발생할 수 있는 손실을 고려하여 필요한 총 세포수보다 20% 더 많이 사용하십시오. - 여러 세대에 걸쳐 살아있는 세포에 남아 있는 뚜렷한 형광 생명 염색을 사용하여 서로 다른 세포 유형을 개별적으로 라벨링합니다. 세포가 들어있는 배지(예: 종양: CFSE - 녹색 염료, 섬유아세포: CMTPX - 적색 염료, 단핵구, 보라색 BMQC - 청색 염료)에 최적화된 농도의 형광 염료를 추가하고 37°C에서 20분 동안 배양합니다.
NOTE: 사용할 컨포칼 현미경의 사양에 따라 스펙트럼 중복을 피하기 위해 excitation 및 emission 스펙트럼이 다른 형광 프로브를 선택하십시오. - 실온에서 400 x g 에서 5분 동안 세포를 원심분리하여 세포 펠릿을 형성합니다. 200 μL 피펫을 사용하여 배지를 흡입하고 1 mL의 1x PBS에 다시 현탁시킵니다.
- 400 x g 에서 5분 동안 원심분리하여 세포 펠릿을 형성하고 사용된 세포 유형/세포주(예: 종양 - 100 μg/mL 스트렙토마이신, 100 IU/mL 페니실린, 10% (vol) FBS, 및 400 μg/mL 하이드로코르티손; 섬유아세포 및 단핵구 - 100 μg/mL 스트렙토마이신, 100 IU / mL 페니실린, 10 % (vol) FBS). 현미경에서 형광 강도를 확인하고 trypan blue 염색으로 세포를 계수합니다.
2. 3D 세포 배양
참고: 이 연구는 바이오프린팅 자기장 방법11 을 사용하여 헤테로스테로이드를 생성했습니다. 여기에서 세포는 생체 적합성 자성 나노 입자를 사용하여 자화되고 부드러운 자기력을 받습니다. 세포 유형에 따라 세포에 대한 나노 입자의 비율을 최적화합니다. 스페로이드 배양을 확립하기 위한 대체 방법도 사용될 수 있습니다. 이 섹션의 단계는 층류 후드에서 수행하십시오.
- 나노 입자 1 μL와 20,000 세포의 비율로 자성 나노 입자를 첨가하고 10 회 혼합하여 철저히 재현탁시킵니다.
- 실온에서 400 x g으로 5분 동안 세포를 원심분리하고 10회 혼합하여 다시 현탁시킵니다. 이 원심분리/재현탁 주기를 두 번 더 반복합니다.
알림: 자화된 세포는 갈색을 띤 펠릿을 형성합니다. - 마지막 원심분리 주기를 완료한 후 배지를 흡인하고 종양 세포에 대해 보충된 배양 배지(100μg/mL 스트렙토마이신, 100IU/mL 페니실린 및 5%(vol) FBS를 포함하는 DMEM/F12)의 웰당 34μL(34μL/5,000개의 종양 세포, 34μL/3,000개의 섬유아세포 세포, 34μL/2,000개의 단핵구 세포)에 세포를 다시 현탁시킵니다.
알림: 웰 크기를 기준으로 부피를 계산합니다. 이 프로토콜은 웰당 총 100μL의 배지인 96웰 플레이트를 사용했습니다. - 공동 배양을 위해 모든 세포를 새 튜브에 혼합한 다음 다시 현탁시킵니다.
- 100 μL의 공동 배양된 세포를 초저 부착 플레이트의 각 웰로 옮깁니다.
- 스페로이드 드라이브 자기장을 플레이트 아래에 삽입하여 응집 및 스페로이드 형성을 유도하고 인큐베이터(5% CO2, 37°C)에 3시간 동안 넣습니다.
알림: 자기장에 노출되는 시간은 스페로이드의 크기나 구성에 따라 달라질 수 있습니다. - 자기장을 제거하고 플레이트를 인큐베이터(5% CO2, 37°C)에 최소 24시간 동안 넣어 세포외 기질 단백질의 생산과 세포 간/세포 대 기질 상호 작용을 허용합니다.
3. 세포외 기질 코팅된 미세 다공성 막의 제조
알림: 이 섹션의 단계를 층류 후드에서 수행하십시오.
- 200 μL 팁을 사용하여 시중에서 판매되는 50 μL의 세포외 기질을 24웰 미세 다공성 멤브레인의 중심에 추가합니다.
참고: 세포외 기질을 젖은 얼음 위에 두십시오. 매트릭스를 위에 놓을 때 미세 다공성 멤브레인을 만지지 마십시오. - 멸균 바늘을 사용하여 기포를 제거하고 매트릭스가 전체 멤브레인 표면을 덮고 있는지 확인합니다.
- 세포외 기질의 겔 형성을 허용하기 위해 멤브레인을 인큐베이터(37°C)에 1시간 동안 놓습니다.
4. 침습 분석
알림: 이 섹션의 단계를 층류 후드에서 수행하십시오.
- 10% 소 태아 혈청이 보충된 DMEM/F12 배양 배지 500μL를 화학 유인제로 미세 다공성 멤브레인의 하부 챔버에 추가합니다.
- 형성된 스페로이드에서 배지를 조심스럽게 제거하고 헤테로스페로이드 위에 50μL/웰의 신선하고 보충되지 않은 DMEM/F12 배지를 부드럽게 추가합니다.
참고: 이 단계는 바이오프린팅 자기장 방법을 위한 홀딩 드라이브를 사용하여 수행할 수 있습니다. - 멸균 가위로 200μL의 저머틀 팁의 가장자리를 자릅니다.
참고: 팁의 크기는 스페로이드의 크기에 따라 다릅니다. - 낮은 머무름 팁으로 스페로이드와 50μL의 매체를 수집합니다.
참고: 스페로이드의 분해를 방지하기 위해 이 단계를 천천히 조심스럽게 수행하십시오. - 스페로이드를 세포외 기질 위에 부드럽게 놓습니다.
알림: 젤리화된 세포외 기질을 만지지 마십시오. - 보충되지 않은 DMEM/F12 배지 150μL를 한 방울 한 방울 조심스럽게 첨가하여 총 부피 200μL에 도달합니다.
- 플레이트를 인큐베이터(5% CO2, 37°C)에 48시간 동안 놓습니다.
참고: 배양 시간은 세포주 또는 프로토콜에 따라 달라질 수 있습니다.
5. 이미지 획득
- 이미징을 위해 컨포칼 현미경을 사용합니다.
- 사용된 중요한 형광 염색제의 여기 및 방출 특성(예: CFSE 염료, 488nm 레이저 및 520nm 검출 파장, 섬유아세포: CMTPX 염료, 561nm 레이저 및 610nm 검출 파장, 단핵구, 보라색 BMQC 염료, 405nm 레이저 및 516nm 검출 파장)의 여기 및 방출 특성에 따라 현미경을 설정합니다.
- 플레이트를 현미경 스테이지에 로드합니다.
- 10x 배율의 명시야를 사용하여 스페로이드/세포를 찾습니다.
- 확대/축소를 40배 확대로 조정합니다.
- 각 형광 채널에 대한 레이저 출력과 검출기 게인을 설정합니다.
- Bright Field를 사용하여 멤브레인 기공을 찾아 Z-Stack 시작점을 멤브레인 초점면으로 식별합니다.
- 밝은 시야를 포함하여 각 채널에 대해 z축을 따라 멤브레인 아래에 3개의 이미지와 5-8개의 이미지를 캡처합니다. z축에서 90-120μm의 총 깊이를 커버하는 이미지 사이에 10μm 간격을 보장합니다.
- 이미지를 생성한 후 프로젝트를 .czi 확장자 파일로 저장합니다.
6. 이미지 추출
참고: 이미지 소프트웨어의 사용법은 아래에 설명되어 있습니다.
- 이미지 편집 소프트웨어를 사용하여 .czi 파일을 엽니다( 자료 표 참조).
- 오른쪽 상단 모서리에 있는 Processing(처리 )을 클릭한 다음 Single(단일)을 선택합니다. 그런 다음 방법을 클릭하고 이미지 내보내기를 선택합니다.
- 입력에서 파일을 선택합니다.
- 매개 변수 버튼을 클릭한 후 다음 설정을 선택합니다: 파일 형식(태그가 지정된 이미지 파일 형식 - . TIFF), 압축(LZM), 크기 조정(100%), 디스플레이 곡선 및 채널 색상 적용, 개별 채널 이미지, 채널 이름 사용, 하위 집합 정의(채널, 모든 채널 선택), Z-위치(모두 추출), 영역(전체), 타일(선택한 타일 내보내기) 및 내보내기(대상 파일 선택).
참고: 병합된 채널 이미지를 추출하려면 파일 형식 (태그가 지정된 이미지 파일 형식 - . TIFF), 압축 (LZM), 크기 조정 (100%), 디스플레이 곡선 및 채널 색상 적용, 병합된 채널 이미지, 채널 이름 사용, 하위 집합 정의 (채널, 오버레이할 특정 채널 선택), Z-위치 (모두 추출), 영역 (전체), 타일 (선택한 타일 내보내기) 및 내보내기 (대상 파일 선택). - 오른쪽 상단 모서리에 있는 적용 아이콘을 클릭합니다.
참고: 이 단계는 다른 채널에서 이미지를 동시에 내보냅니다.
7. 이미지 분석
참고: 이 단계에서는 무료 소프트웨어의 사용법에 대해 설명합니다.
- 왼쪽 상단 모서리에 있는 파일을 클릭하고, 열기를 선택하고, 이미지를 선택한 다음, 확인을 클릭합니다.
- Analyze( 분석)를 클릭한 다음 Set Measurements(측정 설정)를 클릭하고 Area(영역), Integrated Density(통합 밀도) 및 Display Label( 디스플레이 레이블)을 선택합니다. 확인을 클릭합니다.
- Analyze( 분석)를 클릭한 다음 Measure(측정)를 클릭합니다.
참고: 모든 이미지의 영역이 동일한지 확인하십시오. "Integrated Density"는 두 가지 값을 표시합니다 : (1) Raw Integrated Density (RawIntDen) : 이미지의 모든 픽셀 값의 합; (2) Integrated Density (IntDen) : 평균 회색 값과 면적의 곱. 이미지가 RGB 색상이고 모든 이미지의 영역이 동일하므로 형광 측정 값으로 RawIntDen을 사용하는 것이 좋습니다. 이미지 간의 형광 값(강도 및 양)의 차이는 세포 침습 및 증식 강도의 차이를 나타낼 수 있습니다. 서로 다른 세포 유형의 공동 배양을 사용하여 미세다공성 막에 대한 세포외 기질의 침입 패턴을 정규화하는 또 다른 방법은 RawIntDen 값의 비율을 계산하는 것입니다.
비율 RawIntDen =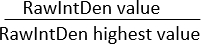
비율 1은 z축을 따라 특정 세포 유형에 대한 세포의 침입/국소화가 가장 높은 이미지/위치를 나타냅니다.
결과
이 연구는 다양한 세포 유형으로 구성된 스페로이드를 사용하여 체외에서 세포 침입을 평가하는 대체 방법을 제시합니다. 이를 통해 다층적 맥락에서 세포 침습 패턴을 분석하고 침습 중 세포 공동 국소화 역학을 조사할 수 있습니다(그림 1).
명시야 이미지는 어둡은/검은색 응집체로 식별되는 스페로이드/세포 국소화를 나타냅니다(
토론
3차원 스페로이드 배양은 세포 생물학의 다양한 측면을 조사할 수 있는 강력한 접근 방식입니다. 이 연구에서는 종양 미세환경을 모방하는 헤테로스페로이드를 사용하여 다층적이고 보다 역동적인 접근 방식으로 종양 세포 침입을 평가하기 위한 프로토콜을 보고합니다. 이 방법을 사용하면 비종양성 기질 세포의 존재 하에서 co-localization 및 침입 패턴을 평가할 수 있습니다.
...
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 연구는 상파울루 연구 재단(FAPESP 20/10544-1 및 20/10664-7)의 지원을 받았습니다. 일부 이미지는 BioRender.com 를 사용하여 생성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 96 Well Bioprinting Kit | Greiner Bio-one | 655840 | Spheroid drive magnetic field. Holding drive. 96 well microplate, cell-repellent surface |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen, ThermoFisher Scientific | C34554 | |
| CellTracker Red CMTPX | Invitrogen, ThermoFisher Scientific | C34552 | |
| CellTracker Violet BMQC Dye | Invitrogen, Thermo Fisher | C10094 | |
| DMEM | Gibco, ThermoFisher Scientific | 31600-034 | |
| DMEM/F12 | Gibco, ThermoFisher Scientific | 12400-024 | |
| Extracellular matrix with Myogel | doi: 10.1186/s12885-015-1944-z | Mix composed of myogel (2.4 mg/mL), collagen (0.8 mg/mL) and non-supplemented medium of neoplastic cell | |
| FBS | Gibco, ThermoFisher Scientific | 12657-029 | |
| Hydrocortisone | Sigma | H088 | |
| ImageJ | National Institutes of Health | Software | |
| Nanoshuttle-PL | Greiner Bio-one | 657841 | Magnetic nanoparticles |
| Needle 23 G | Medix | AHMD004 | 25 x 0.60 mm (23 G x 1) |
| PBS pH 7.2 (1x) | Gibco, ThermoFisher Scientific | 2012-027 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco, ThermoFisher Scientific | 15070063 | |
| Pipet Tips | Axygen, Corning Inc. | TF-200-L-R-S | Pipet tip with barrier (filter), 200 µL Low Retention Filter, short, maximum recovery |
| RPMI | Gibco, ThermoFisher Scientific | 31800-022 | |
| TransWell 24 well | Costar, Corning Inc. | 3422 | Transwell Permeable Supports 6.5 mm Insert, 24 well plate; 0.8 µm Polycarbonate Membrane |
| Zen 3.4 (blue edition) | Zeiss Group | Software |
참고문헌
- Steeg, P. S. Tumor metastasis: Mechanistic insights and clinical challenges. Nat Med. 12 (8), 895-904 (2006).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3, 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: Plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Transl Oncol. 14 (1), 100899 (2021).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Front Cell Dev Biol. 7, 1-16 (2019).
- Nagy, &. #. 1. 9. 3. ;. G., Székács, I., Bonyár, A., Horvath, R. Simple and automatic monitoring of cancer cell invasion into an epithelial monolayer using label-free holographic microscopy. Sci Rep. 12 (1), 1-13 (2022).
- Kramer, N., et al. In vitro cell migration and invasion assays. Mutat Res Rev Mutat Res. 752 (1), 10-24 (2013).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. J Vis Exp. (88), e51046 (2014).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - A comparison of different. Arch Med Sci. 14 (4), 910-919 (2016).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 1-15 (2022).
- Trindade, J., et al. Magnetic 3D cell culture State of the art and current advances. Life Sci. 286, 1-8 (2021).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 1-19 (2021).
- Lin, Y. N., et al. Monitoring cancer cell invasion and T-cell cytotoxicity in 3D culture. J Vis Exp. (160), e61392 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유