このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
3D培養物へのIn vitro細胞浸潤を解析するための代替戦略
要約
浸潤は、がんの発生と進行における主要な生物学的現象です。このプロセスは、腫瘍微小環境の非腫瘍性細胞および成分の影響を受けます。この研究の目的は、三次元(3D)培養を使用して in vitro で腫瘍細胞の浸潤を分析するための代替方法を説明することです。
要約
スフェロイド培養は、従来の2次元(2D)培養と比較して、in vivo微小環境の複製が改善された3Dモデルです。浸潤は、がん生物学において最も関心のある細胞結果です。このプロトコルでは、口腔扁平上皮がん(OSCC)、がん関連線維芽細胞(CAF)、および単球で構成されるヘテロスフェロイドを使用して、 in vitroでがん細胞の浸潤を評価するための代替戦略を考案しました。これらのヘテロスフェロイドは、がん細胞と並んで2つの関連する非腫瘍性細胞タイプを含む腫瘍微小環境(TME)を模倣することを目的としています。各細胞タイプは、スフェロイド形成前に異なる波長で発光する重要な蛍光マーカーで標識されました。形成されたヘテロスフェロイドは、微多孔質膜の上部コンパートメントにあるヒト平滑筋腫由来の細胞外マトリックスの層に播種されました。共焦点顕微鏡を用いてz軸での浸潤を評価した。デジタル画像は、対応する蛍光チャネルで10μm間隔で取得され、z軸の深さ90μmをカバーしました。解析は、フリーウェアの画像ソフトウェアを用いて、各画像と蛍光チャネルの積分蛍光強度を計算して行いました。このアプローチにより、多層的な状況での細胞浸潤パターンのより動的な解析が可能になり、浸潤中の異なる細胞タイプの空間的共局在を調べることができます。
概要
浸潤は、腫瘍性細胞が細胞外マトリックスを通って周囲の組織に移動するプロセスです1,2。腫瘍が進行するにつれて、腫瘍細胞はますます複雑な微小環境にさらされます。腫瘍微小環境には、細胞外マトリックスのさまざまな成分と非腫瘍性細胞型が含まれます。線維芽細胞や常在マクロファージなどの間質細胞は、細胞外マトリックス成分や成長因子、サイトカインを分泌して微小環境をリモデリングし、これが腫瘍細胞機能に影響を与える3。間質細胞および浸潤性白血球細胞も、腫瘍細胞と直接相互作用し、互いに相互作用し、三次元微小環境において細胞外マトリックスと相互作用します。全体として、TME組成物は、腫瘍性細胞浸潤の有効性およびパターンに影響を与える4。
腫瘍微小環境の複雑な性質は、腫瘍組織内の細胞間相互作用を理解するための効果的な方法論の実装を必要とします。浸潤の評価に使用されるほとんどのin vitroアッセイは、主に従来の2Dモデルおよび/または単一細胞タイプの培養5,6,7,8で行われてきましたが、これは浸潤の複雑なプロセスを過度に単純化し、組織構造、間質成分、in vivo再現性の欠如などの複数の制限があります。スフェロイド培養は、腫瘍塊の形態を模倣するin vitro 3D培養の1つのモデルであり、物理的および生化学的特徴9を含む細胞-細胞および細胞-マトリックスの相互作用を可能にします。3D培養モデルの使用は過去数十年で増加しており、治療に対する反応、細胞形態、遺伝子発現などのさまざまな生物学的転帰が2Dモデルと比較して異なるという証拠があります9,10。
このプロトコールは、3Dスフェロイド細胞培養を使用してヒト細胞外マトリックスへの in vitro 浸潤を評価する方法を示しています。さらに、腫瘍細胞、線維芽細胞、および単球で構成されるヘテロスフェロイドを使用して、2つの関連する非腫瘍性細胞タイプで腫瘍微小環境を模倣しました。微多孔質膜へのさまざまな浸潤面に沿った共焦点顕微鏡による細胞のイメージングにより、このプロセスをよりダイナミックで多層的な状況で視覚化することができます。
プロトコル
初代ヒト細胞の使用は、アララクアラの歯学部の機関向けヒト研究倫理委員会(CAAE 57895822.0.0000.5416)によって承認されました - ユネスコ。本試験で使用した試薬および機器の詳細は、 資料表に記載されています。
1. 3D細胞培養用細胞の調製
注意: このセクションのすべての手順は、層流フード内で実行する必要があります。
- ヘテロスフェロイドを形成する細胞の単一細胞懸濁液を取得します。
注:この実験では、OSCC細胞株(SCC9)、線維芽細胞(舌がん生検からの原発性がん関連線維芽細胞)、および単球(健康なドナーからの初代単球)からなるスフェロイド(ステップ2を参照)を作製しました。実験の興味に応じて細胞の種類を選択します。 - 血球計算盤とトリパンブルー染色を用いて細胞数と生存率を確認します。
注:このプロトコルの細胞比は5:3:2(5,000腫瘍性:3,000線維芽細胞:2,000単球)、スフェロイドあたり合計10,000細胞です。実験の関心に応じて細胞の比率と総数を最適化します。 - 各細胞タイプに適した非補充培地(例えば、腫瘍細胞の場合 - DMEM/F12、線維芽細胞の場合 - DMEM、単球の場合 - RPMI)で1.5 mLチューブで細胞を別々に希釈し、ウェルあたり5,000個の腫瘍細胞、ウェルあたり3,000個の線維芽細胞、およびウェルあたり2,000個の単球、または1ミリリットルあたり500,000個の細胞の適切な播種密度を達成します。
注:実験に十分な数の細胞を確保するには、染色および遠心分離ステップ中の潜在的な損失を考慮して、必要な合計よりも20%多く使用してください。 - 数世代にわたって生細胞に残存する異なる蛍光バイタル染色を使用して、異なる細胞タイプを別々に標識します。細胞を含む培地(例:腫瘍性:CFSE - 緑色色素、線維芽細胞:CMTPX - 赤色色素、単球、バイオレットBMQC - 青色色素)に最適化濃度の蛍光色素を添加し、37°Cで20分間インキュベートします。
注:使用する共焦点顕微鏡の仕様に従ってスペクトルの重複を避けるために、励起スペクトルと発光スペクトルが異なる蛍光プローブを選択してください。 - 細胞を400 x g で室温で5分間遠心分離し、細胞ペレットを形成します。200 μLピペットを使用して培地を吸引し、1x PBSの1 mLに再懸濁します。
- 400 x g で 5 分間遠心分離して細胞ペレットを形成し、使用した細胞タイプ/細胞株に応じて、補充した培地 1 mL 中の細胞の総数を再懸濁します (例:腫瘍性 - 100 μg/mL ストレプトマイシン、100 IU/mL ペニシリン、10% (vol) FBS、400 μg/mL ヒドロコルチゾン、線維芽細胞および単球 - 100 μg/mL ストレプトマイシン、 100 IU/mLペニシリン、10%(vol)FBS)。顕微鏡で蛍光強度を確認し、トリパンブルー染色で細胞をカウントします。
2. 3D細胞培養
注:この研究では、バイオプリンティング磁界法11 を用いてヘテロスフェロイドを作製した。ここでは、生体適合性のある磁性ナノ粒子を用いて細胞を磁化し、穏やかな磁力にさらします。細胞の種類に応じて、ナノ粒子と細胞の比率を最適化します。スフェロイド培養を確立するための代替方法も使用され得る。このセクションの手順は、層流フードで実行します。
- 磁性ナノ粒子を20,000細胞に対して1μLの割合で添加し、10回混合して完全に再懸濁します。
- 細胞を400 x g、室温で5分間遠心分離し、10回混合して再懸濁します。この遠心分離/再懸濁のサイクルをさらに2回繰り返します。
注:磁化された細胞は茶色がかった色のペレットを形成します。 - 最後の遠心分離サイクルが完了したら、培地を吸引し、腫瘍細胞に補充した培養培地(100 μg/mL ストレプトマイシン、100 IU/mL ペニシリン、5 %( vol)FBS を含むDMEM/F12)のウェルあたり 34 μL (34 μL/5,000 腫瘍細胞、34 μL/3,000 線維芽細胞、34 μL/2,000 単球細胞) に細胞を再懸濁します。
注:ウェルサイズに基づいて容量を計算します。このプロトコルでは、96ウェルプレートを使用し、ウェルあたり合計100μLの培地を使用しました。 - すべての細胞を新しいチューブに混合して共培養し、その後再懸濁します。
- 100 μLの共培養細胞を超低接着プレートの各ウェルに移します。
- プレートの下にスフェロイド駆動磁場を挿入して凝集とスフェロイド形成を誘導し、インキュベーター(5%CO2、37°C)に3時間置きます。
注:磁界へのばく露時間は、スフェロイドのサイズまたは組成によって異なります。 - 磁界を除去し、プレートをインキュベーター(5% CO2、37°C)に少なくとも24時間置くことで、細胞外マトリックスタンパク質および細胞間/細胞間/細胞間相互作用を産生できます。
3. 細胞外マトリックス被覆微多孔膜の作製
注意: このセクションの手順は、層流フードで実行します。
- 200 μLのチップを使用して、市販の細胞外マトリックス50 μLを24ウェル微多孔質メンブレンの中心に加えます。
注:細胞外マトリックスを濡れた氷の上に置いてください。マトリックスを上に置くときは、微多孔質膜に触れないでください。 - 滅菌針を使用して気泡を取り除き、マトリックスが膜表面全体を覆っていることを確認します。
- メンブレンをインキュベーター(37°C)に1時間置き、細胞外マトリックスのゲル形成を可能にします。
4. インベージョンアッセイ
注意: このセクションの手順は、層流フードで実行します。
- 10%ウシ胎児血清を添加したDMEM/F12培地500 μLを、化学誘引剤として微多孔質メンブレンの下部チャンバーに加えます。
- 形成したスフェロイドから培地を慎重に取り出し、ヘテロスフェロイド上に50 μL/ウェルの新鮮な非添加DMEM/F12培地を静かに加えます。
注:この手順は、バイオプリンティング磁場法の保持ドライブを使用して実行できます。 - 200 μLのローリテンションチップの端を滅菌ハサミで切断します。
注意: 先端のサイズは、回転楕円体のサイズによって異なります。 - スフェロイドと50 μLの培地を低保持チップで回収します。
注:この手順は、スフェロイドの分解を避けるために、ゆっくりと慎重に実行してください。 - スフェロイドを細胞外マトリックスの上に穏やかに置きます。
注:ゼリー状の細胞外マトリックスには触れないでください。 - 150 μLの非添加DMEM/F12培地を1滴ずつ慎重に添加し、総容量が200 μLになるようにします。
- プレートをインキュベーター(5%CO2、37°C)に48時間置きます。
注:インキュベーション時間は、細胞株またはプロトコールによって異なります。
5. 画像取得
- イメージングには共焦点顕微鏡を使用してください。
- 使用する生体蛍光染色の励起および発光特性に基づいて顕微鏡をセットアップします(例:CFSE色素、488 nmレーザー、520 nm検出波長、線維芽細胞:CMTPX色素、561 nmレーザー、610 nm検出波長、単球、バイオレットBMQC色素、405 nmレーザー、516 nm検出波長)。
- プレートを顕微鏡ステージにロードします。
- 10倍の倍率で明視野を使用してスフェロイド/細胞を見つけます。
- ズームを40倍に調整します。
- レーザー出力と検出器ゲインを各蛍光チャンネルに設定します。
- 明視野を使用してメンブレンの細孔を見つけることにより、Z-Stackの開始点をメンブレンの焦点面として特定します。
- 明視野を含む各チャネルについて、Z軸に沿ってメンブレンの下に3つの画像と5〜8枚の画像をキャプチャします。画像間の間隔は10μmを確保し、z軸の総深度90〜120μmをカバーします。
- イメージを生成した後、プロジェクトを .czi 拡張子ファイルとして保存します。
6.画像抽出
※画像ソフトのご利用方法については、以下でご説明します。
- 画像編集ソフトウェアを使用して .czi ファイルを開きます ( 資料の表を参照)。
- 右上隅の 「処理 中」をクリックし、「 単一」を選択します。次に、[ 方法 ]をクリックして、[ 画像のエクスポート]を選択します。
- [入力] でファイルを選択します。
- [パラメータ]ボタンをクリックし、次の設定を選択します:ファイルタイプ(タグ付き画像ファイル形式 - .TIFF)、圧縮(LZM)、サイズ変更(100%)、表示カーブとチャンネルカラーの適用、個々のチャンネル画像、チャンネル名の使用、サブセットの定義(チャンネル、すべてのチャンネルを選択)、Z位置(すべて抽出)、リージョン(フル)、タイル(選択したタイルをエクスポート)、エクスポート先(宛先のファイルを選択)。
注: 結合されたチャネル画像を抽出するには、次の設定を選択します: ファイルの種類 (タグ付き画像ファイル形式 - .TIFF)、 圧縮 (LZM)、 サイズ変更 (100%)、 表示カーブとチャンネルカラーの適用、マージされたチャンネル画像、チャンネル名の使用、サブセットの定義 (チャンネル、オーバーレイする特定のチャンネルを選択)、 Z位置 (すべて抽出)、 リージョン (フル)、 タイル (選択したタイルをエクスポート)、 エクスポート先 (宛先のファイルを選択)。 - 右上隅にある [適用 ]アイコンをクリックします。
注意: この手順では、異なるチャネルから画像を同時にエクスポートします。
7. 画像解析
注:フリーソフトウェアの使い方は、このステップで説明します。
- 左上隅の[ ファイル ]をクリックし、[ 開く]を選択し、画像を選択して、[ OK]をクリックします。
- 「Analyze」をクリックし、「Set Measurements」をクリックして、「Area」、「Integrated Density」、「Display Label」を選択します。[OK]をクリックします。
- [分析] をクリックし、[測定] をクリックします。
注意: すべての画像の領域が同じであることを確認してください。「Integrated Density」は2つの値を表示します:(1)Raw Integrated Density(RawIntDen):画像内のすべてのピクセル値の合計。(2)積分密度(IntDen):平均グレー値と面積の積。画像はRGBカラーで、すべての画像の面積が同じですので、蛍光測定値としてRawIntDenの使用を検討してください。画像間の蛍光値(強度と量)の違いは、細胞の浸潤と増殖強度のばらつきを示している可能性があります。異なる細胞タイプの共培養を使用して、細胞外マトリックスの微多孔膜への浸潤パターンを正規化する別の方法は、RawIntDen値の比率を計算することです。
比率 RawIntDen =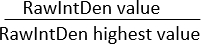
比率 1 は、その特定の細胞タイプに対する細胞の浸潤/局在が最も高い z 軸に沿った画像/位置を表します。
結果
この研究は、異なる細胞タイプで構成されたスフェロイドを使用して in vitro で細胞浸潤を評価するための代替方法を提示します。これにより、多層的な状況での細胞浸潤パターンの解析や、浸潤中の細胞共局在ダイナミクスの検討が可能になります(図1)。
明視野画像は、暗い/黒い凝集体によって識別されるスフェロイド/細胞の局在を表し?...
ディスカッション
三次元スフェロイド培養は、細胞生物学のさまざまな側面を調査するための強力なアプローチです。この研究では、腫瘍微小環境を模倣するヘテロスフェロイドを使用して腫瘍細胞の浸潤を評価するためのプロトコルを、多層的でより動的なアプローチで報告します。この方法により、非腫瘍性間質細胞の存在下での共局在と浸潤パターンの評価が可能になります。
考?...
開示事項
著者は、利益相反がないことを宣言します。
謝辞
この研究は、サンパウロ研究財団(FAPESP 20/10544-1および20/10664-7)の支援を受けました。一部の画像は BioRender.com を使用して生成されました。
資料
| Name | Company | Catalog Number | Comments |
| 96 Well Bioprinting Kit | Greiner Bio-one | 655840 | Spheroid drive magnetic field. Holding drive. 96 well microplate, cell-repellent surface |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen, ThermoFisher Scientific | C34554 | |
| CellTracker Red CMTPX | Invitrogen, ThermoFisher Scientific | C34552 | |
| CellTracker Violet BMQC Dye | Invitrogen, Thermo Fisher | C10094 | |
| DMEM | Gibco, ThermoFisher Scientific | 31600-034 | |
| DMEM/F12 | Gibco, ThermoFisher Scientific | 12400-024 | |
| Extracellular matrix with Myogel | doi: 10.1186/s12885-015-1944-z | Mix composed of myogel (2.4 mg/mL), collagen (0.8 mg/mL) and non-supplemented medium of neoplastic cell | |
| FBS | Gibco, ThermoFisher Scientific | 12657-029 | |
| Hydrocortisone | Sigma | H088 | |
| ImageJ | National Institutes of Health | Software | |
| Nanoshuttle-PL | Greiner Bio-one | 657841 | Magnetic nanoparticles |
| Needle 23 G | Medix | AHMD004 | 25 x 0.60 mm (23 G x 1) |
| PBS pH 7.2 (1x) | Gibco, ThermoFisher Scientific | 2012-027 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco, ThermoFisher Scientific | 15070063 | |
| Pipet Tips | Axygen, Corning Inc. | TF-200-L-R-S | Pipet tip with barrier (filter), 200 µL Low Retention Filter, short, maximum recovery |
| RPMI | Gibco, ThermoFisher Scientific | 31800-022 | |
| TransWell 24 well | Costar, Corning Inc. | 3422 | Transwell Permeable Supports 6.5 mm Insert, 24 well plate; 0.8 µm Polycarbonate Membrane |
| Zen 3.4 (blue edition) | Zeiss Group | Software |
参考文献
- Steeg, P. S. Tumor metastasis: Mechanistic insights and clinical challenges. Nat Med. 12 (8), 895-904 (2006).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3, 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: Plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Transl Oncol. 14 (1), 100899 (2021).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Front Cell Dev Biol. 7, 1-16 (2019).
- Nagy, &. #. 1. 9. 3. ;. G., Székács, I., Bonyár, A., Horvath, R. Simple and automatic monitoring of cancer cell invasion into an epithelial monolayer using label-free holographic microscopy. Sci Rep. 12 (1), 1-13 (2022).
- Kramer, N., et al. In vitro cell migration and invasion assays. Mutat Res Rev Mutat Res. 752 (1), 10-24 (2013).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. J Vis Exp. (88), e51046 (2014).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - A comparison of different. Arch Med Sci. 14 (4), 910-919 (2016).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 1-15 (2022).
- Trindade, J., et al. Magnetic 3D cell culture State of the art and current advances. Life Sci. 286, 1-8 (2021).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 1-19 (2021).
- Lin, Y. N., et al. Monitoring cancer cell invasion and T-cell cytotoxicity in 3D culture. J Vis Exp. (160), e61392 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved