需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
分析 3D 培养物体外细胞侵袭的替代策略
摘要
侵袭是癌症发生发展中的主要生物现象。这个过程受非肿瘤细胞和肿瘤微环境成分的影响。本研究的目的是描述一种使用 3D (3D) 培养物在 体外 分析肿瘤细胞侵袭的替代方法。
摘要
球状体培养是一种 3D 模型,与传统的二维 (2D) 培养相比,它提供了改进的体内微环境复制。侵袭是癌症生物学中最感兴趣的细胞结果。在该方案中,我们设计了一种替代策略来评估 体外癌细胞侵袭,采用由口腔鳞状细胞癌 (OSCC)、癌症相关成纤维细胞 (CAF) 和单核细胞组成的异球体。这些异球体旨在模拟肿瘤微环境 (TME),包括癌细胞旁边的两种相关非肿瘤细胞类型。在球状体形成之前,每种细胞类型都用以不同波长发射的重要荧光标记物标记。形成后,将异球接种到微孔膜上部隔室中人平滑肌瘤衍生的细胞外基质层上。使用共聚焦显微镜在 z 轴上评估浸润。在相应的荧光通道中以 10 μm 的间隔获得数字图像,在 z 轴上覆盖 90 μm 的深度。使用免费软件图像软件通过计算每个图像和荧光通道中的集成荧光强度进行分析。这种方法能够在多层环境中对细胞侵袭模式进行更动态的分析,以及检查侵袭过程中不同细胞类型的空间共定位。
引言
侵袭是肿瘤细胞通过细胞外基质迁移到周围组织的过程 1,2。随着肿瘤的进展,肿瘤细胞会暴露在越来越复杂的微环境中。肿瘤微环境包括细胞外基质和非肿瘤细胞类型的各种成分。基质细胞,包括成纤维细胞和驻留巨噬细胞,通过分泌细胞外基质成分和生长因子以及细胞因子来重塑微环境,这反过来又影响肿瘤细胞功能3。基质和浸润白细胞也直接与肿瘤细胞相互作用,彼此相互作用,并与三维微环境中的细胞外基质相互作用。总而言之,TME 组成会影响肿瘤细胞侵袭的疗效和模式4。
肿瘤微环境的复杂性要求实施有效的方法来理解肿瘤组织内的细胞间相互作用。大多数用于评估侵袭的体外测定主要在传统的 2D 模型和/或单细胞型培养物中进行 5,6,7,8,这过度简化了侵袭的复杂过程,并具有多种局限性,例如缺乏组织结构、基质成分和体内可重复性。球状体培养物代表了一种模拟肿瘤块状的体外 3D 培养模型,允许涉及物理和生化特征的细胞-细胞和细胞-基质相互作用9。3D 培养模型的使用在过去几十年中有所增长,有证据表明,与 2D 模型相比,各种生物学结果(例如对治疗的反应、细胞形态和基因表达)不同 9,10。
该方案展示了一种使用 3D 球状体细胞 培养物评估 人细胞外基质中体外侵袭的方法。此外,我们采用由肿瘤细胞、成纤维细胞和单核细胞组成的异球体来模拟具有两种相关非肿瘤细胞类型的肿瘤微环境。通过共聚焦显微镜沿着朝向微孔膜的不同侵袭平面对细胞进行成像,可以在更动态和多层的环境中可视化这一过程。
研究方案
原代人类细胞的使用已获得 Araraquara 牙科学院 - UNESP 的机构人类研究伦理委员会 (CAAE 57895822.0.0000.5416) 的批准。材料 表中列出了研究中使用的试剂和设备的详细信息。
1. 用于 3D 细胞培养的细胞制备
注意:本节中的所有步骤都必须在层流罩内进行。
- 获得将形成异球体的细胞的单细胞悬液。
注意:在本实验中,我们生成了由 OSCC 细胞系 (SCC9)、成纤维细胞(来自舌癌活检的原代癌症相关成纤维细胞)和单核细胞(来自健康供体的原代单核细胞)组成的球体(参见步骤 2)。根据实验兴趣选择细胞类型。 - 使用血细胞计数器和台盼蓝染色检查细胞数量和活力。
注意:该方案中的细胞比例为 5:3:2(5,000 个肿瘤:3,000 个成纤维细胞:2,000 个单核细胞),每个球体总计 10,000 个细胞。根据实验兴趣优化细胞的比例和总数。 - 使用适合每种细胞类型的非补充培养基(例如,对于肿瘤细胞 - DMEM/F12;对于成纤维细胞 - DMEM;对于单核细胞 - RPMI),分别在 1.5 mL 试管中稀释细胞,以达到每孔 5,000 个肿瘤细胞、每孔 3,000 个成纤维细胞和每孔 2,000 个单核细胞,或 500,000 个细胞/毫升的适当接种密度。
注:为确保实验中有足够的细胞数量,考虑到染色和离心步骤中的潜在损失,使用比所需细胞总数多 20%。 - 使用保留在活细胞中几代的不同荧光活体染色剂分别标记不同的细胞类型。将优化浓度的荧光染料添加到含有细胞的培养基中(例如,肿瘤:CFSE - 绿色染料;成纤维细胞:CMTPX - 红色染料;单核细胞,紫色 BMQC - 蓝色染料)并在 37 °C 下孵育 20 分钟。
注:根据将使用的共聚焦显微镜的规格,选择具有不同激发和发射光谱的荧光探针,以避免光谱重叠。 - 在室温下以 400 x g 离心细胞 5 分钟以形成细胞沉淀。使用 200 μL 移液器吸出培养基,并重悬于 1 mL 的 1x PBS 中。
- 以 400 x g 离心 5 分钟以形成细胞沉淀,并根据所使用的细胞类型/细胞系(例如,肿瘤 - 100 μg/mL 链霉素、100 IU/mL 青霉素、10% (vol) FBS 和 400 μg/mL 氢化可的松;成纤维细胞和单核细胞 - 100 μg/mL 链霉素, 100 IU/mL 青霉素,10% (vol) FBS)。在显微镜上检查荧光强度,并用台盼蓝染色对细胞进行计数。
2. 3D细胞培养
注意:本研究采用生物打印磁场法11 来创建异球体。在这里,细胞使用生物相容性磁性纳米颗粒磁化,并受到温和的磁力。根据细胞类型优化纳米颗粒与细胞的比例。也可以使用建立球状体培养物的替代方法。在层流罩中执行本节中的步骤。
- 以 1 μL 纳米颗粒的比例向 20,000 个细胞中加入磁性纳米颗粒,并通过混合 10 次彻底重悬。
- 将细胞在 400 x g 室温下离心 5 分钟,然后混合 10 次重新悬浮。再重复离心/重悬循环两次。
注意:磁化的细胞会形成棕色的颗粒。 - 完成最后一个离心循环后,吸出培养基并将细胞重悬于每孔 34 μL(34 μL/5,000 个肿瘤细胞;34 μL/3,000 个成纤维细胞;34 μL/2,000 个单核细胞)补充培养基(含有 100 μg/mL 链霉素、100 IU/mL 青霉素和 5%(体积)FBS 的 DMEM/F12)肿瘤细胞。
注意:根据孔大小计算体积。该方案使用 96 孔板,每孔总计 100 μL 培养基。 - 将所有细胞混合到新管中进行共培养,然后重新悬浮。
- 将 100 μL 共培养细胞转移到超低吸附板的每个孔中。
- 将球体驱动磁场插入板下方以诱导聚集和球体形成,并将其置于培养箱(5% CO 2,37°C)中 3 小时。
注意:暴露于磁场中的时间可以根据球体的大小或成分而变化。 - 去除磁场并将板放入培养箱(5% CO 2,37°C)中至少 24 小时,以允许产生细胞外基质蛋白和细胞间/细胞间基质相互作用。
3. 细胞外基质包被微孔膜的制备
注意:在层流罩中执行本节中的步骤。
- 使用 200 μL 吸头将 50 μL 市售细胞外基质添加到 24 孔微孔膜的中心。
注意:将细胞外基质保存在湿冰上。将基质放在顶部时,请勿触摸微孔膜。 - 使用无菌针头去除气泡,并确保基质覆盖整个膜表面。
- 将膜置于培养箱 (37 °C) 中 1 小时,以使细胞外基质形成凝胶。
4. 侵袭试验
注意:在层流罩中执行本节中的步骤。
- 将 500 μL 补充有 10% 胎牛血清的 DMEM/F12 培养基作为趋化剂添加到微孔膜的下腔中。
- 小心地从形成的球状体中取出培养基,并在异质球体上轻轻加入 50 μL/孔的新鲜未补充 DMEM/F12 培养基。
注意:可以使用生物打印磁场法的保持驱动器执行此步骤。 - 用无菌剪刀剪断 200 μL 低吸附尖端的边缘。
注意:尖端的大小取决于椭球体的大小。 - 使用低吸附吸头收集球状体和 50 μL 培养基。
注意:缓慢而小心地执行此步骤,以避免球体解聚。 - 将球体轻轻放在细胞外基质的顶部。
注意:不要触摸果冻化的细胞外基质。 - 小心地逐滴加入 150 μL 未添加的 DMEM/F12 培养基,以达到 200 μL 的总体积。
- 将板放入培养箱(5% CO2,37°C)中 48 小时。
注:孵育时间可能因细胞系或实验步骤而异。
5. 图像采集
- 使用共聚焦显微镜进行成像。
- 根据所用重要荧光染色剂的激发和发射特性(例如,CFSE 染料、488 nm 激光和 520 nm 检测波长;成纤维细胞:CMTPX 染料、561 nm 激光和 610 nm 检测波长;单核细胞、紫色 BMQC 染料、405 nm 激光和 516 nm 检测波长)设置显微镜。
- 将板加载到显微镜载物台上。
- 使用 10 倍放大倍率的明场定位球状体/细胞。
- 将缩放比例调整到 40 倍放大倍率。
- 设置每个荧光通道的激光功率和检测器增益。
- 通过使用明场定位膜孔,将 Z 堆栈起点确定为膜焦平面。
- 沿每个通道的 z 轴在膜下方捕获 3 张图像,在膜上方捕获 5 到 8 张图像,包括明场。确保图像之间的间隔为 10 μm,在 z 轴上覆盖 90-120 μm 的总深度。
- 生成图像后,将项目另存为 .czi 扩展文件。
6. 图像提取
注意: 图像软件的使用说明如下。
- 使用图像编辑软件打开 .czi 文件(请参阅 材料表)。
- 单击右上角的 处理 ,然后选择 单 。接下来,单击 方法 并选择 图像导出。
- 在 Input (输入) 下选择文件。
- 单击 参数 按钮,然后选择以下设置: 文件类型 (标记图像文件格式 - .TIFF)、 压缩 (LZM)、 调整大小 (100%)、 应用显示曲线和通道颜色、 单个通道图像、 使用通道名称、 定义子集 (通道、选择所有通道)、 Z 位置 (全部提取)、 区域 (完整)、 平铺 (导出所选平铺)和 导出到 (选择目标文件)。
注意:要提取合并的通道图像,请选择以下设置: 文件类型 (标记图像文件格式 - .TIFF)、 压缩 (LZM)、 调整大小 (100%)、 应用显示曲线和通道颜色、合并通道图像、使用通道名称、定义子集 (通道、选择要叠加的特定通道)、 Z 位置 (全部提取)、 区域 (完整)、 平铺 (导出所选平铺)和 导出到 (选择目标文件)。 - 点击 使用 位于右上角的图标。
注意:此步骤将同时从不同通道导出图像。
7. 图像分析
注意:此步骤介绍了免费软件的使用方法。
- 单击左上角的 File,选择 Open,选择图像,然后单击 OK。
- 单击 Analyze,然后单击 Set Measurements,然后选择 Area 、Integrated Density 和 Display Label。点击 OK。
- 单击 Analyze(分析),然后单击 Measure(测量)。
注意:确保所有图像的区域相同。"积分密度"显示两个值:(1) 原始积分密度 (RawIntDen):图像中所有像素值的总和;(2) 积分密度 (IntDen):平均灰度值与面积的乘积。由于图像是 RGB 颜色,并且所有图像的面积相同,因此请考虑使用 RawIntDen 作为荧光测量值。图像之间荧光值(强度和数量)的差异可能表明细胞侵袭和增殖强度的变化。使用不同细胞类型的共培养物将细胞外基质中朝向微孔膜的侵袭模式标准化的另一种方法是计算 RawIntDen 值的比率:
比率 RawIntDen =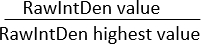
比率为 1 表示该特定细胞类型沿 z 轴的图像/位置,具有最高的细胞侵袭/定位。
结果
本研究提出了一种使用由不同细胞类型组成的球体在 体外 评估细胞侵袭的替代方法。它能够在多层环境中分析细胞侵袭模式,并检查侵袭过程中的细胞共定位动力学(图 1)。
明场图像表示球状体/细胞定位,由深色/黑色团聚体识别(图 2A)。膜的平面由膜孔内的最佳焦点决定,如图 4 所示(图 2B)?...
讨论
三维球状体培养是研究细胞生物学各个方面的强大方法。在这项研究中,我们报告了一种使用异球体评估肿瘤细胞侵袭的方案,该异球体以多层和更动态的方式模拟肿瘤微环境。该方法允许在非肿瘤基质细胞存在下评估共定位和侵袭模式。
有一些关键步骤值得考虑。首先,选择能够形成球体的细胞很重要12。其次,细胞以不同的速度侵袭,因此在实验方案中...
披露声明
作者声明他们没有利益冲突。
致谢
这项工作得到了圣保罗研究基金会 (FAPESP 20/10544-1 和 20/10664-7) 的支持。一些图像是使用 BioRender.com 生成的。
材料
| Name | Company | Catalog Number | Comments |
| 96 Well Bioprinting Kit | Greiner Bio-one | 655840 | Spheroid drive magnetic field. Holding drive. 96 well microplate, cell-repellent surface |
| CellTrace CFSE Cell Proliferation Kit | Invitrogen, ThermoFisher Scientific | C34554 | |
| CellTracker Red CMTPX | Invitrogen, ThermoFisher Scientific | C34552 | |
| CellTracker Violet BMQC Dye | Invitrogen, Thermo Fisher | C10094 | |
| DMEM | Gibco, ThermoFisher Scientific | 31600-034 | |
| DMEM/F12 | Gibco, ThermoFisher Scientific | 12400-024 | |
| Extracellular matrix with Myogel | doi: 10.1186/s12885-015-1944-z | Mix composed of myogel (2.4 mg/mL), collagen (0.8 mg/mL) and non-supplemented medium of neoplastic cell | |
| FBS | Gibco, ThermoFisher Scientific | 12657-029 | |
| Hydrocortisone | Sigma | H088 | |
| ImageJ | National Institutes of Health | Software | |
| Nanoshuttle-PL | Greiner Bio-one | 657841 | Magnetic nanoparticles |
| Needle 23 G | Medix | AHMD004 | 25 x 0.60 mm (23 G x 1) |
| PBS pH 7.2 (1x) | Gibco, ThermoFisher Scientific | 2012-027 | |
| Penicillin-Streptomycin (5,000 U/mL) | Gibco, ThermoFisher Scientific | 15070063 | |
| Pipet Tips | Axygen, Corning Inc. | TF-200-L-R-S | Pipet tip with barrier (filter), 200 µL Low Retention Filter, short, maximum recovery |
| RPMI | Gibco, ThermoFisher Scientific | 31800-022 | |
| TransWell 24 well | Costar, Corning Inc. | 3422 | Transwell Permeable Supports 6.5 mm Insert, 24 well plate; 0.8 µm Polycarbonate Membrane |
| Zen 3.4 (blue edition) | Zeiss Group | Software |
参考文献
- Steeg, P. S. Tumor metastasis: Mechanistic insights and clinical challenges. Nat Med. 12 (8), 895-904 (2006).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3, 362-374 (2003).
- Friedl, P., Alexander, S. Cancer invasion and the microenvironment: Plasticity and reciprocity. Cell. 147 (5), 992-1009 (2011).
- Wu, J. S., et al. Plasticity of cancer cell invasion: Patterns and mechanisms. Transl Oncol. 14 (1), 100899 (2021).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Front Cell Dev Biol. 7, 1-16 (2019).
- Nagy, &. #. 1. 9. 3. ;. G., Székács, I., Bonyár, A., Horvath, R. Simple and automatic monitoring of cancer cell invasion into an epithelial monolayer using label-free holographic microscopy. Sci Rep. 12 (1), 1-13 (2022).
- Kramer, N., et al. In vitro cell migration and invasion assays. Mutat Res Rev Mutat Res. 752 (1), 10-24 (2013).
- Justus, C. R., Leffler, N., Ruiz-Echevarria, M., Yang, L. V. In vitro cell migration and invasion assays. J Vis Exp. (88), e51046 (2014).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - A comparison of different. Arch Med Sci. 14 (4), 910-919 (2016).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 1-15 (2022).
- Trindade, J., et al. Magnetic 3D cell culture State of the art and current advances. Life Sci. 286, 1-8 (2021).
- Han, S. J., Kwon, S., Kim, K. S. Challenges of applying multicellular tumor spheroids in preclinical phase. Cancer Cell Int. 21 (1), 1-19 (2021).
- Lin, Y. N., et al. Monitoring cancer cell invasion and T-cell cytotoxicity in 3D culture. J Vis Exp. (160), e61392 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。