A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תהליך עבודה מהיר ופשוט לכימות מבני דרוזופילה חיצוניים למבוגרים
In This Article
Summary
כאן, אנו מציגים זרימת עבודה מהירה, בעלות נמוכה, עבור הדמיה ברזולוציה גבוהה של עיני דרוזופילה בוגרות כדי לכמת דפוסי דפוס ופגמי גדילה. אנו מתארים את הפרוטוקול שלנו להכנת דגימות על ידי הרכבה נקודתית, רכישת תמונה ברזולוציה גבוהה וניתוח תמונה.
Abstract
עין תרכובת דרוזופילה היא רקמה בעלת תבנית מדויקת שחשפה מנגנונים מולקולריים ותהליכים ביולוגיים המניעים מורפוגנזה. זהו מבנה פשוט של עיני יחידה חוזרות, המכונה ommatidia, המשמש לאפיון אינטראקציות גנטיות ותפקודי גנים. מוטציות המשפיעות על ארכיטקטורת העין ניתן לזהות ולנתח בקלות; לפיכך, מערכת זו משמשת לעתים קרובות במוסדות חסרי משאבים. ניתוח פנוטיפי נוסף כולל לעתים קרובות מיקרוסקופ אלקטרונים סורק (SEM) כדי להפיק תמונות בהגדלה גבוהה המתאימות לניתוח כמותי. עם זאת, SEMs הם יקרים ודורשים ריאגנטים יקרים; הכנת הדגימה משתרעת על פני ימים; ולעתים קרובות, הם זקוקים לצוות במשרה מלאה להכנת דגימות ותחזוקת מכשירים. זה מגביל את התועלת שלהם במוסדות חסרי משאבים או במהלך צנע תקציבי. באנטומולוגיה, השימוש בטכנולוגיית הדמיה דיגיטלית ברזולוציה גבוהה הוא פרקטיקה נפוצה לזיהוי ואפיון מינים. מאמר זה מתאר שיטה המשלבת אסטרטגיות ומאפשרת הדמיה דיגיטלית ברזולוציה גבוהה של מבני דרוזופילה בוגרים וניתוח כמותי באמצעות התוכנה הפתוחה ImageJ. זרימת העבודה היא חלופה מהירה וידידותית לסטודנטים המתקנת את המגבלות של מתקני מחקר תת-ממומנים ותת-משאבים עם גישה חסכונית ומהירה לניתוח פנוטיפי כמותי.
Introduction
Drosophila melanogaster הוא אורגניזם מודל גנטי רב עוצמה המשמש במשך עשרות שנים כדי להבהיר מסלולי איתות מולקולרי והתנהגויות תאיות. רבים ממסלולי האיתות שהשתמרו אבולוציונית וחיוניים להתפתחות רב-תאית זוהו לראשונה ומנגנון הפעולה שלהם הוגדר בדרוזופילה. כ 65-75% מכל הגנים הקשורים למחלות אנושיות יש אורתולוגים Drosophila 1,2. עין הדרוזופילה הבוגרת היא מודל חשוב שאיפשר בדיקות גנטיות בלתי משוחדות שאפשרו גילוי גנים שמורים חשובים המעורבים במחלות אנושיות, כולל סרטן 3,4, ניוון עצבי 5 והפרעות מטבוליות6.
עין הדרוזופילה מורכבת מ~800 עיני יחידה, הנקראות אומטידיה, המסודרות במדויק בתבנית משושה על פני השטח של העין הבוגרת7. כל אומטידיום מורכב משמונה נוירונים קולטי אור התופסים מיקום מובחן בתוך טרפז א-סימטרי. אלה נתמכים על ידי ארבעה תאי חרוט לא עצביים ושני תאי פיגמנט ראשוניים המפרישים עדשה ופסאודו-חרוט כדי למקד אור על הרבדומרים קולטי האור של נוירוני קולטני האור. אומטידיה שכנה מופרדת על ידי שורה אחת של תאי סריג אינטראומטידיאלים, המורכבים מתאי פיגמנט משניים, תאי פיגמנט שלישוניים וקומפלקסי זיפים מכנו-סנסוריים 8,9,10.
הפרעות בהתפתחות העיניים נראות בעיניים בוגרות כגודל עיניים מוגדל או קטן, שפע חריג או מבנה של עדשות או זיפים, או כ"עין מחוספסת" שבה דפוס המשושה האינווריאנטי בדרך כלל משתבש כך שלא ניתן עוד לעקוב אחר שורה של אומטידיה על פני השטח של העין. ניתן להבקיע פנוטיפים אלה ברמת הרקמה הגסה באמצעות מיקרוסקופים מנתחים. ניתוח מפורט של פנוטיפים כולל באופן מסורתי סריקת מיקרוסקופ אלקטרונים ואחריו ניתוח תמונה כמותי11. עם זאת, סריקת מיקרוסקופ אלקטרונים דורשת מכשור יקר, ריאגנטים יקרים, הכנת דגימות המתפרשת על פני ימים, ולעתים קרובות, צוות במשרה מלאה לתחזוקה.
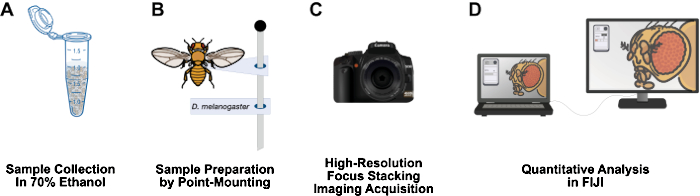
איור 1: תהליך עבודה להדמיית מבני דרוזופילה בוגרים. (A) לאסוף ולתקן דרוזופילה בוגרת באתנול 70%. (B) הכינו דגימות להדמיה על ידי הרכבה נקודתית והצמדה לפינים. (C) קבל תמונות ברזולוציה גבוהה באמצעות ערימת מיקוד ושילוב. (D) כימות תמונות באמצעות FIJI. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מאמר זה מציג תהליך עבודה זול יחסית, בעל זמן הכנת דגימה קצר, ניתן להציב אותו בקלות על ספסל מעבדה בגובה 3 מטרים, אינו דורש חומרים מסוכנים, ויכול להיות תוספת ארוכת חיים למעבדות מחקר דרוזופילה (איור 1). הרכבה נקודתית היא טכניקה אנטומולוגית המשמשת לייבוש באוויר ולשימור חרקים קטנים ובעלי גוף רך, כגון דרוזופילה12. שיטה זו מסתמכת על שילוב מטרות מיקרוסקופ עם מצלמות DSLR ברזולוציה גבוהה להגדלות יעילות של פי 10 עד פי 1,000. עומק השדה המוגבל הטבוע בצילום מאקרו מתגבר על ידי הערמת מיקוד: תפירת סדרה של תמונות כאשר מישור המוקד נע דרך הדגימה המעניינת13. שיטה זו מניבה תמונות ברזולוציה גבוהה המתאימה לכימות פנוטיפים וניתן להתאים אותה בקלות למבנים אחרים בעלי עניין, כגון כנף, רגל, בית חזה ובטן. תהליך העבודה של ניתוח התמונה משתמש בתוכנית ניתוח התמונות החינמית FIJI (NIH ImageJ). מתודולוגיה זו הופכת את הכנת הדגימות, הדמיה ברזולוציה גבוהה וניתוח לנגישים לסטודנטים לתואר ראשון ולמדענים במוסדות חסרי משאבים.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. איסוף וקיבוע דרוזופילה למבוגרים
- הגדירו צלבי דרוזופילה או זנים נבחרים והניחו אותם בבקבוקונים המכילים מזון לזבובים. לדגור על הבקבוקונים בטמפרטורה הרצויה (בדרך כלל 25 מעלות צלזיוס) עד שהזבובים התפתחו והמבוגרים נסגרים (~ 10-14 ימים ב 25 מעלות צלזיוס).
- הרדימו את הזבובים עםCO2 והניחו אותם על כרית CO2 .
- מיין את הזבובים עם נוצה ובחר את הפרטים עם הפנוטיפ הרצוי (למשל, כנפיים ישרות). צור סדרן זבוב נוצות על ידי חיתוך נוצת אווז כך שתתאים לקצה המחודד של פיפטה סרולוגית של 1 מ"ל.
- הכינו צינור מיקרוצנטריפוגה 1.7 מ"ל עם 1 מ"ל של 70% אתנול. מניחים את הזבובים שנבחרו בצינור המיקרוצנטריפוגה ומניחים קרח. אחסנו את צינורות המיקרוצנטריפוגות בטמפרטורה של 4°C למשך הלילה (איור 2A).
הערה: אין לשמר זבובים באתנול למשך יותר מ-24 שעות. אחסון ארוך טווח של זבובים באתנול 70% יגרום לאובדן פיגמנט בעיניים ובגוף.
2. הכנת דגימה על ידי הרכבה נקודתית
הערה: דרוזופילה הם חרקים בעלי גוף רך שהופכים שבירים וקורסים כאשר הם מיובשים באוויר; לכן, פרוטוקול זה דורש שהדגימות יצולמו באותו יום שבו הן מותקנות. עבוד בקבוצות קטנות של ~5 זבובים בכל פעם כדי למנוע אובדן דגימה. הגדל את מספר הדגימות בקבוצה בהתבסס על יעילות. דגימות הדורשות זמן רב יותר לפני הדמיה יכולות להתייבש באמצעות סדרה של ריכוז הולך וגדל של hexamethyldisilazane (HMDS)14.
- חתך נקודות משולש קטנות (7.1 מ"מ x 2.7 מ"מ) מקרטון ארכיוני במשקל 65 ליברות באמצעות ניקוב נקודתי מיוחד. הכינו נקודות על-ידי כיפוף החוד (הצר ביותר ב-25%) לזווית של 90° בעזרת מלקחיים עדינים מסוג Dumont #5 (איור 2B).
- באמצעות מלקחיים עדינים של Dumont #5, הסר את הזבובים מצינורות המיקרוצנטריפוגות (שלב 1.4). הכתם בעדינות את הזבובים ברקמת מעבדה נטולת סיבים כדי להסיר עודפי אתנול. מקמו כל זבוב על צדו השמאלי על כרטיס אינדקס תחת מיקרוסקופ מנתח.
הערה: הסר את הזבובים מהצינור על ידי אחיזה במבנה אנטומי שאינו אזור העניין - כאשר אנו מדמים את הראש, אנו מחזיקים דגימות על ידי הכנף או הרגל. אין להחזיק דגימות ליד הבטן, מכיוון שמבנה זה משמש להדבקת הזבוב על נקודת הקלף. - הכינו את דבק הסתרה, התאמת עקביותו לצמיגות הרצויה. ערבבו 1-2 טיפות של דבק הסתרה עם 1-2 טיפות מים שעברו דה-יוניזציה (DI), וערבבו עם צינור העברה על כרטיס אינדקס. הרימו נקודת קלף מוכנה בקצה הרחב בעזרת מלקחיים, והניחו כמות קטנה של הדבק המדולל על הקצה הכפוף של הנקודה על-ידי טבילתה לתוך תערובת הדבק-מים (איור 2C).
הערה: הדבק צריך להיות ניתן למריחה אך לא נוזלי. - מרחו את הקצה הכפוף של הנקודה על הצד הקדמי של הבטן הימנית סביב מקטעי בטן 2-3 (איור 2C). לפני שהדבק מתייבש, בצעו התאמות קלות בזבוב כך שהציר הקדמי-אחורי של הזבוב יהיה מאונך לקצה הכפוף של הנקודה.
- הכניסו פין הרכבה מס' 3 לקצה הרחב של נקודת הכרטיס (איור 2D) והדקו אותו לגוש הצמדת חרקים (איור 2E). תייג כל סיכה או שורת סיכות בגנוטיפ המתאים.

איור 2: הכנת הדגימה. (A) דרוזופילה בוגרת ממוינת על פי סמנים פנוטיפיים ונאספת לצינורות מיקרוצנטריפוגות מסומנים המכילים 70% אתנול על קרח. הזבובים מאוחסנים בטמפרטורה של 4 מעלות צלזיוס למשך הלילה. (B) נקודות כרטיס נייר מוכנות על ידי כיפוף הקצה הצר 90° משאר הכרטיס באמצעות זוג #5 מלקחיים. (C) זבובים מוחלצים מצינורות ומאפשרים להם להתייבש באוויר לזמן קצר. דבק הסתר נמרח על הקצה הקטן והמקופל של נקודת הקלף המוכנה ומודבק לזבוב הבוגר במקטעים 2-3 בבטן. (D) הדגימות מותקנות, עם תווית זיהוי, על סיכת חרק נירוסטה #3. (E) דגימות מוצמדות מאוחסנות בלוח דגימה עד שהן מוכנות לרכישת תמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. רכישת הדמיה בערימת מיקוד ברזולוציה גבוהה
- קבל צילומים ברזולוציה גבוהה של עיני זבוב באמצעות מערכת הדמיה מורכבת ומותאמת אישית להערמת פוקוס שהורכבה ומותאמת אישית.
- צלם תמונות עם גוף מצלמת DSLR עם עדשת טלפוטו 70-200 מ"מ המחוברת ליעד מיקרוסקופ Apo 20x באמצעות מתאם עדשת 77 מ"מ.
- ודאו שהדגימה מוארת באמצעות הבזק דרך מפזר (איור 3).
- שלוט במיקום Z באמצעות בקר Stackshot ומסילת מאקרו.
- חבר את המצלמה, המבזק והבמה הממונעת לחצובת אלומיניום אנודייז כבדה.
- מקם כל דגימה נקודתית על גימבל במה אוניברסלי כשהראש מכוון כך שהעין פונה לכיוון העדשה. בצע התאמות מיקום הראש על ידי הזזת הראש בעדינות עם המלקחיים.
התראה: התאמות גדולות ומהירות עלולות לגרום לעריפת ראשים בשוגג. - כאשר המצלמה קשורה למחשב נייד, התאם את הגדרות הרכישה בתוכנה. דגימות צילום בהגדלה של 20x עם ההגדרות הבאות: עוצמת הבזק 1/32, מהירות תריס 1/200, צמצם F2.8 ו-ISO 400. ודא שכל תכונות המיקוד האוטומטי וייצוב התמונה כבויות.
הערה: הגדרות אלה מאזנות בין תאורת המבזק האופטימלית, מהירות התריס ועומק השדה. יהיה צורך להתאים אותם להגדלות אחרות ו / או שילובי עדשות. - קבעו את המיקום לשמירת אוסף התמונות שנוצר (10-50 תמונות) בתיקיית הקבצים הרצויה. ודא קיבולת אחסון מספקת עבור התמונות (~ 8.5 MB לתמונה).
- התאם את הגדרות מחסנית המיקוד ביחידת הבקרה Stackshot במצב מרחק אוטומטי.
- הגדר את גודל הצעד ל- 5 מיקרומטר וחשב את מספר השלבים על-ידי הגדרת מיקומי ההתחלה והעצירה של ערימת המיקוד.
- הצג את הדגימה במצב LiveView וכשהמצלמה במצב צילום אוטומטי כדי לזהות את מיקומי ההתחלה והעצירה.
- הזז את המסילה כך שהחלק הקרוב ביותר של הדגימה יהיה בפוקוס (הגדר את מיקום ההתחלה ), ולאחר מכן עבור למקום שבו התכונה הרחוקה ביותר של עניין נמצאת בפוקוס (קבע מיקום קצה ).
- החזר את המצלמה למצב צילום ידני והתחל את רכישת התמונה מיחידת הבקרה Stackshot.
הערה: זמן רכישת התמונה תלוי בגודל הדגימה. ככל שעומק השדה הדרוש לדגימות גדולות גדול יותר, כך יותר פרוסות נכללות באוסף התמונות, מה שיאריך את זמן הרכישה הכולל. - פתח קבצים בתוכנת ערימת המיקוד שבוצעה אליה הפניה. צור תמונה מוערמת על-ידי לחיצה על ערימה | יישור וערמה הכל (PMax).
- שמור את התמונה הסופית בכונן הקשיח של המחשב כקובץ .tif על-ידי לחיצה על קובץ | שמור תמונת פלט.
הערה: בהתאם לרזולוציה של קובץ התמונה המוערם ומספר הדגימות המצולמות, ייתכן שיהיה צורך בכוננים קשיחים חיצוניים גדולים (1 TB) לגיבוי תמונה. בפרוטוקול זה, ערימת תמונות היא כ- 100 MB כל אחת לפני דחיסה.

איור 3: רכישת תמונה. (א) מכשיר הדמיה עם חלקים המסומנים כדלקמן: א) גוף מצלמת DSLR; ב) עדשת טלפוטו; ג) 20x Apo מיקרוסקופ מטרה ומתאם; ד) פלאש; ה) מפזרי עדשה וכיפה; ו) בקר Stackshot, מסילת מאקרו ושלב סיבובי; ז) גימבל במה אוניברסלי; ח) חצובה. (B) מכשיר הדמיה עם מפזר אור במקומו. (C) צילום תקריב של דגימה רכובה במקומה לצורך הדמיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. זרימת עבודה לניתוח FIJI לחישוב אזור העיניים למבוגרים
- לניתוח תמונות, השג את תוכנת FIJI15 מאתר האינטרנט של ImageJ.net.
- בחר תמונות לניתוח שבהן העין ממורכזת ומיושרת עם תאורה מתאימה וטשטוש היקפי מינימלי, המציין יישור נכון עם המצלמה.
- כייל את קנה המידה של התמונה.
- הורד את תמונת סרגל קנה המידה להגדלה של 20x המתאימה ל- 500 מיקרומטר. לחלופין, בזמן רכישת התמונה, צלם סרגל באמצעות אותן הגדרות. פתח את התמונה בתוכנת FIJI.
- מדדו את אורך סרגל קנה המידה (איור 4A). השתמש בכלי קו ישר כדי לעקוב אחר הקו במדויק. לחץ על נתח | למדוד. מרחק פיקסלים זה שווה ערך ל- 500 מיקרומטר (איור 4B).
- חישוב פיקסלים למיקרון. השתמש באפשרות זו כדי להמיר מדידות פיקסלים למדידות מיקרומטר.
- פתחו את קובץ התמונה המוערם בפיג'י (איור 4C).
- בחר זכוכית מגדלת מסרגל הכלים כדי להגדיל את אזור המיקוד. נסו למלא את המסך בעין ובקוטיקולה הקרובה של הראש (איור 4D).
- בחר Freehand Select Tool מסרגל הכלים. שרטט את אזור הרשתית קרוב ככל האפשר, לפי קווי המתאר של השורה החיצונית ביותר של אומטידיה (איור 4E). להסרת חלק מהבחירה, לחצו לחיצה ממושכת על לחצן האפשרויות ובחרו בפיקסלים להסרה. להוספה לבחירה, לחצו לחיצה ממושכת על לחצני האפשרויות וההזחה ובחרו בפיקסלים להוספה.
- כדי לחשב את האזור, בחר נתח | מדידה מהתפריט העליון (איור 4F). יופיע חלון חדש עם פרמטרים של שטח, ממוצע, מינימום ומקסימום. העתק והדבק נתונים אלה בגיליון אלקטרוני לצורך תיעוד והמרה מפיקסלים למדידות מיקרומטר.
- לבצע ניתוחים סטטיסטיים מתאימים.
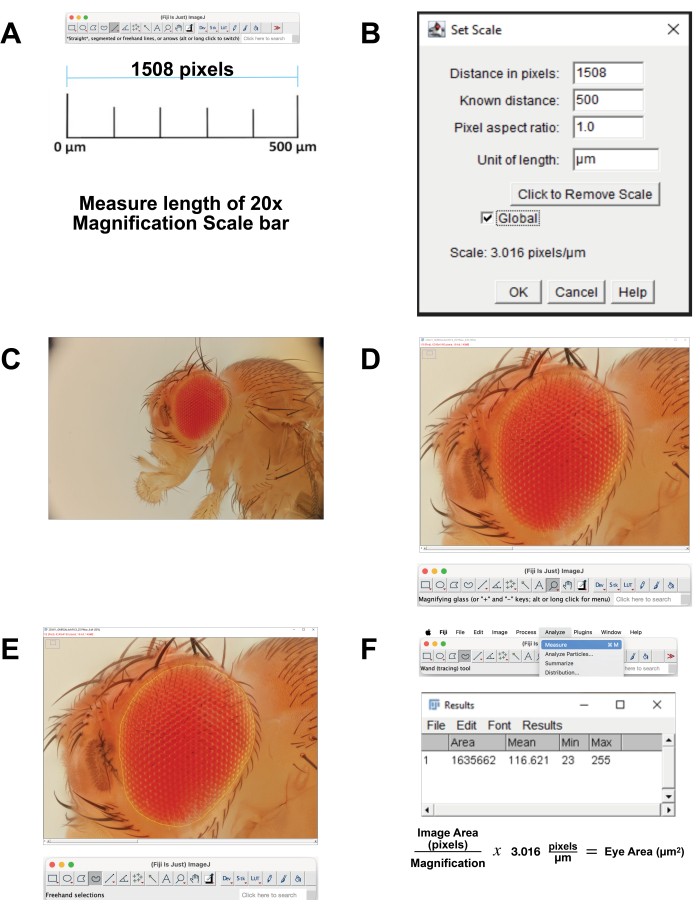
איור 4: ניתוח תמונות בפיג'י. (A) שינוי קנה מידה של התמונה המקורית. הורד את תמונת הכיול ומדוד את אורך הסרגל של 500 מיקרומטר. (B) התאם את קנה המידה באמצעות הפונקציה Set Scale . (C) פתח את התמונה המוערמת. (D) הגדל את התמונה כך שהעין תהיה ממורכזת וכמעט מסך מלא. (E) השתמש בכלי בחירה חופשית כדי לשרטט את העין בגבול שבין השורה החיצונית ביותר של אומטידיה לבין הקוטיקולה שמסביב. (ו) מדידת האזור באזור שנבחר מחושבת על ידי לחיצה על נתח | מדידה | אזור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
עין דרוזופילה היא מערכת מודל מצוינת לחקר דפוסי רקמות, בקרת גדילה ומוות תאי. לאחרונה פרסמנו מחקר החוקר כיצד pH תוך-תאי (pHi) משפיע על צמיחת רקמות. ראשית, ביססנו מערכת גנטית שבה ביטוי יתר של מחליף נתרן-פרוטונים DNhe2 (האורתולוג של יונקים NHE1) בעין המתפתחת גורם למומים בדפו...
Access restricted. Please log in or start a trial to view this content.
Discussion
כאן אנו מתארים שיטה להכנת דגימה, הדמיה ברזולוציה גבוהה וניתוח של מבני דרוזופילה בוגרים. עין הדרוזופילה היא מערכת מודל גנטית שהניבה תובנות קריטיות לגבי מנגנונים מולקולריים העומדים בבסיס מחלות כולל סרטן19, ניוון עצבי20 ומחלות מטבוליות
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
המחברים רוצים להודות לחברי מעבדת גרילו-היל על הדיונים והתמיכה. אנו מודים לטים אנדריז, רנדי קירשנר, קיטי (נגוק-הונג) נגוין, מרקו פרנט, ג'וני שלוב וליברדו וליז על התמיכה הטכנית המצוינת. עבודה זו נתמכה על ידי פרסי NIH SC3GM132049 ו- 1R16GM153640 (BKGH), פרס מחקר של הפקולטה לביוטכנולוגיה של CSU (LM ו- BKGH), וקרנות הזנק מהמכללה למדעים והמחלקה למדעי הביולוגיה באוניברסיטת סן חוזה (FJL). ציון מיוחד מגיע לברנד בקר על תושייתם ועזרתם בתהליך זה. אנו מודים לקהילת BioIcons (https://bioicons.com/) על אספקת סמלים באיכות גבוהה עבור הדמויות שלנו ובמיוחד ל-Serviere עבור סמל הפיפט, ול-DBCLS עבור הסמלים של דרוזופילה, מלקחיים ומיקרוסקופ אלקטרונים שולחני המשמשים באיור 1 ובאיור 2, אשר מורשים תחת CC-BY 4.0 Unported. אנו מודים גם לקהילת SciDraw (https://scidraw.io/) על אספקת אייקונים באיכות גבוהה עבור הדמויות שלנו, במיוחד Diogo Losch De Oliveira (doi.org/10.5281/zenodo.3925953), אשר מורשים תחת רישיון Creative Commons 4.0 (CC-BY).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL serological pipette | ThermoFisher Scientific | 170353N | |
| 1.7 mL microcentrifuge tubes | Genesee Scientific | 24-282LR | |
| 20x Apo Microscope Objective | Mitutoyo Corp. | 378-804-3 | |
| Archival 65 lb cardstock | Neenah, Inc. | 91901 | |
| Canon EF 70-200 mm USM II telephoto lens | Canon | 3044C002 | |
| Canon EOS 6D Mark II DSLR Camera Body | Canon | 1897C002 | |
| Diffuser Dome | Macroscopic Solutions | PA-DIF-GIM-SM | |
| Diffuser for Mitutoyo M Plan APO Objectives | Macroscopic Solutions | mitutoyo-diffusers | |
| Drosophila vials and plugs | Genesee Scientific | 32-117BF | |
| Dumont #5 fine-tip forceps | Fisher Scientific | NC9889584 | |
| Goose feathers | Amazon | B01CMMJI6U | |
| Heavy-Duty Anodized Aluminum Tripod | Really Right Stuff, LLC | TFA-32G | |
| Kimwipes | Fisher Scientific | 06-666A | lint-free lab tissue |
| Levenhuk M1000 Plus Digital Camera | Levenhuk | 70358 | |
| No. 3 mounting pin | Indigo Instruments | 33414-3 | |
| Nutri-Fly Bloomington Drosophila media | Genesee Scientific | 66-113 | fly food |
| Point-Punch | M.C. Mieth Manufacturing, Inc. | 448Detail | |
| Screwknob Clamp | Really Right Stuff, LLC | SK-Clamp | For attaching the macro rail to the tripod |
| Stackshot Controller and Macro Rail | Cognisys Inc. | ST3X_100_BUNDLE | |
| Step-down Ring Adapter | RAF Camera | 763461174207 | Lens adapter to connect the microscope objective to the camera lens |
| Titebond Glue | Franklin International | 5013 | |
| Yongnuo YN-24-EX Macro Twin Lite Flash | Shenzhen Yongnuo Photographic Equipment Co. | YN-24EX | |
| Software | |||
| Canon EOS Utility (v. 3.16.1). | Canon | acquisition software | |
| FIJI | National Institutes of Health | Fiji is released as open source under the GNU General Public License. FIJI Version 2.14.0/1.54f | |
| GraphPad Prism | GraphPad Software, Boston, Massachusetts USA | Prism Version 10.3.1 | |
| Zerene Stacker (v.1.04) | Zerene Systems, LLC | Focus Stacking Software |
References
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287 (5461), 2204-2215 (2000).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9 (3), 235-244 (2016).
- Hodgson, J. A., Parvy, J. -P., Yu, Y., Vidal, M., Cordero, J. B. Drosophila larval models of invasive tumorigenesis for in vivo studies on tumour/peripheral host tssue interactions during cancer cachexia. Int J Mol Sci. 22 (15), 8317(2021).
- Lam Wong, K. K., Verheyen, E. M. Metabolic reprogramming in cancer: mechanistic insights from Drosophila. Dis Model Mech. 14 (7), dmm048934(2021).
- Bonini, N. M. A perspective on Drosophila genetics and its insight into human neurodegenerative disease. Front Mol Biosci. 9, e1060796(2022).
- Drummond-Barbosa, D., Tennessen, J. M. Reclaiming Warburg: using developmental biology to gain insight into human metabolic diseases. Development. 147 (11), dev189340(2020).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Johnson, R. I. Hexagonal patterning of the Drosophila eye. Dev Biol. 478, 173-182 (2021).
- Weasner, B. P., Kumar, J. P. The early history of the eye-antennal disc of Drosophila melanogaster. Genetics. 221 (1), iyac041(2022).
- Pichaud, F., Casares, F. Shaping an optical dome: The size and shape of the insect compound eye. Semin Cell Dev Biol. 130, 37-44 (2022).
- Oster, I. I., Crang, R. E. Scanning electron microscopy of Drosophila mutant and wild type eyes. Trans Am Microsc Soc. 91 (4), 600-602 (1972).
- Gibb, T. J., Oseto, C. Insect collection and identification: Techniques for the field and laboratory. , Academic Press. (2019).
- Mertens, J., Roie, M. V., Merckx, J., Dekoninck, W. The use of low cost compact cameras with focus stacking functionality in entomological digitization projects. ZooKeys. 712, 141-154 (2017).
- Brown, B. V. A further chemical alternative to critical-point-drying for preparing small (or large) flies. Fly Times. 11, 10(1993).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Method. 9 (7), 676-682 (2012).
- Grillo-Hill, B. K., Choi, C., Jimenez-Vidal, M., Barber, D. L. Increased H+ efflux is sufficient to induce dysplasia and necessary for viability with oncogene expression. eLife. 4, e03270(2015).
- White, K. A., Grillo-Hill, B. K., Barber, D. L. Cancer cell behaviors mediated by dysregulated pH dynamics at a glance. J Cell Sci. 130 (4), 663-669 (2017).
- Peralta, J., et al. Drosophila Nhe2 overexpression induces autophagic cell death. Mol Biol Cell. 35 (7), br13(2024).
- Munnik, C., Xaba, M. P., Malindisa, S. T., Russell, B. L., Sooklal, S. A. Drosophila melanogaster: A platform for anticancer drug discovery and personalized therapies. Front Genet. 13, 949241(2022).
- Nitta, Y., Sugie, A. Studies of neurodegenerative diseases using Drosophila and the development of novel approaches for their analysis. Fly. 16 (1), 275-298 (2022).
- Pletcher, R. C., et al. A genetic screen using the Drosophila melanogaster TRiP RNAi collection to identify metabolic enzymes required for eye development. G3: Genes|Genomes|Genetics. 9 (7), 2061-2070 (2019).
- Bangi, E., et al. A personalized platform identifies trametinib plus zoledronate for a patient with KRAS-mutant metastatic colorectal cancer. Sci Adv. 5 (5), eaav6528(2019).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved