Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Harici yetişkin Drosophila yapılarının miktarının belirlenmesi için hızlı ve basit bir iş akışı
Bu Makalede
Özet
Burada, desenlenme ve büyüme kusurlarını ölçmek için yetişkin Drosophila gözlerinin yüksek çözünürlüklü görüntülemesi için hızlı, düşük maliyetli bir iş akışı sunuyoruz. Nokta montajı, yüksek çözünürlüklü görüntü elde etme ve görüntü analizi ile numune hazırlama protokolümüzü açıklıyoruz.
Özet
Drosophila bileşik göz, morfogenezi yönlendiren moleküler mekanizmaları ve biyolojik süreçleri ortaya çıkaran hassas bir şekilde desenlenmiş bir dokudur. Genetik etkileşimleri ve gen fonksiyonlarını karakterize etmek için kullanılan, ommatidia olarak adlandırılan, tekrarlayan birim gözlerin basit bir yapısıdır. Göz mimarisini etkileyen mutasyonlar kolayca tespit edilebilir ve analiz edilebilir; Bu nedenle, bu sistem yetersiz kaynaklara sahip kurumlarda sıklıkla kullanılmaktadır. Daha fazla fenotipik analiz, kantitatif analize uygun yüksek büyütmeli görüntüler oluşturmak için genellikle bir Taramalı Elektron Mikroskobu (SEM) içerir. Bununla birlikte, SEM'ler pahalıdır ve maliyetli reaktifler gerektirir; Numune hazırlama günlere yayılır; Ve çoğu zaman, numune hazırlama ve cihaz bakımı için tam zamanlı personele ihtiyaç duyarlar. Bu, yetersiz kaynaklara sahip kurumlarda veya bütçe kemer sıkma sırasında faydalarını sınırlar. Entomolojide, türlerin tanımlanması ve karakterizasyonu için yüksek çözünürlüklü dijital görüntüleme teknolojisinin kullanılması yaygın bir uygulamadır. Bu makale, stratejileri birleştiren ve yetişkin Drosophila yapılarının yüksek çözünürlüklü dijital görüntülemesine ve açık yazılım ImageJ kullanılarak kantitatif analize izin veren bir yöntemi açıklamaktadır. İş akışı, kantitatif fenotipik analize uygun maliyetli ve hızlı bir yaklaşımla, yetersiz finanse edilen ve yetersiz kaynaklara sahip araştırma tesislerinin sınırlamalarını gideren hızlı ve öğrenci dostu bir alternatiftir.
Giriş
Drosophila melanogaster, moleküler sinyal yollarını ve hücresel davranışları aydınlatmak için onlarca yıldır kullanılan güçlü bir genetik model organizmadır. Çok hücreli gelişim için gerekli olan evrimsel olarak korunmuş sinyal yollarının çoğu ilk olarak Drosophila'da tanımlanmış ve etki mekanizmaları tanımlanmıştır. İnsan hastalığıyla ilişkili tüm genlerin yaklaşık% 65-75'i Drosophila 1,2'de ortologlara sahiptir. Yetişkin Drosophila gözü, kanser 3,4, nörodejenerasyon5 ve metabolik bozukluklar6 dahil olmak üzere insan hastalıklarında rol oynayan önemli korunmuş genlerin keşfedilmesini kolaylaştıran tarafsız genetik taramalara izin veren önemli bir modeldir.
Drosophila gözü, yetişkin gözünün7 yüzeyi boyunca altıgen bir desende hassas bir şekilde dizilmiş, ommatidia adı verilen ~ 800 birim gözden oluşur. Her ommatidium, asimetrik bir yamuk içinde ayrı bir yer işgal eden sekiz fotoreseptör nöronundan oluşur. Bunlar, ışığı fotoreseptör nöronlarının ışığa duyarlı rabdomerelerine odaklamak için lens ve yalancı koni salgılayan dört nöral olmayan koni hücresi ve iki birincil pigment hücresi tarafından desteklenir. Komşu ommatidia, ikincil pigment hücreleri, üçüncül pigment hücreleri ve mekanosensoriyel kıl komplekslerinden oluşan tek bir sıra interommatidiyal kafes hücresi ile ayrılır 8,9,10.
Göz gelişimindeki bozulmalar, yetişkin gözlerde artmış veya azalmış göz boyutu, lenslerin veya kılların anormal bolluğu veya yapısı veya normalde değişmez altıgen desenin bozulduğu ve bir dizi ommatidianın artık göz yüzeyi boyunca takip edilemediği "pürüzlü bir göz" olarak görülebilir. Bu fenotipler, diseksiyon mikroskopları kullanılarak brüt doku düzeyinde skorlanabilir. Fenotiplerin ayrıntılı analizi geleneksel olarak taramalı elektron mikroskobunu ve ardından kantitatif görüntü analizini içerir11. Bununla birlikte, taramalı elektron mikroskobu pahalı enstrümantasyon, pahalı reaktifler, günlere yayılan numune hazırlama ve genellikle bakımı için tam zamanlı personel gerektirir.
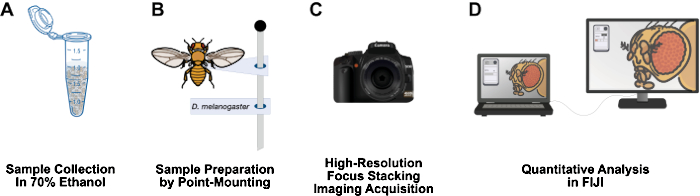
Şekil 1: Yetişkin Drosophila yapılarını görüntülemek için iş akışı. (A) Yetişkin Drosophila'yı %70 etanol içinde toplayın ve sabitleyin. (B) Nokta montajı ve pimlere yapıştırma yoluyla görüntüleme için numuneler hazırlayın. (C) Odak istifleme ve entegrasyon yoluyla yüksek çözünürlüklü görüntüler elde edin. (D) FIJI kullanarak görüntüleri nicelleştirin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu makale, nispeten ucuz olan, kısa bir numune hazırlama süresine sahip, 3 metrelik bir laboratuvar tezgahında kolayca kurulabilen, tehlikeli maddeler gerektirmeyen ve Drosophila araştırma laboratuvarlarına uzun ömürlü bir katkı olabilecek bir iş akışı sunmaktadır (Şekil 1). Nokta montajı, Drosophila12 gibi küçük, yumuşak gövdeli böcekleri havada kurutmak ve korumak için kullanılan entomolojik bir tekniktir. Bu yöntem, 10x ila 1.000x arasında etkili büyütmeler için mikroskop objektiflerini yüksek çözünürlüklü DSLR kameralarla birleştirmeye dayanır. Makro fotoğrafçılığın doğasında bulunan sınırlı alan derinliği, odak istifleme ile aşılır: odak düzlemi ilgilenilen örnekte hareket ederken bir dizi görüntüyü bir araya getirmek13. Bu yöntem, fenotiplerin nicelleştirilmesi için uygun yüksek çözünürlüklü görüntüler verir ve kanat, bacak, göğüs kafesi ve karın gibi diğer ilgili yapılar için kolayca uyarlanabilir. Görüntü analizi iş akışı, ücretsiz görüntü analiz programı FIJI'yi (NIH ImageJ) kullanır. Bu metodoloji, numune hazırlama, yüksek çözünürlüklü görüntüleme ve analizi, yetersiz kaynaklara sahip kurumlardaki lisans öğrencileri ve bilim adamları için erişilebilir hale getirir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Yetişkin Drosophila toplanması ve fiksasyonu
- Drosophila haçlarını ayarlayın veya suşları seçin ve bunları sinek yemi içeren şişelere yerleştirin. Sinekler gelişene ve yetişkinler kapanana kadar (25 ° C'de ~ 10-14 gün) şişeleri istenen sıcaklıkta (genellikle 25 ° C) inkübe edin.
- Sinekleri CO2 ile uyuşturun ve bir CO2 pedine yerleştirin.
- Sinekleri bir tüyle sıralayın ve istenen fenotipe sahip bireyleri seçin (örneğin, düz kanatlar). Bir kaz tüyünü 1 mL'lik bir serolojik pipetin konik ucuna sığacak şekilde keserek bir tüy sineği sıralayıcı yapın.
- 1 mL %70 etanol içeren 1.7 mL'lik bir mikrosantrifüj tüpü hazırlayın. Seçilen sinekleri mikrosantrifüj tüpüne yerleştirin ve buzun üzerine koyun. Mikrosantrifüj tüplerini gece boyunca 4 °C'de saklayın (Şekil 2A).
NOT: Sinekleri etanolde 24 saatten fazla tutmayın. Sineklerin %70 etanol içinde uzun süreli depolanması göz ve vücut pigmenti kaybına neden olur.
2. Nokta montaj ile numune hazırlama
NOT: Drosophila , havada kurutulduğunda kırılgan hale gelen ve çöken yumuşak gövdeli böceklerdir; Bu nedenle, bu protokol, numunelerin monte edildikleri gün görüntülenmesini gerektirir. Numune kaybını önlemek için bir seferde ~ 5 sinekten oluşan küçük setler halinde çalışın. Verimliliğe bağlı olarak bir setteki numune sayısını artırın. Görüntülemeden önce daha fazla zamana ihtiyaç duyan numuneler, artan bir konsantrasyon serisi heksametildisilazan (HMDS) ile kurutulabilir14.
- Özel bir uç zımba kullanarak arşiv 65 lb kart stoğundan küçük üçgen uçları (7,1 mm x 2,7 mm) kesin. Dumont #5 ince uçlu forseps ile ucu (en dar %25) 90°'lik bir açıyla bükerek noktaları hazırlayın (Şekil 2B).
- Dumont #5 ince uçlu forseps kullanarak, sinekleri mikrosantrifüj tüplerinden çıkarın (adım 1.4). Fazla etanolü çıkarmak için sinekleri tüy bırakmayan laboratuvar dokusuyla nazikçe kurulayın. Her sineği diseksiyon mikroskobu altında bir indeks kartına sol tarafına yerleştirin.
NOT: İlgi alanı olmayan anatomik bir yapıya tutunarak sinekleri tüpten çıkarın - kafayı görüntülerken, örnekleri kanat veya bacaktan tutuyoruz. Numuneleri karın tarafından tutmayın, çünkü bu yapı sineği kart noktasına yapıştırmak için kullanılır. - Deri tutkalını hazırlayın, kıvamını istenen viskoziteye ayarlayın. 1-2 damla deri yapıştırıcısını 1-2 damla deiyonize (DI) su ile karıştırın ve bir indeks kartı üzerinde bir transfer pipeti ile karıştırın. Forseps ile geniş ucundan hazırlanmış bir kart noktası alın ve az miktarda seyreltilmiş yapıştırıcıyı, tutkal-su karışımına batırarak noktanın bükülmüş ucuna yerleştirin (Şekil 2C).
NOT: Yapıştırıcı sürülebilir olmalı ancak akıcı olmamalıdır. - Noktanın bükülmüş ucunu sağ karın ön tarafına, abdominal segment 2-3 civarına uygulayın (Şekil 2C). Tutkal kurumadan önce, sineğin ön-arka ekseni noktanın bükülmüş ucuna dik olacak şekilde sineğe hafif ayarlamalar yapın.
- Kart ucunun geniş ucuna 3 No'lu bir montaj pimi yerleştirin (Şekil 2D) ve bir böcek sabitleme bloğuna sabitleyin (Şekil 2E). Her bir pimi veya pim sırasını karşılık gelen genotiple etiketleyin.

Şekil 2: Numune hazırlama. (A) Yetişkin Drosophila , fenotipik belirteçlere göre sıralanır ve buz üzerinde% 70 etanol içeren etiketli mikrosantrifüj tüplerine toplanır. Sinekler gece boyunca 4 ° C'de saklanır. (B) Kağıt kart noktaları, bir çift #5 forseps kullanılarak dar ucun kartın geri kalanından 90° bükülmesiyle hazırlanır. (C) Sinekler tüplerden geri kazanılır ve kısa bir süre havada kurumaya bırakılır. Deri tutkalı, hazırlanan kart noktasının küçük, katlanmış ucuna uygulanır ve 2-3 karın segmentlerinde yetişkin sineğe yapıştırılır. (D) Numuneler, bir tanımlama etiketi ile #3 paslanmaz çelik böcek pimine monte edilir. (E) Sabitlenmiş numuneler, görüntü elde etmeye hazır olana kadar bir numune panosunda saklanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Yüksek çözünürlüklü odak istifleme görüntüleme edinimi
- Bir araya getirilmiş ve özelleştirilmiş, monte edilmiş ve özelleştirilmiş bir odak istifleme görüntüleme sistemi ile sinek gözlerinin yüksek çözünürlüklü fotoğraflarını elde edin.
- 77 mm lens adaptörü ile 20x Apo Mikroskop Objektifine bağlı 70-200 mm telefoto lensli bir DSLR Kamera Gövdesi ile fotoğraf çekin.
- Numunenin bir difüzör aracılığıyla bir flaşla aydınlatıldığından emin olun (Şekil 3).
- Bir Stackshot Denetleyicisi ve Makro Rayı kullanarak Z konumunu kontrol edin.
- Kamerayı, flaşı ve motorlu s'yi bağlayıntage, ağır hizmet tipi anodize alüminyum tripoda.
- Noktaya monte edilmiş her bir sözü, göz merceğe bakacak şekilde baş yönlendirilmiş olarak evrensel bir s'ye yerleştirin.tage. Forseps ile başı hafifçe hareket ettirerek baş pozisyonu ayarlamaları yapın.
DİKKAT: Büyük ve hızlı ayarlamalar, kazara kafa kesilmesine neden olabilir. - Kamera bir dizüstü bilgisayara bağlıyken, yazılımdaki edinme ayarlarını yapın. Şu ayarlarla örnekleri 20x büyütmede fotoğraflayın: Flaş Gücü 1/32, Deklanşör Hızı 1/200, Diyafram F2.8 ve ISO 400. Otomatik Odaklama ve Görüntü Sabitleme özelliklerinin kapalı olduğundan emin olun.
NOT: Bu ayarlar optimum flaş aydınlatmasını, deklanşör hızını ve alan derinliğini dengeler. Diğer büyütmeler ve/veya lens kombinasyonları için ayarlanmaları gerekir. - Elde edilen görüntü yığınını (10-50 görüntü) istediğiniz dosya klasörüne kaydetmek için konumu ayarlayın. Görüntüler için yeterli depolama kapasitesi olduğundan emin olun (görüntü başına ~8,5 MB).
- Otomatik Mesafe modunda Stackshot kontrol ünitesindeki odak yığını ayarlarını yapın.
- Adım boyutunu 5 μm olarak ayarlayın ve odak yığınının başlangıç ve bitiş konumlarını ayarlayarak adım sayısını hesaplayın.
- Başlangıç ve bitiş konumlarını belirlemek için numuneyi LiveView Modunda ve fotoğraf makinesi Otomatik Çekim Modundayken görüntüleyin.
- Rayı, numunenin en yakın kısmı odakta olacak şekilde hareket ettirin ( başlangıç konumunu ayarlayın), ardından ilgilenilen en uzak özelliğin odakta olduğu yere hareket ettirin ( bitiş konumunu ayarlayın).
- Fotoğraf makinesini Manuel Çekim Moduna geri getirin ve Stackshot kontrol ünitesinden görüntü alımını başlatın.
NOT: Görüntü alma süresi, numunenin boyutuna bağlıdır. Büyük numuneler için gerekli alan derinliği ne kadar büyük olursa, görüntü yığınına o kadar fazla dilim dahil edilir ve bu da genel alım süresini uzatır. - Dosyaları referans verilen odak istifleme yazılımında açın. Yığın | Tümünü Hizala ve Yığ (PMax).
- Son görüntüyü bilgisayarın sabit diskine .tif dosyası olarak kaydetmek için Dosya | Çıktı görüntüsünü kaydedin.
NOT: Yığılmış görüntü dosyasının çözünürlüğüne ve görüntülenen örnek sayısına bağlı olarak, görüntü yedekleme için büyük harici sabit sürücüler (1 TB) gerekebilir. Bu protokolde, yığılmış görüntüler sıkıştırılmadan önce her biri yaklaşık 100 MB'dir.

Şekil 3: Görüntü elde etme. (A) Aşağıdaki gibi etiketlenmiş parçalara sahip görüntüleme cihazı: a) DSLR Fotoğraf Makinesi Gövdesi; b) telefoto lens; c) 20x Apo Mikroskop Objektifi ve Adaptörü; d) Flaş; e) Lens ve Dome Difüzörler; f) Stackshot Kontrol Cihazı, Makro Ray ve Döner Aşama; g) Evrensel Sahne Gimbal; h) Sehpa (tripod). (B) Yerinde ışık difüzörü bulunan görüntüleme cihazı. (C) Görüntüleme için monte edilmiş numunenin yakın çekimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Yetişkin göz alanını hesaplamak için FIJI analiz iş akışı
- Görüntü analizi için ImageJ.net web sitesinden FIJI yazılımını15 edinin.
- Analiz için gözün ortalandığı ve yeterli aydınlatma ve minimum çevresel bulanıklık ile hizalandığı görüntüleri seçin, bu da kamerayla doğru hizalamayı gösterir.
- Görüntü ölçeğini kalibre edin.
- 500 μm'ye karşılık gelen 20x büyütme için ölçek çubuğu görüntüsünü indirin. Alternatif olarak, görüntü alma sırasında, aynı ayarları kullanarak bir cetvelin fotoğrafını çekin. Görüntüyü FIJI Yazılımında açın.
- Ölçek çubuğunun uzunluğunu ölçün (Şekil 4A). Çizgiyi tam olarak izlemek için Düz Çizgi Aracını kullanın. Analiz Et | Ölçün. Bu piksel mesafesi 500 μm'ye eşdeğerdir (Şekil 4B).
- Mikron başına pikselleri hesaplayın. Piksel ölçümlerini mikrometre ölçümlerine dönüştürmek için bunu kullanın.
- Yığılmış görüntü dosyasını FIJI'de açın (Şekil 4C).
- Odak alanını büyütmek için araç çubuğundan Büyüteç'i seçin. Ekranı göz ve hemen çevresindeki kafa kütikülü ile doldurmaya çalışın (Şekil 4D).
- Araç çubuğundan Freehand Select Tool'u seçin. En dıştaki ommatidia sırasının dış hatlarını takip ederek retina alanını mümkün olduğunca yakın bir şekilde ana hatlarıyla belirtin (Şekil 4E). Seçimin bir kısmını kaldırmak için seçenek düğmesini basılı tutun ve kaldırılacak pikselleri seçin. Seçime eklemek için seçenek ve shift düğmelerini basılı tutun ve eklenecek pikselleri seçin.
- Alanı hesaplamak için Analiz | Üst menüden ölçün (Şekil 4F). Alan, ortalama, minimum ve maksimum parametreleri içeren yeni bir pencere açılacaktır. Dokümantasyon ve piksellerden mikrometre ölçümlerine dönüştürme için bu verileri kopyalayıp bir elektronik tabloya yapıştırın.
- Uygun istatistiksel analizler yapın.
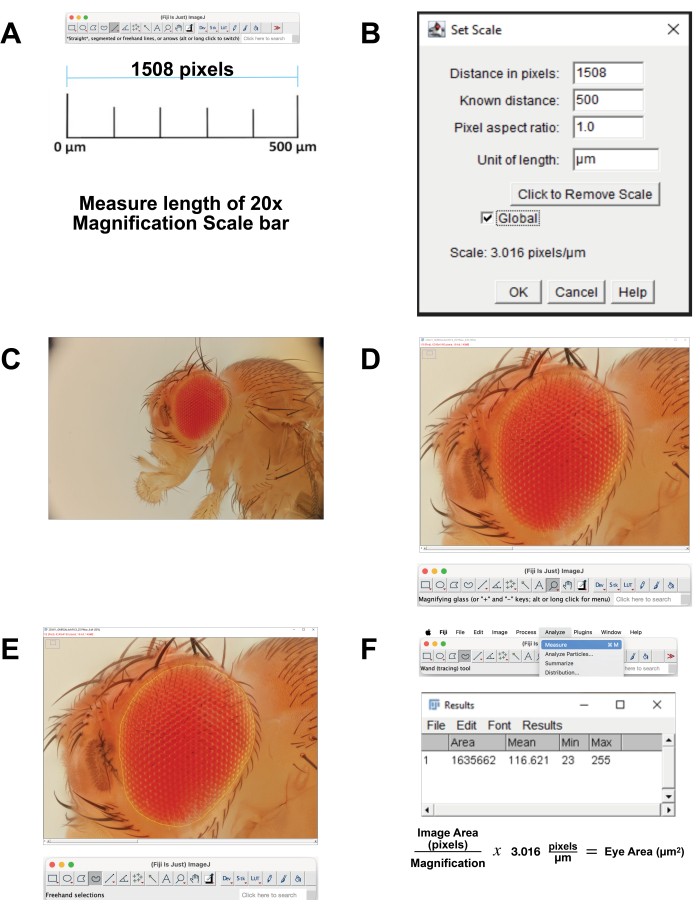
Şekil 4: FIJI'de görüntü analizi. (A) Orijinal görüntüyü ölçeklendirin. Kalibrasyon görüntüsünü indirin ve 500 μm'lik çubuğun uzunluğunu ölçün. (B) Ölçek Ayarla işlevini kullanarak ölçeklendirmeyi ayarlayın. (C) Yığılmış görüntüyü açın. (D) Görüntüyü, göz ortalanacak ve neredeyse tam ekran olacak şekilde büyütün. (E) En dıştaki ommatidia sırası ile onu çevreleyen kütikül arasındaki sınırda gözün ana hatlarını çizmek için Serbest El Seçimi aracını kullanın. (F) Seçilen bölge içindeki alanı ölçmek, Analiz Et | Ölçün | Alan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Drosophila gözü, doku örüntüsü, büyüme kontrolü ve hücre ölümünü incelemek için mükemmel bir model sistemdir. Yakın zamanda hücre içi pH'ın (pHi) doku büyümesini nasıl etkilediğini araştıran bir çalışma yayınladık. İlk olarak, gelişmekte olan gözde sodyum-proton değiştirici DNhe2'nin (memeli NHE1'in ortoloğu) aşırı ekspresyonunun desen bozukluklarına ve artmış proliferasyona neden olduğu bir genetik sistem kurduk
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Burada, yetişkin Drosophila yapılarının numune hazırlama, yüksek çözünürlüklü görüntüleme ve analizi için bir yöntem açıklıyoruz. Drosophila gözü, kanser 19, nörodejenerasyon20 ve metabolik hastalıklar21 dahil olmak üzere hastalıkların altında yatan moleküler mekanizmalar hakkında kritik bilgiler sağlayan, genetik olarak izlenebilir bir model sistemdir. Özellikle, onk...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Yazarlar, tartışmalar ve destek için Grillo-Hill pHly laboratuvarı üyelerine teşekkür eder. Mükemmel teknik destek için Tim Andriese, Randy Kirschner, Kitty (Ngoc-Huong) Nguyen, Marco Parent, Jonny Shaloub ve Librado Veliz'e teşekkür ederiz. Bu çalışma, NIH SC3GM132049 ve 1R16GM153640 ödülleri (BKGH), CSU Biyoteknoloji Fakülte-Öğrenci Araştırma Ödülü (LM ve BKGH) ve San José Eyalet Üniversitesi (FJL) Fen Fakültesi ve Biyolojik Bilimler Bölümü'nden başlangıç fonları tarafından desteklenmiştir. Bu süreçteki becerikliliği ve yardımları için Bernd Becker'e özel bir övgü gidiyor. Figürlerimiz için yüksek kaliteli simgeler sağladığı için BioIcons (https://bioicons.com/) topluluğuna ve özellikle pipet simgesi için Serviere'ye ve Şekil 1 ve Şekil 2'de kullanılan Drosophila, forseps ve masaüstü elektron mikroskobu simgeleri için DBCLS'ye teşekkür ederiz. Ayrıca, Creative Commons 4.0 lisansı (CC-BY) altında lisanslı olan Diogo Losch De Oliveira (doi.org/10.5281/zenodo.3925953) başta olmak üzere figürlerimiz için yüksek kaliteli simgeler sağladıkları için SciDraw (https://scidraw.io/) topluluğuna teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL serological pipette | ThermoFisher Scientific | 170353N | |
| 1.7 mL microcentrifuge tubes | Genesee Scientific | 24-282LR | |
| 20x Apo Microscope Objective | Mitutoyo Corp. | 378-804-3 | |
| Archival 65 lb cardstock | Neenah, Inc. | 91901 | |
| Canon EF 70-200 mm USM II telephoto lens | Canon | 3044C002 | |
| Canon EOS 6D Mark II DSLR Camera Body | Canon | 1897C002 | |
| Diffuser Dome | Macroscopic Solutions | PA-DIF-GIM-SM | |
| Diffuser for Mitutoyo M Plan APO Objectives | Macroscopic Solutions | mitutoyo-diffusers | |
| Drosophila vials and plugs | Genesee Scientific | 32-117BF | |
| Dumont #5 fine-tip forceps | Fisher Scientific | NC9889584 | |
| Goose feathers | Amazon | B01CMMJI6U | |
| Heavy-Duty Anodized Aluminum Tripod | Really Right Stuff, LLC | TFA-32G | |
| Kimwipes | Fisher Scientific | 06-666A | lint-free lab tissue |
| Levenhuk M1000 Plus Digital Camera | Levenhuk | 70358 | |
| No. 3 mounting pin | Indigo Instruments | 33414-3 | |
| Nutri-Fly Bloomington Drosophila media | Genesee Scientific | 66-113 | fly food |
| Point-Punch | M.C. Mieth Manufacturing, Inc. | 448Detail | |
| Screwknob Clamp | Really Right Stuff, LLC | SK-Clamp | For attaching the macro rail to the tripod |
| Stackshot Controller and Macro Rail | Cognisys Inc. | ST3X_100_BUNDLE | |
| Step-down Ring Adapter | RAF Camera | 763461174207 | Lens adapter to connect the microscope objective to the camera lens |
| Titebond Glue | Franklin International | 5013 | |
| Yongnuo YN-24-EX Macro Twin Lite Flash | Shenzhen Yongnuo Photographic Equipment Co. | YN-24EX | |
| Software | |||
| Canon EOS Utility (v. 3.16.1). | Canon | acquisition software | |
| FIJI | National Institutes of Health | Fiji is released as open source under the GNU General Public License. FIJI Version 2.14.0/1.54f | |
| GraphPad Prism | GraphPad Software, Boston, Massachusetts USA | Prism Version 10.3.1 | |
| Zerene Stacker (v.1.04) | Zerene Systems, LLC | Focus Stacking Software |
Referanslar
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287 (5461), 2204-2215 (2000).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9 (3), 235-244 (2016).
- Hodgson, J. A., Parvy, J. -P., Yu, Y., Vidal, M., Cordero, J. B. Drosophila larval models of invasive tumorigenesis for in vivo studies on tumour/peripheral host tssue interactions during cancer cachexia. Int J Mol Sci. 22 (15), 8317(2021).
- Lam Wong, K. K., Verheyen, E. M. Metabolic reprogramming in cancer: mechanistic insights from Drosophila. Dis Model Mech. 14 (7), dmm048934(2021).
- Bonini, N. M. A perspective on Drosophila genetics and its insight into human neurodegenerative disease. Front Mol Biosci. 9, e1060796(2022).
- Drummond-Barbosa, D., Tennessen, J. M. Reclaiming Warburg: using developmental biology to gain insight into human metabolic diseases. Development. 147 (11), dev189340(2020).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Johnson, R. I. Hexagonal patterning of the Drosophila eye. Dev Biol. 478, 173-182 (2021).
- Weasner, B. P., Kumar, J. P. The early history of the eye-antennal disc of Drosophila melanogaster. Genetics. 221 (1), iyac041(2022).
- Pichaud, F., Casares, F. Shaping an optical dome: The size and shape of the insect compound eye. Semin Cell Dev Biol. 130, 37-44 (2022).
- Oster, I. I., Crang, R. E. Scanning electron microscopy of Drosophila mutant and wild type eyes. Trans Am Microsc Soc. 91 (4), 600-602 (1972).
- Gibb, T. J., Oseto, C. Insect collection and identification: Techniques for the field and laboratory. , Academic Press. (2019).
- Mertens, J., Roie, M. V., Merckx, J., Dekoninck, W. The use of low cost compact cameras with focus stacking functionality in entomological digitization projects. ZooKeys. 712, 141-154 (2017).
- Brown, B. V. A further chemical alternative to critical-point-drying for preparing small (or large) flies. Fly Times. 11, 10(1993).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Method. 9 (7), 676-682 (2012).
- Grillo-Hill, B. K., Choi, C., Jimenez-Vidal, M., Barber, D. L. Increased H+ efflux is sufficient to induce dysplasia and necessary for viability with oncogene expression. eLife. 4, e03270(2015).
- White, K. A., Grillo-Hill, B. K., Barber, D. L. Cancer cell behaviors mediated by dysregulated pH dynamics at a glance. J Cell Sci. 130 (4), 663-669 (2017).
- Peralta, J., et al. Drosophila Nhe2 overexpression induces autophagic cell death. Mol Biol Cell. 35 (7), br13(2024).
- Munnik, C., Xaba, M. P., Malindisa, S. T., Russell, B. L., Sooklal, S. A. Drosophila melanogaster: A platform for anticancer drug discovery and personalized therapies. Front Genet. 13, 949241(2022).
- Nitta, Y., Sugie, A. Studies of neurodegenerative diseases using Drosophila and the development of novel approaches for their analysis. Fly. 16 (1), 275-298 (2022).
- Pletcher, R. C., et al. A genetic screen using the Drosophila melanogaster TRiP RNAi collection to identify metabolic enzymes required for eye development. G3: Genes|Genomes|Genetics. 9 (7), 2061-2070 (2019).
- Bangi, E., et al. A personalized platform identifies trametinib plus zoledronate for a patient with KRAS-mutant metastatic colorectal cancer. Sci Adv. 5 (5), eaav6528(2019).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır