JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
외부 성체 초파리 구조의 정량화를 위한 빠르고 간단한 워크플로우
요약
여기에서는 패터닝 및 성장 결함을 정량화하기 위해 성인 초파리 눈의 고해상도 이미징을 위한 빠르고 저렴한 워크플로우를 제시합니다. 포인트 마운팅(point-mounting), 고해상도 이미지 획득(high-resolution image acquisition) 및 이미지 분석을 통한 시료 전처리를 위한 프로토콜에 대해 설명합니다.
초록
초파리(Drosophila) 겹눈은 형태 형성을 주도하는 분자 메커니즘과 생물학적 과정을 밝혀낸 정밀한 패턴의 조직입니다. 그것은 유전적 상호 작용과 유전자 기능을 특성화하는 데 사용되는 ommatidia라고 하는 반복되는 단위 눈의 간단한 구조입니다. 눈 구조에 영향을 미치는 돌연변이는 쉽게 감지하고 분석할 수 있습니다. 따라서 이 시스템은 자원이 부족한 기관에서 자주 사용됩니다. 추가 표현형 분석에는 종종 정량 분석에 적합한 고배율 이미지를 생성하기 위해 주사 전자 현미경(SEM)이 포함됩니다. 그러나 SEM은 비용이 많이 들고 값비싼 시약이 필요합니다. 샘플 준비는 며칠에 걸쳐 진행됩니다. 또한 시료 준비 및 기기 유지보수를 위해 상근 직원이 필요한 경우가 많습니다. 이로 인해 자원이 부족한 기관이나 긴축 예산 기간 동안 유용성이 제한됩니다. 곤충학에서 고해상도 디지털 이미징 기술의 사용은 종의 식별 및 특성화를 위한 일반적인 관행입니다. 이 논문은 개방형 소프트웨어 ImageJ를 사용하여 성체 초파리 구조의 고해상도 디지털 이미징과 정량 분석을 가능하게 하는 전략을 결합하는 방법을 설명합니다. 이 워크플로우는 정량적 표현형 분석에 대한 비용 효율적이고 신속한 접근 방식을 통해 자금이 부족하고 자원이 부족한 연구 시설의 한계를 해결하는 빠르고 학생 친화적인 대안입니다.
서문
Drosophila melanogaster는 분자 신호 전달 경로와 세포 행동을 규명하기 위해 수십 년 동안 사용되어 온 강력한 유전자 모델 유기체입니다. 다세포 발달에 필수적인 진화적으로 보존된 많은 신호 전달 경로가 처음으로 확인되었고 그 작용 메커니즘이 초파리에서 정의되었습니다. 모든 인간 질병 관련 유전자의 약 65-75%는 Drosophila 1,2에 ortholog를 가지고 있습니다. 성인 초파리 눈은 암 3,4, 신경 퇴행5 및 대사 장애6를 포함한 인간 질병과 관련된 중요한 보존 유전자의 발견을 용이하게 하는 편견 없는 유전자 검사를 가능하게 한 중요한 모델입니다.
초파리의 눈은 옴마티디아(ommatidia)라고 불리는 ~800개의 눈들로 구성되어 있으며, 이들은 성인의 눈 7의 표면을 가로질러 육각형 패턴으로 정확하게 배열되어 있다. 각 옴마티듐은 비대칭 사다리꼴 내에서 뚜렷한 위치를 차지하는 8개의 광수용체 뉴런으로 구성됩니다. 이들은 4개의 비신경 원추세포와 2개의 주요 색소 세포에 의해 지원되며, 수정체와 유사 원추세포를 분비하여 광수용체 뉴런의 빛을 감지하는 횡문골에 빛을 집중시킵니다. 인접한 ommatidia는 2 차 색소 세포, 3 차 색소 세포 및 기계 감각 강모 복합체 8,9,10으로 구성된 단일 줄의 interommatidial lattice cells로 분리됩니다.
눈 발달의 섭동은 성인의 눈에서 눈 크기의 증가 또는 감소, 수정체 또는 칫솔모의 비정상적인 존재 또는 구조, 또는 일반적으로 변하지 않는 육각형 패턴이 중단되어 더 이상 눈 표면을 가로질러 옴마티디아를 따라갈 수 없는 "거친 눈"으로 볼 수 있습니다. 이러한 표현형은 절개 현미경을 사용하여 총 조직 수준에서 점수를 매길 수 있습니다. 표현형의 상세 분석에는 전통적으로 주사 전자 현미경 검사와 정량적 이미지 분석이 포함된다11. 그러나 주사 전자 현미경을 사용하려면 값비싼 기기, 값비싼 시약, 며칠에 걸친 시료 준비, 유지 관리를 위한 정규직 직원이 필요한 경우가 많습니다.
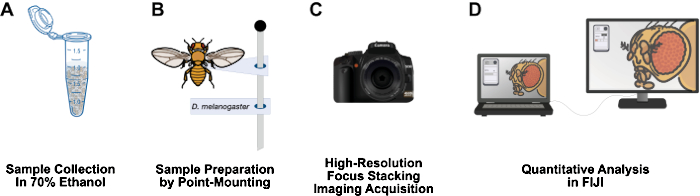
그림 1: 성체 Drosophila 구조를 이미징하기 위한 워크플로우. (A) 70% 에탄올에서 성인 초파리를 수집하고 고정합니다. (B) 포인트 마운팅 및 핀에 부착하여 이미징을 위한 샘플을 준비합니다. (C) 초점 스태킹 및 통합을 통해 고해상도 이미지를 획득합니다. (D) FIJI를 사용하여 이미지를 정량화합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 백서는 상대적으로 저렴하고, 시료 전처리 시간이 짧고, 3피트 실험실 벤치에 쉽게 설치할 수 있고, 위험 물질이 필요하지 않으며, 초파리 연구 실험실에 오래 사용할 수 있는 워크플로우를 제시합니다(그림 1). 포인트 장착은 Drosophila12와 같은 작고 부드러운 몸체의 곤충을 공기 건조하고 보존하는 데 사용되는 곤충학 기술입니다. 이 방법은 10배에서 1,000배의 효과적인 배율을 위해 현미경 대물렌즈와 고해상도 DSLR 카메라를 결합하는 데 의존합니다. 매크로 사진에 내재된 제한된 피사계 심도는 초점 스태킹(focus stacking)에 의해 극복됩니다: 관심 표본13을 통해 이동하는 초점면으로 일련의 이미지를 함께 연결합니다. 이 방법은 표현형의 정량화에 적합한 고해상도 이미지를 생성하며 날개, 다리, 흉부 및 복부와 같은 다른 관심 구조에 쉽게 적용할 수 있습니다. 이미지 분석 워크플로우는 무료 이미지 분석 프로그램인 FIJI(NIH ImageJ)를 사용합니다. 이 방법론은 자원이 부족한 기관의 학부생과 과학자들이 시료 준비, 고해상도 이미징 및 분석을 이용할 수 있도록 합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 성인 초파리 수집 및 고정
- Drosophila crosses를 설정하거나 균주를 선택하여 파리 먹이가 들어있는 바이알에 넣으십시오. 파리가 발달하고 성충이 닫힐 때까지(25°C에서 ~10-14일) 원하는 온도(보통 25°C)에서 바이알을 배양합니다.
- CO2 로 파리를 마취하고 CO2 패드에 놓습니다.
- 깃털로 파리를 분류하고 원하는 표현형(예: 직선 날개)을 가진 개체를 선택합니다. 1mL 혈청학적 피펫의 가늘어진 끝 부분에 맞게 거위 깃털을 다듬어 깃털 파리 분류기를 만듭니다.
- 1.7% 에탄올 1mL가 든 70mL 미세 원심분리기 튜브를 준비합니다. 선택한 파리를 마이크로 원심 분리기 튜브에 넣고 얼음에 넣으십시오. 마이크로 원심분리기 튜브를 4°C에서 밤새 보관합니다(그림 2A).
알림: 파리를 에탄올에 24시간 이상 보존하지 마십시오. 70% 에탄올에 파리를 장기간 보관하면 눈과 신체 색소가 손실됩니다.
2. 포인트 마운팅을 통한 시료 전처리
참고 : 초파리 는 공기 건조시 부서지기 쉽고 붕괴되는 부드러운 몸체의 곤충입니다. 따라서 이 프로토콜은 샘플이 장착되는 당일에 이미징해야 합니다. 샘플 손실을 방지하기 위해 한 번에 ~5마리의 작은 세트로 작업하십시오. 효율성에 따라 한 세트의 샘플 수를 늘립니다. 이미징까지 더 많은 시간이 필요한 표본은 농도가 증가하는 HMDS(hexamethyldisilazane) 시리즈를 통해 탈수할 수 있습니다14.
- 특수 포인트 펀치를 사용하여 보관용 65lb 카드스톡에서 작은 삼각형 포인트(7.1mm x 2.7mm)를 자릅니다. Dumont #5 파인 팁 핀셋을 사용하여 팁(가장 좁은 25%)을 90° 각도로 구부려 포인트를 준비합니다(그림 2B).
- Dumont #5 파인 팁 핀셋을 사용하여 마이크로 원심분리기 튜브에서 파리를 제거합니다(1.4단계). 과도한 에탄올을 제거하기 위해 보푸라기가 없는 실험실 티슈로 파리를 부드럽게 닦아냅니다. 해부 현미경 아래의 인덱스 카드에 각 파리를 왼쪽에 놓습니다.
참고: 관심 영역이 아닌 해부학적 구조를 잡고 튜브에서 파리를 제거합니다 - 머리를 이미징할 때 날개나 다리로 샘플을 잡습니다. 샘플을 복부로 잡지 마십시오., 그 구조는 파리를 카드 포인트에 붙이는 데 사용됩니다. - 가죽 접착제를 준비하고 원하는 점도에 맞게 농도를 조정하십시오. 가죽 접착제 1-2방울과 탈이온수(DI) 1-2방울을 섞고 인덱스 카드의 전사 피펫과 섞습니다. 집게로 넓은 끝에서 준비된 카드 포인트를 집어 올리고 접착제-물 혼합물에 두드려 포인트의 구부러진 끝에 소량의 희석된 접착제를 놓습니다(그림 2C).
알림: 접착제는 퍼질 수 있어야 하지만 묽지 않아야 합니다. - 점의 구부러진 끝을 복부 분절 2-3 주위의 오른쪽 복부 앞쪽에 적용합니다(그림 2C). 접착제가 마르기 전에 파리의 전후 축이 점의 구부러진 끝과 수직이 되도록 파리를 약간 조정하십시오.
- 3번 장착 핀을 카드 포인트의 넓은 끝에 삽입하고(그림 2D) 곤충 고정 블록(그림 2E)에 고정합니다. 각 핀 또는 핀의 행에 해당 유전자형을 레이블을 지정합니다.

그림 2: 시료 전처리. (A) 성체 초파리 는 표현형 마커를 기반으로 분류되고 얼음에 70% 에탄올을 함유한 라벨링된 미세 원심분리기 튜브에 수집됩니다. 파리는 4°C에서 하룻밤 동안 보관됩니다. (B) 종이 카드 포인트는 한 쌍의 #5 집게를 사용하여 좁은 끝을 카드의 나머지 부분에서 90° 구부려 준비합니다. (C) 튜브에서 파리를 회수하고 잠시 자연 건조시킵니다. 가죽 접착제는 준비된 카드 포인트의 작고 접힌 끝에 바르고 복부 세그먼트 2-3에서 성인 플라이에 붙입니다. (D) 표본은 식별 라벨과 함께 #3 스테인리스강 곤충 핀에 장착됩니다. (E) 고정된 표본은 이미지 획득 준비가 될 때까지 샘플 보드에 보관됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 고해상도 초점 스태킹 이미징 획득
- 조립되고 맞춤화된 초점 스태킹 이미징 시스템을 사용하여 파리 눈의 고해상도 사진을 획득합니다.
- 77mm 렌즈 어댑터를 통해 20x Apo Microscope 대물렌즈에 연결된 70-200mm 망원 렌즈가 장착된 DSLR 카메라 본체로 사진을 캡처합니다.
- 표본이 디퓨저를 통해 플래시로 조명되는지 확인합니다(그림 3).
- Stackshot Controller 및 Macro Rail을 사용하여 Z 위치를 제어합니다.
- 카메라, 플래시 및 전동 스테이지를 견고한 아노다이징 알루미늄 삼각대에 연결합니다.
- 각 포인트 마운트 샘플을 범용 스테이지 짐벌에 배치하여 눈이 렌즈를 향하도록 머리를 향하게 합니다. 집게로 머리를 부드럽게 움직여 머리 위치를 조정합니다.
주의: 크고 빠르게 조정하면 우발적으로 목이 잘릴 수 있습니다. - 카메라를 랩톱 컴퓨터에 테더링한 상태에서 소프트웨어에서 획득 설정을 조정합니다. 플래시 파워 1/32, 셔터 속도 1/200, 조리개 F2.8 및 ISO 400 설정을 사용하여 20x 배율로 표본을 촬영합니다. 자동 초점 및 이미지 안정화 기능이 모두 꺼져 있는지 확인합니다.
참고: 이 설정은 최적의 플래시 조명, 셔터 속도 및 피사계 심도의 균형을 유지합니다. 다른 배율 및/또는 렌즈 조합에 맞게 조정해야 합니다. - 결과 이미지 스택(10-50개 이미지)을 원하는 파일 폴더에 저장할 위치를 설정합니다. 이미지에 충분한 저장 용량(이미지당 ~8.5MB)을 확인합니다.
- 자동 거리 모드에서 Stackshot 제어 장치의 초점 스택 설정을 조정합니다.
- 스텝 크기를 5μm로 설정하고 포커스 스택의 시작 및 중지 위치를 설정하여 스텝 수를 계산합니다.
- LiveView 모드에서 표본을 보고 자동 촬영 모드에서 카메라로 표본을 확인하여 시작 및 중지 위치를 식별할 수 있습니다.
- 표본의 가장 가까운 부분에 초점이 맞춰지도록 레일을 이동한 다음(설정 시작 위치) 가장 관심 있는 특징에 초점이 맞춰진 위치로 이동합니다( 설정 끝 위치).
- 카메라를 수동 촬영 모드로 되돌리고 스택샷 컨트롤 유닛에서 이미지 획득을 시작합니다.
참고: 이미지 획득 시간은 표본의 크기에 따라 다릅니다. 대형 표본에 필요한 피사계 심도가 클수록 이미지 스택에 더 많은 슬라이스가 포함되어 전체 획득 시간이 연장됩니다. - 참조된 포커스 스태킹 소프트웨어에서 파일을 엽니다. 를 클릭하여 스택형 이미지를 생성합니다 . 모두 정렬 및 적층(PMax).
- .tif 파일 | 출력 이미지를 저장합니다.
참고: 적층된 이미지 파일의 해상도와 이미징된 표본의 수에 따라 이미지 백업을 위해 대형 외장 하드 드라이브(1TB)가 필요할 수 있습니다. 이 프로토콜에서 스택된 이미지는 압축되기 전에 각각 약 100MB입니다.

그림 3: 이미지 획득. (A) 다음과 같이 표시된 부품이 있는 이미징 장치: a) DSLR 카메라 본체; b) 망원 렌즈; c) 20x Apo 현미경 대물렌즈 및 어댑터; d) 플래시; e) 렌즈 및 돔 디퓨저; f) 스택샷 컨트롤러, 매크로 레일 및 로터리 스테이지; g) 유니버설 스테이지 짐벌; h) 삼각대. (B) 광 확산기가 있는 이미징 장치. (C) 이미징을 위한 위치에 장착된 표본의 클로즈업. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 성인의 눈 면적을 계산하기 위한 FIJI 분석 워크플로우
- 이미지 분석을 위해 ImageJ.net 웹 사이트에서 FIJI 소프트웨어15 를 구하십시오.
- 분석할 이미지를 선택하면 눈이 중앙에 배치되고 적절한 조명과 주변 흐림 현상을 최소화하여 카메라와의 적절한 정렬을 나타낼 수 있습니다.
- 이미지 배율을 보정합니다.
- 500 μm와 상관관계가 있는 20x 배율을 위한 스케일 바 이미지를 다운로드하십시오. 또는 이미지 획득 시 동일한 설정을 사용하여 자를 촬영합니다. FIJI Software에서 이미지를 엽니다.
- 눈금 막대의 길이를 측정합니다(그림 4A). 직선 도구를 사용하여 선을 정확하게 추적합니다. Analyze(분석) | 측정. 이 픽셀 거리는 500μm 에 해당합니다(그림 4B).
- 미크론당 픽셀을 계산합니다. 이를 사용하여 픽셀 측정을 마이크로미터 측정으로 변환합니다.
- FIJI에서 스택 이미지 파일을 엽니다(그림 4C).
- 도구 모음에서 돋보기를 선택하여 초점 영역을 확대합니다. 눈과 바로 주변의 머리 표피로 화면을 채우십시오(그림 4D).
- 도구 모음에서 자유형 선택 도구를 선택합니다. ommatidia의 가장 바깥쪽 줄의 윤곽을 따라 망막 영역의 윤곽을 가능한 한 가깝게 그립니다(그림 4E). 선택 영역의 일부를 제거하려면 옵션 버튼을 누른 상태에서 제거할 픽셀을 선택합니다. 선택 영역에 추가하려면 option 버튼과 shift 버튼을 누른 상태에서 추가할 픽셀을 선택합니다.
- 면적을 계산하려면 분석 | 상단 메뉴에서 측정합니다(그림 4F). 면적, 평균, 최소 및 최대 매개변수가 있는 새 창이 나타납니다. 이러한 데이터를 복사하여 스프레드시트에 붙여넣어 문서화하고 픽셀에서 마이크로미터 측정으로 변환할 수 있습니다.
- 적절한 통계 분석을 수행합니다.
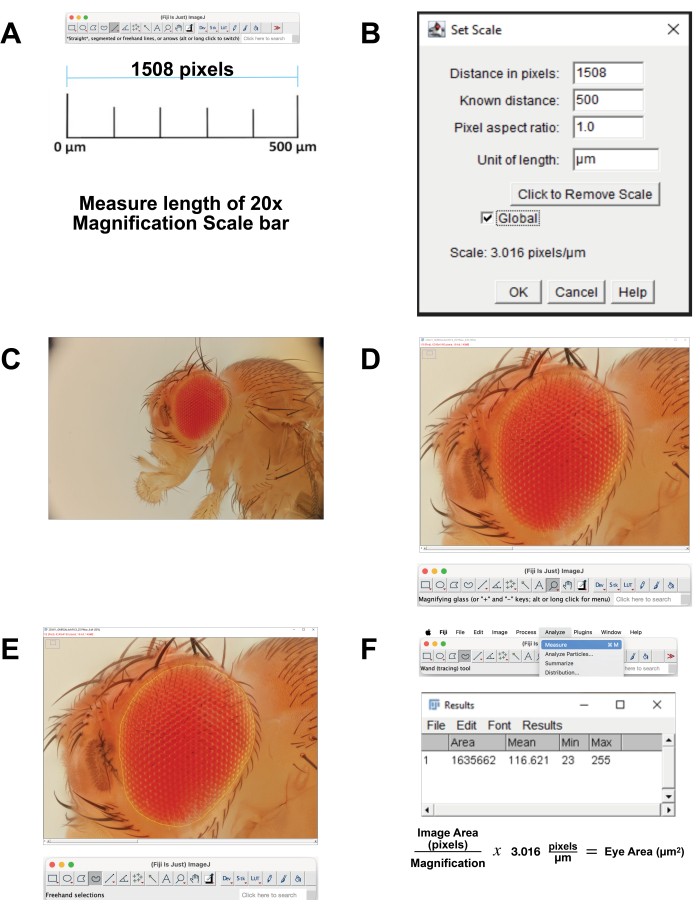
그림 4: FIJI의 이미지 분석. (A) 원본 이미지의 배율을 조정합니다. 캘리브레이션 이미지를 다운로드하고 500 μm bar의 길이를 측정합니다. (B) Set Scale 기능을 사용하여 스케일을 조정합니다. (C) 스택된 이미지를 엽니다. (D) 눈이 중앙에 있고 거의 전체 화면이 되도록 이미지를 확대합니다. (E) 자유형 선택 도구를 사용하여 옴마티디아의 가장 바깥쪽 줄과 주변 큐티클 사이의 경계에서 눈의 윤곽을 그립니다. (F) 선택한 영역 내의 면적을 측정하려면 Analyze | 측정 | 지역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
Drosophila eye는 조직 패턴화, 성장 조절 및 세포 사멸을 연구하기 위한 훌륭한 모델 시스템입니다. 당사는 최근 세포 내 pH(pHi)가 조직 성장에 어떤 영향을 미치는지 조사한 연구를 발표했습니다. 첫째, 발달 중인 눈에서 나트륨-양성자 교환기 DNhe2(포유류 NHE1의 ortholog)의 과발현이 패턴 결함을 유발하고 증식을 증가시키는 유전 시스템을 확립했다16...
Access restricted. Please log in or start a trial to view this content.
토론
여기에서는 시료 전처리, 고분해능 이미징 및 성체 초파리 구조 분석을 위한 방법을 설명합니다. 초파리 눈은 유전적으로 다루기 쉬운 모델 시스템으로, 암19, 신경 퇴행20 및 대사 질환21을 포함한 질병의 기저에 있는 분자 메커니즘에 대한 중요한 통찰력을 제공합니다. 특히, 암환자 "아바타(avatar)"는 종?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
저자들은 토론과 지원에 대해 Grillo-Hill pHly 연구소의 구성원들에게 감사의 뜻을 전합니다. 탁월한 기술 지원을 제공해 주신 Tim Andriese, Randy Kirschner, Kitty (Ngoc-Huong) Nguyen, Marco Parent, Jonny Shaloub, Librado Veliz에게 감사드립니다. 이 연구는 NIH SC3GM132049 및 1R16GM153640 상(BKGH), CSU 생명공학 교수-학생 연구상(LM 및 BKGH), 산호세 주립대학교(FJL)의 과학 대학 및 생물 과학과의 초기 자금의 지원을 받았습니다. 이 과정에서 보여준 지략과 도움에 대해 베른트 베커(Bernd Becker)에게 특별한 감사를 표합니다. 우리는 우리의 그림에 고품질 아이콘을 제공해 준 BioIcons (https://bioicons.com/) 커뮤니티에 감사하며, 특히 피펫 아이콘에 대한 Serviere와 CC-BY 4.0 Unported에 따라 라이선스가 부여된 그림 1 및 그림 2에 사용된 Drosophila, 겸자 및 탁상용 전자 현미경 아이콘에 대한 DBCLS에 감사드립니다. 또한 크리에이티브 커먼즈 4.0 라이선스(CC-BY)에 따라 라이선스가 부여된 피규어, 특히 Diogo Losch De Oliveira(doi.org/10.5281/zenodo.3925953)에 고품질 아이콘을 제공해 준 SciDraw(https://scidraw.io/) 커뮤니티에 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL serological pipette | ThermoFisher Scientific | 170353N | |
| 1.7 mL microcentrifuge tubes | Genesee Scientific | 24-282LR | |
| 20x Apo Microscope Objective | Mitutoyo Corp. | 378-804-3 | |
| Archival 65 lb cardstock | Neenah, Inc. | 91901 | |
| Canon EF 70-200 mm USM II telephoto lens | Canon | 3044C002 | |
| Canon EOS 6D Mark II DSLR Camera Body | Canon | 1897C002 | |
| Diffuser Dome | Macroscopic Solutions | PA-DIF-GIM-SM | |
| Diffuser for Mitutoyo M Plan APO Objectives | Macroscopic Solutions | mitutoyo-diffusers | |
| Drosophila vials and plugs | Genesee Scientific | 32-117BF | |
| Dumont #5 fine-tip forceps | Fisher Scientific | NC9889584 | |
| Goose feathers | Amazon | B01CMMJI6U | |
| Heavy-Duty Anodized Aluminum Tripod | Really Right Stuff, LLC | TFA-32G | |
| Kimwipes | Fisher Scientific | 06-666A | lint-free lab tissue |
| Levenhuk M1000 Plus Digital Camera | Levenhuk | 70358 | |
| No. 3 mounting pin | Indigo Instruments | 33414-3 | |
| Nutri-Fly Bloomington Drosophila media | Genesee Scientific | 66-113 | fly food |
| Point-Punch | M.C. Mieth Manufacturing, Inc. | 448Detail | |
| Screwknob Clamp | Really Right Stuff, LLC | SK-Clamp | For attaching the macro rail to the tripod |
| Stackshot Controller and Macro Rail | Cognisys Inc. | ST3X_100_BUNDLE | |
| Step-down Ring Adapter | RAF Camera | 763461174207 | Lens adapter to connect the microscope objective to the camera lens |
| Titebond Glue | Franklin International | 5013 | |
| Yongnuo YN-24-EX Macro Twin Lite Flash | Shenzhen Yongnuo Photographic Equipment Co. | YN-24EX | |
| Software | |||
| Canon EOS Utility (v. 3.16.1). | Canon | acquisition software | |
| FIJI | National Institutes of Health | Fiji is released as open source under the GNU General Public License. FIJI Version 2.14.0/1.54f | |
| GraphPad Prism | GraphPad Software, Boston, Massachusetts USA | Prism Version 10.3.1 | |
| Zerene Stacker (v.1.04) | Zerene Systems, LLC | Focus Stacking Software |
참고문헌
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287 (5461), 2204-2215 (2000).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9 (3), 235-244 (2016).
- Hodgson, J. A., Parvy, J. -P., Yu, Y., Vidal, M., Cordero, J. B. Drosophila larval models of invasive tumorigenesis for in vivo studies on tumour/peripheral host tssue interactions during cancer cachexia. Int J Mol Sci. 22 (15), 8317(2021).
- Lam Wong, K. K., Verheyen, E. M. Metabolic reprogramming in cancer: mechanistic insights from Drosophila. Dis Model Mech. 14 (7), dmm048934(2021).
- Bonini, N. M. A perspective on Drosophila genetics and its insight into human neurodegenerative disease. Front Mol Biosci. 9, e1060796(2022).
- Drummond-Barbosa, D., Tennessen, J. M. Reclaiming Warburg: using developmental biology to gain insight into human metabolic diseases. Development. 147 (11), dev189340(2020).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Johnson, R. I. Hexagonal patterning of the Drosophila eye. Dev Biol. 478, 173-182 (2021).
- Weasner, B. P., Kumar, J. P. The early history of the eye-antennal disc of Drosophila melanogaster. Genetics. 221 (1), iyac041(2022).
- Pichaud, F., Casares, F. Shaping an optical dome: The size and shape of the insect compound eye. Semin Cell Dev Biol. 130, 37-44 (2022).
- Oster, I. I., Crang, R. E. Scanning electron microscopy of Drosophila mutant and wild type eyes. Trans Am Microsc Soc. 91 (4), 600-602 (1972).
- Gibb, T. J., Oseto, C. Insect collection and identification: Techniques for the field and laboratory. , Academic Press. (2019).
- Mertens, J., Roie, M. V., Merckx, J., Dekoninck, W. The use of low cost compact cameras with focus stacking functionality in entomological digitization projects. ZooKeys. 712, 141-154 (2017).
- Brown, B. V. A further chemical alternative to critical-point-drying for preparing small (or large) flies. Fly Times. 11, 10(1993).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Method. 9 (7), 676-682 (2012).
- Grillo-Hill, B. K., Choi, C., Jimenez-Vidal, M., Barber, D. L. Increased H+ efflux is sufficient to induce dysplasia and necessary for viability with oncogene expression. eLife. 4, e03270(2015).
- White, K. A., Grillo-Hill, B. K., Barber, D. L. Cancer cell behaviors mediated by dysregulated pH dynamics at a glance. J Cell Sci. 130 (4), 663-669 (2017).
- Peralta, J., et al. Drosophila Nhe2 overexpression induces autophagic cell death. Mol Biol Cell. 35 (7), br13(2024).
- Munnik, C., Xaba, M. P., Malindisa, S. T., Russell, B. L., Sooklal, S. A. Drosophila melanogaster: A platform for anticancer drug discovery and personalized therapies. Front Genet. 13, 949241(2022).
- Nitta, Y., Sugie, A. Studies of neurodegenerative diseases using Drosophila and the development of novel approaches for their analysis. Fly. 16 (1), 275-298 (2022).
- Pletcher, R. C., et al. A genetic screen using the Drosophila melanogaster TRiP RNAi collection to identify metabolic enzymes required for eye development. G3: Genes|Genomes|Genetics. 9 (7), 2061-2070 (2019).
- Bangi, E., et al. A personalized platform identifies trametinib plus zoledronate for a patient with KRAS-mutant metastatic colorectal cancer. Sci Adv. 5 (5), eaav6528(2019).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유