Method Article
ניתוח יציבות פלסמיד עם מיקרופלואידיקה טיפתית בקוד פתוח
In This Article
Summary
זרימת עבודה מיקרופלואידית נגישה בקוד פתוח מוצגת לניתוח מקביל של שימור פלסמיד בחיידקים. על ידי שימוש במיקרוסקופ פלואורסצנטי כדי לכמת נוכחות פלסמיד במיקרו-מושבות חד-תאיות בתוך מיקרו-טיפות ג'ל, שיטה זו מספקת אלטרנטיבה מדויקת, נגישה וניתנת להרחבה לספירת צלחות מסורתית.
Abstract
פלסמידים ממלאים תפקיד חיוני בביולוגיה סינתטית בכך שהם מאפשרים החדרה וביטוי של גנים זרים באורגניזמים שונים, ובכך מקלים על בניית מעגלים ומסלולים ביולוגיים בתוך ובין אוכלוסיות תאים. עבור יישומים רבים, שמירה על פלסמידים פונקציונליים ללא בחירת אנטיביוטיקה היא קריטית. מחקר זה מציג זרימת עבודה מיקרופלואידית מבוססת חומרה פתוחה לניתוח שימור פלסמיד על ידי תרבית תאים בודדים במיקרו-טיפות ג'ל וכימות מיקרו-מושבות באמצעות מיקרוסקופיה פלואורסצנטית. גישה זו מאפשרת ניתוח מקביל של טיפות ומיקרו-מושבות רבות, ומספקת כוח סטטיסטי גדול יותר בהשוואה לספירת צלחות מסורתית ומאפשרת שילוב של הבדיקה בתהליכי עבודה מיקרופלואידיים אחרים של טיפות. על ידי שימוש בפלסמידים המבטאים חלבונים פלואורסצנטיים לצד כתם DNA פלואורסצנטי לא ספציפי, ניתן לזהות ולהבדיל מושבות בודדות על סמך אובדן פלסמיד או ביטוי סמן פלואורסצנטי. יש לציין כי זרימת עבודה מתקדמת זו, המיושמת עם חומרת קוד פתוח, מציעה בקרת זרימה מדויקת וניהול טמפרטורה הן של הדגימה והן של השבב המיקרופלואידי. תכונות אלה משפרות את קלות השימוש, החוסן והנגישות של זרימת העבודה. בעוד שהמחקר מתמקד ב-Escherichia coli כמודל הניסיוני, הפוטנציאל האמיתי של השיטה טמון ברבגוניות שלה. ניתן להתאים אותו למחקרים שונים הדורשים כימות אותות פלואורסצנטיים מפלסמידים או כתמים, כמו גם ליישומים אחרים. אימוץ חומרת קוד פתוח מרחיב את הפוטנציאל לביצוע ביואנליזות בתפוקה גבוהה באמצעות טכנולוגיה נגישה במסגרות מחקר מגוונות.
Introduction
פלסמידים הם יסודות גנטיים חיוניים בתאים פרוקריוטיים, התורמים באופן משמעותי לאבולוציה מיקרוביאלית באמצעות העברת DNA רוחבית והסתגלות מהירה לשינויים סביבתיים 1,2. מולקולות DNA חוץ-כרומוזומליות אלו נושאות גנים המספקים תכונות מועילות, כגון עמידות לאנטיביוטיקה, תפקודים מטבוליים וגורמי אלימות, מה שהופך אותם לבעלי ערך למחקר מיקרוביולוגיה, ביולוגיה סינתטית ומחקרי אבולוציה2. עם זאת, תחזוקת פלסמיד באוכלוסיות תאים היא מאתגרת בשל העומס המטבולי של שכפול והפרדה, וכתוצאה מכך לעתים קרובות אובדן פלסמיד ללא לחץ בחירה3. בנוסף, תורשה יציבה דורשת מנגנונים כמו מערכות רעלן-אנטי-רעלן וחלוקה, מה שמוסיף מורכבות לתחזוקת הפלסמיד. הערכת יציבות הפלסמיד בתנאים משתנים היא חיונית הן למחקר בסיסי והן ליישומים מעשיים המשתמשים בפלסמידים כמרכיב מחקר עיקרי 4,5. לרוב השיטות הנוכחיות להערכת יציבות הפלסמיד יש מגבלות משמעותיות: שיטות מבוססות ציטומטריית זרימה מספקות נתונים עקיפים ברמת האוכלוסייה, דורשות ציוד יקר וחסרות הדמיה ישירה של מושבות6. שיטות טרנסקריפטומיקה ופרוטאומיקה בתפזורת הן יקרות, מספקות רק תגובות תאיות ממוצעות, ואינן יכולות לכמת ישירות את שימור הפלסמיד במושבות בודדות6. שיטות מסורתיות כמו דילול סדרתי ומעבר הן פשוטות אך גוזלות זמן וחסרות דיוק וייצוג7. בסך הכל, הסקה כמותית או הקרנה של מספר המושבות השומרות על פלסמיד פונקציונלי ספציפי לאורך זמן או לחצים סלקטיביים נותרה מאתגרת.
כדי להתמודד עם אתגרים אלה, מוצג זרימת עבודה מיקרופלואידית חדשה המשתמשת במכשירי מחקר חומרה פתוחים כדי לכמת אותות פלואורסצנטיים במושבות מבודדות מרובות של חיידקים, תוך שימוש ב-Escherichia coli כמודל. שיטה זו מאפשרת תפוקה גבוהה וניתוח מדויק של שימור פלסמיד בתנאים שונים או לחצים סלקטיביים. ניתוח רזולוציה של תא בודד מספק שיטה מדויקת למניפולציה של מושבות מבודדות, ומניב נתונים רגישים על כימות פלסמיד שיכולים לעזור להעריך את שיעורי השמירה והאובדן4.
מיקרופלואידיקה, במיוחד מיקרופלואידיקה טיפתית, התגלתה ככלי רב עוצמה לעטיפה ומניפולציה של תאים בודדים בסביבות מבוקרות8. באופן ספציפי, טיפות מיקרוג'ל יכולות לעטוף תאים בודדים לתפוקה גבוהה וניתוח מדויק ללא צורך בשמירה על טיפות תלויות בשמן9, מה שמאפשר מחקר מבוקר של דינמיקת פלסמיד במיקרו-סביבה מוגדרת. לאחר עטיפה של תרחיפי תאים ישירות מקצה פיפטה10, ניתן להשתמש בטכניקות פלואורסצנטיות כדי לנטר את הצמיחה של מיקרו-מושבות בתוך טיפות, מה שמאפשר ניתוח מפורט של שימור והפרדה של פלסמיד בלחצי בחירה שונים3.
היתרונות של שיטה זו על פני טכניקות מסורתיות של תרבית בתפזורת כוללים דיוק מוגבר, שונות מופחתת ויכולת לבצע ניתוחים בתפוקה גבוהה. טכנולוגיית מיקרופלואידיקה בקוד פתוח מתגברת על המגבלות של מערכות קנייניות יקרות, כגון סוגיות של נגישות, הסתגלות ותחזוקה, שלעתים קרובות מעכבות את התקדמות המחקר 11,12,13. על ידי הדגמה כיצד ליישם את זרימת העבודה הניסויית המתקדמת של ניתוח שימור פלסמיד במיקרוג'לים עם מכשור קוד פתוח, ניתנת שיטה נגישה ואמינה למחקר בביולוגיה של פלסמידים, יישומי ביולוגיה סינתטית וטכניקות ניתוח טיפות מיקרופלואידיות.
לסיכום, מאמר זה מציג שיטה נגישה להערכה כמותית של שימור פלסמיד ב - E. coli בעל עוצמה סטטיסטית גבוהה. היכולות של שיטה זו הופכות אותה לכלי רב ערך לקידום ההבנה של ביולוגיה של פלסמידים ושיפור יישומי ביולוגיה סינתטית.
Protocol
איור 1מספק סקירה סכמטית להערכת יציבות הפלסמיד ב - E. coli. פרטי הריאגנטים והציוד המשמש מפורטים בטבלת החומרים. הנתונים הגולמיים ותסריטי ההדמיה זמינים בכתובת https://doi.org/10.17605/OSF.IO/6YWJK.
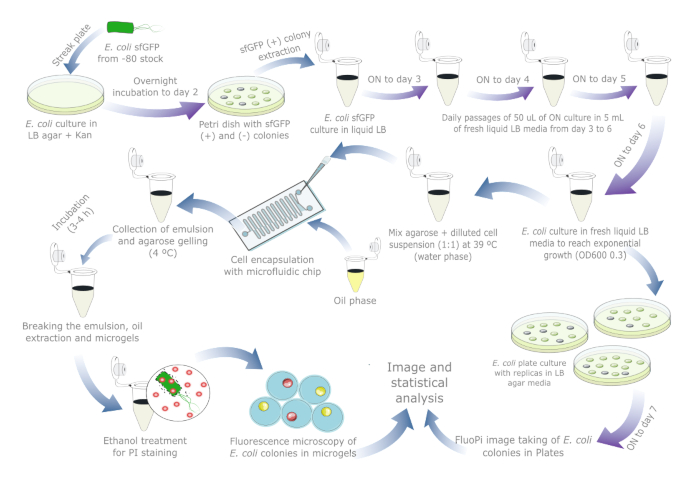
איור 1: פרוטוקול יומיומי להערכת יציבות פלסמיד ב - E. coli. חיצים כחולים מציינים צעדים במהלך היום, וחצים סגולים מציינים דגירה של לילה. כל דגירה של נוזל ואגר בוצעה ב-37 מעלות צלזיוס לצד צינור/צלחת בקרה שלילית נפרדת. שים לב שהכנת תרבית התאים והמעברים אינם נחוצים עבור דגימות בעולם האמיתי שבהן ייתכן שכבר התרחש אובדן פלסמיד, ולכן יש לצמצם את הפרוטוקול ליום או יומיים אם כלולה תרבית ייחוס צלחת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
1. הכנת שבב מיקרופלואידית
הערה: בפרוטוקול זה, ניתן להשתמש בעיצובים שונים של שבבים מסחריים או מותאמים אישית עבור אנקפסולציה של תאים המסוגלים ליצור טיפות מים בשמן בקוטר של פחות מ-100 מיקרומטר במשטר טפטוף. עבור מחקר זה, השבב תוכנן ויוצר (ראה נתוני מאמר https://doi.org/10.17605/OSF.IO/6YWJK) באותה שיטת תכנון וייצור כפי שדווח בדוח14 שפורסם בעבר.
- השג או הכן שבב מיקרופלואידית PDMS על זכוכית באמצעות תבנית מאסטר המיועדת ליצירת מיקרו-טיפות ג'ל.
- הזריק תמיסה דוחה מים (פלואורואלקיל סילאן) לתוך השבב כדי להפוך את המיקרו-תעלות הפנימיות להידרופוביות. החדירו את התמיסה לתוך הכניסות וודאו שכל התעלות מלאות בנוזל. השאירו את התעלות המלאות לנוח כ-30-60 שניות.
- הסר את התמיסה מהמכשיר על ידי הוצאת אוויר למיקרו-תעלות הפנימיות. השתמש במזרק אוויר ריק כדי לשטוף את האוויר ובמגבון סופג על היציאות האחרות כדי למנוע התזות.
- אופים את המכשיר המטופל בחום של 65 מעלות צלזיוס למשך 15 דקות על פלטה לאידוי עודפי תמיסה. לחלופין, אחסן את המכשיר במקרר (4 מעלות צלזיוס) למשך הלילה.
הערה: השבב המיקרופלואידי מוכן לשימוש. ניתן להשהות את הפרוטוקול כאן.
2. הכנת מדגם
- קצירת תאים
הערה: תרבית תאים בטיפות יכולה לספק נתונים רלוונטיים על דינמיקת פלסמיד. כמודל חיידקים ניסיוני, נעשה שימוש בזן E. coli TOP10 עם pCA_Odd1 הפלסמיד (ראה נתונים מופקדים https://doi.org/10.17605/OSF.IO/6YWJK) המקודד חלבון פלואורסצנטי ירוק (sfGFP) ועמידות לקנמיצין15. חיידקים, פלסמיד ואמצעי גידול יכולים להשתנות בהתאם למערכת הניסוי.- הכן את Luria Bertoni (LB)-Agar על ידי המסת 25 גרם LB מעורבב מראש ו-12 גרם אגר ב-800 מ"ל מים מזוקקים (dH2O). כמו כן, הכינו מדיית LB נוזלית על ידי המסת 25 גרם של LB מעורבב מראש ב-800 מ"ל של dH2O. אוטוקלאב את התמיסות ואפשר להן להתקרר לסביבות 60 מעלות צלזיוס. עברו לסביבה סטרילית כמו קולט אדים לשלבים הבאים.
הערה: אבקת LB המעורבבת מראש מכילה 10 גרם טריפטון, 5 גרם תמצית שמרים ו-10 גרם NaCl. ניתן להשתמש גם במדיית LB-agar מעורבת עצמית. - הוסף 50 מיקרוליטר של קנמיצין (מוכן ב-100 מ"ג/מ"ל) ל-50 מ"ל של נוזל LB-אגר (ריכוז סופי: 100 מיקרוגרם/מ"ל). מערבבים את התמיסה על ידי היפוך הצינור מספר פעמים.
- יוצקים כ -15 מ"ל LB-אגר נוזלי לכל צלחת פטרי (90 מ"מ על 15 מ"מ). הכן שתי צלחות: אחת לבקרה השלילית (ניטור זיהום) ואחת לתרבית הניסוי. הניחו לתמיסת LB-agar להתקרר ולהתמצק עד שהצבע משתנה מכהה לבהיר בשתי הצלחות.
- השתמש בלולאה סטרילית כדי לפזר את זן E. coli על צלחת התרבית בטכניקת צלחת הפסים. החזירו את ציר הגליצרול E. coli לטמפרטורה של -80 מעלות צלזיוס מיד לאחר השימוש. סוגרים את שתי הצלחות ומדגרים אותן למשך הלילה בטמפרטורה של 37 מעלות צלזיוס (יום 1).
- ביום השני, בדוק את לוחית הבקרה השלילית עבור מושבה כלשהי כאות לזיהום (אם כן, חזור על השלבים מ-2.1.4.). זהה מושבות פלואורסצנטיות בודדות על צלחת E. coli באמצעות טרנסמאייטור אור כחול להכנת מלאי תרבית נוזלית.
- בתנאים סטריליים, פתח את הצלחת והשתמש בלולאה סטרילית או בקצה פיפטה של 200 מיקרוליטר כדי לבחור את המושבה שנבחרה ולהעביר אותה לצינור תרבית עם 5 מ"ל של חומר LB נוזלי טרי ו-5 מיקרוליטר של קנמיצין (מוכן ב-100 מ"ג/מ"ל). הכן צינור בקרה שלילי ללא חיסון לניטור זיהום. דגרו את צינורות התרבות בטמפרטורה של 37 מעלות צלזיוס למשך הלילה תוך ניעור ב-220 סל"ד.
- העבירו את הדגימה למשך 3 ימים נוספים במדיה ללא אנטיביוטיקה כדי לדמות מצבים שבהם עלול להתרחש אובדן פלסמיד. בימים 3, 4 ו-5, העבירו 50 מיקרוליטר מתרבית הלילה לצינור תרבית חדש המכיל 5 מ"ל LB נוזלי ללא אנטיביוטיקה. דגירה בטמפרטורה של 37 מעלות צלזיוס למשך הלילה עם רעידות ב-220 סל"ד. חזור על שלב זה עד היום השישי, וקבל תרבית סופית של 5 מ"ל לאחר ארבעה מעברים בסך הכל.
- העבירו 50 מיקרוליטר מתרבית הלילה הסופית לצינור תרבית חדש המכיל 2 מ"ל של LB נוזלי. אפשרו לתרבית להגיע לצפיפות אופטית (OD600) של 0.3 באמצעות ספקטרופוטומטר (3-4 שעות בערך).
הערה: יש להשתמש בתרבית הטרייה לפני עליית ה-OD600 כדי להבטיח שהחיידקים נמצאים בשלב הצמיחה הלוגריתמי. אם הריכוז הרצוי לא הושג, חזור על הפעולה משלב 2.1.8.
- הכן את Luria Bertoni (LB)-Agar על ידי המסת 25 גרם LB מעורבב מראש ו-12 גרם אגר ב-800 מ"ל מים מזוקקים (dH2O). כמו כן, הכינו מדיית LB נוזלית על ידי המסת 25 גרם של LB מעורבב מראש ב-800 מ"ל של dH2O. אוטוקלאב את התמיסות ואפשר להן להתקרר לסביבות 60 מעלות צלזיוס. עברו לסביבה סטרילית כמו קולט אדים לשלבים הבאים.
- תערובת תאים-אגרוז לאנקפסולציה
הערה: בקרת ריכוז חיונית כדי להבטיח עטיפת טיפות של תא בודד. ניתן לחשב את ריכוז התאים הנדרש עבור קצב עטיפת יעד ונפח טיפות ספציפי, כפי שמוצג בדוגמה הבאה:
נפח טיפות (ירידה V): אם נוצרות טיפות של 50 מיקרומטר
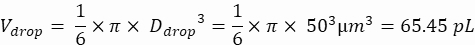
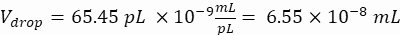
תאים רצויים לטיפה (Cpd): תא אחד לכל חמש טיפות בממוצע (0.2 תאים/טיפה)
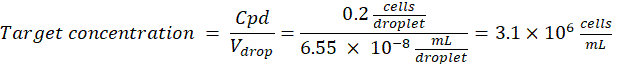
גורם דילול: ריכוז התאים הראשוני מתקבל בשלב 2.1.8
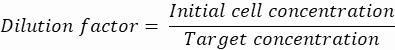
כאן, נוצרות טיפות של 50 מיקרומטר או 100 מיקרומטר (ללא פיצול טיפות) (65-520 pL) כאשר תא אחד לכל חמש טיפות עטוף, או 1.6 תאים לכל טיפה ללא פיצול. עבור E. coli, השתמש במקדם ההמרה של 1 יחידת OD600 ≈ 7.8 x 108 תאים/מ"ל16. הכפל את ערך ה-OD600 משלב 2.1.8 במקדם ההמרה כדי לקבל את הריכוז הראשוני (תאים/מ"ל) של התרבית.- השעו מחדש את E. coli ממלאי התרבית המוכנה ב-LB נוזלי ללא קנמיצין בריכוז של 6.2e+6 תאים/מ"ל (ריכוז יעד לטיפות בקוטר 50 מיקרומטר). שמור את תרחיף החיידקים בטמפרטורת החדר עד לערבוב עם אגרוז.
הערה: אנטיביוטיקה תדכא היווצרות מיקרו-מושבה שלילית ולכן חיוני להוציא אותה מהמדיה לניסויי אובדן פלסמיד. - הכן טמפרטורת ג'ל נמוכה במיוחד על ידי חימום ל-90 מעלות צלזיוס בנוזל LB בריכוז של 2% (w/v). מנערים את התערובת למשך 10 דקות בשייקר מבוקר טמפרטורה.
- הפחיתו את הטמפרטורה של התרמו-שייקר ל-39 מעלות צלזיוס כדי לקרר את תמיסת האגרוז. במקביל, הנח את צינור ההשעיה של החיידקים בשייקר התרמי למשך 4 דקות כדי לחמם אותו ל-39 מעלות צלזיוס.
- מערבבים את החיידקים ואת תרחיפי האגרוז ביחס של 1:1 לקבלת ריכוז אגרוז של 1% (w/v) עם תרחיף תאים ב-3.1e+6 תאים/מ"ל. הכן את תמיסת הבקרה השלילית (ניטור זיהום) עם אותו ריכוז אגרוז באמצעות LB נוזלי במקום תרחיף החיידקים.
הערה: יש להשתמש בתרחיף תאי אגרוז במהירות כדי למנוע שינויי ריכוז עקב צמיחת חיידקים. שמור על התרמו-שייקר ב-39 מעלות צלזיוס כדי לשמור על נוזל האגרוז עד לטעינה למחמם הקצה ליצירת טיפות.
- השעו מחדש את E. coli ממלאי התרבית המוכנה ב-LB נוזלי ללא קנמיצין בריכוז של 6.2e+6 תאים/מ"ל (ריכוז יעד לטיפות בקוטר 50 מיקרומטר). שמור את תרחיף החיידקים בטמפרטורת החדר עד לערבוב עם אגרוז.
3. גידול מושבה אחת בתפוקה גבוהה
- מערך ניסיוני
- בנה או השג את פלטפורמת הזרימה המלאה בקוד פתוח (ראה https://doi.org/10.17605/OSF.IO/6YWJK), כולל דוחפי לחץ גז וחיישני זרימה. לחלופין, בנה את שלב המיקרוסקופיה הפשוטה יותר של חומרת קוד פתוח (ראה הוראות בנייה https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ ומאגר הפרויקט https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage).
הערה: ניתן גם להשתמש במערך מיקרופלואידיקה מסורתי עם מיקרוסקופ מסחרי, מצלמה מהירה ויכולות חימום דגימה. - שלב את מערכת בקרי הלחץ והזרימה מבוססת הקוד הפתוח של Raspberry Pi כפי שתועד במאגר הייעודי (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller).
הערה: פקד המודול מתואר ומגובה במאגר הנתונים (https://doi.org/10.17605/OSF.IO/6YWJK. כחלופה, ניתן להשתמש בבקרי לחץ מסורתיים או משאבות מזרק בעלות מומנט גבוה. - כלול מגלשת זכוכית ומחממי קצה פיפטה (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring) בהתקנה כדי לשלוט בטמפרטורה של דגימת תאי האגרוז כשהיא נכנסת לשבב.
הערה: תנורי חימום אלה, המוצגים במאגר הנתונים (https://github.com/wenzel-lab/flow-microscopy-platform ו-https://doi.org/10.17605/OSF.IO/6YWJK), הם תכונה חשובה של מערכת בקרי הקוד הפתוח המאפשרת את העבודה עם agarose וייתכן שלא תהיה זמינה במערכות מסחריות אחרות.
- בנה או השג את פלטפורמת הזרימה המלאה בקוד פתוח (ראה https://doi.org/10.17605/OSF.IO/6YWJK), כולל דוחפי לחץ גז וחיישני זרימה. לחלופין, בנה את שלב המיקרוסקופיה הפשוטה יותר של חומרת קוד פתוח (ראה הוראות בנייה https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ ומאגר הפרויקט https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage).
- אנקפסולציה של תא בודד
- מקם את השבב המיקרופלואידי על שלב המיקרוסקופיה המשופרת ב-strobe, וודא שצומת יצירת הטיפות (הצטלבות השלבים המימיים והשמן) נראה לעין.
- הגדר את מחמם קצה הפיפטה ואת מחמם שקופיות הזכוכית ל-40 מעלות צלזיוס באמצעות ממשק תוכנת הבקרה.
- השתמש במזרק עם צינורות ותקע PDMS כדי להעמיס את תערובת האגרוז של 1% עם תרחיף תאים לקצה פיפטה של 200 מיקרוליטר. הכנס את הקצה למחמם הקצה והנח אותו על כניסת השלב המימי בשבב המיקרופלואידי. החלף את אטם ה-PDMS של הקצה באחד המחובר לצינור מערכת בקרת הזרימה והתחל בעירוי של תרחיף התא.
- הכנס את קצה צינור היציאה לתוך צינור פסולת והגדר קצבי זרימה או לחצים של שני שלבים בממשק המשתמש כדי להעביר נוזל לאט לתעלה המיקרופלואידית. השתמש ב-200 מיקרוליטר לשעה (180 מבר) לשלב המימי ו-1700 מיקרוליטר לשעה (320 מבר) לשלב השמן. אפשר דקה אחת לייצוב יצירת הטיפות.
הערה: ערכי הלחץ תלויים בגדלי הערוצים של עיצוב השבב, וייתכן שיהיה צורך להתאים את ערכי הזרימה עבור עיצובי צומת שונים של יצירת טיפות. - לאחר שייצור הטיפות יציב, העבירו את הפסולת וצינורות האיסוף לצינור האיסוף. המשך איסוף טיפות עד שמאגר הדגימה ריק. חזור על שלבים 3.2.3 עד 3.2.5 כדי לעטוף את תמיסת הבקרה השלילית משלב 2.2.4.
הערה: יש להשלים את איסוף הדגימה תוך 15 דקות. - אחסן את צינורות האיסוף על קרח במהלך יצירת הטיפות או הנח אותם בטמפרטורה של 4 מעלות צלזיוס לאחר הניסוי למשך שעה אחת כדי לאפשר לאגרוז לג'ל בתוך הטיפות.
הערה: ניתן לעשות שימוש חוזר בשבב המיקרו-נוזלי אם המיקרו-ערוצים נשארים לא סתומים ואותו מתלה נטען. השלך את קצה הפיפטה לאחר השלמת יצירת האמולסיה (שלבים 3.2.3-3.2.5).
- צמיחת מושבה ושחרור מתחליב
- העבירו את מיקרו-טיפות הג'ל המכילות חיידקים ואת הבקרה השלילית בטיפות לתא דגירה המוגדר ל-37 מעלות צלזיוס.
- דגרו על המיקרו-טיפות למשך 4 שעות לפחות, או למשך הלילה, כדי לאפשר צמיחה מספקת של המושבה. ודא שהבקרה השלילית אינה מראה סימני זיהום באמצעות מיקרוסקופ שדה בהיר.
- כדי לשחרר את המושבות מהאמולסיה, הסר כמה שיותר שמן מתחת לתחליב מיקרו-טיפות הג'ל באמצעות פיפטה או מזרק עם מחט (כאן נעשה שימוש במחט בגודל 21 G).
- העבירו 50 מיקרוליטר של מיקרו-טיפות הג'ל למיקרו-צינור חדש ואחסנו אותו ב-4 מעלות צלזיוס להמשך ניתוח טיפות. לאמולסיה הנותרת, הוסף תערובת 1:1 של שמן מופלר עם 1H,1H,2H,2H-perfluoro-1-octanol (PFO) בנפח השווה לאמולסיה.
- הוסף כ-200 מיקרוליטר של מאגר מי מלח עם חוצץ פוספט (PBS), או 0.9% w/v מאגר NaCl, על גבי האמולסיה. מערבלים את התערובת וסובבו אותה לזמן קצר בצנטריפוגה במהירות קבועה.
- הסר בזהירות את שלב השמן מתחתית ממשק הנוזל והשליך 100 מיקרוליטר PBS מלמעלה. חזור על שלבים 3.3.4–3.3.5 כדי להשיג מיקרוג'לים שטופים במאגר PBS עם שאריות שמן מינימליות או ללא שאריות שמן.
הערה: המיקרוג'לים מתיישבים בממשק הנוזלי; הימנע מהסרתם יחד עם שלב השמן.
4. ניתוח מושבה אחת
- צביעת תאים
הערה: שילובי כתמים רבים ושונים פועלים עבור פרוטוקול זה. בעיקרו של דבר, יש לבחור כתם DNA או דופן תא בעל צבע שונה מהחלבון הפלואורסצנטי המקודד על ידי הפלסמיד ושניתן לנתח אותו באמצעות שילובי המסננים הזמינים במיקרוסקופ הקרינה. כאן, ה-DNA של התאים נצבע ב-Propidium Iodide (PI) כדי להבדיל בין הקרינה שלו לחלבון הפלואורסצנטי הירוק המקודד על הפלסמידים, אך ניתן להשתמש בכתמי DNA רבים אחרים.
זהירות: PI הוא מסרטן פוטנציאלי ויש לטפל בו עם ציוד מגן אישי מתאים. השלך את הצבע בבטחה ובהתאם לתקנות המקומיות.- צנטריפוגה את המיקרוג'לים השטופים בכ- 80 x גרם למשך 5 דקות בטמפרטורת החדר. השליכו את הסופרנטנט בעזרת פיפטה.
- העבירו 50 uL של המיקרוג'לים למיקרו-צינור חדש כדי לשמש כבקרה שלילית לטיפול באתנול.
הערה: כתם PI נכנס רק לתאים עם ממברנות שנפגעו, כגון אלה המושפעים מטיפול באתנול. - הוסף נפח שווה של 70% אתנול למיקרוג'לים הנותרים וערבב קצרות עם מערבולת. דגירה בטמפרטורת החדר למשך 15 דקות כדי לחלחל ממברנות חיידקים לצביעה PI. חזור על שלב 4.1.1.
- הוסף נפח שווה של 0.9% w/v NaCl למיקרוג'ל ולזמן קצר מערבולת. חזור על שלב 4.1.1.
- הוסף 2 מיקרוליטר של PI (1 מ"ג/מ"ל) לשתי דגימות המיקרו-צינורות. מערבבים היטב ודוגרים בחושך בטמפרטורת החדר למשך 15 דקות.
הערה: אם הבקרה השלילית מציגה אות פלואורסצנטי אדום כלשהו באמצעות מיקרוסקופיה פלואורסצנטית, ייתכן ששלמות המושבות נפגעה במהלך חשיפתן לתמיסות אחרות בשלבים הקודמים.
- מיקרוסקופ
הערה: טיפות ומיקרוג'לים מצולמים באמצעות מיקרוסקופ אפי-פלואורסצנטי הפוך כדי לקבל את התפלגות גודל הטיפות ואת הקרינה של מושבות חיידקים במיקרוג'לים (איור 2). כאן, נעשה שימוש בפלטפורמת מיקרוסקופיה הפוכה בקוד פתוח (https://github.com/wenzel-lab/SQUID-bioimaging-platform)17 עם יעד 10x 0.3NA, מערך LED לבן לתאורת שדה בהיר ו-LED 470nm לעירור. ניתן להשתמש במיקרוסקופים אפי-פלואורסצנטיים מסחריים להדמיית טיפות ומיקרוג'לים. כיול נדרש מכיוון שהתאורה והמסננים משתנים בהתאם לדגם, למותג ולחלבונים הפלואורסצנטיים המשמשים.- העבירו 2 מיקרוליטר של מיקרו-טיפות ג'ל לשקופית תא הדמיה והוסיפו 5 מיקרוליטר של שמן מופלר כדי לסייע ביצירת שכבה אחת של טיפות להדמיה אופטימלית.
הערה: תאי ספירת תאים או תאים מיקרופלואידיים פשוטים יכולים לעזור לפזר את האמולסיה דק ולהאט את תהליך הייבוש. - במיקרוסקופ, הפעל את תאורת מטריצת ה-LED הלבנה מלמעלה להדמיית שדה בהיר. הרכיב את השקופית המוכנה, התמקד בדגימה ואתר שכבה אחת של טיפות. צלם תמונה בשדה בהיר.
- מבלי להזיז את הדגימה, צלם תמונת פלואורסצנטיות של המושבות על ידי מעבר ל-LED של 470 ננומטר לעירור. כוונן את גלגל המסנן כך שיתיישר עם מסנן אורך הגל הירוק להדמיית sfGFP. סרוק את כל האזורים המכילים חד-שכבות של טיפות וחזור על שלבים 4.2.2-4.2.3 כדי להבטיח חוסן סטטיסטי בניתוח טיפות.
- העבירו 2 מיקרוליטר מהמיקרוג'לים המוכתמים לשבב תא הדמיה ו-5 מיקרוליטר של 0.9% w/v NaCl כדי לסייע ביצירת שכבה אחת של מיקרוג'לים. אטום את הכניסה והיציאה של השבב כדי למנוע אידוי במהלך ההדמיה.
הערה: אידוי יכול להשפיע על הקולוקליזציה של תוויות הפלורסנט. תאים מיקרופלואידיים מומלצים להדמיה ממושכת. - חזור על שלבים 4.2.2–4.2.3. כוונן את מסנן מרווח אורך הגל האדום להדמיית PI וצלם את התמונות המתאימות.
- לאחר השלמת ההדמיה במקום אחד, מצא את האזור המתאים הבא בשקופית עם שכבה אחת של מיקרוג'ל וחזור על תהליך ההדמיה כדי להבטיח חוסן סטטיסטי וניתוח מקיף של הדגימה.
- העבירו 2 מיקרוליטר של מיקרו-טיפות ג'ל לשקופית תא הדמיה והוסיפו 5 מיקרוליטר של שמן מופלר כדי לסייע ביצירת שכבה אחת של טיפות להדמיה אופטימלית.
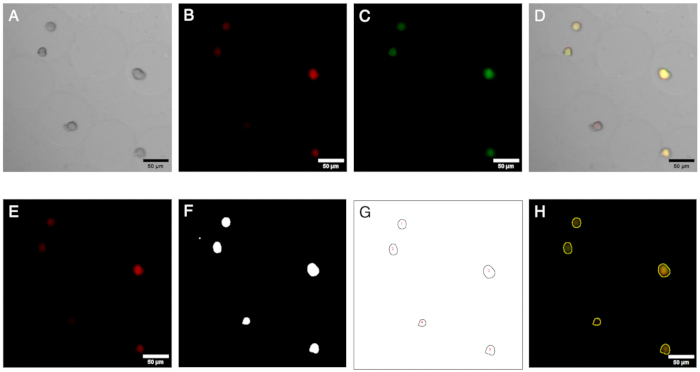
איור 2: תמונות מיקרוסקופיה וניתוחן. הדמיה פלואורסצנטית וניתוח מושבות במיקרוג'לים. (א-ג) ערוצי תמונה נרכשים באמצעות מיקרוסקופ שדה בהיר ופלואורסצנטי עם המיקרוסקופ ההפוך. התמונה המרוכבת (D) מראה נוכחות של מושבה שלילית (פלואורסצנטיות אדומה בלבד) בתוך המיקרוג'לים. (ה-ח) תוצאות תהליך העבודה של ניתוח תמונות. על ידי יצירת החזר ROI, ניתן לזהות מושבות בערוצים אדומים וירוקים, ולכמת את האותות כדי להגדיר את נוכחותן של מושבות שליליות. פסי קנה מידה: 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- ניתוח תמונה
הערה: כדי לנתח את אותות הקרינה מהמושבות העטופות ולזהות אירועים נדירים, ניתן לעבד תמונות מהדמיית שדה בהיר ופלואורסצנטי עם Fiji/ImageJ (איור 3). ניתן ליישם שלבים אלה בסקריפט מאקרו, וערכי הפרמטרים עשויים להשתנות בהתאם לתצורה האופטית.- פתחו את התמונות מהערוצים הירוק והאדום. הגדר אזור עניין מלבני (ROI) המתחיל בקואורדינטות (500, 500) ברוחב ובגובה של 2000 פיקסלים כל אחד.
הערה: פרמטרים אלה חלים על תמונות בגודל 3000 x 3000 פיקסלים, והחזר ה-ROI מגדיר את האזור עם תאורה טובה יותר. - חתוך את התמונה להחזר ההשקעה המלבני המוגדר. הפחיתו ערך קבוע של 10 מעוצמת כל פיקסל והחילו מסנן החלקה על התמונה כדי להפחית את רעשי הרקע ולהפוך את האובייקטים המעניינים למובחנים יותר.
הערה: רק אזור זה ישמש לניתוח נוסף. - שכפל את התמונה מהערוץ האדום והמר אותה למסכה בינארית כדי לזהות את האירועים הנדירים הקשורים לפלסמיד. הגדר את ערכי הסף בין 10 ל- 255. פיקסלים בטווח זה ייחשבו לחזית (אובייקטים מעניינים), בעוד שאחרים יטופלו כרקע.
- בצע פעולות מורפולוגיות כדי לסגור פערים קטנים ולמלא חורים בתוך האובייקטים המעניינים. החילו את אלגוריתם פרשת המים על עצמים חופפים נפרדים בתוך המסיכה הבינארית.
- נתח את החלקיקים במסכה הבינארית. שקול רק חלקיקים בגודל גדול מ- 30 פיקסלים ומעגליות בין 0.50 ל- 1.00. התוצאות מסוכמות ומתווספות לטבלת התוצאות. שמור את מערך ההחזר על ההשקעה שזוהה על-ידי ניתוח החלקיקים לצורך הדמיה נוספת.
- הצג את ההחזר על ההשקעה שנשמר בתמונות מהערוצים הירוקים והאדומים. מדוד את העוצמה או מאפיינים אחרים של ההחזר על ההשקעה בתמונות אלה. רשום את המדידות בטבלת התוצאות ושמור את התוצאות בקבצי CSV נפרדים להמשך ניתוח סטטיסטי.
- פתחו את התמונות מהערוצים הירוק והאדום. הגדר אזור עניין מלבני (ROI) המתחיל בקואורדינטות (500, 500) ברוחב ובגובה של 2000 פיקסלים כל אחד.
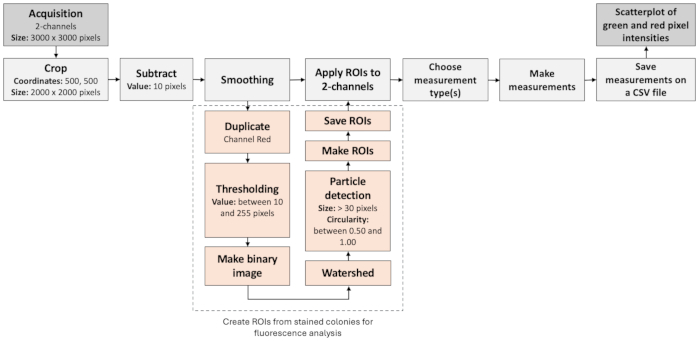
איור 3: זרימת עבודה של ניתוח תמונות לזיהוי מושבות שליליות. האיור ממחיש זרימת עבודה שלב אחר שלב לעיבוד והערכה אוטומטית של תמונות פלואורסצנטיות. זרימת העבודה מבוססת על לוקליזציה של תוויות פלואורסצנטיות כמו גם ניתוח חלקיקים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
5. בדיקת השוואת לוחות אגר
הערה: כדי להשוות את שיטת הטיפות לבדיקת צלחת מסורתית, כימות המושבות הפלואורסצנטיות של אותו זן E. coli הושג בשלב 2.1.8. בוצע באמצעות צלחות פטרי. זה שימש כשיטת בקרה אנלוגית למדידת יציבות פלסמיד sfGFP. ראה גם איור שיטה באיור 1.
- הכן LB-אגר (ללא אנטיביוטיקה) כמתואר בשלב 2.1.1 מסעיף קצירת תאים. מצננים את האגר מתחת ל -60 מעלות צלזיוס והומוגניזציה.
- בסביבה סטרילית, שפכו 15 מ"ל ממדיום האגר לכל צלחת פטרי. הניחו לצלחות להתמצק עם מכסים פתוחים חלקית עד שהם מוכנים לשימוש.
- חסנו שלוש צלחות עם 10 מיקרוליטר כל אחת מתרבית E. coli במדיה LB עם OD600 של 0.007 ± 0.002. מורחים באופן שווה באמצעות מפזר בצורת L. דגרו את הצלחות בטמפרטורה של 37 מעלות צלזיוס, סגורות והפוכות. הכן צלחת בקרה ללא חיידקים באותם תנאים.
- לאחר 24 שעות, צלם תמונות פלואורסצנטיות של הלוחות באמצעות FluoPi, מערכת הדמיה פלואורסצנטית בקוד פתוח (https://github.com/RudgeLab/FluoPi)15.
הערה: ה-FluoPi מורכב ממצלמת Raspberry Pi עם אור עירור כחול באורך גל שמרכזו 470 ננומטר ומסנני עירור ופליטה אקריליים. - ספור ידנית את המושבות הפלואורסצנטיות והלא פלואורסצנטיות בכל צלחת באמצעות התמונות שצולמו.
תוצאות
אימות אנקפסולציה של תאים והיווצרות מיקרו-מושבה
ניתן לאשר חזותית את עטיפת התא על ידי ביצוע מיקרוסקופ שדה בהיר על מיקרו-טיפות הג'ל לפני שבירת האמולסיה ושטיפת המיקרוג'לים. תוצאה מייצגת של האמולסיה בשלב זה מוצגת באיור 4.
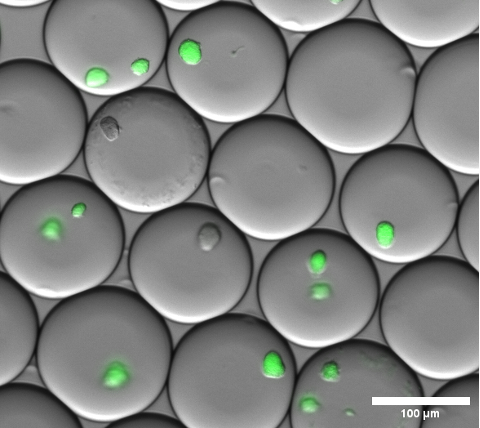
איור 4: קטע של תמונת שכבת-על של מיקרוסקופיה פלואורסצנטית. לאחר דגירה של לילה, מיקרו-מושבות מייצגות של sfGFP המבטאות מושבות E. coli בתוך מיקרו-טיפות ג'ל. נעשה שימוש באובייקט מיקרוסקופ עם הגדלה של פי 10 ו-NA של 0.30. סרגל קנה מידה: 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
תוצאות ניתוח תמונות
ברגע שמיקרוג'לים מוכתמים ושדה בהיר, כמו גם תעלות פלואורסצנטיות שנרכשות בכמה מיקומים, ניתן לדמיין את המושבות שזוהו כשליליות בתמונות המקוריות (ראו איור 5A). ניתן לשרטט נתונים שחולצו מכל התמונות של ניסוי אחד כדי להראות את יחס הקרינה של מושבות שונות, תוך הדגשת אלה שאיבדו את הקרינה המקודדת בפלסמיד (ראה איור 5B). התוצאות מצביעות על כך ש-100 מושבות איבדו את פונקציונליות הפלסמיד או הפלסמיד שלהן מתוך סך של 2785 מיקרו-מושבות שנותחו, המקבילות ל-3.6%.
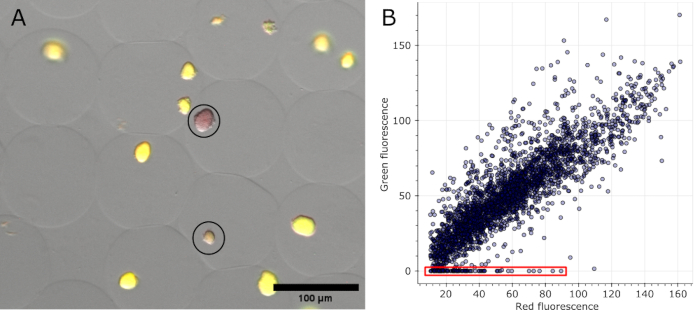
איור 5: כימות של מיקרו-מושבות שליליות. (A) קטע של תמונת כיסוי של מיקרוסקופיה פלואורסצנטית. לאחר הסרת שמן וצביעה, מושבות מייצגות במיקרוג'לים המבטאים sfGFP ושתי מושבות שליליות הראו את הקרינה האדומה של כתם ה-DNA (מוקף בעיגול בשחור). סרגל קנה מידה: 100 מיקרומטר. (B) תרשים פיזור של ערכי הקרינה של מיקרו-מושבות בודדות שחולצו מ-16 תמונות מיקרוסקופיה רב-ערוציות. מושבות ללא כל פלואורסצנטיות ירוקה נספרו כשליליות, כפי שמצוין באדום בגרף. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
כימות לוחית אגר
תמונות של הלוחות המשולשים מוצגות באיור 6, עם מושבות לא פלואורסצנטיות המסומנות על ידי חיצים לבנים. הלוח הראשון (איור 6A) הציג בסך הכל 213 מושבות, מתוכן 1 לא היה פלואורסצנטי. בלוח השני (איור 6B) היו בסך הכול 49 מושבות, ללא מושבות שאינן פלואורסצנטיות. הלוח השלישי (איור 6C) הראה בסך הכל 252 מושבות, שש מהן לא היו פלואורסצנטיות. תוצאות אלו תואמות לשיעור אובדן פלסמיד מושבה ממוצע של 2.3%, עם סטיית תקן גדולה של 3.2.
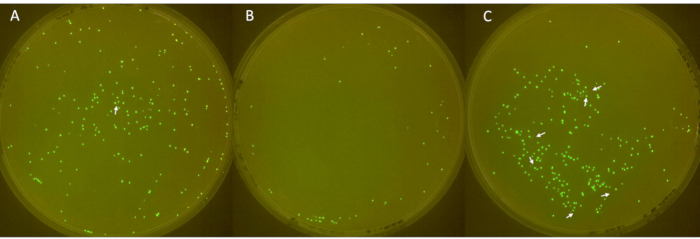
איור 6: זיהוי מושבות שליליות על צלחות. (א-ג) מושבות E. coli פלואורסצנטיות ולא פלואורסצנטיות על לוחות LB-agar (קוטר: 90 מ"מ, גובה: 15 מ"מ). החיסון, שמקורו ב-E. coli עם sfGFP ממאגר של -80 מעלות צלזיוס, היה מפוספס ביום הראשון, תורבת באנטיביוטיקה ביום השני, ודולל 1:100 מדי יום מהיום השלישי עד השישי כדי לאפשר אובדן פלסמיד. המושבות הודגרו בטמפרטורה של 37 מעלות צלזיוס למשך 24 שעות וצולמו בתא FluoPi. מושבות שאינן פלואורסצנטיות שופרו עם GIMP וסומנו בחיצים לבנים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
שיטה מבוססת מיקרו-טיפות ג'ל הוכחה כמזהה ומכמת ביעילות מושבות עם ובלי ביטוי גנטי מקודד פלסמיד של חלבונים פלואורסצנטיים, כגון sfGFP. מושבות שאינן מבטאות מספיק את תוצר הפלסמיד מזוהות באמצעות כתם DNA פלואורסצנטי (כאן, Propidium Iodide) שמכתים את כל המושבות וכולל אורך גל פליטה שונה. שילוב זה של מיקרופלואידיקה טיפתית, ג'ל ומיקרוסקופיה פלואורסצנטית, תוך שימוש בטכנולוגיית קוד פתוח, מאפשר ביצוע זרימת עבודה מתקדמת במסגרות מחקר רבות11,13. הדור המוצלח של מיקרו-טיפות ג'ל מאפשר זרימות עבודה מתקדמות של ביולוגיה מולקולרית של תא בודד, כולל ליזה של תאים, הגברת גנום בודד, מסכי אינטראקציה מטבולית בין תאים, חילופי מדיה ועוד 8,9. יתרונות אלה משמשים בפרוטוקול זה כדי לגדל, להכתים ולנתח מיקרו-מושבות בצורה ניתנת להרחבה יותר מאשר במבחנים מסורתיים מבוססי צלחת.
שלבים קריטיים
תהליך האנקפסולציה הוא חלק קריטי ועדין בפרוטוקול. נדרשת בקרה מדויקת של ריכוזי המרכיבים, קצבי הזרימה והלחצים כדי ליצור מיקרוג'לים אחידים בטווח גודל ספציפי ולשלוט במספר התאים הממוצע לטיפה. יתר על כן, שמירה על הריכוז והטמפרטורה של תערובת התאים-אגרוז מונעת גוש או ג'לציה מוקדמת. בקרת הטמפרטורה של מתלה תאי האגרוז הנוזלי בקצה פיפטה היא יישום מועיל במיוחד של תחנת העבודה שלנו למיקרופלואידיקה בחומרה בקוד פתוח המספקת ייצור מיקרוג'ל קל וחזק בהרבה בהשוואה למאמצים לשלוט בטמפרטורה של משאבות מזרקים וצינורות. מכיוון שתאים מעורבבים עם מצע הגידול של האגרוז לפני האנקפסולציה והגידול, יש לייצר את המיקרוג'לים של האגרוז במהירות על מנת למנוע שינויים גדולים בריכוז התאים. למטרה זו, עיצוב שבב מיקרופלואידי מפצל טיפות בהשראת Abate et al. עבר אופטימיזציה18.
שינויים ופתרון בעיות
מספר כיולים ושינויים נדרשו כדי לחדד את הפרוטוקול המקורי. האנקפסולציה של אגרוז מאתגרת הרבה יותר מטיפות מים בשמן, ודורשת תכנון של מערכת לשמירה על האגרוז במצב נוזלי תוך הבטחת זרימת הפאזה המימית משיגה טווח גודל חלקיקים הומוגני. שינויים בצמיגות האגרוז עקב ג'לציה משפיעים על קצב הזרימה, מה שמוביל לגדלים גדולים יותר של חלקיקים. המיקרוסקופיה דורשת בחירה קפדנית של מסננים ומקורות אור כדי להבטיח אותות עירור ופליטה לא חופפים לבידול ברור. בתחילה, DAPI נבחר לצביעת חיידקים, אך אות הפליטה שלו חפף ל-sfGFP, מה שגרם לזיהוי sfGFP בערוץ הזיהוי הכחול. עברנו ל-PI מכיוון שהפליטה שלו מופרדת היטב מ-sfGFP באורכי גל ארוכים (אור אדום).
בעוד שאובדן הפלסמיד כומת בשיטה המוצעת, הפלסמיד sfGFP ששימש היה יציב באופן בלתי צפוי, וכמעט ולא הציג מקרים של אובדן פלסמיד בדור הראשון של תאים שגודלו ללא אנטיביוטיקה, אפילו בתנאי לחץ כגון מדיה pH9 ודגירה ב-40 מעלות צלזיוס. תצפית זו עולה בקנה אחד עם הממצאים של קבוצות מחקר אחרות 1,19. יציבות הפלסמיד הגבילה את ההדגמה של יכולות הכימות המלאות של השיטה עבור דורות ראשוניים של תרביות תאים, אך היא הוכיחה שהשיטה רגישה מספיק כדי לזהות אפילו הבדלים קטנים בשימור הפלסמיד. לתצפית על יציבות פלסמיד גבוהה בדורות המוקדמים יש השלכה חשובה על מסכים מיקרופלואידיים טיפתיים המשתמשים בבדיקת ברירה שלילית, כגון עיכוב חיידקי מטרה. המשמעות היא שאובדן הפלסמיד של יעדי הבחירה הוא מקור נמוך לתוצאות בחירה חיוביות כוזבות. מכיוון שמסכים מיקרופלואידיים טיפתיים עולים בדרך כלל על מסכים אחרים בעלי תפוקה גבוהה, כגון זרימות עבודה של רובוט פיפטינג, בסדרי גודל בתפוקה, יש להעריך ולקחת בחשבון את האירועים הנדירים הללו.
מגבלות
למרות יתרונותיה, ישנן מגבלות לשיטה המוצגת. ייצור מכשירים מיקרופלואידיים דורש מומחיות ותשומת לב קפדנית לפרטים, כמו גם בקרה ניסיונית הדוקה של קצבי הזרימה כדי להבטיח יעילות אנקפסולציה דטרמיניסטית. היבטים אלה עשויים לדרוש אופטימיזציה עבור הגדרות ניסיוניות שונות. בעוד ששיטה זו מסתמכת על מיקרוסקופיה פלואורסצנטית לזיהוי אותות, מה שמחייב גישה לציוד הדמיה מתאים, ניתן לייצר ציוד זה באמצעות חומרת קוד פתוח, מה שהופך אותו לנגיש יותר. יתר על כן, ניתן לעבד מיקרוג'לים בציטומטריית זרימה מסחרית עם חרירים גדולים, מה שמשפר עוד יותר את הנגישות ואת התפוקה הניסיונית. ניתן להשתמש במייני טיפות גם לניתוח ציטומטרי זה.
יתרה מכך, בעוד שהשיטה נועדה לזהות אותות פלואורסצנטיים מפלסמידים, כתמים או סמנים אחרים, היא מוגבלת לתאים שניתן לתייג פלואורסצנטי, מה שעשוי שלא לחול על כל זני החיידקים או תנאי הניסוי. עם זאת, ניתן להתאים את השיטה לשילוב סוגים אחרים של מיקרוסקופיות, כגון ניגודיות פאזה או מיקרוסקופיית שדה בהיר, מה שמאפשר יישומי פנוטיפ מעבר לפלואורסצנטיות. בנוסף, ניתן לשלב אותו עם טכניקות ספקטרוסקופיות כמו FTIR או ספקטרוסקופיה ראמאן, ולהרחיב את יכולותיו לנתח הרכבים כימיים ומידע מבני של התאים העטופים. התאמות אלה מרחיבות את טווח הישימות שלו, והופכות אותו לכלי רב-תכליתי למסגרות מחקר מגוונות.
משמעויות ויישומים
מבחנים מסורתיים לאובדן פלסמיד19 אינם מאפשרים כימות טוב של יחס התאים שאיבדו את ביטוים, מידע שיכול להיות חשוב מאוד בתכנון שיטות ניסוי ויישומים ביולוגיים שונים. בדרך כלל, סוגי מושבות נספרים במבחני לוחות אגר, שם ניתן להשיג מושבות מבודדות מוגדרות היטב, כפי שמודגם באיור 4. עם זאת, קשה לזהות מושבות חופפות בביטחון; בידינו, לא תמיד אנו משיגים צפיפות מושבה אופטימלית, ולוחות רבים נחוצים כדי להשיג סטטיסטיקה טובה של אירועי אובדן פלסמיד בתדר נמוך. השיטה המוצעת מציעה גישה חזקה יותר לכימות מדויק של אותות פלואורסצנטיים המגיעים ממושבות מבודדות עם מספר גבוה יותר של מושבות מאשר השיטות האנלוגיות של לוחות אגר מכיוון שבמיקרו-טיפות, מושבות מתפתחות בנפרד, קטנות יותר וקלות לטעינה לתאי הדמיה, מה שמאפשר כימות מבוסס מיקרוסקופיה או זרימה-ציטומטריה של מספרי מושבות גדולות. זה יכול לשפר משמעותית את הייצוג הסטטיסטי של השיטה ולאפשר שילוב בתהליכי עבודה אחרים של ג'ל-מיקרו-טיפות.
השימוש בחומרת קוד פתוח11,20 מאפשר לחוקרים להתאים אישית את עיצוב תחנת העבודה המיקרופלואידית ולהתאים במדויק את חולדת הזרימה; לכן, גודל החלקיקים תומך בסוגי תאים שונים ובתנאי ניסוי. גמישות זו משתרעת על שילוב פוטנציאלי של סוגי מיקרוסקופיה אחרים, כגון ניגודיות פאזה או ספקטרוסקופיה, מה שמרחיב את ישימות השיטה. יכולתה של השיטה להעריך את יציבות הפלסמיד בתנאים שונים היא קריטית ליישומים הדורשים שימור פלסמיד ללא בחירת אנטיביוטיקה, בתנאי לחץ מסוימים או דורות תרבית שונים. הרבגוניות ויכולת ההסתגלות של השיטה המוצגת הופכות אותה לבעלת ערך עבור יישומי מחקר מגוונים בתחומים הכוללים ביולוגיה סינתטית, ניטור סביבתי ואבחון קליני2.
Disclosures
המחברים מצהירים כי שום אינטרסים פיננסיים מתחרים או יחסים אישיים לא יכלו להשפיע על העבודה המדווחת במאמר זה.
Acknowledgements
עבודה זו היא חלק מפרויקטים ממומנים שהוענקו ל-T.W. מ-ANID FONDECYT Regular 1241621 ופרויקט יוזמת צ'אנג צוקרברג 'מרכז אמריקה הלטינית להדמיה ביולוגית באמצעות חומרה פתוחה'. T.W. אסיר תודה גם על המימון מ-CIFAR, כחוקר עזריאלי גלובלי בתוכנית CIFAR MacMillan Multiscale Human Program.
Materials
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 370533-25G | For breaking emulsion |
| 70% ethanol | For cell permeabilization | ||
| Agar-Agar | Winkler | 9002-18-0 | |
| Biopsy Punch | 0.75 mm and 1.8 mm | ||
| Blue LED transilluminator | IO Rodeo | ||
| Culture tube | 15 mL | ||
| Desiccator | With vacuum pump | ||
| Disposable cup | For mixing PDMS | ||
| Disposable fork | For mixing PDMS | ||
| E. coli TOP10 strain | |||
| FluoPi microscope | https://github.com/wenzel-lab/FluoPi | Green fluorescence imaging system for analyzing plates | |
| Fluorinated Oil | 3M | Novec 7500 | |
| Glass slide heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of microfluidic chip | |
| Glass Slides | |||
| Hotplate | Mechanic | For evaporating Aquapel | |
| Image analysis software | Fiji/ImageJ | 2.14.0/1.54f | |
| Incubator | Mundo Lab | MLAB Scientific / For incubation of plates and microgels | |
| Isopropanol | For cleaning glass slides | ||
| Kanamycin | 100 ug/mL concentration | ||
| L-shaped spreader | For spreading bacteria on agar plates | ||
| Master mold | Chip design on silicone or glass wafer | ||
| Microtubes | 2 mL | ||
| NaCl solution | Sodium chloride 0.9% w/v | ||
| Open-source hardware strobe-enhanced microscopy stage | https://github.com/wenzel-lab/flow-microscopy-platform | For bright-field microscopy | |
| Petri dish | Citotest | 2303-1090 | 90 x 15 mm |
| Pipette tip heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of pipette tip | |
| Plasma Cleaner | Diener Electronic | 117056 | For bonding PDMS with a glass slide |
| Plasmid pCA_Odd1 | Encodes sfGFP and kanamycin resistance | ||
| Polytetrafluoroethylene (PTFE) tubing | Adtech Polymer Engineering Ltd | ||
| Pre-mixed Luria Bertoni medium | US Biological Life Science | L1520 | |
| Propidium iodide (PI) | For staining | ||
| Raspberry Pi-based pressure and flow controller system | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller | For controlling pressure and flow rates | |
| Silicone elastomer base | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Silicone elastomer curing agent | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Spectrophotometer | For measuring absorbance | ||
| SQUID microscope | https://github.com/wenzel-lab/SQUID-bioimaging-platform | Multi-fluorescence imaging system for analyzing stained cells | |
| Sterile loop | For picking a colony and streaking plating | ||
| Surfactant | Sphere Fluidics | Pico-Surf | |
| Syringes | NIPRO | With filters and tubing | |
| Temperature-controlled shaker | Mundo Lab | DLAB HCM100-Pro | |
| Tweezer | |||
| Ultra-low gelling temperature agarose | Sigma-Aldrich | A2576-5G | For generating hydrogel beads |
| Water repelent solution (fluoroalkyl silane) | Aquapel | For treating microchannels of PDMS device |
References
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under non-selective conditions maintains antibiotic resistance. Nat Commun. 10 (1), 2595(2019).
- Rodríguez-Beltrán, J., DelaFuente, J., León-Sampedro, R., MacLean, R. C., Millán, ÁS. Beyond horizontal gene transfer: The role of plasmids in bacterial evolution. Nat Rev Microbiol. 19 (6), 347(2021).
- Wein, T., Dagan, T. Plasmid evolution. Curr Biol. 30 (19), R1158-R1163 (2020).
- Chen, S., Larsson, M., Robinson, R. C., Chen, S. L. Direct and convenient measurement of plasmid stability in lab and clinical isolates of E. coli. Sci Rep. 7 (1), 4788(2017).
- Rouches, M. V., Xu, Y., Cortes, L. B. G., Lambert, G. A plasmid system with tunable copy number. Nat Commun. 13 (1), 3908(2022).
- Silva, F., Queiroz, J. A., Domingues, F. C. Evaluating metabolic stress and plasmid stability in plasmid DNA production by Escherichia coli. Biotechnol Adv. 30 (3), 691-708 (2012).
- Wang, R., et al. Construction of novel pJRD215-derived plasmids using chloramphenicol acetyltransferase (cat) gene as a selection marker for Acidithiobacillus caldus. PLoS ONE. 12 (8), e0183307(2017).
- Moragues, T., et al. Droplet-based microfluidics. Nat Rev Methods Primers. 3 (1), 32(2023).
- Vitalis, C., Wenzel, T. Leveraging interactions in microfluidic droplets for enhanced biotechnology screens. Current Opinion in Biotechnology. 82, 102966(2023).
- Sinha, N., Subedi, N., Wimmers, F., Soennichsen, M., Tel, J. A pipette-tip based method for seeding cells to droplet microfluidic platforms. J Vis Exp. (144), e57848(2019).
- Wenzel, T. Open hardware: From DIY trend to global transformation in access to laboratory equipment. PLOS Biol. 21 (1), e3001931(2023).
- Murillo, L. F. R., Wenzel, T. Welcome to the journal of open hardware. J Open Hardware. 1 (1), (2017).
- Shin, J. H., Choi, S. Open-source and do-it-yourself microfluidics. Sens Actuators B Chem. 347, 130624(2021).
- Pryszlak, A., et al. Enrichment of gut microbiome strains for cultivation-free genome sequencing using droplet microfluidics. Cell Rep Methods. 2 (1), 100137(2021).
- Pollak, B., et al. Universal loop assembly: open, efficient and cross-kingdom DNA fabrication. Biology. 5 (1), (2020).
- Volkmer, B., Heinemann, M. Condition-dependent cell volume and concentration of Escherichia coli to facilitate data conversion for systems biology modeling. PLoS ONE. 6 (7), e23126(2011).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , (2020).
- Abate, A. R., Weitz, D. A. Faster multiple emulsification with drop splitting. Lab Chip. 11 (11), 1911-1915 (2011).
- Lau, B. T. C., Malkus, P., Paulsson, J. New quantitative methods for measuring plasmid loss rates reveal unexpected stability. Plasmid. 70 (3), 353-361 (2013).
- Oellermann, M., et al. Open hardware in science: The benefits of open electronics. Integr Comp Biol. 62 (4), 1061-1075 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved