Method Article
Açık Kaynak Damlacık Mikroakışkanları ile Plazmid Stabilite Analizi
Bu Makalede
Özet
Bakterilerde plazmit retansiyonunun paralelleştirilmiş analizi için erişilebilir, açık kaynaklı bir mikroakışkan iş akışı sunulmaktadır. Jel mikro damlacıklar içindeki tek hücreli mikrokolonilerde plazmit varlığını ölçmek için floresan mikroskobu kullanan bu yöntem, geleneksel plaka sayımına kesin, erişilebilir ve ölçeklenebilir bir alternatif sunar.
Özet
Plazmitler, çeşitli organizmalarda yabancı genlerin tanıtılmasını ve ekspresyonunu sağlayarak, böylece hücre popülasyonları içinde ve arasında biyolojik devrelerin ve yolların inşasını kolaylaştırarak sentetik biyolojide hayati bir rol oynar. Birçok uygulama için, antibiyotik seçimi olmadan fonksiyonel plazmitlerin korunması kritik öneme sahiptir. Bu çalışma, jel mikrodamlacıklardaki tek hücreleri kültürleyerek ve floresan mikroskobu kullanarak mikrokolonileri ölçerek plazmit retansiyonunu analiz etmek için açık donanım tabanlı bir mikroakışkan iş akışı sunmaktadır. Bu yaklaşım, çok sayıda damlacık ve mikrokoloninin paralel analizine izin vererek, geleneksel plaka sayımına kıyasla daha fazla istatistiksel güç sağlar ve testin diğer damlacık mikroakışkan iş akışlarına entegrasyonunu sağlar. Spesifik olmayan bir floresan DNA boyasının yanı sıra floresan proteinleri eksprese eden plazmitler kullanılarak, tek koloniler plazmit kaybına veya floresan işaretleyici ekspresyonuna dayalı olarak tanımlanabilir ve ayırt edilebilir. Özellikle, açık kaynaklı donanımla uygulanan bu gelişmiş iş akışı, hem numunenin hem de mikroakışkan çipin hassas akış kontrolünü ve sıcaklık yönetimini sunar. Bu özellikler, iş akışının kullanım kolaylığını, sağlamlığını ve erişilebilirliğini artırır. Çalışma, deneysel model olarak Escherichia coli'ye odaklanırken, yöntemin gerçek potansiyeli çok yönlülüğünde yatmaktadır. Plazmitlerden veya lekelerden floresan sinyal ölçümü gerektiren çeşitli çalışmalar ve diğer uygulamalar için uyarlanabilir. Açık kaynaklı donanımın benimsenmesi, çeşitli araştırma ortamlarında erişilebilir teknolojiyi kullanarak yüksek verimli biyoanalizler yapma potansiyelini genişletir.
Giriş
Plazmitler, prokaryotik hücrelerdeki temel genetik elementlerdir ve yanal DNA transferi ve çevresel değişikliklere hızlı adaptasyon yoluyla mikrobiyal evrime önemli ölçüde katkıda bulunur 1,2. Bu ekstrakromozomal DNA molekülleri, antibiyotik direnci, metabolik fonksiyonlar ve virülans faktörleri gibi avantajlı özellikler sağlayan genleri taşır ve bu da onları mikrobiyoloji araştırmaları, sentetik biyoloji ve evrim çalışmaları için değerli kılar2. Bununla birlikte, hücre popülasyonlarında plazmit bakımı, replikasyon ve ayrışmanın metabolik yükü nedeniyle zordur ve genellikle seçim baskısı olmadan plazmit kaybına neden olur3. Ek olarak, kararlı kalıtım, toksin-antitoksin ve bölümleme sistemleri gibi mekanizmalar gerektirir ve bu da plazmid bakımına karmaşıklık katar. Değişen koşullar altında plazmit stabilitesinin değerlendirilmesi, hem temel araştırmalar hem de plazmitleri birincil araştırma unsuru olarak kullanan pratik uygulamalar için çok önemlidir 4,5. Plazmit stabilitesini değerlendirmek için mevcut yöntemlerin çoğunun önemli sınırlamaları vardır: Akış sitometrisi tabanlı yöntemler dolaylı, popülasyon düzeyinde veri sağlar, pahalı ekipman gerektirir ve kolonilerin doğrudan görselleştirilmesinden yoksundur6. Toplu transkriptomik ve proteomik yöntemler maliyetlidir, yalnızca ortalama hücresel yanıtlar sağlar ve tek tek kolonilerde plazmit retansiyonunu doğrudan ölçemez6. Seri seyreltme ve pasaj gibi geleneksel yöntemler basit ancak zaman alıcıdır ve hassasiyet ve temsil edilebilirlikten yoksundur7. Genel olarak, zaman içinde belirli bir fonksiyonel plazmidi veya seçici basınçları koruyan kolonilerin sayısını kantitatif olarak çıkarmak veya tahmin etmek zor olmaya devam etmektedir.
Bu zorlukların üstesinden gelmek için, Escherichia coli'yi model olarak kullanarak, birden fazla izole bakteri kolonisindeki floresan sinyallerini ölçmek için açık donanım araştırma araçlarını kullanan yeni bir mikroakışkan iş akışı sunulmaktadır. Bu yöntem, çeşitli koşullar veya seçici basınçlar üzerinde plazmit retansiyonunun yüksek verimli ve hassas analizine izin verir. Tek hücre çözünürlük analizi, izole edilmiş kolonileri manipüle etmek için kesin bir yöntem sağlayarak, tutma ve kayıp oranlarını değerlendirmeye yardımcı olabilecek plazmit miktar tayini hakkında hassas veriler sağlar4.
Mikroakışkanlar, özellikle damlacık mikroakışkanları, kontrollü ortamlarda tek tek hücreleri kapsüllemek ve manipüle etmek için güçlü bir araç olarak ortaya çıkmıştır8. Spesifik olarak, mikrojel damlacıkları, yağ9 içinde asılı kalan damlacıkların korunmasına gerek kalmadan yüksek verimli ve hassas analiz için tek hücreleri kapsülleyebilir ve tanımlanmış bir mikro ortamda plazmit dinamiklerinin kontrollü bir çalışmasına olanak tanır. Hücre süspansiyonlarının doğrudan bir pipet ucundan10 kapsüllenmesini takiben, damlacıklar içindeki mikrokolonilerin büyümesini izlemek için floresan teknikleri kullanılabilir, bu da farklı seçim basınçları altında plazmit retansiyonu ve ayrışmasının ayrıntılı analizini sağlar3.
Bu yöntemin geleneksel yığın kültür tekniklerine göre avantajları arasında artan hassasiyet, azaltılmış değişkenlik ve yüksek verimli analizler yapma yeteneği yer alır. Açık kaynaklı mikroakışkan teknolojisi, genellikle araştırmanın ilerlemesini engelleyen erişilebilirlik, uyarlanabilirlik ve bakım sorunları gibi pahalı tescilli sistemlerin sınırlamalarının üstesinden gelir 11,12,13. Açık kaynaklı enstrümantasyonlu mikrojellerde plazmit tutma analizinin gelişmiş deneysel iş akışının nasıl uygulanacağını göstererek, plazmit biyolojisi, sentetik biyoloji uygulamaları ve mikroakışkan damlacık analiz tekniklerinde araştırmalar için erişilebilir ve güvenilir bir yöntem sağlanır.
Özetle, bu makale, yüksek istatistiksel güce sahip E. coli'de plazmit retansiyonunu kantitatif olarak değerlendirmek için erişilebilir bir yöntem sunmaktadır. Bu yöntemin yetenekleri, onu plazmit biyolojisinin anlaşılmasını ilerletmek ve sentetik biyoloji uygulamalarını geliştirmek için değerli bir araç haline getirir.
Protokol
Şekil 1, E. coli'de plazmit stabilitesini değerlendirmek için şematik bir genel bakış sağlar.Reaktiflerin ve kullanılan ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir. Ham veriler ve görselleştirme komut dosyaları https://doi.org/10.17605/OSF.IO/6YWJK'da mevcuttur.
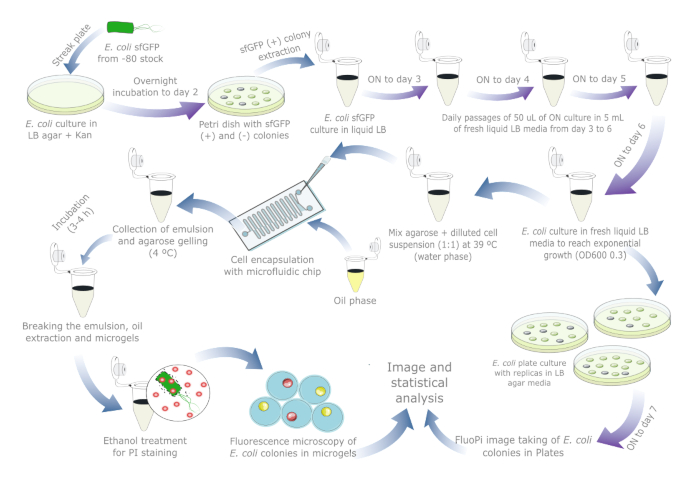
Şekil 1: E. coli'de plazmit stabilitesini değerlendirmek için günlük protokol. Mavi oklar gün içindeki adımları, mor oklar ise gece boyunca inkübasyonu gösterir. Her sıvı ve agar inkübasyonu, ayrı bir negatif kontrol tüpü / plakası ile birlikte 37 ° C'de gerçekleştirildi. Plazmit kaybının zaten meydana gelmiş olabileceği gerçek dünya numuneleri için hücre kültürü hazırlığının ve pasajlarının gerekli olmadığını unutmayın, bu nedenle bir plaka referans kültürü dahil edilirse protokol bir veya iki güne düşürülmelidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Mikroakışkan çip hazırlama
NOT: Bu protokolde, bir damlama rejiminde çapı 100 μm'den daha küçük yağ içinde su damlacıkları üretebilen hücre kapsüllemesi için farklı ticari veya özel çip tasarımları kullanılabilir. Bu çalışma için, çip, daha önce yayınlanmış bir raporda14 bildirildiği gibi aynı tasarım ve üretim yöntemi izlenerek tasarlanmış ve üretilmiştir (bkz. makale verileri https://doi.org/10.17605/OSF.IO/6YWJK).
- Jel-mikrodamlacık üretimi için tasarlanmış bir ana kalıp kullanarak bir PDMS cam üzerinde mikroakışkan çip edinin veya hazırlayın.
- İç mikro kanalları hidrofobik hale getirmek için çipe su itici bir çözelti (floroalkil silan) enjekte edin. Solüsyonu girişlere demleyin ve tüm kanalların sıvıyla dolduğundan emin olun. Dolu kanalları yaklaşık 30-60 saniye dinlenmeye bırakın.
- Havayı iç mikro kanallara atarak çözeltiyi cihazdan çıkarın. Havayı yıkamak için boş bir hava şırıngası kullanın ve sıçramayı önlemek için diğer bağlantı noktalarının üzerine emici bir mendil kullanın.
- Fazla çözeltiyi buharlaştırmak için işlenmiş cihazı 65 °C'de bir ocak gözü üzerinde 15 dakika pişirin. Alternatif olarak, cihazı gece boyunca buzdolabında (4 °C) saklayın.
NOT: Mikroakışkan çip kullanıma hazırdır. Protokol buradan duraklatılabilir.
2. Numune hazırlama
- Hücre toplama
NOT: Damlacıklardaki hücre kültürü, plazmit dinamikleri hakkında ilgili verileri sağlayabilir. Deneysel bir bakteri modeli olarak, bir E. coli TOP10 suşu, bir süper klasör yeşil floresan proteini (sfGFP) ve kanamisin direnci15'i kodlayan plazmit pCA_Odd1 (https://doi.org/10.17605/OSF.IO/6YWJK depolanan verilere bakınız) ile kullanılır. Bakteriler, plazmit ve büyüme ortamları deney sistemine göre değişebilir.- 25 g önceden karıştırılmış LB ve 12 g agarı 800 mL damıtılmış suda (dH2O) çözerek Luria Bertoni (LB) -Agar'ı hazırlayın. Ayrıca, 25 g önceden karıştırılmış LB'yi 800 mL dH2O içinde çözerek sıvı LB ortamı hazırlayın. Çözeltileri otoklavlayın ve yaklaşık 60 ° C'ye soğumaya bırakın. Sonraki adımlar için akış başlığı gibi steril bir ortama geçin.
NOT: Önceden karıştırılmış LB tozu, 10 g tripton, 5 g maya özü ve 10 g NaCl içerir. Kendi kendine karıştırılan LB-agar ortamı da kullanılabilir. - 50 mL sıvı LB-Agar'a (nihai konsantrasyon: 100 μg / mL) 50 μL kanamisin (100 mg / mL'de hazırlanmış) ekleyin. Tüpü birkaç kez ters çevirerek çözeltiyi karıştırın.
- Petri kabı başına yaklaşık 15 mL sıvı LB-agar dökün (90 mm x 15 mm). İki plaka hazırlayın: biri negatif kontrol (kontaminasyon izleme) ve diğeri deney kültürü için. LB-agar solüsyonunun soğumasını ve her iki plakada da renk koyudan berrak hale gelene kadar katılaşmasını bekleyin.
- Çizgi plakası tekniğini kullanarak E. coli suşunu kültür plakasına yaymak için steril bir halka kullanın. Gliserol stoğu E. coli'yi kullanımdan hemen sonra –80 °C'ye geri koyun. Her iki plakayı da kapatın ve gece boyunca 37 °C'de (1. gün) inkübe edin.
- 2. günde, kontaminasyon sinyali olarak herhangi bir koloni için negatif kontrol plakasını kontrol edin (eğer öyleyse, 2.1.4.'teki adımları tekrarlayın). Sıvı bir kültür stoğu hazırlamak için mavi ışıklı bir transilluminatör kullanarak E. coli plakası üzerindeki tek floresan kolonileri tanımlayın.
- Steril koşullar altında, plakayı açın ve seçilen koloniyi almak için steril bir halka veya 200 μL pipet ucu kullanın ve 5 mL taze sıvı LB ortamı ve 5 μL kanamisin (100 mg / mL'de hazırlanmış) içeren bir kültür tüpüne aktarın. Kontaminasyon izleme için aşılama olmadan negatif bir kontrol tüpü hazırlayın. Kültür tüplerini 220 rpm'de çalkalarken gece boyunca 37 °C'de inkübe edin.
- Plazmit kaybının meydana gelebileceği koşulları simüle etmek için numuneyi antibiyotiksiz ortamda 3 gün daha geçirin. 3, 4 ve 5. günlerde, gece boyunca 50 μL'yi antibiyotiksiz 5 mL sıvı LB içeren yeni bir kültür tüpüne aktarın. Gece boyunca 37 °C'de 220 rpm'de çalkalayarak inkübe edin. Bu adımı 6. güne kadar tekrarlayın ve toplam dört geçişten sonra son 5 mL kültür elde edin.
- Son gece kültüründen 50 μL'yi 2 mL sıvı LB içeren yeni bir kültür tüpüne aktarın. Bir spektrofotometre (yaklaşık 3-4 saat) kullanarak kültürün 0,3'lük bir optik yoğunluğa (OD600) ulaşmasına izin verin.
NOT: Bakterilerin logaritmik büyüme aşamasında olduğundan emin olmak için OD600 artmadan önce taze kültür kullanılmalıdır. İstenen konsantrasyon elde edilmezse, adım 2.1.8'den itibaren tekrarlayın.
- 25 g önceden karıştırılmış LB ve 12 g agarı 800 mL damıtılmış suda (dH2O) çözerek Luria Bertoni (LB) -Agar'ı hazırlayın. Ayrıca, 25 g önceden karıştırılmış LB'yi 800 mL dH2O içinde çözerek sıvı LB ortamı hazırlayın. Çözeltileri otoklavlayın ve yaklaşık 60 ° C'ye soğumaya bırakın. Sonraki adımlar için akış başlığı gibi steril bir ortama geçin.
- Kapsülleme için hücre-agaroz karışımı
NOT: Tek hücreli damlacık kapsüllemesini sağlamak için konsantrasyon kontrolü çok önemlidir. Aşağıdaki örnekte gösterildiği gibi, bir hedef kapsülleme hızı ve spesifik damlacık hacmi için gerekli hücre konsantrasyonu hesaplanabilir:
Damlacık hacmi (Vdamla): 50 μm damlacıklar oluşursa
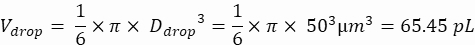
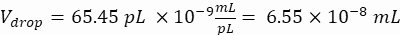
Damlacık başına istenen hücre sayısı (Cpd): Ortalama olarak beş damlacık başına bir hücre (0,2 hücre/damlacık)
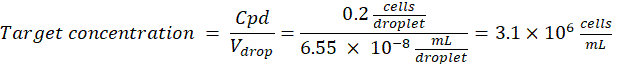
Seyreltme faktörü: İlk hücre konsantrasyonu adım 2.1.8'de elde edilir.
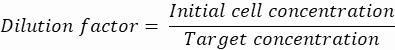
Burada, 50 μm veya 100 μm (damlacık bölünmesi olmadan) damlacıkları (65-520 pL), beş damlacık başına yaklaşık bir hücrenin kapsüllendiği veya bölünmeden damlacık başına 1.6 hücre üretilir. E. coli için, 1 OD600 biriminin dönüştürme faktörünü ≈ 7.8 x 108 hücre / mL16 kullanın. Kültürün başlangıç konsantrasyonunu (hücreler/mL) elde etmek için adım 2.1.8'deki OD600 değerini dönüştürme faktörü ile çarpın.- E. coli'yi hazırlanan kültür stoğundan 6.2e+6 hücre/mL konsantrasyonda (50 μm çaplı damlacıklar için hedef konsantrasyon) kanamisin içermeyen sıvı LB içinde yeniden süspanse edin. Bakteri süspansiyonunu agaroz ile karışana kadar oda sıcaklığında tutun.
NOT: Antibiyotikler negatif mikrokoloni oluşumunu baskılayacaktır, bu nedenle plazmit kaybı deneyleri için ortamdan çıkarılması önemlidir. - %2 (a/h) konsantrasyonda sıvı LB içinde 90 °C'ye ısıtarak ultra düşük jelleşme sıcaklığında agaroz hazırlayın. Karışımı sıcaklık kontrollü bir çalkalayıcıda 10 dakika çalkalayın.
- Agaroz çözeltisini soğutmak için termo-çalkalayıcının sıcaklığını 39 °C'ye düşürün. Paralel olarak, bakteri süspansiyon tüpünü 39 °C'ye ısıtmak için 4 dakika boyunca termo-çalkalayıcıya yerleştirin.
- 3.1e+6 hücre/mL'de hücre süspansiyonu ile %1'lik (a/h) bir agaroz konsantrasyonu elde etmek için bakterileri ve agaroz süspansiyonlarını 1:1 oranında karıştırın. Negatif kontrol solüsyonunu (kontaminasyon izleme) bakteri süspansiyonu yerine sıvı LB kullanarak aynı agaroz konsantrasyonu ile hazırlayın.
NOT: Bakteri büyümesine bağlı konsantrasyon değişikliklerini önlemek için agaroz hücre süspansiyonu hızlı bir şekilde kullanılmalıdır. Damlacık oluşumu için uç ısıtıcıya yüklenene kadar agaroz sıvısını tutmak için termo-çalkalayıcıyı 39 °C'de tutun.
- E. coli'yi hazırlanan kültür stoğundan 6.2e+6 hücre/mL konsantrasyonda (50 μm çaplı damlacıklar için hedef konsantrasyon) kanamisin içermeyen sıvı LB içinde yeniden süspanse edin. Bakteri süspansiyonunu agaroz ile karışana kadar oda sıcaklığında tutun.
3. Yüksek verimli tek koloni yetiştiriciliği
- Deney düzeneği
- Gaz basıncı sürücüleri ve akış sensörleri de dahil olmak üzere tam açık kaynaklı akış platformunu oluşturun veya edinin (bkz. https://doi.org/10.17605/OSF.IO/6YWJK). Alternatif olarak, daha basit açık kaynaklı donanım flaşıyla geliştirilmiş mikroskopi aşamasını oluşturun (https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ oluşturma talimatlarına ve proje deposu https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage bakın).
NOT: Ticari bir mikroskop, yüksek hızlı kamera ve numune ısıtma özelliklerine sahip geleneksel bir mikroakışkan kurulumu da kullanılabilir. - Açık kaynaklı Raspberry Pi tabanlı basınç ve akış kontrol sistemini, belirlenen depoda (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller) belgelendiği gibi entegre edin.
NOT: Modül kontrolü resimlidir ve veri havuzuna yedeklenir (https://doi.org/10.17605/OSF.IO/6YWJK. Alternatif olarak, geleneksel basınç kontrolörleri veya yüksek torklu şırınga pompaları kullanılabilir. - Agaroz hücresi numunesinin çipe girerken sıcaklığını kontrol etmek için kuruluma bir cam sürgü ve pipet ucu ısıtıcıları (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring) dahil edin.
NOT: Veri deposunda (https://github.com/wenzel-lab/flow-microscopy-platform ve https://doi.org/10.17605/OSF.IO/6YWJK) gösterilen bu ısıtıcılar, agaroz ile çalışmayı sağlayan açık kaynaklı denetleyici sisteminin önemli bir özelliğidir ve diğer ticari sistemlerde bulunmayabilir.
- Gaz basıncı sürücüleri ve akış sensörleri de dahil olmak üzere tam açık kaynaklı akış platformunu oluşturun veya edinin (bkz. https://doi.org/10.17605/OSF.IO/6YWJK). Alternatif olarak, daha basit açık kaynaklı donanım flaşıyla geliştirilmiş mikroskopi aşamasını oluşturun (https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ oluşturma talimatlarına ve proje deposu https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage bakın).
- Tek hücreli kapsülleme
- Mikroakışkan çipi, damlacık oluşturma bağlantısının (sulu ve yağ fazlarının kesişimi) görünür olduğundan emin olarak, flaşla geliştirilmiş mikroskopi aşamasına yerleştirin.
- Kontrol yazılımı arayüzünü kullanarak pipet ucu ısıtıcısını ve cam sürgülü ısıtıcıyı 40 °C'ye ayarlayın.
- Hücre süspansiyonlu %1 agaroz karışımını 200 μL'lik bir pipet ucuna yüklemek için hortumlu ve PDMS tapalı bir şırınga kullanın. Ucu uç ısıtıcıya yerleştirin ve mikroakışkan çipteki sulu fazın girişine yerleştirin. Ucun PDMS contasını, akış kontrol sistemi borusuna bağlı olanla değiştirin ve hücre süspansiyonunun infüzyonunu başlatın.
- Çıkış borusu ucunu bir atık tüpüne yerleştirin ve sıvıyı mikroakışkan kanala yavaşça iletmek için kullanıcı arayüzünde akış hızlarını veya iki fazlı basınçları ayarlayın. Sulu faz için 200 μL/sa (180 mbar) ve yağ fazı için 1700 μL/sa (320 mbar) kullanın. Damlacık oluşumunun stabilizasyonu için 1 dakika bekleyin.
NOT: Basınç değerleri, çip tasarımının kanal boyutlarına bağlıdır ve akış değerlerinin farklı damlacık oluşturma bağlantı tasarımları için ayarlanması gerekebilir. - Damlacık oluşumu stabil hale geldiğinde, atık ve toplama borusunu toplama tüpüne aktarın. Numune haznesi boşalana kadar damlacıkları toplamaya devam edin. Adım 2.2.4'teki negatif kontrol çözümünü kapsüllemek için 3.2.3 ila 3.2.5 arasındaki adımları tekrarlayın.
NOT: Numune toplama işlemi 15 dakika içinde tamamlanmalıdır. - Toplama tüplerini damlacık oluşumu sırasında buz üzerinde saklayın veya agarozun damlacıkların içinde jelleşmesine izin vermek için deneyden sonra 1 saat boyunca 4 ° C'de saklayın.
NOT: Mikrokanallar tıkalı kalırsa ve aynı süspansiyon yüklenirse, mikroakışkan çip yeniden kullanılabilir. Emülsiyon oluşturmayı tamamladıktan sonra pipet ucunu atın (adım 3.2.3–3.2.5).
- Koloni büyümesi ve emülsiyondan salınması
- Bakteri içeren jel mikro damlacıklarını ve damlacıklardaki negatif kontrolü 37 °C'ye ayarlanmış bir inkübasyon odasına aktarın.
- Yeterli koloni büyümesine izin vermek için mikro damlacıkları en az 4 saat veya gece boyunca inkübe edin. Negatif kontrolün parlak alan mikroskobu ile kontaminasyon belirtisi göstermediğini onaylayın.
- Kolonileri emülsiyondan çıkarmak için, bir pipet veya iğneli bir şırınga kullanarak jel mikro damlacık emülsiyonunun altından mümkün olduğunca fazla yağı çıkarın (burada 21 G boyutunda iğne kullanılmıştır).
- 50 μL jel mikro damlacıklarını yeni bir mikrotüpe aktarın ve daha fazla damlacık analizi için 4 °C'de saklayın. Kalan emülsiyona, emülsiyona eşit bir hacimde 1H, 1H, 2H, 2H-perfloro-1-oktanol (PFO) ile 1: 1 florlu yağ karışımı ekleyin.
- Emülsiyonun üzerine yaklaşık 200 μL fosfat tamponlu tuzlu su (PBS) tamponu veya %0.9 w/v NaCl tamponu ekleyin. Karışımı vorteksleyin ve sabit hızlı bir santrifüjde kısa bir süre döndürün.
- Yağ fazını sıvı arayüzünün altından dikkatlice çıkarın ve üstten 100 μL PBS'yi atın. Minimum yağ kalıntısı olan veya hiç yağ kalıntısı olmayan PBS tamponunda yıkanmış mikrojeller elde etmek için 3.3.4–3.3.5 adımlarını tekrarlayın.
NOT: Mikrojeller sıvı arayüze çöker; Bunları yağ fazı ile birlikte çıkarmaktan kaçının.
4. Tek koloni analizi
- Hücre boyama
NOT: Bu protokol için birçok farklı leke kombinasyonu çalışır. Özünde, plazmit tarafından kodlanan floresan proteinden farklı bir renge sahip bir DNA veya hücre duvarı boyası seçilmeli ve floresan mikroskobu üzerindeki mevcut filtre kombinasyonları kullanılarak analiz edilebilmelidir. Burada, hücrelerin DNA'sı, floresansını plazmitler üzerinde kodlanan yeşil floresan proteininden ayırt etmek için Propidyum İyodür (PI) ile boyandı, ancak diğer birçok DNA boyası kullanılabilir.
DİKKAT: PI potansiyel bir kanserojendir ve uygun kişisel koruyucu ekipmanla kullanılmalıdır. Boyayı güvenli bir şekilde ve yerel yönetmeliklere uygun olarak atın.- Yıkanmış mikrojelleri oda sıcaklığında 5 dakika boyunca yaklaşık 80 x g'da santrifüjleyin. Süpernatanı bir pipet kullanarak atın.
- Etanol tedavisi için negatif bir kontrol görevi görmesi için 50 uL mikrojelleri yeni bir mikrotüpe aktarın.
NOT: PI lekesi yalnızca etanol işleminden etkilenenler gibi zarları bozulmuş hücrelere girer. - Kalan mikrojellere eşit hacimde% 70 etanol ekleyin ve bir girdapla kısaca karıştırın. PI boyama için bakteri zarlarını geçirgen hale getirmek için oda sıcaklığında 15 dakika inkübe edin. Adım 4.1.1'i tekrarlayın.
- Mikrojellere eşit hacimde %0.9 w/v NaCl ekleyin ve kısaca girdap yapın. Adım 4.1.1'i tekrarlayın.
- Her iki mikrotüp örneğine 2 μL PI (1 mg / mL) ekleyin. İyice karıştırın ve karanlıkta oda sıcaklığında 15 dakika inkübe edin.
NOT: Negatif kontrol, floresan mikroskobu yoluyla herhangi bir kırmızı floresan sinyali sunarsa, kolonilerin bütünlüğü, önceki adımlarda diğer çözeltilere maruz kalmaları sırasında tehlikeye girmiş olabilir.
- Mikroskopi
NOT: Damlacıklar ve mikrojeller, mikrojellerdeki damlacık boyutu dağılımını ve bakteri kolonilerinin floresansını elde etmek için ters çevrilmiş bir epi-floresan mikroskobu ile görüntülenir (Şekil 2). Burada, 10x 0,3NA objektif, parlak alan aydınlatması için beyaz bir LED dizisi ve uyarma için 470 nm LED ile açık kaynaklı bir ters mikroskopi platformu (https://github.com/wenzel-lab/SQUID-bioimaging-platform)17 kullanılır. Ticari epi-floresan mikroskoplar, damlacıkları ve mikrojelleri görüntülemek için kullanılabilir. Kalibrasyon gereklidir çünkü aydınlatma ve filtreler modele, markaya ve kullanılan floresan proteinlere göre değişir.- 2 μL jel mikro damlacıkları bir görüntüleme odası lamına aktarın ve optimum görüntüleme için tek katmanlı bir damlacık oluşturmaya yardımcı olmak için 5 μL florlu yağ ekleyin.
NOT: Hücre sayma odaları veya basit mikroakışkan odaları, emülsiyonun ince bir şekilde yayılmasına ve kurutma işleminin yavaşlamasına yardımcı olabilir. - Mikroskopta, parlak alan görüntüleme için üstten beyaz LED matris aydınlatmayı etkinleştirin. Hazırlanan slaydı monte edin, örneğe odaklanın ve tek katmanlı bir damlacık bulun. Parlak alanlı bir görüntü yakalayın.
- Numuneyi hareket ettirmeden, uyarma için 470 nm LED'e geçerek kolonilerin floresan görüntüsünü yakalayın. Filtre tekerleğini, sfGFP görüntüleme için yeşil dalga boyu filtresiyle hizalanacak şekilde ayarlayın. Tek katmanlı damlacık içeren tüm alanları tarayın ve damlacık analizinde istatistiksel sağlamlığı sağlamak için 4.2.2–4.2.3 adımlarını tekrarlayın.
- Tek katmanlı bir mikrojel oluşturmaya yardımcı olmak için 2 μL lekeli mikrojelleri bir görüntüleme odası çipine ve 5 μL %0.9 w/v NaCl'ye aktarın. Görüntüleme sırasında buharlaşmayı önlemek için çipin giriş ve çıkışını kapatın.
NOT: Buharlaşma, floresan etiketlerin kolokalizasyonunu etkileyebilir. Uzun süreli görüntüleme için mikroakışkan odalar önerilir. - 4.2.2–4.2.3 adımlarını tekrarlayın. PI görüntüleme için kırmızı dalga boyu aralığı filtresini ayarlayın ve ilgili görüntüleri yakalayın.
- Görüntülemeyi bir yerde tamamladıktan sonra, tek katmanlı bir mikrojel ile slayt üzerinde bir sonraki uygun alanı bulun ve numunenin istatistiksel sağlamlığını ve kapsamlı analizini sağlamak için görüntüleme işlemini tekrarlayın.
- 2 μL jel mikro damlacıkları bir görüntüleme odası lamına aktarın ve optimum görüntüleme için tek katmanlı bir damlacık oluşturmaya yardımcı olmak için 5 μL florlu yağ ekleyin.
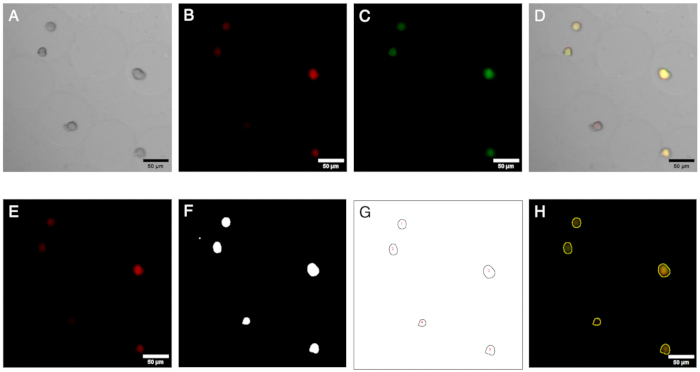
Şekil 2: Mikroskopi görüntüleri ve analizi. Mikrojellerdeki kolonilerin floresan görüntüleme ve analizi. (A-C) Ters mikroskop ile parlak alan ve floresan mikroskobu ile elde edilen görüntü kanalları. Kompozit görüntü (D), mikrojeller içinde negatif bir koloninin (yalnızca kırmızı floresan) varlığını gösterir. (E-H) Görüntü analizi iş akışının sonuçları. ROI'ler üreterek, koloniler kırmızı ve yeşil kanallarda tanımlanabilir ve sinyaller, negatif kolonilerin varlığını tanımlamak için ölçülebilir. Ölçek çubukları: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Görüntü analizi
NOT: Kapsüllenmiş kolonilerden gelen floresan sinyallerini analiz etmek ve nadir olayları belirlemek için, parlak alan ve floresan görüntülemeden elde edilen görüntüler Fiji/ImageJ ile işlenebilir (Şekil 3). Bu adımlar bir makro komut dosyasına uygulanabilir ve parametre değerleri optik yapılandırmaya bağlı olarak değişebilir.- Yeşil ve kırmızı kanallardan görüntüleri açın. Her biri 2000 piksel genişlik ve yüksekliğe sahip koordinatlardan (500, 500) başlayan dikdörtgen bir ilgi alanı (ROI) tanımlayın.
NOT: Bu parametreler 3000 x 3000 piksel görüntüler için geçerlidir ve ROI, daha iyi aydınlatmaya sahip alanı tanımlar. - Görüntüyü, tanımlanan dikdörtgen ROI'ye göre kırpın. Her pikselin yoğunluğundan 10 sabit bir değer çıkarın ve arka plan gürültüsünü azaltmak ve ilgilenilen nesneleri daha belirgin hale getirmek için görüntüye bir yumuşatma filtresi uygulayın.
NOT: Daha fazla analiz için yalnızca bu bölge kullanılacaktır. - Görüntüyü kırmızı kanaldan çoğaltın ve plazmit ile ilgili nadir olayları tanımlamak için ikili bir maskeye dönüştürün. Eşik değerlerini 10 ile 255 arasında ayarlayın. Bu aralıktaki pikseller ön plan (ilgilenilen nesneler) olarak kabul edilirken, diğerleri arka plan olarak kabul edilir.
- Küçük boşlukları kapatmak ve ilgilenilen nesnelerdeki delikleri doldurmak için morfolojik işlemler gerçekleştirin. İkili maske içinde çakışan nesneleri ayırmak için havza algoritmasını uygulayın.
- İkili maskedeki parçacıkları analiz edin. Yalnızca boyutu 30 pikselden büyük ve daireselliği 0,50 ile 1,00 arasında olan parçacıkları dikkate alın. Sonuçlar özetlenir ve sonuç tablosuna eklenir. Daha fazla görselleştirme için parçacık analizi tarafından tespit edilen ROI setini kaydedin.
- Kaydedilen ROI'leri yeşil ve kırmızı kanallardan gelen görüntülerde görüntüleyin. Bu görüntülerdeki ROI'lerin yoğunluğunu veya diğer özelliklerini ölçün. Ölçümleri sonuç tablosuna kaydedin ve daha fazla istatistiksel analiz için sonuçları ayrı CSV dosyalarına kaydedin.
- Yeşil ve kırmızı kanallardan görüntüleri açın. Her biri 2000 piksel genişlik ve yüksekliğe sahip koordinatlardan (500, 500) başlayan dikdörtgen bir ilgi alanı (ROI) tanımlayın.
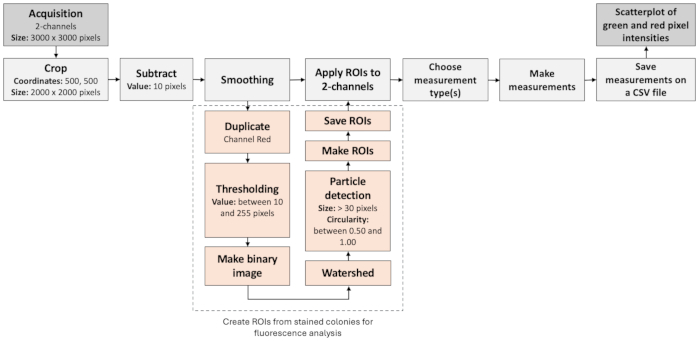
Şekil 3: Negatif kolonileri tanımlamak için görüntü analizi iş akışı. Şekil, floresan görüntüleri otomatik olarak işlemek ve değerlendirmek için adım adım bir iş akışını göstermektedir. İş akışı, floresan etiketlerin kolokalizasyonunun yanı sıra partikül analizine de dayanmaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Agar plaka karşılaştırma testi
NOT: Damlacık yöntemini geleneksel bir plaka tahlili ile karşılaştırmak için, aynı E. coli suşunun floresan kolonilerinin miktar tayini adım 2.1.8'de elde edilmiştir. Petri kapları kullanılarak gerçekleştirildi. Bu, sfGFP plazmit stabilitesini ölçmek için bir analog kontrol yöntemi olarak görev yaptı. Ayrıca Şekil 1'deki yöntem resmine bakın.
- LB-agar'ı (antibiyotiksiz) Hücre Toplama bölümünden adım 2.1.1'de açıklandığı gibi hazırlayın. Agarı 60 °C'nin altına soğutun ve homojenize edin.
- Steril bir ortamda, her bir Petri kabına 15 mL agar ortamı dökün. Kullanıma hazır olana kadar kapaklar kısmen açık olarak plakaların katılaşmasına izin verin.
- LB ortamında her biri 10 μL'lik bir E. coli kültürü olan üç plakayı, 0.007 ± 0.002'lik bir OD600 ile aşılayın. L şeklinde bir yayıcı kullanarak eşit şekilde yayın. Plakaları 37 °C'de, kapalı ve ters çevrilmiş olarak inkübe edin. Aynı koşullar altında bakteri içermeyen bir kontrol plakası hazırlayın.
- 24 saat sonra, açık kaynaklı bir floresan görüntüleme sistemi (https://github.com/RudgeLab/FluoPi)15 olan FluoPi'yi kullanarak plakaların floresan görüntülerini yakalayın.
NOT: FluoPi, 470 nm merkezli bir dalga boyunda mavi uyarma ışığına sahip bir Raspberry Pi kameradan ve akrilik uyarma ve emisyon filtrelerinden oluşur. - Yakalanan görüntüleri kullanarak her plakadaki floresan ve floresan olmayan kolonileri manuel olarak sayın.
Sonuçlar
Hücre kapsüllemesi ve mikrokoloni oluşumunun doğrulanması
Hücre kapsüllemesi, emülsiyonu kırmadan ve mikrojelleri yıkamadan önce jel mikro damlacıkları üzerinde parlak alan mikroskobu yapılarak görsel olarak doğrulanabilir. Bu adımdaki emülsiyonun temsili bir sonucu Şekil 4'te gösterilmiştir.
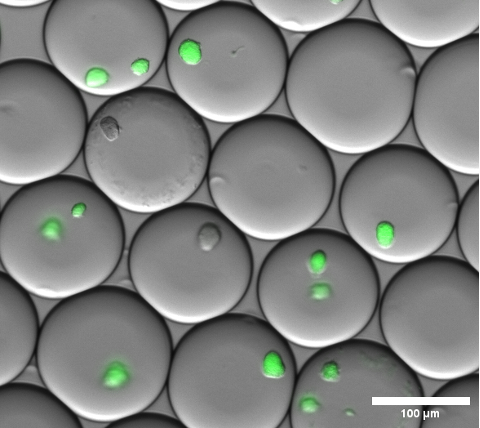
Şekil 4: Floresan mikroskobu kaplama görüntüsünün kesiti. Gece boyunca inkübasyondan sonra, jel mikrodamlacıklarının içindeki E. coli kolonilerini eksprese eden sfGFP'nin temsili mikrokolonileri. 10x büyütme ve 0.30 NA olan bir mikroskop objektifi kullanıldı. Ölçek çubuğu: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Görüntü analizi sonuçları
Mikrojeller boyandıktan ve parlak alan haline getirildikten sonra, çeşitli pozisyonlarda elde edilen floresan kanallarının yanı sıra, orijinal görüntülerde negatif olarak tanımlanan koloniler görselleştirilebilir (bkz. Şekil 5A). Bir deneyin tüm görüntülerinden elde edilen veriler, çeşitli kolonilerin floresan oranını gösterecek şekilde çizilebilir ve plazmid kodlu floresan kaybedenleri vurgulayabilir (bkz. Şekil 5B). Sonuçlar, analiz edilen toplam 2785 mikrokoloniden 100 koloninin plazmit veya plazmit işlevselliğini kaybettiğini ve bu oranın %3.6'ya tekabül ettiğini göstermektedir.
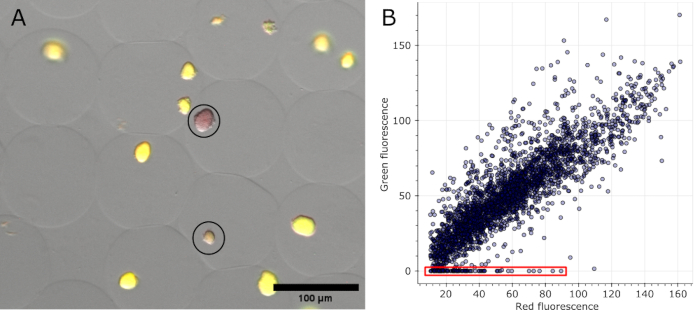
Şekil 5: Negatif mikrokolonilerin miktar tayini. (A) Floresan mikroskobu kaplama görüntüsünün bir bölümü. Yağın çıkarılması ve boyanmasından sonra, sfGFP'yi eksprese eden mikrojellerdeki temsili koloniler ve iki negatif koloni, DNA boyasının kırmızı floresansını gösterdi (siyah daire içine alınmış). Ölçek çubuğu: 100 μm. (B) 16 çok kanallı mikroskopi görüntüsünden çıkarılan tek tek mikrokolonilerin floresan değerlerinin dağılım grafiği. Yeşil floresan olmayan koloniler, grafikte kırmızı ile gösterildiği gibi negatif olarak sayıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Agar plaka miktar tayini
Üçlü plakaların görüntüleri, beyaz oklarla gösterilen floresan olmayan kolonilerle Şekil 6'da gösterilmiştir. İlk plaka (Şekil 6A), 1'i floresan olmayan toplam 213 koloni gösterdi. İkinci plaka (Şekil 6B) toplam 49 koloniye sahipti ve floresan olmayan koloniler yoktu. Üçüncü plaka (Şekil 6C), 6'sı floresan olmayan toplam 252 koloni gösterdi. Bu sonuçlar, 3.2'lik büyük bir standart sapma ile ortalama %2.3'lük bir koloni plazmit kaybı oranına karşılık gelir.
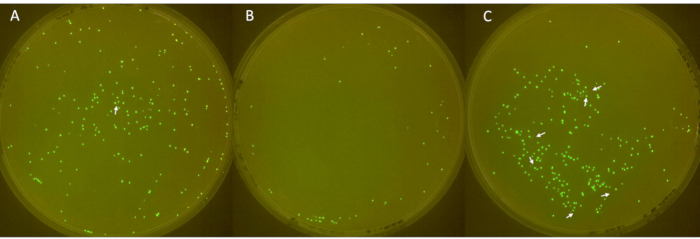
Şekil 6: Plakalar üzerindeki negatif kolonilerin tanımlanması. (A-C) LB-agar plakaları üzerinde floresan ve floresan olmayan E. coli kolonileri (çap: 90 mm, yükseklik: 15 mm). -80 °C stoğundan sfGFP'li E. coli'den türetilen aşı, 1. günde çizgilendi, 2. günde antibiyotikle kültürlendi ve plazmit kaybına izin vermek için 3. günden 6. güne kadar günde 1:100 oranında seyreltildi. Koloniler 37 ° C'de 24 saat inkübe edildi ve bir FluoPi odasında görüntülendi. Floresan olmayan koloniler GIMP ile arttırıldı ve beyaz oklarla gösterildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Jel mikro damlacık bazlı bir yöntemin, sfGFP gibi floresan proteinlerin plazmid kodlu genetik ekspresyonu olan ve olmayan kolonileri etkili bir şekilde tanımladığı ve miktarını belirlemek için gösterilmiştir. Plazmit ürününü yeterince ifade etmeyen koloniler, tüm kolonileri lekeleyen ve farklı bir emisyon dalga boyuna sahip bir floresan DNA boyası (burada, Propidium İyodür) kullanılarak tanımlanır. Açık kaynak teknolojisini kullanan damlacık mikroakışkanları, jelleşme ve floresan mikroskobunun bu entegrasyonu, birçok araştırma ortamında gelişmiş bir iş akışının yürütülmesini sağlar11,13. Jel-mikro damlacıkların başarılı bir şekilde üretilmesi, hücre lizisi, tek genom amplifikasyonu, metabolik hücre etkileşim ekranları, ortam alışverişi ve daha fazlası dahil olmak üzere gelişmiş moleküler biyoloji tek hücreli iş akışlarını mümkün kılar 8,9. Bu avantajlar, bu protokolde mikrokolonileri geleneksel plaka bazlı tahlillere göre daha ölçeklenebilir bir şekilde büyütmek, lekelemek ve analiz etmek için kullanılır.
Kritik adımlar
Kapsülleme işlemi, protokolün kritik ve hassas bir parçasıdır. Belirli bir boyut aralığında tek tip mikrojeller oluşturmak ve damlacık başına ortalama hücre sayısını kontrol etmek için bileşen konsantrasyonlarının, akış hızlarının ve basınçların hassas kontrolü gereklidir. Ayrıca, hücre-agaroz karışımının konsantrasyonunun ve sıcaklığının korunması, topaklanmayı veya erken jelleşmeyi önler. Bir pipet ucundaki sıvı agaroz hücre süspansiyonunun sıcaklık kontrolü, şırınga pompalarının ve boruların sıcaklığını kontrol etme çabalarına kıyasla çok daha kolay ve daha sağlam mikrojel üretimi sağlayan açık kaynaklı donanım mikroakışkan iş istasyonumuzun özellikle avantajlı bir uygulamasıdır. Hücreler, kapsülleme ve yetiştirmeden önce agaroz büyüme ortamı ile karıştırıldığından, büyük hücre konsantrasyonu değişikliklerini önlemek için agaroz mikrojellerinin hızlı bir şekilde üretilmesi gerekir. Bu amaçla, Abate ve ark.'dan ilham alan damlacık bölücü bir mikroakışkan çip tasarımı optimize edildi18.
Değişiklikler ve sorun giderme
Orijinal protokolü iyileştirmek için çeşitli kalibrasyonlar ve modifikasyonlar gerekliydi. Agarozun kapsüllenmesi, normal yağ içinde su damlacıklarından çok daha zordur ve sulu faz akışının homojen bir partikül boyutu aralığına ulaşmasını sağlarken agarozu sıvı halde tutmak için bir sistemin tasarlanmasını gerektirir. Jelleşmeye bağlı agaroz viskozitesindeki değişiklikler akış hızını etkileyerek daha büyük partikül boyutlarına yol açar. Mikroskopi, net bir farklılaşma için örtüşmeyen uyarma ve emisyon sinyallerini sağlamak için dikkatli bir filtre ve ışık kaynağı seçimi gerektirir. Başlangıçta, bakterileri boyamak için DAPI seçildi, ancak emisyon sinyali sfGFP ile örtüştü ve mavi algılama kanalında sfGFP'nin tespit edilmesine neden oldu. PI'ye geçtik çünkü emisyonu uzun dalga boylarında (kırmızı ışık) sfGFP'den iyi bir şekilde ayrıldı.
Plazmit kaybı önerilen yöntem kullanılarak ölçülürken, kullanılan sfGFP plazmidi beklenmedik bir şekilde stabildi ve pH9 ortamı ve 40 °C'de inkübasyon gibi stres koşulları altında bile antibiyotiksiz yetiştirilen ilk nesil hücrelerde neredeyse hiç plazmit kaybı örneği göstermedi. Bu gözlem, diğer araştırma gruplarınınbulguları ile tutarlıdır 1,19. Plazmit stabilitesi, yöntemin ilk hücre kültürü nesilleri için tam miktar tayin yeteneklerinin gösterilmesini sınırladı, ancak yöntemin plazmit tutulumundaki küçük farklılıkları bile tespit edecek kadar hassas olduğunu gösterdi. Erken nesillerde yüksek plazmit stabilitesinin gözlemlenmesi, hedef bakteri inhibisyonu gibi negatif bir seçim testi kullanan damlacık mikroakışkan ekranlar için önemli bir etkiye sahiptir. Bu, seçim hedeflerinin plazmit kaybının, yanlış pozitif seçim sonuçlarının düşük bir kaynağı olduğu anlamına gelir. Damlacık mikroakışkan ekranlar tipik olarak pipetleme robotu iş akışları gibi diğer yüksek verimli ekranları verim büyüklüklerine göre aştığından, bu nadir olayların değerlendirilmesi ve dikkate alınması gerekir.
Sınırlama
Avantajlarına rağmen, sunulan yöntemin sınırlamaları vardır. Mikroakışkan cihaz üretimi, deterministik kapsülleme verimliliğini sağlamak için uzmanlık ve ayrıntılara titiz bir dikkatin yanı sıra akış hızlarının sıkı deneysel kontrolünü gerektirir. Bu yönler, farklı deney kurulumları için optimizasyon gerektirebilir. Bu yöntem, sinyal algılama için floresan mikroskobuna dayanır ve uygun görüntüleme ekipmanına erişim gerektirirken, bu ekipman açık kaynaklı donanım kullanılarak üretilebilir ve bu da onu daha erişilebilir hale getirir. Ayrıca, mikrojeller, büyük nozullarla ticari akış sitometrisinde işlenebilir, bu da erişilebilirliği ve deneysel verimi daha da artırır. Bu sitometrik analiz için damlacık ayırıcılar da kullanılabilir.
Ayrıca, yöntem plazmitlerden, lekelerden veya diğer belirteçlerden gelen floresan sinyallerini tespit etmek için tasarlanmış olsa da, floresan olarak etiketlenebilen hücrelerle sınırlıdır, bu da tüm bakteri suşları veya deneysel koşullar için geçerli olmayabilir. Bununla birlikte, yöntem, faz kontrastı veya parlak alan mikroskobu gibi diğer mikroskop türlerini içerecek şekilde uyarlanabilir ve floresanın ötesinde fenotipleme uygulamalarına izin verir. Ek olarak, FTIR veya Raman spektroskopisi gibi spektroskopik tekniklerle birleştirilebilir ve kapsüllenmiş hücrelerin kimyasal bileşimlerini ve yapısal bilgilerini analiz etme yeteneklerini genişletir. Bu uyarlamalar, uygulanabilirlik yelpazesini genişleterek onu çeşitli araştırma ortamları için çok yönlü bir araç haline getirir.
Önemi ve uygulamaları
Plazmit kaybı19 için geleneksel tahliller, ekspresyonlarını kaybeden hücrelerin oranının iyi bir şekilde ölçülmesine izin vermez, bu bilgiler deneysel yöntem tasarımında ve çeşitli biyolojik uygulamalarda çok önemli olabilir. Genellikle, koloni tipleri, Şekil 4'te gösterildiği gibi, iyi tanımlanmış izole kolonilerin elde edilebildiği agar plakası tahlillerinde numaralandırılır. Bununla birlikte, örtüşen kolonileri güvenle tanımlamak zordur; Elimizde her zaman optimal bir koloni yoğunluğu elde edemeyiz ve düşük frekanslı plazmit kaybı olaylarının iyi istatistiklerini elde etmek için birçok plaka gereklidir. Önerilen yöntem, agar plakası analog yöntemlerinden daha fazla sayıda koloniye sahip izole kolonilerden gelen floresan sinyallerini doğru bir şekilde ölçmek için daha sağlam bir yaklaşım sunar, çünkü mikro damlacıklarda koloniler ayrı ayrı gelişir, daha küçüktür ve görüntüleme odalarına yüklenmesi kolaydır, bu da büyük koloni sayılarının mikroskopi veya akış sitometrisine dayalı nicelleştirilmesini sağlar. Bu, yöntemin istatistiksel temsilini önemli ölçüde iyileştirebilir ve diğer jel-mikro damlacık iş akışlarına entegrasyona izin verebilir.
Açık kaynaklı donanımın11,20 kullanılması, araştırmacıların mikroakışkan iş istasyonu tasarımını özelleştirmesine ve akış sıçanını hassas bir şekilde ayarlamasına olanak tanır; Bu nedenle, parçacık boyutu çeşitli hücre tiplerini ve deneysel koşulları destekler. Bu esneklik, faz kontrastı veya spektroskopi gibi diğer mikroskopi tiplerinin potansiyel olarak dahil edilmesine kadar uzanır ve yöntemin uygulanabilirliğini genişletir. Yöntemin çeşitli koşullar altında plazmit stabilitesini değerlendirme kapasitesi, antibiyotik seçimi olmadan, belirli stres koşulları veya çeşitli kültür nesilleri altında plazmit retansiyonu gerektiren uygulamalar için çok önemlidir. Sunulan yöntemin çok yönlülüğü ve uyarlanabilirliği, onu sentetik biyoloji, çevresel izleme ve klinik teşhis gibi alanlardaki çeşitli araştırma uygulamaları için değerli kılmaktadır2.
Açıklamalar
Yazarlar, rekabet eden hiçbir finansal çıkar veya kişisel ilişkinin bu yazıda bildirilen çalışmayı etkileyemeyeceğini beyan eder.
Teşekkürler
Bu çalışma, ANID FONDECYT Regular 1241621 ve Chang Zuckerberg Girişimi projesi 'Açık Donanım Yoluyla Biyogörüntüleme için Latin Amerika Merkezi' tarafından T.W.'ye verilen finanse edilen projelerin bir parçasıdır. TW ayrıca, CIFAR MacMillan Çok Ölçekli İnsan programında Azrieli Global Scholar olarak CIFAR'dan fon aldığı için minnettardır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 370533-25G | For breaking emulsion |
| 70% ethanol | For cell permeabilization | ||
| Agar-Agar | Winkler | 9002-18-0 | |
| Biopsy Punch | 0.75 mm and 1.8 mm | ||
| Blue LED transilluminator | IO Rodeo | ||
| Culture tube | 15 mL | ||
| Desiccator | With vacuum pump | ||
| Disposable cup | For mixing PDMS | ||
| Disposable fork | For mixing PDMS | ||
| E. coli TOP10 strain | |||
| FluoPi microscope | https://github.com/wenzel-lab/FluoPi | Green fluorescence imaging system for analyzing plates | |
| Fluorinated Oil | 3M | Novec 7500 | |
| Glass slide heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of microfluidic chip | |
| Glass Slides | |||
| Hotplate | Mechanic | For evaporating Aquapel | |
| Image analysis software | Fiji/ImageJ | 2.14.0/1.54f | |
| Incubator | Mundo Lab | MLAB Scientific / For incubation of plates and microgels | |
| Isopropanol | For cleaning glass slides | ||
| Kanamycin | 100 ug/mL concentration | ||
| L-shaped spreader | For spreading bacteria on agar plates | ||
| Master mold | Chip design on silicone or glass wafer | ||
| Microtubes | 2 mL | ||
| NaCl solution | Sodium chloride 0.9% w/v | ||
| Open-source hardware strobe-enhanced microscopy stage | https://github.com/wenzel-lab/flow-microscopy-platform | For bright-field microscopy | |
| Petri dish | Citotest | 2303-1090 | 90 x 15 mm |
| Pipette tip heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of pipette tip | |
| Plasma Cleaner | Diener Electronic | 117056 | For bonding PDMS with a glass slide |
| Plasmid pCA_Odd1 | Encodes sfGFP and kanamycin resistance | ||
| Polytetrafluoroethylene (PTFE) tubing | Adtech Polymer Engineering Ltd | ||
| Pre-mixed Luria Bertoni medium | US Biological Life Science | L1520 | |
| Propidium iodide (PI) | For staining | ||
| Raspberry Pi-based pressure and flow controller system | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller | For controlling pressure and flow rates | |
| Silicone elastomer base | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Silicone elastomer curing agent | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Spectrophotometer | For measuring absorbance | ||
| SQUID microscope | https://github.com/wenzel-lab/SQUID-bioimaging-platform | Multi-fluorescence imaging system for analyzing stained cells | |
| Sterile loop | For picking a colony and streaking plating | ||
| Surfactant | Sphere Fluidics | Pico-Surf | |
| Syringes | NIPRO | With filters and tubing | |
| Temperature-controlled shaker | Mundo Lab | DLAB HCM100-Pro | |
| Tweezer | |||
| Ultra-low gelling temperature agarose | Sigma-Aldrich | A2576-5G | For generating hydrogel beads |
| Water repelent solution (fluoroalkyl silane) | Aquapel | For treating microchannels of PDMS device |
Referanslar
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under non-selective conditions maintains antibiotic resistance. Nat Commun. 10 (1), 2595 (2019).
- Rodríguez-Beltrán, J., DelaFuente, J., León-Sampedro, R., MacLean, R. C., Millán, &. #. 1. 9. 3. ;. S. Beyond horizontal gene transfer: The role of plasmids in bacterial evolution. Nat Rev Microbiol. 19 (6), 347 (2021).
- Wein, T., Dagan, T. Plasmid evolution. Curr Biol. 30 (19), R1158-R1163 (2020).
- Chen, S., Larsson, M., Robinson, R. C., Chen, S. L. Direct and convenient measurement of plasmid stability in lab and clinical isolates of E. coli. Sci Rep. 7 (1), 4788 (2017).
- Rouches, M. V., Xu, Y., Cortes, L. B. G., Lambert, G. A plasmid system with tunable copy number. Nat Commun. 13 (1), 3908 (2022).
- Silva, F., Queiroz, J. A., Domingues, F. C. Evaluating metabolic stress and plasmid stability in plasmid DNA production by Escherichia coli. Biotechnol Adv. 30 (3), 691-708 (2012).
- Wang, R., et al. Construction of novel pJRD215-derived plasmids using chloramphenicol acetyltransferase (cat) gene as a selection marker for Acidithiobacillus caldus. PLoS ONE. 12 (8), e0183307 (2017).
- Moragues, T., et al. Droplet-based microfluidics. Nat Rev Methods Primers. 3 (1), 32 (2023).
- Vitalis, C., Wenzel, T. Leveraging interactions in microfluidic droplets for enhanced biotechnology screens. Current Opinion in Biotechnology. 82, 102966 (2023).
- Sinha, N., Subedi, N., Wimmers, F., Soennichsen, M., Tel, J. A pipette-tip based method for seeding cells to droplet microfluidic platforms. J Vis Exp. (144), e57848 (2019).
- Wenzel, T. Open hardware: From DIY trend to global transformation in access to laboratory equipment. PLOS Biol. 21 (1), e3001931 (2023).
- Murillo, L. F. R., Wenzel, T. Welcome to the journal of open hardware. J Open Hardware. 1 (1), (2017).
- Shin, J. H., Choi, S. Open-source and do-it-yourself microfluidics. Sens Actuators B Chem. 347, 130624 (2021).
- Pryszlak, A., et al. Enrichment of gut microbiome strains for cultivation-free genome sequencing using droplet microfluidics. Cell Rep Methods. 2 (1), 100137 (2021).
- Pollak, B., et al. Universal loop assembly: open, efficient and cross-kingdom DNA fabrication. Biology. 5 (1), (2020).
- Volkmer, B., Heinemann, M. Condition-dependent cell volume and concentration of Escherichia coli to facilitate data conversion for systems biology modeling. PLoS ONE. 6 (7), e23126 (2011).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , (2020).
- Abate, A. R., Weitz, D. A. Faster multiple emulsification with drop splitting. Lab Chip. 11 (11), 1911-1915 (2011).
- Lau, B. T. C., Malkus, P., Paulsson, J. New quantitative methods for measuring plasmid loss rates reveal unexpected stability. Plasmid. 70 (3), 353-361 (2013).
- Oellermann, M., et al. Open hardware in science: The benefits of open electronics. Integr Comp Biol. 62 (4), 1061-1075 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır