Method Article
تحليل استقرار البلازميد باستخدام الموائع الدقيقة ذات القطرات مفتوحة المصدر
In This Article
Summary
يتم تقديم سير عمل ميكروفلويدي مفتوح المصدر يمكن الوصول إليه للتحليل الموازي لاحتباس البلازميد في البكتيريا. من خلال استخدام الفحص المجهري الفلوري لتحديد وجود البلازميد في المستعمرات الدقيقة أحادية الخلية داخل قطرات الهلام الدقيقة ، توفر هذه الطريقة بديلا دقيقا ويمكن الوصول إليه وقابلا للتطوير لعد الألواح التقليدي.
Abstract
تلعب البلازميدات دورا حيويا في البيولوجيا التركيبية من خلال تمكين إدخال الجينات الغريبة والتعبير عنها في الكائنات الحية المختلفة ، وبالتالي تسهيل بناء الدوائر والمسارات البيولوجية داخل مجموعات الخلايا وفيما بينها. بالنسبة للعديد من التطبيقات ، يعد الحفاظ على البلازميدات الوظيفية دون اختيار المضادات الحيوية أمرا بالغ الأهمية. تقدم هذه الدراسة سير عمل ميكروفلويدي قائم على الأجهزة المفتوحة لتحليل احتباس البلازميد عن طريق زراعة الخلايا المفردة في قطرات هلامية دقيقة وتحديد المستعمرات الدقيقة باستخدام الفحص المجهري الفلوري. يسمح هذا النهج بالتحليل الموازي للعديد من القطرات والمستعمرات الدقيقة ، مما يوفر قوة إحصائية أكبر مقارنة بعد الألواح التقليدي وتمكين دمج الاختبار في تدفقات عمل الموائع الدقيقة الأخرى للقطرات. باستخدام البلازميدات التي تعبر عن بروتينات الفلورسنت جنبا إلى جنب مع صبغة الحمض النووي الفلورية غير المحددة ، يمكن تحديد المستعمرات الفردية وتمييزها بناء على فقدان البلازميد أو تعبير علامة الفلورسنت. والجدير بالذكر أن سير العمل المتقدم هذا ، الذي يتم تنفيذه باستخدام أجهزة مفتوحة المصدر ، يوفر تحكما دقيقا في التدفق وإدارة درجة الحرارة لكل من العينة وشريحة الموائع الدقيقة. تعمل هذه الميزات على تحسين سهولة استخدام سير العمل وقوته وإمكانية الوصول. بينما تركز الدراسة على الإشريكية القولونية كنموذج تجريبي ، فإن الإمكانات الحقيقية للطريقة تكمن في تعدد استخداماتها. يمكن تكييفه مع العديد من الدراسات التي تتطلب القياس الكمي لإشارة التألق من البلازميدات أو البقع ، وكذلك للتطبيقات الأخرى. يؤدي اعتماد الأجهزة مفتوحة المصدر إلى توسيع إمكانية إجراء تحليلات حيوية عالية الإنتاجية باستخدام تقنية يمكن الوصول إليها في بيئات بحثية متنوعة.
Introduction
البلازميدات هي عناصر وراثية أساسية في الخلايا بدائية النواة ، وتساهم بشكل كبير في التطور الميكروبي من خلال نقل الحمض النووي الجانبي والتكيف السريع مع التغيرات البيئية1،2. تحمل جزيئات الحمض النووي خارج الكروموسومات جينات توفر سمات مفيدة ، مثل مقاومة المضادات الحيوية ، ووظائف التمثيل الغذائي ، وعوامل الفوعة ، مما يجعلها ذات قيمة لأبحاث علم الأحياء الدقيقة والبيولوجيا التركيبية ودراسات التطور2. ومع ذلك ، فإن الحفاظ على البلازميد في مجموعات الخلايا يمثل تحديا بسبب العبء الأيضي للنسخ المتماثل والفصل ، مما يؤدي غالبا إلى فقدان البلازميد دون ضغط الاختيار3. بالإضافة إلى ذلك ، يتطلب الوراثة المستقرة آليات مثل السموم المضادة للسموم وأنظمة التقسيم ، مما يضيف تعقيدا إلى صيانة البلازميد. يعد تقييم استقرار البلازميد في ظل ظروف مختلفة أمرا بالغ الأهمية لكل من البحث الأساسي والتطبيقات العملية التي تستخدم البلازميدات كعنصر بحثي أساسي4،5. معظم الطرق الحالية لتقييم استقرار البلازميد لها قيود كبيرة: توفر الطرق القائمة على قياس التدفق الخلوي بيانات غير مباشرة على مستوى السكان ، وتتطلب معدات باهظة الثمن ، وتفتقر إلى التصور المباشر للمستعمرات6. تعتبر طرق النسخ والبروتينات بالجملة مكلفة ، ولا توفر سوى استجابات خلوية متوسطة ، ولا يمكنها تحديد احتباس البلازميد بشكل مباشر في المستعمرات الفردية6. الطرق التقليدية مثل التخفيف التسلسلي والمرور بسيطة ولكنها تستغرق وقتا طويلا وتفتقر إلى الدقة وقابليةالتمثيل 7. بشكل عام ، لا يزال الاستنتاج الكمي أو الإسقاط لعدد المستعمرات التي تحتفظ ببلازميد وظيفي معين بمرور الوقت أو الضغوط الانتقائية أمرا صعبا.
لمواجهة هذه التحديات ، يتم تقديم سير عمل جديد للموائع الدقيقة باستخدام أدوات بحث الأجهزة المفتوحة لتحديد إشارات الفلورسنت في العديد من مستعمرات البكتيريا المعزولة ، باستخدام الإشريكية القولونية كنموذج. تسمح هذه الطريقة بتحليل عالي الإنتاجية ودقيق للاحتفاظ بالبلازميد خلال ظروف مختلفة أو ضغوط انتقائية. يوفر تحليل دقة الخلية المفردة طريقة دقيقة لمعالجة المستعمرات المعزولة ، مما ينتج عنه بيانات حساسة حول القياس الكمي البلازميد التي يمكن أن تساعد في تقييم معدلات الاحتفاظ والخسارة4.
برزت الموائع الدقيقة ، وخاصة الموائع الدقيقة بالقطرات ، كأداة قوية لتغليف الخلايا الفردية ومعالجتها في البيئات الخاضعة للرقابة8. على وجه التحديد ، يمكن لقطرات الميكروجيل أن تغلف الخلايا المفردة لتحليل عالي الإنتاجية ودقيق دون الحاجة إلى الحفاظ على القطرات المعلقة في الزيت9 ، مما يسمح بدراسة خاضعة للرقابة لديناميكيات البلازميد في بيئة مكروية محددة. بعد تغليف معلقات الخلايا مباشرة من طرف الماصة10 ، يمكن استخدام تقنيات التألق لمراقبة نمو المستعمرات الدقيقة داخل القطرات ، مما يتيح تحليلا مفصلا لاحتباس البلازميد وفصله تحت ضغوط اختيار مختلفة3.
وتشمل مزايا هذه الطريقة مقارنة بتقنيات الاستزراع السائب التقليدية زيادة الدقة، وتقليل التباين، والقدرة على إجراء تحليلات عالية الإنتاجية. تتغلب تقنية الموائع الدقيقة مفتوحة المصدر على قيود أنظمة الملكية باهظة الثمن ، مثل قضايا إمكانية الوصول والقدرة على التكيف والصيانة ، والتي غالبا ما تعيق تقدم البحث11،12،13. من خلال توضيح كيفية تطبيق سير العمل التجريبي المتقدم لتحليل احتباس البلازميد في الهلاميات الدقيقة باستخدام أجهزة مفتوحة المصدر ، يتم توفير طريقة يمكن الوصول إليها وموثوقة للبحث في بيولوجيا البلازميد ، وتطبيقات البيولوجيا التركيبية ، وتقنيات تحليل قطرات الموائع الدقيقة.
باختصار ، تقدم هذه المقالة طريقة يمكن الوصول إليها لتقييم الاحتفاظ بالبلازميد كميا في بكتريا قولونية بقوة إحصائية عالية. تجعلها قدرات هذه الطريقة أداة قيمة لتعزيز فهم بيولوجيا البلازميد وتحسين تطبيقات البيولوجيا التركيبية.
Protocol
يقدم الشكل 1نظرة عامة تخطيطية لتقييم استقرار البلازميد في بكتريا قولونية. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد. تتوفر البيانات الأولية ونصوص التصور في https://doi.org/10.17605/OSF.IO/6YWJK.
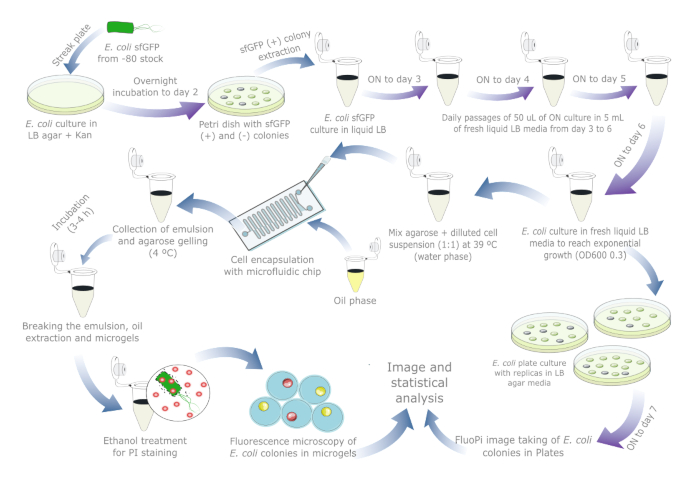
الشكل 1: بروتوكول يومي لتقييم استقرار البلازميد في الإشريكية القولونية. تشير الأسهم الزرقاء إلى الخطوات خلال النهار ، وتشير الأسهم الأرجوانية إلى الحضانة بين عشية وضحاها. تم إجراء كل حضانة سائل وأجار عند 37 درجة مئوية جنبا إلى جنب مع أنبوب / لوحة تحكم سلبية منفصلة. لاحظ أن تحضير زراعة الخلايا والممرات ليست ضرورية لعينات العالم الحقيقي التي قد يكون فقدان البلازميد قد حدث فيها بالفعل ، لذلك يجب تقليل البروتوكول إلى يوم أو يومين إذا تم تضمين ثقافة مرجعية لللوحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. إعداد رقاقة الموائع الدقيقة
ملاحظة: في هذا البروتوكول ، يمكن استخدام تصميمات مختلفة للرقائق التجارية أو المخصصة لتغليف الخلايا القادرة على توليد قطرات ماء في زيت يقل قطرها عن 100 ميكرومتر في نظام التنقيط. بالنسبة لهذه الدراسة ، تم تصميم الشريحة وتصنيعها (انظر بيانات المقالة https://doi.org/10.17605/OSF.IO/6YWJK) باتباع نفس طريقة التصميم والتصنيع كما ورد في تقرير نشرسابقا 14.
- احصل على رقاقة الموائع الدقيقة PDMS على الزجاج أو قم بإعدادها باستخدام قالب رئيسي مصمم لتوليد قطرات الهلام الدقيقة.
- قم بحقن محلول طارد للماء (فلورو ألكيل سيلان) في الرقاقة لجعل القنوات الدقيقة الداخلية كارهة للماء. قم بنقع المحلول في المداخل وتأكد من امتلاء جميع القنوات بالسوائل. اترك القنوات المملوءة لترتاح لمدة 30-60 ثانية.
- قم بإزالة المحلول من الجهاز عن طريق طرد الهواء إلى القنوات الدقيقة الداخلية. استخدم حقنة هواء فارغة لشطف الهواء ومسح ماص على المنافذ الأخرى لمنع تناثره.
- اخبز الجهاز المعالج على حرارة 65 درجة مئوية لمدة 15 دقيقة على لوح تسخين لتبخر المحلول الزائد. بدلا من ذلك ، قم بتخزين الجهاز في الثلاجة (4 درجات مئوية) طوال الليل.
ملاحظة: شريحة الموائع الدقيقة جاهزة للاستخدام. يمكن إيقاف البروتوكول مؤقتا هنا.
2. إعداد العينة
- حصاد الخلايا
ملاحظة: يمكن أن توفر زراعة الخلايا في القطرات بيانات ذات صلة بديناميكيات البلازميد. كنموذج بكتيريا تجريبي ، يتم استخدام بكتريا قولونية سلالة TOP10 مع pCA_Odd1 البلازميد (انظر البيانات المودعة https://doi.org/10.17605/OSF.IO/6YWJK) التي تشفر بروتين فلورسنت أخضر فائق المجلد (sfGFP) ومقاومة الكاناميسين15. يمكن أن تختلف البكتيريا والبلازميد ووسائط النمو بناء على النظام التجريبي.- تحضير Luria Bertoni (LB) -Agar عن طريق إذابة 25 جم من LB المخلوط مسبقا و 12 جم من الأجار في 800 مل من الماء المقطر (dH2O). أيضا ، قم بإعداد وسائط LB السائلة عن طريق إذابة 25 جم من LB الممزوج مسبقا في 800 مل من dH2O. قم بتعقيم المحاليل واتركها تبرد إلى حوالي 60 درجة مئوية. انتقل إلى بيئة معقمة مثل غطاء التدفق للخطوات التالية.
ملاحظة: يحتوي مسحوق LB الممزوج مسبقا على 10 جم من التربتون و 5 جم من مستخلص الخميرة و 10 جم من كلوريد الصوديوم. يمكن أيضا استخدام وسائط LB-agar ذاتية الخلوط. - أضف 50 ميكرولتر من الكاناميسين (المحضر بمقدار 100 مجم / مل) إلى 50 مل من LB-Agar السائل (التركيز النهائي: 100 ميكروغرام / مل). امزج المحلول عن طريق قلب الأنبوب عدة مرات.
- صب حوالي 15 مل من LB-agar السائل لكل طبق بتري (90 مم × 15 مم). قم بإعداد لوحين : أحدهما للتحكم السلبي (مراقبة التلوث) والآخر لثقافة التجربة. دع محلول LB-agar يبرد ويتصلب حتى يتغير اللون من الظلام إلى الشفاف على كلا اللوحين
- استخدم حلقة معقمة لنشر الإشريكية القولونية سلالة على لوحة الثقافة باستخدام تقنية لوحة الخط. ضع مخزون الجلسرين الإشريكية القولونية مرة أخرى في -80 درجة مئوية بعد الاستخدام مباشرة. أغلق كلا الطبقين واحتضانهما طوال الليل عند 37 درجة مئوية (اليوم 1).
- في اليوم 2 ، تحقق من لوحة التحكم السلبية لأي مستعمرة كإشارة للتلوث (إذا كان الأمر كذلك ، كرر الخطوات من 2.1.4). حدد مستعمرات الفلورسنت المفردة على بكتريا قولونية صفيحة باستخدام مصباح ضوئي أزرق لإعداد مخزون استزراع سائل.
- في ظل ظروف معقمة، افتح اللوحة واستخدم حلقة معقمة أو طرف ماصة سعة 200 ميكرولتر لاختيار المستعمرة المختارة ونقلها إلى أنبوب استزراع يحتوي على 5 مل من وسائط LB السائلة الطازجة و 5 ميكرولتر من الكاناميسين (محضر عند 100 ملغم/مل). قم بإعداد أنبوب تحكم سلبي بدون تلقيح لمراقبة التلوث. احتضان أنابيب الاستزراع عند 37 درجة مئوية طوال الليل أثناء الاهتزاز عند 220 دورة في الدقيقة.
- مرر العينة لمدة 3 أيام إضافية في وسائط بدون مضادات حيوية لمحاكاة الظروف التي قد يحدث فيها فقدان البلازميد. في الأيام 3 و 4 و 5 ، انقل 50 ميكرولتر من المزرعة الليلية إلى أنبوب استزراع جديد يحتوي على 5 مل من LB السائل بدون مضادات حيوية. احتضان عند 37 درجة مئوية طوال الليل مع الاهتزاز عند 220 دورة في الدقيقة. كرر هذه الخطوة حتى اليوم 6 ، واحصل على ثقافة نهائية سعة 5 مل بعد أربعة مقاطع إجمالية.
- انقل 50 ميكرولتر من المزرعة الليلية النهائية إلى أنبوب استزراع جديد يحتوي على 2 مل من LB السائل. اسمح للثقافة بالوصول إلى كثافة ضوئية (OD600) تبلغ 0.3 باستخدام مقياس الطيف الضوئي (3-4 ساعات تقريبا).
ملاحظة: يجب استخدام المزرعة الطازجة قبل زيادة OD600 للتأكد من أن البكتيريا في مرحلة النمو اللوغاريتمي. إذا لم يتحقق التركيز المطلوب ، كرر الخطوة 2.1.8.
- تحضير Luria Bertoni (LB) -Agar عن طريق إذابة 25 جم من LB المخلوط مسبقا و 12 جم من الأجار في 800 مل من الماء المقطر (dH2O). أيضا ، قم بإعداد وسائط LB السائلة عن طريق إذابة 25 جم من LB الممزوج مسبقا في 800 مل من dH2O. قم بتعقيم المحاليل واتركها تبرد إلى حوالي 60 درجة مئوية. انتقل إلى بيئة معقمة مثل غطاء التدفق للخطوات التالية.
- مزيج الخلية الاغاروز للتغليف
ملاحظة: يعد التحكم في التركيز ضروريا لضمان تغليف القطرات أحادية الخلية. يمكن حساب تركيز الخلية المطلوب لمعدل التغليف المستهدف وحجم القطرات المحدد، كما هو موضح في المثال التالي:
حجم القطرات (قطرة V): إذا تم توليد قطرات 50 ميكرومتر
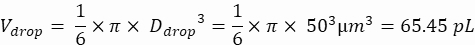
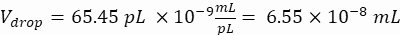
الخلايا المرغوبة لكل قطرة (Cpd): خلية واحدة لكل خمس قطرات في المتوسط (0.2 خلية / قطرة)
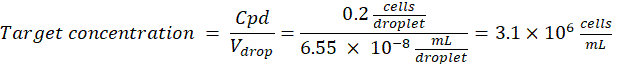
عامل التخفيف: يتم الحصول على تركيز الخلية الأولي في الخطوة 2.1.8
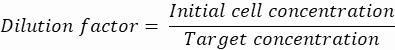
هنا ، يتم إنشاء قطرات 50 ميكرومتر أو 100 ميكرومتر (بدون تقسيم القطيرات) (65-520 pL) حيث يتم تغليف حوالي خلية واحدة لكل خمس قطرات ، أو 1.6 خلية لكل قطرة دون انقسام. بالنسبة للإشريكية القولونية ، استخدم عامل التحويل 1 OD600 وحدة ≈ 7.8 × 108 خلايا / مل16. اضرب قيمة OD600 من الخطوة 2.1.8 في عامل التحويل للحصول على التركيز الأولي (خلايا / مل) للثقافة.- إعادة تعليق الإشريكية القولونية من مخزون الاستزراع المحضر في LB السائل بدون الكاناميسين بتركيز 6.2e + 6 خلايا / مل (التركيز المستهدف لقطرات قطرها 50 ميكرومتر). احتفظ بتعليق البكتيريا في درجة حرارة الغرفة حتى تختلط مع الاغاروز.
ملاحظة: ستثبط المضادات الحيوية تكوين المستعمرات الدقيقة السلبي ، لذلك من الضروري استبعادها من الوسائط لتجارب فقدان البلازميد. - قم بإعداد درجة حرارة التبلور المنخفضة للغاية عن طريق تسخينها إلى 90 درجة مئوية في LB السائل بتركيز 2٪ (وزن / حجم). رجي الخليط لمدة 10 دقائق في شاكر يتم التحكم في درجة حرارته.
- اخفض درجة حرارة الخلاط الحراري إلى 39 درجة مئوية لتبريد محلول الاغاروز. في موازاة ذلك ، ضع أنبوب تعليق البكتيريا في الخلاط الحراري لمدة 4 دقائق لتسخينه إلى 39 درجة مئوية.
- امزج البكتيريا ومعلقات الاغاروز بنسبة 1: 1 للحصول على تركيز الاغاروز 1٪ (وزن / حجم) مع تعليق الخلية عند 3.1e + 6 خلية / مل. تحضير محلول المكافحة السلبية (مراقبة التلوث) بنفس تركيز الاغاروز باستخدام LB السائل بدلا من تعليق البكتيريا.
ملاحظة: يجب استخدام معلق خلايا الاغاروز بسرعة لتجنب تغيرات التركيز بسبب نمو البكتيريا. حافظ على شاكر الحرارة عند 39 درجة مئوية للحفاظ على سائل الاغاروز حتى يتم تحميله في المدفأة الطرفية لتوليد القطرات.
- إعادة تعليق الإشريكية القولونية من مخزون الاستزراع المحضر في LB السائل بدون الكاناميسين بتركيز 6.2e + 6 خلايا / مل (التركيز المستهدف لقطرات قطرها 50 ميكرومتر). احتفظ بتعليق البكتيريا في درجة حرارة الغرفة حتى تختلط مع الاغاروز.
3. زراعة مستعمرة واحدة عالية الإنتاجية
- الإعداد التجريبي
- قم ببناء أو الحصول على منصة التدفق مفتوحة المصدر الكاملة (انظر https://doi.org/10.17605/OSF.IO/6YWJK) ، بما في ذلك محركات ضغط الغاز وأجهزة استشعار التدفق. بدلا من ذلك ، قم ببناء مرحلة الفحص المجهري الأبسط مفتوح المصدر المحسنة بالأجهزة القوية (راجع إرشادات الإنشاء https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ ومستودع المشروع https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage).
ملاحظة: يمكن للمرء أيضا استخدام إعداد الموائع الدقيقة التقليدي مع مجهر تجاري وكاميرا عالية السرعة وإمكانيات تسخين العينات. - قم بدمج نظام التحكم في الضغط والتدفق مفتوح المصدر المستند إلى Raspberry Pi كما هو موثق في المستودع المعين (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller).
ملاحظة: يتم توضيح عنصر تحكم الوحدة النمطية ونسخها احتياطيا إلى مستودع البيانات (https://doi.org/10.17605/OSF.IO/6YWJK. كبديل ، يمكن استخدام وحدات التحكم في الضغط التقليدية أو مضخات الحقن عالية عزم الدوران. - قم بتضمين شريحة زجاجية وسخانات ذات طرف ماصة (https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring) في الإعداد للتحكم في درجة حرارة عينة خلية الاغاروز عند دخولها الشريحة.
ملاحظة: تعد هذه السخانات ، الموضحة في مستودع البيانات (https://github.com/wenzel-lab/flow-microscopy-platform و https://doi.org/10.17605/OSF.IO/6YWJK) ، ميزة مهمة لنظام التحكم مفتوح المصدر الذي يتيح العمل مع agarose وقد لا تكون متوفرة في أنظمة تجارية أخرى.
- قم ببناء أو الحصول على منصة التدفق مفتوحة المصدر الكاملة (انظر https://doi.org/10.17605/OSF.IO/6YWJK) ، بما في ذلك محركات ضغط الغاز وأجهزة استشعار التدفق. بدلا من ذلك ، قم ببناء مرحلة الفحص المجهري الأبسط مفتوح المصدر المحسنة بالأجهزة القوية (راجع إرشادات الإنشاء https://wenzel-lab.github.io/strobe-enhanced-microscopy-stage/ ومستودع المشروع https://github.com/wenzel-lab/strobe-enhanced-microscopy-stage).
- تغليف خلية واحدة
- ضع شريحة الموائع الدقيقة على مرحلة الفحص المجهري المعزز بالستروب ، مما يضمن رؤية تقاطع توليد القطرات (تقاطع المرحلتين المائية والزيتية).
- اضبط سخان طرف الماصة وسخان الشريحة الزجاجية على 40 درجة مئوية باستخدام واجهة برنامج التحكم.
- استخدم حقنة مزودة بأنبوب وقابس PDMS لتحميل مزيج الاغاروز بنسبة 1٪ مع تعليق الخلية في طرف ماصة سعة 200 ميكرولتر. أدخل الطرف في سخان الطرف وضعه على مدخل الطور المائي في شريحة الموائع الدقيقة. استبدل ختم PDMS للطرف بآخر متصل بأنبوب نظام التحكم في التدفق وابدأ ضخ تعليق الخلية.
- أدخل طرف أنبوب المخرج في أنبوب النفايات واضبط معدلات التدفق أو الضغوط من مرحلتين على واجهة المستخدم لتوصيل السائل ببطء إلى قناة الموائع الدقيقة. استخدم 200 ميكرولتر / ساعة (180 ملي بار) للطور المائي و 1700 ميكرولتر / ساعة (320 ملي بار) لطور الزيت. اترك 1 دقيقة لتثبيت توليد القطرات.
ملاحظة: تعتمد قيم الضغط على أحجام القنوات لتصميم الرقاقة ، وقد يلزم ضبط قيم التدفق لتصميمات مختلفة لوصلات توليد القطرات. - بمجرد استقرار توليد القطرات ، انقل النفايات وأنابيب التجميع إلى أنبوب التجميع. الاستمرار في جمع القطرات حتى يفرغ خزان العينة. كرر الخطوات 3.2.3 إلى 3.2.5 لتغليف حل التحكم السلبي من الخطوة 2.2.4.
ملاحظة: يجب إكمال جمع العينات في غضون 15 دقيقة. - قم بتخزين أنابيب التجميع على الجليد أثناء توليد القطرات أو ضعها في درجة حرارة 4 درجات مئوية بعد التجربة لمدة ساعة واحدة للسماح للأغروز بالهلام داخل القطرات.
ملاحظة: يمكن إعادة استخدام شريحة الموائع الدقيقة إذا ظلت القنوات الدقيقة غير مسدودة وتم تحميل نفس التعليق. تخلص من طرف الماصة بعد الانتهاء من توليد المستحلب (الخطوات 3.2.3-3.2.5).
- نمو المستعمرة والإفراج عنها من المستحلب
- انقل قطرات الهلام الدقيقة التي تحتوي على البكتيريا والتحكم السلبي في القطرات إلى غرفة حضانة مضبوطة على 37 درجة مئوية.
- احتضان القطرات الدقيقة لمدة 4 ساعات على الأقل ، أو بين عشية وضحاها ، للسماح بنمو مستعمرة كافية. تأكد من أن التحكم السلبي لا يظهر أي علامات تلوث عبر الفحص المجهري للمجال الساطع.
- لتحرير المستعمرات من المستحلب ، قم بإزالة أكبر قدر ممكن من الزيت من أسفل مستحلب القطرات الدقيقة للهلام باستخدام ماصة أو حقنة بإبرة (هنا ، تم استخدام إبرة بحجم 21 جرام).
- انقل 50 ميكرولتر من قطرات الهلام الدقيقة إلى أنبوب دقيق جديد وقم بتخزينه عند 4 درجات مئوية لمزيد من تحليل القطرات. إلى المستحلب المتبقي ، أضف خليطا 1: 1 من الزيت المفلور مع 1H ، 1H ، 2H ، 2H-perfluoro-1-octanol (PFO) بحجم يساوي المستحلب.
- أضف ما يقرب من 200 ميكرولتر من المحلول الملحي المخزن بالفوسفات (PBS) ، أو 0.9٪ وزن / حجم محلول كلوريد الصوديوم ، فوق المستحلب. قم بتدوير الخليط وقم بتدويره لفترة وجيزة في جهاز طرد مركزي ثابت السرعة.
- قم بإزالة طور الزيت بعناية من أسفل واجهة السائل وتخلص من 100 ميكرولتر من PBS من الأعلى. كرر الخطوات 3.3.4-3.3.5 للحصول على وحدات هلامية صغيرة مغسولة في مخزن PBS مع الحد الأدنى من بقايا الزيت أو بدونها.
ملاحظة: تستقر الهلاميات الدقيقة عند الواجهة السائلة ؛ تجنب إزالتها مع مرحلة الزيت.
4. تحليل مستعمرة واحدة
- تلطيخ الخلايا
ملاحظة: تعمل العديد من مجموعات البقع المختلفة مع هذا البروتوكول. في جوهرها ، يجب اختيار بقعة الحمض النووي أو جدار الخلية التي لها لون مختلف عن البروتين الفلوري المشفر بواسطة البلازميد والتي يمكن تحليلها باستخدام مجموعات المرشحات المتاحة على المجهر الفلوري. هنا ، تم تلطيخ الحمض النووي للخلايا باستخدام بروبيديوم يوديد (PI) لتمييز تألقها عن البروتين الفلوري الأخضر المشفر على البلازميدات ، ولكن يمكن استخدام العديد من بقع الحمض النووي الأخرى.
تنبيه: PI مادة مسرطنة محتملة ويجب التعامل معها باستخدام معدات الحماية الشخصية المناسبة. تخلص من الصبغة بأمان ووفقا للوائح المحلية.- الطرد المركزي للهلام المغسول عند حوالي 80 × جم لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية باستخدام ماصة.
- انقل 50 لتر من الهلاميات الدقيقة إلى أنبوب دقيق جديد ليكون بمثابة عنصر تحكم سلبي لمعالجة الإيثانول.
ملاحظة: تدخل صبغة PI فقط الخلايا ذات الأغشية المعرضة للخطر ، مثل تلك المتأثرة بمعالجة الإيثانول. - أضف حجما متساويا من 70٪ من الإيثانول إلى المواد الهلامية الدقيقة المتبقية واخلطها لفترة وجيزة مع دوامة. احتضن في درجة حرارة الغرفة لمدة 15 دقيقة لاختراق الأغشية البكتيرية لتلوين PI. كرر الخطوة 4.1.1.
- أضف حجما متساويا بنسبة 0.9٪ وزن / حجم كلوريد الصوديوم إلى الهلاميات الدقيقة والدوامة لفترة وجيزة. كرر الخطوة 4.1.1.
- أضف 2 ميكرولتر من PI (1 مجم / مل) إلى كلتا عينتي الأنابيب الدقيقة. تخلط جيدا وتحتضن في الظلام في درجة حرارة الغرفة لمدة 15 دقيقة.
ملاحظة: إذا كان عنصر التحكم السلبي يقدم أي إشارة فلورية حمراء عبر الفحص المجهري الفلوري ، فقد تكون سلامة المستعمرات قد تعرضت للخطر أثناء تعرضها لحلول أخرى في الخطوات السابقة.
- مجهريه
ملاحظة: يتم تصوير القطرات والمواد الهلامية الدقيقة باستخدام مجهر مضان epi مقلوب للحصول على توزيع حجم القطرات وتألق المستعمرات البكتيرية في الهلاميات الدقيقة (الشكل 2). هنا ، يتم استخدام منصة مجهرية مقلوبة مفتوحة المصدر (https://github.com/wenzel-lab/SQUID-bioimaging-platform) 17 مع هدف 10x 0.3NA ، ومصفوفة LED بيضاء لإضاءة المجال الساطع ، و 470 نانومتر LED للإثارة. يمكن استخدام المجاهر التجارية المضان لتصوير القطرات والمواد الهلامية الدقيقة. المعايرة مطلوبة لأن الإضاءة والمرشحات تختلف حسب الطراز والعلامة التجارية وبروتينات الفلورسنت المستخدمة.- انقل 2 ميكرولتر من قطرات الهلام الدقيقة إلى شريحة غرفة التصوير وأضف 5 ميكرولتر من الزيت المفلور للمساعدة في تكوين طبقة أحادية من القطرات للحصول على التصوير الأمثل.
ملاحظة: يمكن أن تساعد غرف عد الخلايا أو غرف الموائع الدقيقة البسيطة في نشر المستحلب بشكل رقيق وإبطاء عملية التجفيف. - على المجهر ، قم بتنشيط إضاءة مصفوفة LED البيضاء من الأعلى لتصوير المجال الساطع. قم بتركيب الشريحة المعدة ، وركز على العينة ، وحدد موقع طبقة أحادية من القطرات. التقط صورة المجال الساطع.
- بدون تحريك العينة ، التقط صورة مضان للمستعمرات عن طريق التبديل إلى 470 نانومتر LED للإثارة. اضبط عجلة المرشح لتتماشى مع مرشح الطول الموجي الأخضر لتصوير sfGFP. امسح جميع المناطق التي تحتوي على طبقات أحادية من القطرات وكرر الخطوات 4.2.2-4.2.3 لضمان المتانة الإحصائية في تحليل القطرات.
- انقل 2 ميكرولتر من المواد الهلامية الدقيقة الملطخة إلى شريحة غرفة التصوير و 5 ميكرولتر من 0.9٪ وزن / حجم كلوريد الصوديوم للمساعدة في تكوين طبقة أحادية من الهلاميات الدقيقة. أغلق مدخل ومخرج الرقاقة لمنع التبخر أثناء التصوير.
ملاحظة: يمكن أن يؤثر التبخر على تحديد موقع ملصقات الفلورسنت. يوصى باستخدام غرف الموائع الدقيقة للتصوير المطول. - كرر الخطوات 4.2.2–4.2.3. اضبط مرشح الفاصل الزمني للطول الموجي الأحمر لتصوير PI والتقط الصور المعنية.
- بعد الانتهاء من التصوير في مكان واحد ، ابحث عن المنطقة المناسبة التالية على الشريحة بطبقة أحادية من الهلاميات الدقيقة وكرر عملية التصوير لضمان المتانة الإحصائية والتحليل الشامل للعينة.
- انقل 2 ميكرولتر من قطرات الهلام الدقيقة إلى شريحة غرفة التصوير وأضف 5 ميكرولتر من الزيت المفلور للمساعدة في تكوين طبقة أحادية من القطرات للحصول على التصوير الأمثل.
الشكل 2: صور الفحص المجهري وتحليلها. التصوير الفلوري وتحليل المستعمرات في الهلاميات الدقيقة. (أ - ج) قنوات الصور التي تم الحصول عليها عبر المجهر الساطع والفلوري باستخدام المجهر المقلوب. تظهر الصورة المركبة (D) وجود مستعمرة سالبة (مضان أحمر فقط) داخل الهلاميات الدقيقة. (ه-ح) نتائج سير عمل تحليل الصور. من خلال توليد عائد الاستثمار ، يمكن تحديد المستعمرات على القنوات الحمراء والخضراء ، ويمكن تحديد الإشارات لتحديد وجود المستعمرات السلبية. أشرطة المقياس: 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
- تحليل الصور
ملاحظة: لتحليل إشارات التألق من المستعمرات المغلفة وتحديد الأحداث النادرة ، يمكن معالجة الصور من التصوير الساطع والفلورة باستخدام Fiji / ImageJ (الشكل 3). يمكن تنفيذ هذه الخطوات في برنامج نصي ماكرو ، وقد تختلف قيم المعلمات اعتمادا على التكوين البصري.- افتح الصور من القناتين الخضراء والحمراء. حدد منطقة مستطيلة ذات اهتمام (ROI) تبدأ من الإحداثيات (500 ، 500) بعرض وارتفاع 2000 بكسل لكل منها.
ملاحظة: تنطبق هذه المعلمات على الصور بدقة 3000 × 3000 بكسل، ويحدد عائد الاستثمار المنطقة ذات الإضاءة الأفضل. - قم بقص الصورة إلى عائد الاستثمار المستطيل المحدد. اطرح قيمة ثابتة قدرها 10 من شدة كل بكسل وقم بتطبيق مرشح تجانس على الصورة لتقليل تشويش الخلفية وجعل الكائنات ذات الأهمية أكثر تميزا.
ملاحظة: سيتم استخدام هذه المنطقة فقط لمزيد من التحليل. - قم بتكرار الصورة من القناة الحمراء وتحويلها إلى قناع ثنائي لتحديد الأحداث النادرة المتعلقة بالبلازميد. قم بتعيين قيم الحد بين 10 و255. سيتم اعتبار وحدات البكسل ضمن هذا النطاق في المقدمة (كائنات ذات أهمية) ، بينما سيتم التعامل مع البعض الآخر كخلفية.
- قم بإجراء عمليات مورفولوجية لسد الفجوات الصغيرة وملء أي ثقوب داخل الأشياء ذات الاهتمام. قم بتطبيق خوارزمية مستجمعات المياه لفصل الكائنات المتداخلة داخل القناع الثنائي.
- تحليل الجسيمات في القناع الثنائي. ضع في اعتبارك فقط الجسيمات التي يزيد حجمها عن 30 بكسل ودائرية بين 0.50 و 1.00. يتم تلخيص النتائج وإضافتها إلى جدول النتائج. احفظ مجموعة عائد الاستثمار الذي تم اكتشافه بواسطة تحليل الجسيمات لمزيد من التصور.
- اعرض عائد الاستثمار المحفوظ على الصور من القناتين الخضراء والحمراء. قم بقياس شدة أو خصائص أخرى لعائد الاستثمار داخل هذه الصور. سجل القياسات في جدول النتائج واحفظ النتائج في ملفات CSV منفصلة لمزيد من التحليل الإحصائي.
- افتح الصور من القناتين الخضراء والحمراء. حدد منطقة مستطيلة ذات اهتمام (ROI) تبدأ من الإحداثيات (500 ، 500) بعرض وارتفاع 2000 بكسل لكل منها.
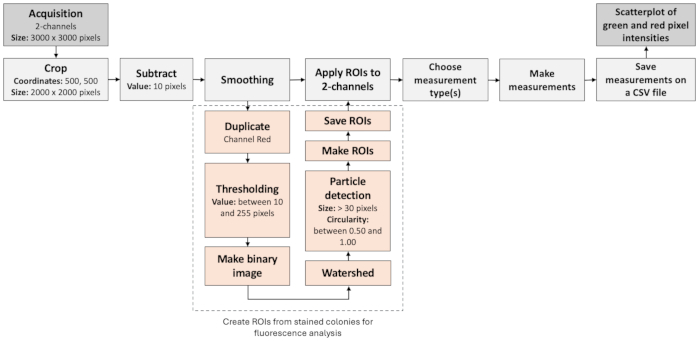
الشكل 3: سير عمل تحليل الصور لتحديد المستعمرات السلبية. يوضح الشكل سير عمل خطوة بخطوة لمعالجة الصور الفلورية وتقييمها تلقائيا. يعتمد سير العمل على التحديد المشترك لملصقات التألق بالإضافة إلى تحليل الجسيمات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. فحص مقارنة لوحة أجار
ملاحظة: لمقارنة طريقة القطرات بفحص اللوحة التقليدية ، تم الحصول على القياس الكمي لمستعمرات الفلورسنت من نفس بكتريا قولونية السلالة في الخطوة 2.1.8. تم إجراؤه باستخدام أطباق بتري. كان هذا بمثابة طريقة تحكم تناظرية لقياس استقرار البلازميد sfGFP. انظر أيضا توضيح الطريقة في الشكل 1.
- تحضير LB-agar (بدون مضاد حيوي) كما هو موضح في الخطوة 2.1.1 من قسم حصاد الخلايا. قم بتبريد الأجار تحت 60 درجة مئوية وتجانس.
- في بيئة معقمة ، اسكب 15 مل من وسط أجار في كل طبق بتري. اترك الألواح تتصلب مع فتح الأغطية جزئيا حتى تصبح جاهزة للاستخدام.
- تلقيح ثلاث لوحات بسعة 10 ميكرولتر لكل منها من استزراع الإشريكية القولونية في وسط LB ب OD600 من 0.007 ± 0.002. يوزع بالتساوي باستخدام مفرشة على شكل حرف L. احتضان الألواح عند 37 درجة مئوية ، مغلقة ومقلوبة. قم بإعداد لوحة تحكم خالية من البكتيريا في نفس الظروف.
- بعد 24 ساعة ، التقط صورا مضانية للألواح باستخدام FluoPi ، وهو نظام تصوير مضان مفتوح المصدر (https://github.com/RudgeLab/FluoPi) 15.
ملاحظة: يتكون FluoPi من كاميرا Raspberry Pi مع ضوء إثارة أزرق بطول موجي متمركز عند 470 نانومتر ومرشحات إثارة وانبعاث أكريليك. - احسب يدويا المستعمرات الفلورية وغير الفلورية في كل لوحة باستخدام الصور الملتقطة.
النتائج
التحقق من صحة تغليف الخلايا وتكوين المستعمرات الدقيقة
يمكن تأكيد تغليف الخلية بصريا عن طريق إجراء الفحص المجهري الساطع على قطرات الهلام الدقيقة قبل كسر المستحلب وغسل الهلاميات الدقيقة. تظهر النتيجة التمثيلية للمستحلب في هذه الخطوة في الشكل 4.
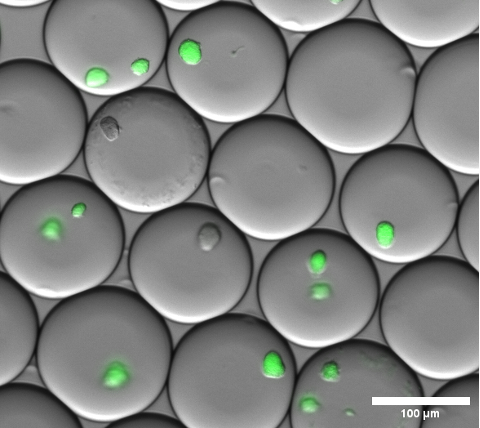
الشكل 4: قسم من صورة تراكب المجهر الفلوري. بعد الحضانة بين عشية وضحاها ، تعبر المستعمرات الدقيقة التمثيلية ل sfGFP عن مستعمرات الإشريكية القولونية داخل قطرات الهلام الصغيرة. تم استخدام هدف مجهر بتكبير 10x و 0.30 NA. شريط المقياس: 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
نتائج تحليل الصور
بمجرد تلطيخ الهلاميات الدقيقة والمجال الساطع ، بالإضافة إلى القنوات الفلورية المكتسبة في عدة مواضع ، يمكن تصور المستعمرات التي تم تحديدها على أنها سلبية في الصور الأصلية (انظر الشكل 5 أ). يمكن رسم البيانات المستخرجة من جميع صور تجربة واحدة لإظهار نسبة التألق للمستعمرات المختلفة ، مع تسليط الضوء على تلك التي فقدت التألق المشفر بالبلازميد (انظر الشكل 5 ب). تشير النتائج إلى أن 100 مستعمرة فقدت وظائف البلازميد أو البلازميد من إجمالي 2785 مستعمرة دقيقة تم تحليلها ، أي ما يعادل 3.6٪.
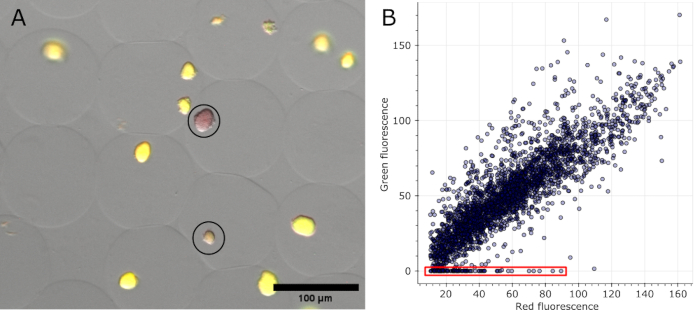
الشكل 5: التقدير الكمي للمستعمرات الدقيقة السلبية. (أ) قسم من صورة تراكب المجهر الفلوري. بعد إزالة الزيت والتلطيخ ، أظهرت المستعمرات التمثيلية في الهلاميات الدقيقة التي تعبر عن sfGFP ومستعمرتين سلبيتين التألق الأحمر لبقعة الحمض النووي (محاطة بدائرة باللون الأسود). شريط المقياس: 100 ميكرومتر. (ب) مخطط مبعثر لقيم التألق للمستعمرات الدقيقة الفردية المستخرجة من 16 صورة مجهرية متعددة القنوات. تم حساب المستعمرات التي لا تحتوي على أي مضان أخضر على أنها سلبية ، كما هو موضح باللون الأحمر في الرسم البياني. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
القياس الكمي للوحة أجار
تظهر صور الألواح الثلاثية في الشكل 6 ، مع وجود مستعمرات غير فلورية موضحة بأسهم بيضاء. عرضت اللوحة الأولى (الشكل 6 أ) ما مجموعه 213 مستعمرة ، منها 1 لم يكن فلورسنت. تحتوي اللوحة الثانية (الشكل 6 ب) على ما مجموعه 49 مستعمرة ، مع عدم وجود مستعمرات غير فلورية. أظهرت اللوحة الثالثة (الشكل 6 ج) ما مجموعه 252 مستعمرة ، 6 منها لم تكن فلورية. تتوافق هذه النتائج مع متوسط معدل فقدان البلازميد في المستعمرة بنسبة 2.3٪ ، مع انحراف معياري كبير قدره 3.2.
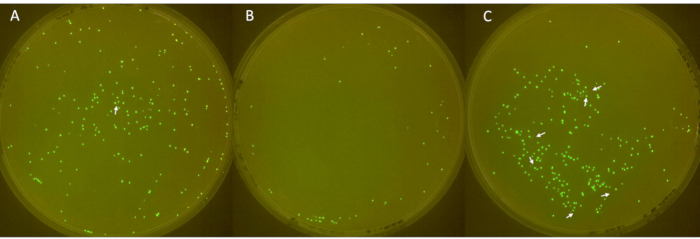
الشكل 6: تحديد المستعمرات السلبية على اللوحات. (أ - ج) مستعمرات الإشريكية القولونية الفلورية وغير الفلورية على ألواح LB-agar (القطر: 90 مم ، الارتفاع: 15 مم). تم اللقاح ، المشتق من الإشريكية القولونية مع sfGFP من مخزون -80 درجة مئوية ، في اليوم الأول ، وتم زراعته بالمضادات الحيوية في اليوم 2 ، وتم تخفيفه 1: 100 يوميا من اليوم 3 إلى 6 للسماح بفقدان البلازميد. تم تحضين المستعمرات عند 37 درجة مئوية لمدة 24 ساعة وتم تصويرها في غرفة FluoPi. تم تعزيز المستعمرات غير الفلورية باستخدام GIMP والإشارة إليها بأسهم بيضاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
تم إثبات طريقة قائمة على الهلام microdroplet لتحديد وتحديد المستعمرات بشكل فعال مع وبدون التعبير الجيني المشفر بالبلازميد للبروتينات الفلورية ، مثل sfGFP. يتم تحديد المستعمرات التي لا تعبر بشكل كاف عن منتج البلازميد باستخدام صبغة الحمض النووي الفلورية (هنا ، بروبيديوم يوديد) التي تلطخ جميع المستعمرات وتتميز بطول موجة انبعاث مختلف. يتيح هذا التكامل بين الموائع الدقيقة بالقطرات ، والتبلور ، والفحص المجهري الفلوري ، باستخدام تقنية مفتوحة المصدر ، تنفيذ سير عمل متقدم في العديد من إعدادات البحث11،13. يتيح الجيل الناجح من قطرات الهلام الدقيقة تدفقات عمل أحادية الخلية المتقدمة في البيولوجيا الجزيئية ، بما في ذلك تحلل الخلايا ، وتضخيم الجينوم الفردي ، وشاشات تفاعل الخلايا الأيضية ، وتبادل الوسائط ، والمزيد 8,9. تستخدم هذه المزايا في هذا البروتوكول لنمو المستعمرات الدقيقة وتلطيخها وتحليلها بطريقة أكثر قابلية للتطوير مقارنة بالمقايسات التقليدية القائمة على الألواح.
الخطوات الحاسمة
تعد عملية التغليف جزءا مهما ودقيقا من البروتوكول. مطلوب تحكم دقيق في تركيزات المكونات ومعدلات التدفق والضغوط لتوليد هلاميات دقيقة موحدة ضمن نطاق حجم محدد والتحكم في متوسط عدد الخلايا لكل قطرة. علاوة على ذلك ، فإن الحفاظ على تركيز ودرجة حرارة مزيج الخلية والأغاروز يمنع التكتل أو التبلور المبكر. يعد التحكم في درجة حرارة تعليق خلايا الاغاروز السائلة في طرف الماصة تطبيقا مفيدا بشكل خاص لمحطة عمل الموائع الدقيقة للأجهزة مفتوحة المصدر التي توفر توليد ميكروهلام أسهل بكثير وأكثر قوة مقارنة بالجهود المبذولة للتحكم في درجة حرارة مضخات الحقن والأنابيب. نظرا لخلط الخلايا مع وسط نمو الاغاروز قبل التغليف والزراعة ، يجب توليد الهلاميات الدقيقة الاغاروز بسرعة لتجنب التغيرات الرئيسية في تركيز الخلايا. لهذا الغرض ، تم تحسين تصميم رقاقة الموائع الدقيقة التي تقسم القطرات المستوحاة من Abate et al.18.
التعديلات واستكشاف الأخطاء وإصلاحها
كانت هناك حاجة إلى العديد من المعايرة والتعديلات لتحسين البروتوكول الأصلي. يعد تغليف الاغاروز أكثر صعوبة من قطرات الماء في الزيت العادية ، مما يتطلب تصميم نظام للحفاظ على الاغاروز في حالة سائلة مع ضمان أن تدفق الطور المائي يحقق نطاقا متجانسا لحجم الجسيمات. تؤثر التغيرات في لزوجة الاغاروز بسبب التبلور على معدل التدفق ، مما يؤدي إلى أحجام جسيمات أكبر. يتطلب الفحص المجهري اختيارا دقيقا للمرشحات ومصادر الضوء لضمان إشارات الإثارة والانبعاث غير المتداخلة للتمايز الواضح. في البداية ، تم اختيار DAPI لتلوين البكتيريا ، لكن إشارة انبعاثها تداخلت مع sfGFP ، مما تسبب في اكتشاف sfGFP في قناة الكشف الزرقاء. لقد تحولنا إلى PI لأن انبعاثه منفصل جيدا عن sfGFP عند الأطوال الموجية الطويلة (الضوء الأحمر).
بينما تم قياس فقدان البلازميد باستخدام الطريقة المقترحة ، كان البلازميد sfGFP المستخدم مستقرا بشكل غير متوقع ، ولم يعرض أي حالات لفقدان البلازميد في الجيل الأول من الخلايا المزروعة بدون مضادات حيوية ، حتى في ظل ظروف الإجهاد مثل الرقم الهيدروجيني 9 الوسائط والحضانة عند 40 درجة مئوية. تتوافق هذه الملاحظة مع نتائج مجموعات البحث الأخرى1،19. حد استقرار البلازميد من عرض قدرات القياس الكمي الكاملة للطريقة لأجيال زراعة الخلايا الأولية ، لكنها أظهرت أن الطريقة حساسة بما يكفي لاكتشاف الاختلافات الصغيرة في الاحتفاظ بالبلازميد. إن ملاحظة استقرار البلازميد العالي في الأجيال المبكرة لها تأثير مهم على شاشات الموائع الدقيقة بالقطرات باستخدام مقايسة الانتقاء السلبية ، مثل تثبيط البكتيريا المستهدفة. هذا يعني أن فقدان البلازميد لأهداف الاختيار هو مصدر منخفض لنتائج الاختيار الإيجابية الكاذبة. نظرا لأن شاشات الموائع الدقيقة القطرية تتجاوز عادة الشاشات الأخرى عالية الإنتاجية ، مثل سير عمل روبوت سحب العينات ، بأوامر من حيث الحجم في الإنتاجية ، يجب تقييم هذه الأحداث النادرة وأخذها في الاعتبار.
القيود
على الرغم من مزاياها ، إلا أن هناك قيودا على الطريقة المقدمة. يتطلب تصنيع الأجهزة الموائع الدقيقة خبرة واهتماما دقيقا بالتفاصيل ، بالإضافة إلى التحكم التجريبي الصارم في معدلات التدفق لضمان كفاءة التغليف الحتمية. قد تتطلب هذه الجوانب تحسينا لإعدادات تجريبية مختلفة. في حين أن هذه الطريقة تعتمد على الفحص المجهري الفلوري للكشف عن الإشارة ، مما يستلزم الوصول إلى معدات التصوير المناسبة ، يمكن تصنيع هذه المعدات باستخدام أجهزة مفتوحة المصدر ، مما يجعلها أكثر سهولة. علاوة على ذلك ، يمكن معالجة الهلاميات الدقيقة في قياس التدفق الخلوي التجاري باستخدام فوهات كبيرة ، مما يزيد من تحسين إمكانية الوصول والإنتاجية التجريبية. يمكن أيضا استخدام آلات فرز القطرات لهذا التحليل الخلوي.
علاوة على ذلك ، في حين أن الطريقة مصممة للكشف عن إشارات الفلورسنت من البلازميدات أو البقع أو العلامات الأخرى ، إلا أنها تقتصر على الخلايا التي يمكن تصنيفها بالفلورسنت ، والتي قد لا تنطبق على جميع السلالات البكتيرية أو الظروف التجريبية. ومع ذلك ، يمكن تكييف الطريقة لدمج أنواع أخرى من النسخ المجهرية ، مثل تباين الطور أو الفحص المجهري الساطع ، مما يسمح بتطبيقات التنميط الظاهري خارج التألق. بالإضافة إلى ذلك ، يمكن دمجه مع تقنيات التحليل الطيفي مثل FTIR أو التحليل الطيفي رامان ، مما يوسع قدراته على تحليل التركيبات الكيميائية والمعلومات الهيكلية للخلايا المغلفة. تعمل هذه التعديلات على توسيع نطاق قابليتها للتطبيق ، مما يجعلها أداة متعددة الاستخدامات لإعدادات البحث المتنوعة.
الأهمية والتطبيقات
لا تسمح المقايسات التقليدية لفقدان البلازميد19 بتقدير كمي جيد لنسبة الخلايا التي فقدت تعبيرها ، والمعلومات التي يمكن أن تكون مهمة جدا في تصميم الطريقة التجريبية والتطبيقات البيولوجية المختلفة. عادة ، يتم تعداد أنواع المستعمرات في فحوصات لوحة أجار ، حيث يمكن الحصول على مستعمرات معزولة محددة جيدا ، كما هو موضح في الشكل 4. ومع ذلك ، فإن المستعمرات المتداخلة يصعب تحديدها بثقة. في أيدينا ، لا نحصل دائما على كثافة مستعمرة مثالية ، والعديد من اللوحات ضرورية للحصول على إحصائيات جيدة لأحداث فقدان البلازميد منخفضة التردد. تقدم الطريقة المقترحة نهجا أكثر قوة لتحديد إشارات الفلورسنت القادمة بدقة من المستعمرات المعزولة ذات عدد أكبر من المستعمرات من الطرق التناظرية للوحة أجار لأنه في القطرات الدقيقة ، تتطور المستعمرات بشكل منفصل ، وتكون أصغر ، ويسهل تحميلها في غرف التصوير ، مما يتيح الفحص المجهري أو قياس التدفق الخلوي القائم على القياس الكمي لأعداد المستعمرات الكبيرة. يمكن أن يؤدي ذلك إلى تحسين التمثيل الإحصائي للطريقة بشكل كبير والسماح بالتكامل في تدفقات عمل الهلام الدقيقة الأخرى.
يسمح استخدام الأجهزة مفتوحة المصدر11،20 للباحثين بتخصيص تصميم محطة العمل الدقيقة وضبط فئران التدفق بدقة. لذلك ، يدعم حجم الجسيمات أنواع الخلايا المختلفة والظروف التجريبية. تمتد هذه المرونة إلى دمج أنواع أخرى من الفحص المجهري ، مثل تباين الطور أو التحليل الطيفي ، مما يوسع نطاق تطبيق الطريقة. تعد قدرة الطريقة على تقييم استقرار البلازميد في ظل ظروف مختلفة أمرا بالغ الأهمية للتطبيقات التي تتطلب الاحتفاظ بالبلازميد دون اختيار المضادات الحيوية ، في ظل ظروف إجهاد معينة ، أو أجيال مختلفة من الثقافة. إن تعدد استخدامات الطريقة المقدمة وقدرتها على التكيف تجعلها ذات قيمة للتطبيقات البحثية المتنوعة في مجالات بما في ذلك البيولوجيا التركيبية والمراقبة البيئية والتشخيص السريري2.
Disclosures
يعلن المؤلفون أنه لا يمكن أن تؤثر أي مصالح مالية متنافسة أو علاقات شخصية على العمل المبلغ عنه في هذه الورقة.
Acknowledgements
هذا العمل هو جزء من المشاريع الممولة الممنوحة ل T.W. من ANID FONDECYT Regular 1241621 ومشروع مبادرة تشانغ زوكربيرج "مركز أمريكا اللاتينية للتصوير البيولوجي من خلال الأجهزة المفتوحة". كما أعرب T.W. عن امتنانه للتمويل المقدم من CIFAR ، بصفته باحثا في Azrieli Global Scholar في برنامج CIFAR MacMillan Multiscale Human Multiscale.
Materials
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 370533-25G | For breaking emulsion |
| 70% ethanol | For cell permeabilization | ||
| Agar-Agar | Winkler | 9002-18-0 | |
| Biopsy Punch | 0.75 mm and 1.8 mm | ||
| Blue LED transilluminator | IO Rodeo | ||
| Culture tube | 15 mL | ||
| Desiccator | With vacuum pump | ||
| Disposable cup | For mixing PDMS | ||
| Disposable fork | For mixing PDMS | ||
| E. coli TOP10 strain | |||
| FluoPi microscope | https://github.com/wenzel-lab/FluoPi | Green fluorescence imaging system for analyzing plates | |
| Fluorinated Oil | 3M | Novec 7500 | |
| Glass slide heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of microfluidic chip | |
| Glass Slides | |||
| Hotplate | Mechanic | For evaporating Aquapel | |
| Image analysis software | Fiji/ImageJ | 2.14.0/1.54f | |
| Incubator | Mundo Lab | MLAB Scientific / For incubation of plates and microgels | |
| Isopropanol | For cleaning glass slides | ||
| Kanamycin | 100 ug/mL concentration | ||
| L-shaped spreader | For spreading bacteria on agar plates | ||
| Master mold | Chip design on silicone or glass wafer | ||
| Microtubes | 2 mL | ||
| NaCl solution | Sodium chloride 0.9% w/v | ||
| Open-source hardware strobe-enhanced microscopy stage | https://github.com/wenzel-lab/flow-microscopy-platform | For bright-field microscopy | |
| Petri dish | Citotest | 2303-1090 | 90 x 15 mm |
| Pipette tip heater | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller/tree/master/module-heating-and-stirring | For controlling the temperature at 40 °C of pipette tip | |
| Plasma Cleaner | Diener Electronic | 117056 | For bonding PDMS with a glass slide |
| Plasmid pCA_Odd1 | Encodes sfGFP and kanamycin resistance | ||
| Polytetrafluoroethylene (PTFE) tubing | Adtech Polymer Engineering Ltd | ||
| Pre-mixed Luria Bertoni medium | US Biological Life Science | L1520 | |
| Propidium iodide (PI) | For staining | ||
| Raspberry Pi-based pressure and flow controller system | https://github.com/wenzel-lab/modular-microfluidics-workstation-controller | For controlling pressure and flow rates | |
| Silicone elastomer base | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Silicone elastomer curing agent | Sylgard | PDMS kit - 184 Silicone Elastomer Kit | |
| Spectrophotometer | For measuring absorbance | ||
| SQUID microscope | https://github.com/wenzel-lab/SQUID-bioimaging-platform | Multi-fluorescence imaging system for analyzing stained cells | |
| Sterile loop | For picking a colony and streaking plating | ||
| Surfactant | Sphere Fluidics | Pico-Surf | |
| Syringes | NIPRO | With filters and tubing | |
| Temperature-controlled shaker | Mundo Lab | DLAB HCM100-Pro | |
| Tweezer | |||
| Ultra-low gelling temperature agarose | Sigma-Aldrich | A2576-5G | For generating hydrogel beads |
| Water repelent solution (fluoroalkyl silane) | Aquapel | For treating microchannels of PDMS device |
References
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under non-selective conditions maintains antibiotic resistance. Nat Commun. 10 (1), 2595 (2019).
- Rodríguez-Beltrán, J., DelaFuente, J., León-Sampedro, R., MacLean, R. C., Millán, &. #. 1. 9. 3. ;. S. Beyond horizontal gene transfer: The role of plasmids in bacterial evolution. Nat Rev Microbiol. 19 (6), 347 (2021).
- Wein, T., Dagan, T. Plasmid evolution. Curr Biol. 30 (19), R1158-R1163 (2020).
- Chen, S., Larsson, M., Robinson, R. C., Chen, S. L. Direct and convenient measurement of plasmid stability in lab and clinical isolates of E. coli. Sci Rep. 7 (1), 4788 (2017).
- Rouches, M. V., Xu, Y., Cortes, L. B. G., Lambert, G. A plasmid system with tunable copy number. Nat Commun. 13 (1), 3908 (2022).
- Silva, F., Queiroz, J. A., Domingues, F. C. Evaluating metabolic stress and plasmid stability in plasmid DNA production by Escherichia coli. Biotechnol Adv. 30 (3), 691-708 (2012).
- Wang, R., et al. Construction of novel pJRD215-derived plasmids using chloramphenicol acetyltransferase (cat) gene as a selection marker for Acidithiobacillus caldus. PLoS ONE. 12 (8), e0183307 (2017).
- Moragues, T., et al. Droplet-based microfluidics. Nat Rev Methods Primers. 3 (1), 32 (2023).
- Vitalis, C., Wenzel, T. Leveraging interactions in microfluidic droplets for enhanced biotechnology screens. Current Opinion in Biotechnology. 82, 102966 (2023).
- Sinha, N., Subedi, N., Wimmers, F., Soennichsen, M., Tel, J. A pipette-tip based method for seeding cells to droplet microfluidic platforms. J Vis Exp. (144), e57848 (2019).
- Wenzel, T. Open hardware: From DIY trend to global transformation in access to laboratory equipment. PLOS Biol. 21 (1), e3001931 (2023).
- Murillo, L. F. R., Wenzel, T. Welcome to the journal of open hardware. J Open Hardware. 1 (1), (2017).
- Shin, J. H., Choi, S. Open-source and do-it-yourself microfluidics. Sens Actuators B Chem. 347, 130624 (2021).
- Pryszlak, A., et al. Enrichment of gut microbiome strains for cultivation-free genome sequencing using droplet microfluidics. Cell Rep Methods. 2 (1), 100137 (2021).
- Pollak, B., et al. Universal loop assembly: open, efficient and cross-kingdom DNA fabrication. Biology. 5 (1), (2020).
- Volkmer, B., Heinemann, M. Condition-dependent cell volume and concentration of Escherichia coli to facilitate data conversion for systems biology modeling. PLoS ONE. 6 (7), e23126 (2011).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , (2020).
- Abate, A. R., Weitz, D. A. Faster multiple emulsification with drop splitting. Lab Chip. 11 (11), 1911-1915 (2011).
- Lau, B. T. C., Malkus, P., Paulsson, J. New quantitative methods for measuring plasmid loss rates reveal unexpected stability. Plasmid. 70 (3), 353-361 (2013).
- Oellermann, M., et al. Open hardware in science: The benefits of open electronics. Integr Comp Biol. 62 (4), 1061-1075 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved