Method Article
מינוף מציאות מדומה לפילוח וניתוח סוחף של נתוני טומוגרפיה קריו-אלקטרונית
In This Article
Summary
טומוגרפיה קריו-אלקטרונית (cryo-ET) מאפשרת הדמיה תלת מימדית של אולטרה-מבנה תאי ברזולוציה ננומטרית, אך סגמנטציה ידנית נשארת גוזלת זמן ומורכבת. אנו מציגים זרימת עבודה חדשנית המשלבת תוכנת מציאות מדומה מתקדמת לפילוח טומוגרפיות קריו-ET, המציגה את יעילותה באמצעות פילוח המיטוכונדריה בתאי יונקים.
Abstract
טומוגרפיה קריו-אלקטרונית (cryo-ET) היא טכניקה רבת עוצמה להמחשת מבנה העל של תאים בתלת מימד (תלת מימד) ברזולוציה ננומטרית. עם זאת, הפילוח הידני של רכיבים סלולריים בנתוני cryo-ET נותר צוואר בקבוק משמעותי בשל מורכבותו ואופיו הגוזל זמן. בעבודה זו, אנו מציגים זרימת עבודה חדשה של פילוח המשלבת תוכנת מציאות מדומה (VR) מתקדמת כדי לשפר את היעילות והדיוק של פילוח מערכי נתונים של cryo-ET. זרימת עבודה זו ממנפת כלי VR סוחף עם אינטראקציה תלת מימדית אינטואיטיבית, המאפשרת למשתמשים לנווט ולהוסיף הערות למבנים סלולריים מורכבים בסביבה טבעית ואינטראקטיבית יותר. כדי להעריך את יעילות זרימת העבודה, יישמנו אותה על פילוח המיטוכונדריה בתאי אפיתל פיגמנט רשתית (RPE1). מיטוכונדריה, החיונית לייצור אנרגיה תאית ולאיתות, מציגה שינויים מורפולוגיים דינמיים, מה שהופך אותם לדגימת בדיקה אידיאלית. תוכנת ה-VR אפשרה תיחום מדויק של ממברנות המיטוכונדריה והמבנים הפנימיים, ואפשרה ניתוח במורד הזרם של מבני הממברנה המפולחים. אנו מדגימים כי זרימת עבודה זו של פילוח מבוסס VR משפרת משמעותית את חווית המשתמש תוך שמירה על פילוח מדויק של מבנים סלולריים מורכבים בנתוני cryo-ET. גישה זו טומנת בחובה הבטחה ליישומים רחבים בביולוגיה מבנית של התא ובחינוך מדעי, ומציעה כלי טרנספורמטיבי לחוקרים העוסקים בניתוח תאים מפורט.
Introduction
טומוגרפיה קריו-אלקטרונית (cryo-ET) חוללה מהפכה ביכולתנו לדמיין רכיבים תאיים במצבם הכמעט טבעי ברזולוציה גבוהה 1,2. טכניקה רבת עוצמה זו מאפשרת לחוקרים לאפיין את המבנה האולטרה-תאי, ומספקת תובנות חסרות תקדים לגבי הארכיטקטורה והתפקוד של התא. עם זאת, cryo-ET אינו חף ממגבלות, העיקרית שבהן היא הדרישה שהדגימות יהיו דקות מספיק כדי להיות שקופות אלקטרונים (בדרך כלל <0.5 מיקרומטר) להדמיה במיקרוסקופי אלקטרונים סטנדרטיים בעלי יכולת קריו. ההתקדמות האחרונה בכרסום קרן יונים ממוקדת קריו אפשרה דילול של דגימות עבות לניתוח cryo-ET 3,4.
זרימות עבודה אופייניות של cryo-ET מתחילות באיסוף של סדרת הטיה, שבה הדגימה מצולמת בזוויות שונות, הנעות בין +60° ל-60°. לאחר מכן, תמונות אלה מיושרות באופן חישובי ומוקרנות לאחור כדי ליצור נפח תלת מימדי (תלת מימד) או טומוגרפיה 5,6,7. טומוגרפיה זו משמשת כמפה תלת מימדית מפורטת של הנוף התאי, ומציעה מידע מרחבי וזמני על מבנים תאיים. חידוד נוסף באמצעות מיצוע תת-טומוגרמה, שבו עותקים מרובים של אותו מבנה מיושרים וממוצעים, יכול לדחוף את גבולות הרזולוציה עוד יותר, ולפעמים להשיג רזולוציה תת-ננומטרית 7,8,9,10.
שלב מכריע בהפקת מידע ביולוגי משמעותי מהטומוגרמות הללו הוא סגמנטציה. תהליך זה כולל ביאור מבנים תאיים ספציפיים, כגון ממברנות, בתוך נפח התלת מימד. סגמנטציה מאפשרת ניתוחים מתקדמים, כולל חישוב מרחקים בין-ממברניים ועקמומיות הממברנה, ומספקת תובנות חשובות לגבי תהליכים תאיים11,12. בעוד שמספר חבילות תוכנה זמינות למשימה זו, כולל Dragonfly, Amira, MemBrain, EMAN2 ו-tomomemsegtv 13,14,15,16,17, תהליך הפילוח נותר צוואר בקבוק משמעותי בניתוח נתוני cryo-ET. לעתים קרובות מדובר בתהליך ידני עתיר עבודה וגוזל זמן, שעלול להימשך שבועות עד חודשים. רבות מהחבילות הללו מציעות תכונות פילוח אוטומטיות, אך לעתים קרובות דורשות תיקון ידני נרחב כדי להסיר תוצאות חיוביות כוזבות, תהליך שיכול להיות מייגע ולא אינטואיטיבי כאשר הוא מבוצע פרוסה אחר פרוסה או בתלת מימד.
אנו מציעים גישה חלופית על ידי מינוף טכנולוגיית מציאות מדומה (VR) כדי להתמודד עם אתגרים אלה. VR מציעה שיטה סוחפת ואינטראקטיבית להדמיית נתונים, המאפשרת למשתמשים לנווט בנפח הטומוגרפי כאילו בתוך הסביבה הסלולרית עצמה. גישה זו מספקת גם פלטפורמה רבת ערך לחינוך מדעי וחקירה מדעית וגילוי של נתוני cryo-ET באתרם על ידי מתן חוויה סוחפת ומרתקת באופן ייחודי. בעבודה זו אנו מציגים פרוטוקול לפילוח נתונים cryo-ET באמצעות syGlass18, תוכנת VR המיועדת להדמיה מדעית. תוכנה זו מספקת ערכת כלים מקיפה לניתוח נתוני cryo-ET, כולל פילוח ידני, חידוד של פילוחים שנוצרו אוטומטית ואפילו איסוף חלקיקים בתוך טומוגרפיה. המחקר שלנו מדגים את הכדאיות של VR ככלי רב עוצמה לניקוי סגמנטציות, איסוף חלקיקים ופילוח ידני בניתוח נתוני cryo-ET.
כדי להמחיש את התועלת של תוכנת VR לפילוח cryo-ET, אנו מתמקדים בניתוח המורפולוגיה המיטוכונדריאלית בתאי אפיתל פיגמנט רשתית (RPE1). מיטוכונדריה משמשות כמקרה מבחן מצוין לסגמנטציה בשל המבנה המורכב שלהן ונוכחותן של תכונות הניתנות לכימות בקלות, כגון המרחק בין ממברנות המיטוכונדריה החיצוניות והפנימיות. ניתן למדוד במדויק תכונות אלו באמצעות כלי ניתוח מורפומטריים של פני השטח12, המספקים מדדים חזקים להערכת איכות הפילוח. פרוטוקול זה מספק הוראות שלב אחר שלב לפילוח נתוני cryo-ET באמצעות syGlass, ומדגים את התועלת שלו בתוך צינור הפילוח של cryo-ET. על ידי שילוב פילוח מבוסס VR בזרימת העבודה של cryo-ET, אנו שואפים לשפר הן את היעילות והן את הדיוק של ניתוח מבני ידני בביולוגיה תאית.
Protocol
1. הכנת נתוני cryo-ET לפילוח
- המר טומוגרמות גולמיות של Cryo-ET לפורמט נתונים התואם ל-syGlass, כגון ערימות TIFF. הגדר את האות כך שהחלקיקים יהיו לבנים על שחור, ובצע השוואת היסטוגרמה עם ImageJ19.
הערה: כדי לשפר את יחס האות לרעש, מומלץ להסיר את הטומוגרפיה באמצעות תוכנה כגון Warp20, Topaz Denoise21, cryoCARE22,23 או IsoNet24 לפני ייבואן לתוכנה. - הפעל את תוכנת ה-VR במחשב. נווט לתפריט קובץ ובחר צור פרויקט.
- לוחצים על יצירת פרויקט חדש | הוסף קבצים. נווט למיקום שבו נשמרים קבצי ה-TIFF וייבא אותם לתוכנה.
- כאשר תתבקש לאשר אם הקבצים הם סדרת זמן, לחץ על לא.
- תן שם לפרוייקט ולאחר מכן לחץ על שמור כדי ליצור פרוייקט חדש תחת רשימת הפרוייקטים.
- לחץ פעמיים על הפרויקט כדי לפתוח את הטומוגרמה ולטעון אותה לסביבת המציאות המדומה האינטראקטיבית של התוכנה.
2. הגדרת מציאות מדומה (VR)
- חברו את ערכת המציאות המדומה ואת בקרי היד למחשב.
- עקבו אחר ההוראות שעל המסך כדי לכייל את סביבת המציאות המדומה.
הערה: כיול מתייחס למרחב התלת מימדי שבו יבוצע הפילוח. יש להגדיר את הפרמטרים (אורך, רוחב וגובה) של חלל העבודה לפני הצגת הקרנת ה-VR. הקרנת ה-VR תהיה גלויה רק בפרמטרים אלה. - הפילוח ייעשה רק בתוך המרחב התלת מימדי העובד המוגדר. ודאו ששדה הראייה מכיל את האזור הרצוי לעבודה בסביבת המציאות המדומה.
3. אופטימיזציה של הדמיה תלת מימדית
- לחץ על כפתור ההדמיה בממשק התוכנה. התאם אפשרויות הדמיה שונות כגון ניגודיות, חלונות, בהירות ומחווני סף כדי לשפר את האות ולמזער רעש.
- השתמש בבקרי היד כדי לקרב את הטומוגרפיה או לדחוף אותה לפי הצורך.
- הפעל את הכלי Cut באמצעות הבקר השמאלי כדי לבדוק פרוסות שונות בתוך הטומוגרפיה באופן חזותי.
4. תהליך פילוח
- נווט דרך הטומוגרמה לפרוסה הרצויה בה יתחיל הפילוח.
- הפעל את האפשרות אזור עניין (ROI) תחת תפריט ההערות באמצעות בקרי היד. תיבה ירוקה תופיע בתוך הטומוגרמה.
- התאם את הגודל והמיקום של התיבה הירוקה, והעבר אותה לאזור שיש לפלח.
- נעל את החזר ה-ROI באמצעות הבקר השמאלי והתחל סגמנטציה. לאחר נעילת ההחזר על ההשקעה, הכלי עובר אוטומטית למצב צביעה המאפשר פילוח של הנתונים הנפחיים.
- הגדל או הקטן את התצוגה של הטומוגרמה לפילוח מדויק.
- התאם את גודל מברשת הצבע על ידי סיבוב עם כיוון השעון או נגד כיוון השעון לשליטה מיטבית.
- פלח בזהירות את ההחזר על ההשקעה (למשל, ממברנות מיטוכונדריאליות) בתוך האזור התלת-ממדי שנבחר. אם מתרחשת שגיאה במהלך הפילוח, לחץ והחזק את הדק הבקר המשני כדי להפעיל מצב מחיקה , ולאחר מכן מחק את השגיאה באמצעות אותה תנועה כמו סגמנטציה.
- חזור על תהליך זה אזור אחר אזור עד לחלוקת הטומוגרפיה כולה.
5. ייצוא נתונים וניתוח מפולחים
- לאחר השלמת הפילוח, בחר את הפרויקט על ידי לחיצה עליו כדי לוודא שהוא מודגש.
- לחץ על הכרטיסייה פרויקטים בפינה הימנית העליונה ולאחר מכן בחר החזר על ההשקעה.
- בחר לייצא את אמצעי האחסון כולו או החזר השקעה ספציפי. ציין את מיקום הייצוא עבור הנתונים המפולחים.
- טען ונתח את הנתונים המפולחים באמצעות התוכנה לבחירתך וצור נתונים לפרסום.
6. ייבוא מסכה בינארית לתוכנה לניקוי
- בצע את שלבים 1.1-1.6.
- לחץ לחיצה ימנית על הפרויקט ולחץ על הוסף נתוני מסכה. לאחר מכן, נווט למקום שבו נשמר הפילוח הראשוני וייבא אותו תחת אותו פרויקט.
- השתמש בהערת החזר ROI כדי לבצע עריכות בפילוח הראשוני.
- הוסף/מחק פילוח כדי לנקות את הפילוח הראשוני.
- התאם את החזר ה-ROI של המסכה תחת אפשרות החזר ה-ROI בכרטיסייה מסכות . כדי לשנות את החזר ה-ROI של המסכה מאחד לשני, הפעל את אפשרות החלפת המסכה היחידה ועבור למצב צביעה עם בקר היד. מצב זה יחליף רק את נתוני המסיכה הגלויים.
- ייצא את החזר ה-ROI של המסכה המותאמת תוך שימוש בשלבים המתוארים בשלבים 5.1-5.3.
7. בחירת קואורדינטות חלקיקים באמצעות תוכנת VR
- צור פרויקט באמצעות טומוגרפיה (מחסנית TIFF) תוך שימוש בשלבים המתוארים בסעיף 1.
- לחץ על ביאור | ספירה, הפותחת חלון עם אפשרויות ידניות או אוטומטיות .
- עבור האפשרות הידנית , בחר צבע לספירות והתחל לסמן קואורדינטות.
- עבור האפשרות האוטומטית, בחר גודל תא והזן את הרזולוציה. לחץ על הפעל ספירה אוטומטית, ערוך את הספירה (שמור בחירות טובות והשליך גרועות), ושמור את ההתקדמות.
- ייצא את קואורדינטות הספירה על ידי לחיצה על לשונית הפרויקט | ביאורים.
- למקור הביאור, בחר פינה שמאלית תחתונה ועבור יחידות ביאורים, בחר Voxels.
- לחץ על תא ספירת הנקודות כדי להדגיש את התא.
- לחץ על Export selected כדי לשמור את הקואורדינטות של הבחירה בקובץ .csv.
הערה: ניתן להשתמש בקובץ זה כדי לחלץ תת-טומוגרפיה מהטומוגרמה עבור מיצוע תת-טומוגרמה
תוצאות
במחקר זה, פילחנו טומוגרמות המכילות מיטוכונדריה ואברונים קרומיים נוספים (למשל, שלפוחית, רשתית אנדופלזמית) באמצעות syGlass. טומוגרמות שוחזרו בתחילה ב-Warp באמצעות הקרנה משוקללת לאחור ב-16.00 Å/pixel והיו נתונים לתיקון טריז חסר והפחתת רעשים באמצעות התוכנה IsoNet. הטומוגרפיות הבאות עברו עיבוד נוסף לייבוא כפי שמוצג באיור 1A (ראה גם סרטון משלים S1, סרטון משלים S2, וידאו משלים S3 ווידאו משלים S4).
לאחר עיבוד מקדים, טומוגרמות בפורמט MRC הומרו לערימות TIFF באמצעות ImageJ, עם היפוך ניגודיות שהוחל כדי לגרום לממברנות להיראות לבנות על רקע שחור. לאחר מכן בוצעה השוואת היסטוגרמה כדי לשפר עוד יותר את הניגודיות; זה גם מאפשר סף יעיל יותר. ערימות ה-TIFF יובאו והודגמו בתלת-ממד בסביבת VR סוחפת, וסיפקו בדיקה מפורטת של מבנים קרומיים תוך שימוש בכלי החיתוך בתוכנה המוצגת באיור 1B.
פילוח ידני בוצע בתוכנה, כאשר החלונות הוגדרו לאוטומטי והתאמות בהירות/סף בוצעו כדי לייעל את נראות התכונות הסלולריות. החזר ROI סביב מיטוכונדריה ומבנים אחרים הוגדרו באמצעות בקרי VR. כלי הפילוח איפשר תיחום מדויק של גבולות הממברנה, עם שגיאות שתוקנו באמצעות פונקציית המחיקה. ניווט פרוסה אחר פרוסה או בתלת מימד באמצעות כלי ה-ROI לתיבות אזורים ברחבי הטומוגרמה, בשילוב עם כלי מברשת הצבע המתכוונן, הבטיח פילוח מדויק של הממברנות המיטוכונדריאליות ואברונים אחרים כפי שמוצג באיור 1C.
הנתונים המפולחים הוצגו על ידי יצירת רשת באמצעות אפשרות המשטחים של כלי ה-ROI, כאשר איטרציות החלקה מוגדרות ל-12 ורמת הרזולוציה מוגדרת ל-3. העיבודים התלת-ממדיים הסופיים מדגימים בבירור מבנים מיטוכונדריאלים, כולל הממברנות החיצוניות והפנימיות, קריסטה ומרבצי סידן פוספט כפי שמוצג באיור 1D (ראה גם סרטון משלים S5, סרטון משלים S6, סרטון משלים S7 וסרטון משלים S8).
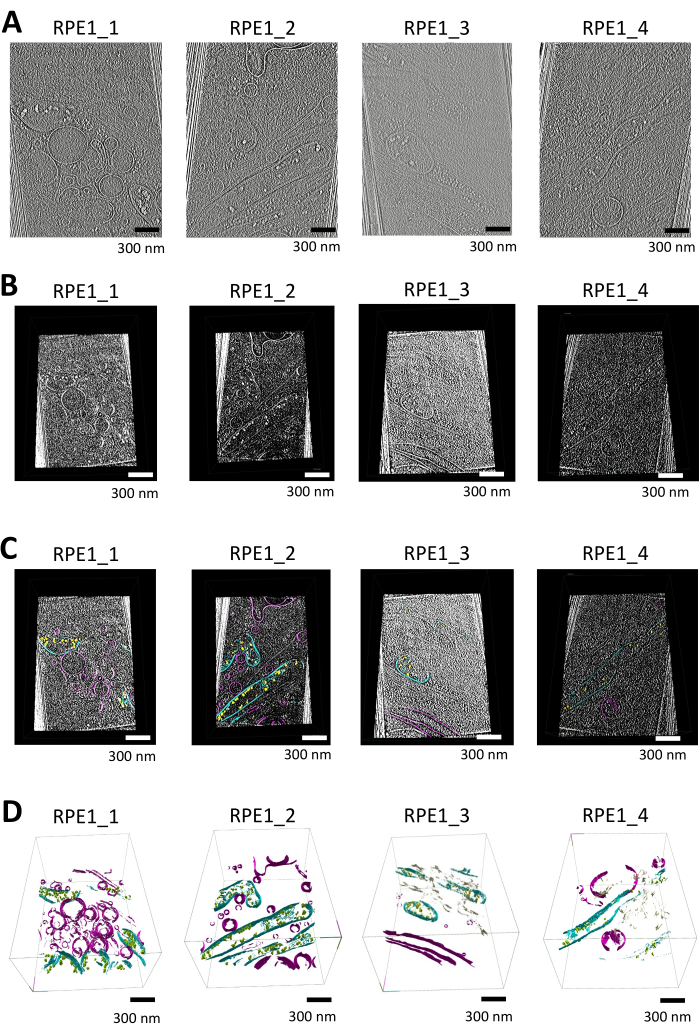
איור 1: זרימת עבודה של ויזואליזציה של טומוגרמה, סגמנטציה ועיבוד תלת-ממד באמצעות syglass. (A) פרוסות טומוגרפיות של תאי RPE1 דקים. טומוגרמות מתוקנות IsoNet משוחזרות ב-Warp ומשמשות לסגמנטציה עם syGlass, המוצגות עם IMOD25. הטומוגרמות נאספו במיקרוסקופ טיטאן-קריוס 300 keV המצויד בגלאי K3 והתמקדו בקצוות הדקים של תאי אפיתל הרשתית. כל טומוגרפיה מכילה לפחות מיטוכונדריון אחד יחד עם אברונים שונים אחרים הקשורים לממברנה. תמונות אלה הן תמונות סטילס מסרטוני וידאו המוצגים בסרטון משלים S1, וידאו משלים S2, וידאו משלים S3 ווידאו משלים S4. (ב) טומוגרמות תואמות המוצגות בתוכנה. פרוסה טומוגרפית שנוצרה באמצעות כלי החיתוך בתוכנת VR לאחר אופטימיזציה של סף, בהירות וחלונות, וחשפה מבנים סלולריים מובחנים. (C) טומוגרמות שמוצגות בתוכנה עם ממברנות מפולחות. פרוסה טומוגרפית שנוצרה עם כלי החיתוך בתוכנת VR, ועליהן הסגמנטציה המתאימה. מרבצי סידן פוספט מוצגים בצהוב, ממברנות מיטוכונדריאליות בציאן, וממברנות אחרות כגון שלפוחיות וקרום הפלזמה בסגול. (D) עיבוד תלת-ממדי של הממברנות המפולחות ב-syGlass. הממברנות המיטוכונדריאליות, כולל הממברנות המיטוכונדריאליות החיצוניות והפנימיות, מוצגות בציאן. מרבצי סידן פוספט הם בצהוב או ירוק, שלפוחיות וקרום הפלזמה בסגול, והרטיקולום האנדופלזמי בשזוף. תמונות אלה הן תמונות סטילס מסרטוני וידאו המוצגים בסרטונים משלימים S5, וידאו משלים S6, וידאו משלים S7 ווידאו משלים S8. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים S1: טומוגרפיה של מדגם RPE-1_1 ששימשה לפילוח במחקר זה. טומוגרפיה זו משוחזרת ב-16 Å/פיקסל באמצעות Warp, ולאחר מכן מבטלת רעש ומתוקנת עבור הטריז החסר עם IsoNet. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S2: טומוגרפיה של מדגם RPE-1_2 ששימשה לפילוח במחקר זה. טומוגרפיה זו משוחזרת ב-16 Å/פיקסל באמצעות Warp, ולאחר מכן מבטלת רעש ומתוקנת עבור הטריז החסר עם IsoNet. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S3: טומוגרפיה של מדגם RPE-1_3 ששימשה לפילוח במחקר זה. טומוגרפיה זו משוחזרת ב-16 Å/פיקסל באמצעות Warp, ולאחר מכן מבטלת רעש ומתוקנת עבור הטריז החסר עם IsoNet. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S4: טומוגרפיה של מדגם RPE-1_4 ששימשה לפילוח במחקר זה. טומוגרפיה זו משוחזרת ב-16 Å/פיקסל באמצעות Warp, ולאחר מכן מבטלת רעש ומתוקנת עבור הטריז החסר עם IsoNet. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S5: הפילוח המתקבל של דגימת RPE-1_1 לאחר יצירת משטחים. הממברנות המיטוכונדריאליות מוצגות בציאן; סידן פוספטים בתוך המיטוכונדריה מתוארים בצהוב; הרטיקולום האנדופלזמי מוצג בשיזוף; וממברנות אחרות מוצגות בסגול. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S6: הפילוח המתקבל של דגימת RPE-1_2 לאחר יצירת משטחים. הממברנות המיטוכונדריאליות מוצגות בציאן; סידן פוספטים בתוך המיטוכונדריה מתוארים בצהוב; הרטיקולום האנדופלזמי מוצג בשיזוף; וממברנות אחרות מוצגות בסגול. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S7: הפילוח המתקבל של דגימת RPE-1_3 לאחר יצירת משטחים. הממברנות המיטוכונדריאליות מוצגות בציאן; סידן פוספטים בתוך המיטוכונדריה מתוארים בצהוב; הרטיקולום האנדופלזמי מוצג בשיזוף; וממברנות אחרות מוצגות בסגול. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים S8: הפילוח המתקבל של דגימת RPE-1_4 לאחר יצירת משטחים. הממברנות המיטוכונדריאליות מוצגות בציאן; סידן פוספטים בתוך המיטוכונדריה מתוארים בצהוב; הרטיקולום האנדופלזמי מוצג בשיזוף; וממברנות אחרות מוצגות בסגול. אנא לחץ כאן להורדת קובץ זה.
Discussion
בעבודה זו, הדגמנו כיצד ניתן לשלב VR, במיוחד באמצעות syGlass, בצנרת cryo-ET כדי לפלח ביעילות מבנים תאיים. למרות שההתמקדות שלנו הייתה בעיקר בממברנות, אין מגבלה מובנית המונעת פילוח של מבנים תאיים אחרים, כגון חוטים או ריבוזומים, שכן ניתן להתאים את צורת המברשת וגודלה, וסף כדי להבטיח שרק ווקסלים המתאימים לאובייקטים התאיים הרצויים יסומנו. אחד היתרונות העיקריים של VR בסגמנטציה הוא האינטראקציה האינטואיטיבית והמעשית עם הנתונים, ובכך מאפשרת למשתמשים לדמיין ולתפעל נפחים כאילו הם נמצאים פיזית בתוכם. שיטות מסורתיות של פילוח ידני או ניקוי מסכות פילוח ראשוניות כוללות בדרך כלל עבודה ישירות על מחשב, שיכולה להיות פחות סוחפת ואיטית יותר להערות.
על ידי שילוב VR בזרימת העבודה של cryo-ET, משתמשים יכולים לא רק לקיים אינטראקציה מהירה עם מסכות פילוח שנוצרו על ידי תוכנות אחרות, אלא גם להשתמש ב-VR כדי להנחות את הפילוח של מבנים מפולחים חלקית ולנקות ביעילות תוצאות חיוביות שגויות. נכון לעכשיו, פילוח ידני עדיין נדרש עבור רוב מקרי השימוש בהערות, וזרימת העבודה המוצגת מאפשרת למשתמשים ליצור פילוחים המתאימים לניתוח במורד הזרם בקלות ובמהירות משופרים. למחקר זה השתמשנו באוזניות HTC Vive VR, אך התוכנה תואמת למכשירים עם תמיכה ב-SteamVR או OculusVR.
עבור יישום אופטימלי של פרוטוקול זה, נתוני cryo-ET צריכים לעמוד בקריטריונים ספציפיים, כגון טומוגרמות באיכות גבוהה עם יחס אות לרעש (SNR) גבוה. ה-SNR הוא פרמטר חיוני, שכן בהירות התכונות המבניות משפיעה ישירות על האפקטיביות של פילוח ידני ב-VR. שלבי עיבוד מקדים כגון תיקון טריז חסר והפחתת רעשים הם חלקים מרכזיים בזרימת העבודה; בפרוטוקול זה, השתמשנו ב-IsoNet למטרות אלה. יש לשחזר את הטומוגרמות ברזולוציה מתאימה - באמצעות גודל ווקסל המספק פירוט מבני מספיק והפרדה מספקת בין מבנים סלולריים כדי לאפשר פילוח יעיל בין המבנים תוך שמירה נוספת על גדלי נתונים הניתנים לניהול עבור הדמיית VR. בנוסף, יש ליישם ניגודיות הפוכה עם מבנים תאיים המופיעים לבן על רקע שחור והשוואת היסטוגרמה כדי לשפר את הנראות של ממברנות ומבנים אחרים בסביבת syGlass.
יש לקחת בחשבון מספר נקודות קריטיות כדי להבטיח את הצלחת פרוטוקול זה. ראשית, במהלך עיבוד מקדים של נתונים, יישום מדויק של היפוך ניגודיות והשוואת היסטוגרמה הוא חיוני; התאמות לא נכונות עלולות לגרום להדמיה לא אופטימלית ב-VR, מה שהופך את הפילוח למאתגר. שנית, בתוך תוכנת ה-VR, התאמות מתאימות של חלונות, בהירות והגדרות סף חיוניות להדמיה אופטימלית של מבנים. על המשתמשים להתנסות בהגדרות אלה כדי להשיג את התוצאות הטובות ביותר עבור מערכי הנתונים הספציפיים והגדרות ה-VR שלהם.
בכל הנוגע לפתרון בעיות, משתמשים עלולים להיתקל בבעיות כגון מגבלות ביצועי מערכת VR, במיוחד בעת טיפול במערכי נתונים גדולים של טומוגרפיה. אם סביבת ה-VR הופכת לפיגור או לא מגיבה, שקול להפחית את דגימת הנתונים או לפלח את הטומוגרמה במקטעים קטנים יותר על ידי התאמת התיבה התוחמת בכלי ה-ROI ב-syGlass והזזתה לאורך הטומוגרמה בזמן ביצוע הפילוח. ניתן גם לכוונן את מחוון הביצועים בתפריט ההדמיה כדי להפחית את הפיגורים במהלך תהליך הפילוח. בנוסף, כדי להפחית מחלת תנועה, משתמשים יכולים להתאים את הגדרות ה-VR כדי להפחית את אפקטי התנועה או לקחת הפסקות קבועות במהלך מפגשי פילוח.
פרוטוקול הפילוח מבוסס ה-VR שלנו מציע יתרונות משמעותיים לתהליכי העבודה הנוכחיים של פילוח cryo-ET. שיטות פילוח ידניות קונבנציונליות כוללות לרוב הערות דו-ממדיות על פרוסות בודדות, מה שעלול לגזול זמן וייתכן שלא יתפוס במלואו המשכיות תלת מימדית13. בנוסף, פילוח מבוסס VR מציג תצוגה הרבה יותר סוחפת של המבנים התאיים, ומסייע בהדמיה. פילוח אוטומטי של למידת מכונה מתגלה כשיטה רבת עוצמה להשגת סגמנטציות מטומוגרפיה סלולרית 14,16,17, אם כי רמות הרעש הגבוהות והמבנים המורכבים הקיימים בנתוני cryo-ET מובילים לפערים ותוצאות חיוביות שגויות הדורשות התערבות ידנית. פרוטוקול זה מציע גישה חלופית לפילוח ידני של טומוגרפיות קריו-אלקטרונים, כדי ליצור סגמנטציות ראשוניות שעשויות לשמש כנתוני אימון עבור תוכנות אחרות של רשת עצבית, או כדי לנקות פילוחים ראשוניים שנוצרו מגישות אוטומטיות אחרות.
לסיכום, מחקר זה מדגיש פילוח מבוסס VR ככלי מבטיח לניתוח וחינוך נתוני cryo-ET, המציע יעילות משופרת וחווית משתמש סוחפת יותר. עם פיתוח נוסף, לטכנולוגיית VR יש פוטנציאל לחולל מהפכה באופן שבו אנו מפרשים ומפיצים תגליות מדעיות של מבנים תאיים מורכבים במערכי נתונים של cryo-ET, ומספקים אלטרנטיבה רבת ערך לשיטות פילוח וחינוך מסורתיות.
Disclosures
המחברים מצהירים שאין להם ניגודי אינטרסים.
Acknowledgements
עבודה זו בוצעה במרכז הלאומי לגישה והדרכה של CryoEM (NCCAT) ובמרכז סימונס למיקרוסקופיה אלקטרונית הממוקם במרכז לביולוגיה מבנית בניו יורק, בתמיכת NIH (Common Fund U24GM129539, U24GM139171 ו-NIGMS R24GM154192), קרן סימונס (SF349247) ואסיפת מדינת ניו יורק.
Materials
| Name | Company | Catalog Number | Comments |
| CryoET Data | Format:TIFF-stack, TIFF | ||
| HTC VIVE Cosmos | HTC | 99HARL000-00 | https://www.vive.com/sea/product/vive-cosmos/features/ |
| Intel(R) Core(TM) i7-10870H CPU @ 2.20 GHz 2.21 GHz | Intel | https://ark.intel.com/content/www/us/en/ark/products/208018/intel-core-i7-10870h-processor-16m-cache-up-to-5-00-ghz.html | |
| NVIDIA GeForce RTX 3070 Laptop GPU | NVIDIA | https://www.nvidia.com/en-us/geforce/laptops/compare/30-series/ | |
| syGlass Software | syGlass | syGlass Software installed on a compatible Windows PC | |
| VIVE Cosmos Hand Controllers | HTC | 99HAFR001-00 | https://www.vive.com/us/accessory/cosmos-controller-right/ |
| Windows 11 Home | Microsoft | Microsoft Windows 11 Home |
References
- Plitzko, J. M., Schuler, B., Selenko, P. Structural biology outside the box-inside the cell. Curr Opin Struct Biol. 46, 110-121 (2017).
- Beck, M., Baumeister, W. Cryo-electron tomography: can it reveal the molecular sociology of cells in atomic detail. Trends Cell Biol. 26 (11), 825-837 (2016).
- Lam, V., Villa, E. Practical approaches for cryo-FIB milling and applications for cellular cryo-electron tomography. Methods Mol Biol. 2215, 49-82 (2021).
- Berger, C., et al. Cryo-electron tomography on focused ion beam lamellae transforms structural cell biology. Nat Methods. 20 (4), 499-511 (2023).
- Watson, A. J. I., Bartesaghi, A. Advances in cryo-ET data processing: meeting the demands of visual proteomics. Curr Opin Struct Biol. 87, 102861 (2024).
- Pyle, E., Zanetti, G. Current data processing strategies for cryo-electron tomography and subtomogram averaging. Biochem J. 478 (10), 1827-1845 (2021).
- Wan, W., Briggs, J. A. G. Cryo-electron tomography and subtomogram averaging. Methods Enzymol. 579, 329-367 (2016).
- Ni, T., Liu, K., Zhang, J., Atanasov, I., Mladenov, M. G., Jiang, W. High-resolution in situ structure determination by cryo-electron tomography and subtomogram averaging using emClarity. Nat Protoc. 17 (2), 421-444 (2022).
- Obr, M., et al. Exploring high-resolution cryo-ET and subtomogram averaging capabilities of contemporary DEDs. J Struct Biol. 214 (2), 107852 (2021).
- Tegunov, D., Xue, L., Dienemann, C., Cramer, P., Mahamid, J. Multi-particle cryo-EM refinement with M visualizes ribosome-antibiotic complex at 3.5 Å in cells. Nat Methods. 18 (2), 186-193 (2021).
- Salfer, M., Collado, J. F., Baumeister, W., Fernández-Busnadiego, R., Martínez-Sánchez, A. Reliable estimation of membrane curvature for cryo-electron tomography. PLoS Comput Biol. 16 (8), e1007962 (2020).
- Barad, B. A., et al. Quantifying organellar ultrastructure in cryo-electron tomography using a surface morphometrics pipeline. J Cell Biol. 222 (2), e202204093 (2023).
- Martinez-Sanchez, A., Garcia, I., Asano, S., Lucic, V., Fernandez, J. J. Robust membrane detection based on tensor voting for electron tomography. J Struct Biol. 186 (1), 49-61 (2014).
- Heebner, J. E., et al. Deep learning-based segmentation of cryo-electron tomograms. J Vis Exp. (189), e64435 (2022).
- Garza-López, E., Robles-Flores, M. Protocols for generating surfaces and measuring 3D organelle morphology using Amira. Cells. 11 (1), 65 (2021).
- Chen, M., et al. Convolutional neural networks for automated annotation of cellular cryo-electron tomograms. Nat Methods. 14 (10), 983-985 (2017).
- Lamm, L., et al. MemBrain v2: an end-to-end tool for the analysis of membranes in cryo-electron tomography. bioRxiv. , (2024).
- Pidhorskyi, S., Morehead, M., Jones, Q., Spirou, G., Doretto, G. syGlass: interactive exploration of multidimensional images using virtual reality head-mounted displays. arXiv. , (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Tegunov, D., Cramer, P. Real-time cryo-electron microscopy data preprocessing with Warp. Nat Methods. 16 (11), 1146-1152 (2019).
- Bepler, T., Kelley, K., Noble, A. J., Berger, B. Topaz-Denoise: general deep denoising models for cryoEM and cryoET. Nat Commun. 11, 5208 (2020).
- Buchholz, T. -. O., Berninger, L., Maurer, M., Jug, F. Cryo-CARE: content-aware image restoration for cryo-transmission electron microscopy data. Proc IEEE Int Symp Biomed Imaging. 16, 502-506 (2019).
- Buchholz, T. -. O., Jordan, M., Pigino, G., Jug, F. Content-aware image restoration for electron microscopy. Methods Cell Biol. 152, 277-289 (2019).
- Liu, Y. -. T., et al. Isotropic reconstruction for electron tomography with deep learning. Nat Commun. 13, 6482 (2022).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J Struct Biol. 116 (1), 71-76 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved