È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Esecuzione personalizzati Esperimenti di Microarray MicroRNA
In questo articolo
Riepilogo
Una semplice procedura di eseguire esperimenti microarray su ordinazione microRNA è descritto. I passaggi includono isolare RNA, l'etichettatura RNA e DNA di riferimento, ibridando i campioni di microarray, la scansione del microarray, quantificare e analizzare segnali di ibridazione.
Abstract
microRNA (miRNA) sono una grande famiglia di circa 22 nucleotidi (nt) lungo molecole di RNA che sono ampiamente espresse in eucarioti 1. Genomi complessi codificare almeno centinaia di miRNA, che in primo luogo inibire l'espressione di un vasto numero di geni bersaglio post-trascrizionalmente 2, 3. miRNA controllare una vasta gamma di processi biologici 1. Inoltre, l'espressione di miRNA alterata è stata associata a malattie umane come i tumori, e miRNA possono servire come biomarcatori per le malattie e la prognosi 4, 5. E 'importante, quindi, per capire l'espressione e le funzioni dei miRNA in diverse condizioni.
Tre approcci principali sono stati impiegati per profilo di espressione di miRNA: real-time PCR, microarray e sequenziamento profondo. La tecnica dei microarray miRNA ha il vantaggio di essere high-throughput, generalmente meno costose, e la maggior parte delle fasi sperimentali e di analisi può essere carrIED in un laboratorio di biologia molecolare alla maggior parte delle università, scuole di medicina e gli ospedali associati. Qui, descriviamo un metodo per l'esecuzione di esperimenti microarray su ordinazione miRNA. Un insieme sonda miRNA verrà stampato su vetrini microarray per produrre miRNA. RNA è isolato utilizzando un metodo o reagente che conserva le piccole specie di RNA, e poi etichettato con un colorante fluorescente. Come controllo, oligonucleotidi DNA di riferimento corrispondente a un sottoinsieme dei miRNA sono etichettati con un colorante diverso fluorescenza. Il DNA di riferimento servirà per dimostrare la qualità della diapositiva e l'ibridazione e sarà anche utilizzata per la normalizzazione dei dati. L'RNA e DNA si mescolano e ibridato a una diapositiva microarray contenenti sonde per la maggior parte dei miRNA nel database. Dopo il lavaggio, la diapositiva viene sottoposto a scansione per ottenere immagini e intensità dei punti individuali quantificati. Questi segnali prime saranno ulteriormente elaborati e analizzati i dati di espressione dei miRNA corrispondente. MicroArray diapositive possono essere rimossi e rigenerata per ridurre i costi di microarray e di migliorare la coerenza degli esperimenti microarray. Gli stessi principi e le procedure sono applicabili ad altri tipi di esperimenti microarray su ordinazione.
Protocollo
1. Stampa di microarray miRNA personalizzate
- Stampare il microarray diapositive utilizzando i servizi di base impianto di microarray presso un'università o una società. La qualità dei microarray fabbricazione è uno dei fattori più critici per il successo di un esperimento di microarray. Provate alcuni servizi, se possibile. Idealmente, si potrebbe stampare 50-100 diapositive alla volta, e tutte le diapositive sarà identico, con ben separate, i punti individuali.
- Per il supporto microarray, usiamo il II APERTURE vetrini rivestiti.
- Per le sonde miRNA, si usa il nCode multispecie miRNA Microarray Probe Set V2.
- Sciogliere tutti gli oligonucleotidi in 3 x SSC a 10 micron e quadruply li stampa nelle diapositive. Fissare gli scivoli per irraggiamento ultravioletto in base alle istruzioni per le diapositive II GAAP. Etichettare il vetrino con una penna di diamante per segnare il territorio e con le sonde lato stampato. Conservare a 22 ° C.
2. Preparazione del campione
- Qualsiasi metodoo reagente può essere utilizzato per isolare l'RNA, fintanto che conserva piccoli RNA. Generalmente usiamo Trizol (Invitrogen) per estrarre l'RNA totale, con quantità soddisfacente e la qualità delle preparazioni di RNA, come misurato da A a 260 nm e 280 nm A letture.
- Per RNA etichettatura, mix ~ 25 mg di RNA totale con 0,5 mg di 5'-PCU-DY547-3 '6 in 1 tampone x (50 HEPES mM, pH 7.8, 20 mM MgCl 2, 10 mcg / ml BSA, il 10% DMSO) contenente ~ 20 unità T4 RNA ligasi 1, integrato con ~ 10 mM DTT e ~ 0,02-0,03 volume finale di x 10 T4 RNA ligasi 1 tampone per l'ATP.
- Consentono l'uso di procedere sul ghiaccio all'interno di un frigorifero per 2-24 ore. Precipitare l'RNA con 0,3 M di acetato di sodio e 3 volumi di etanolo. Per la legatura efficiente e precipitazioni, dissolvere RNA totale di oltre 2 mg / ml, e mantenere il volume totale legatura a ~ 20 l.
- Se meno RNA è disponibile, la quantità di input RNA e 5'-PCU-DY547-3 'può essere ridimensionato.
- Se l'RNA è molto diluita, aggiungere vettore come il tRNA di lievito per aiutare nelle precipitazioni.
- Combinare ed etichetta in totale 1 mg di oligonucleotidi DNA di riferimento corrispondente a un sottoinsieme dei miRNA mammiferi utilizzando il Ulysis Alexa Fluor 647 Nucleic Acid Kit Etichettatura 6 come controllo per il processo di ibridazione. Purificare il DNA marcato con una colonna CentriSep e salvare nel buio a -20 ° C.
3. Microarray di ibridazione
- Per utilizzare le diapositive per la prima volta, pre-ibridare le diapositive in una soluzione filtrata di 3 x SSC, 0,1% SDS, 0.2% BSA per 30-60 minuti a 37 ° C. Immergere in acqua un paio di volte, poi in isopropanolo. Asciugare le diapositive utilizzando una centrifuga con un adattatore per diapositive a 100 g per 5 min a 22 ° C.
Nota: Noi usiamo Corning camere di ibridazione microarray e Erie Scientific mSeries di Lifterslips per eseguire ibridazione microarray.
- Sciacquare il lifterslips in acqua, poi in etanolo, prima di asciugare in aria. Posizionare una diapositiva all'interno di una base della camera di ibridazione microarray, e un lifterslip sulla parte superiore della diapositiva. Il lifterslip coprirà l'area della sonda, con le sue strisce bianche contattando la diapositiva.
- Nel buio, rallenta il precipitato, l'RNA etichettati. Lavare una volta con etanolo al 70%, e l'aria secca il pellet. Il pellet deve essere rossiccio.
- Preparare una soluzione di ibridazione contenente 400 mM Na 2 HPO 4 pH 7,0, lo 0,8% di BSA, 5% SDS, 12% formammide 6 con 1/15-1/100 microlitri della purificato, marcato DNA di riferimento (2,4) per ogni campione di RNA. La quantità di DNA di riferimento aggiunto dipende da quanti oligonucleotidi diversi vengono etichettati (2,4). Se ci sono oltre 100, quindi meno di diluizione è necessario.
- Sciogliere il pellet di RNA bene con ~ 60 microlitri della soluzione di ibridazione.
- Aggiungere 20 ml di acqua per ciascuno dei pozzi umidificazione nella base ibridazione camera Corning microarray.
- Aggiungi tsi miscela di RNA e DNA marcato riferimento alla diapositiva. Utilizzare una punta sottile pipetta, toccare delicatamente il bordo del lifterslip, e consentire la soluzione di inserire lo spazio tra le lifterslip e far scorrere mediante aspirazione.
- Posizionare la camera di ibridazione coprono oltre la base, poi sigillare la camera con clip in metallo.
- Mettete tutta la camera all'interno del sacchetto di plastica che viene fornito con la cassetta camera da Corning.
- Posizionare la cassetta camera (s) all'interno di un contenitore con un tovagliolo di carta bagnata, coprire il recipiente con pellicola trasparente e metterla in un 37 ° C umidi, incubatore per colture cellulari ~ 24 ore. Queste precauzioni (3.6, 3.9, 3.10) garantire che la soluzione di ibridazione non si secchi durante l'incubazione.
4. Post-ibridazione di elaborazione
- Smontare le cassette camera uno per uno. Immergere una diapositiva e la sua lifterslip in 2 x SSC a 22 ° C. Il lifterslip cadrà naturalmente dal vetrino. Luogo in 0,8 x SSC. Lavarele diapositive di 0,8 x SSC due volte, poi tre volte in 0,4 x SSC, 1-2 minuti in totale. Asciugare le diapositive utilizzando una centrifuga con un adattatore per diapositive. Lavare la lifterslips con acqua e risparmiare per il riutilizzo in seguito.
- Scansione le diapositive con qualunque scanner adatto, ad esempio, la Perkin Elmer ScanArray 5000 o Molecular Devices Axon 4000B GenePix scanner microarray. Scansione a lunghezze d'onda vicino a 547 nm e 647 nm per ottenere i file immagine corrispondente.
- Utilizzare programmi come BlueFuse di quantificare le intensità dei pixel in ingresso, i file di immagine da 4,2). Ispezionare i singoli punti con il programma di escludere macchie anomale sul microarray da ogni ulteriore esame. Queste macchie anomale di solito nascono da stampa scivolare poveri o far scorrere la manipolazione dopo ibridazione.
- Utilizzare programmi come GeneSpring ed Excel per l'analisi dei dati e la presentazione. Considerazioni generali per la normalizzazione dei dati microarray applicare, che è oltre la portata di questo documento.
- Una volta che i segnali soddisfacenti si ottengono after 4.3), striscia le diapositive microarray per il riutilizzo 7. Sciacquare i vetrini in acqua, poi immergere in pre-riscaldato, 1 mM NaOH e 0,1 x SSC in un piatto di colorazione a 62 ° C per 10-20 minuti. Ripetere l'incubazione una volta. Lavare le diapositive un paio di volte in acqua per un massimo di 60 minuti agitando delicatamente a 22 ° C. Asciugare le diapositive utilizzando una centrifuga, e conservare a 22 ° C.
- Per utilizzare le diapositive rigenerata, non è necessario per loro pre-ibridare di nuovo. Basta lavarli in acqua seguito da isopropanolo, e asciugare le diapositive a destra prima di ibridazione.
5. Rappresentante dei risultati:
Abbiamo in gran parte seguite le procedure descritte al profilo di espressione globale miRNA in migliaia di campioni, cioè RNA isolato dal pesce zebra a campione umano in diverse condizioni. La figura 1 mostra una immagine digitalizzata di un microarray per dimostrare segnali di ibridazione molto precisa e forte sul diapositive. La Pearson correlatisui coefficienti tecnici tra repliche di ibridazione microarray sono ~ 0.99 7, indicando eccellente riproducibilità.
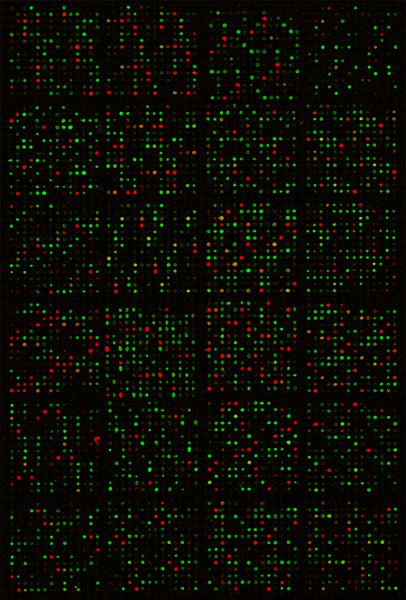
Figura 1 l'immagine composita di una diapositiva scansione microarray miRNA dopo ibridazione. Macchie rosse il risultato di ibridazioni dal DNA di riferimento, le macchie verdi dal DY547 marcato campione di RNA, mentre i punti gialli erano di ibridazioni sia dal DNA e RNA per la stessa sonda.
Discussione
Nonostante i recenti progressi nelle tecnologie di sequenziamento profondo, microarray rimane una scelta praticabile per high-throughput analisi del DNA e RNA. Rispetto al sequenziamento profondo, gli esperimenti microarray sono più economici, e un laboratorio di biologia molecolare tipico in grado di eseguire la maggior parte degli esperimenti e analisi dei dati in-house, che consente flessibilità e consente di risparmiare tempo. In futuro, microarray probabilmente adatto a interrogare intensamente insiemi di geni, p...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Il lavoro è stato sostenuto in parte dal National Institute of Drug Abuse Center (P50 DA 011.806) e dell'esercito degli Stati Uniti Dipartimento della Difesa (W81XWH-07-1-0183).
Materiali
| Name | Company | Catalog Number | Comments |
| Articoli | Venditore | Numero di catalogo | Commenti |
|---|---|---|---|
| NCode multi-specie miRNA Microarray Probe Set V2 | Invitrogen | MIRMPS201 | Progettato sulla base del miRBase versione 9.0 (ottobre 2006). Esso contiene ~ 1140 non modificato, 34-44 oligonucleotidi nt lungo come sonde per verme, volare, zebrafish, topo, ratto, e miRNA umani, e una serie di sonde di controllo interno, come snoRNAs. Le sonde miRNA sono doppietti delle sequenze complementari a miRNA maturo, quindi le dimensioni di ~ 44 nt. Per l'analisi si può concentrare su miRNA da un genoma particolare (s) di interesse. |
| Trizol | Invitrogen | 15596018 | Abbiamo usato anche arricchito, piccola frazione di RNA per l'etichettatura, anche se campioni di RNA totale sono più veloci e più facili da preparare e di quantificare e adatto per applicazioni a valle quali l'analisi di mRNA. |
| T4 RNA ligasi 1 | New England Biolabs | M0204L | |
| Ulysis Alexa Fluor 647 Nucleic Acid Kit Etichettatura | Invitrogen | U21660 | Questo kit o prodotti simili possono essere usati per l'etichetta sperimentale campioni di RNA o RNA di controllo (invece di DNA di controllo) pure. |
| 5'-PCU-DY547-3 ' | Dharmacon | Una soluzione su misura | Piccola frazione di RNA possono essere etichettati in modo simile da legatura. |
| CentriSep colonne | Princeton separazioni | CS-901 | |
| GAPSII scivolo rivestito | Corning | 40004 | Altri tipi di diapositive può essere utilizzato anche. |
| Microarray ibridazione camere | Corning | 2551 o 40080 | Altri tipi di camere di ibridazione e coprioggetto dovrebbe funzionare. Utilizzo di macchinari ibridazione disponibili in commercio possono ridurre il tempo di ibridazione in modo significativo, ad esempio, per circa 2 ore. |
| Lifterslips | ThErmo / Erie scientifico | 25X60I-M5439-001-LS | |
| BlueFuse | BlueGenome | ||
| GeneSpring | Agilent |
Riferimenti
- Ambros, V. The functions of animal microRNAs. Nature. 431, 350-355 (2004).
- Friedman, R. C., Farh, K. K., Burge, C. B., Bartel, D. P. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 19, 92-105 (2009).
- Chekulaeva, M., Filipowicz, W. Mechanisms of miRNA-mediated post-transcriptional regulation in animal cells. Curr. Opin. Cell Biol. 21, 452-460 (2009).
- Farazi, T. A., Spitzer, J. I., Morozov, P., Tuschl, T. miRNAs in human cancer. J. Pathol. 223, 102-115 (2011).
- Small, E. M., Olson, E. N. Pervasive roles of microRNAs in cardiovascular biology. Nature. 469, 336-342 (2011).
- Thomson, J. M., Parker, J., Perou, C. M., Hammond, S. M. A custom microarray platform for analysis of microRNA gene expression. Nat. Methods. 1, 47-53 (2004).
- Zhang, X., Xu, W., Tan, J., Zeng, Y. Stripping custom microRNA microarrays and the lessons learned about probe:slide interactions. Anal. Biochem. 386, 222-227 (2009).
- Griffiths-Jones, S., Saini, H. K., van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucl. Acids. Res. 36, D154-D158 (2008).
- Landgraf, P. A mammalian microRNA expression atlas based on small RNA library sequencing. Cell. 129, 1401-1414 (2007).
- Chiang, H. R. Mammalian microRNAs: experimental evaluation of novel and previously annotated genes. Genes. Dev. 24, 992-1009 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon