É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A realização de experimentos de Microarray personalizado MicroRNA
Neste Artigo
Resumo
Um procedimento simples de realizar experimentos de microarray personalizado microRNA é descrito. As etapas incluem isolar RNA, rotulagem RNA e DNA de referência, hibridação as amostras para microarrays, a digitalização da microarrays, quantificar e analisar os sinais de hibridização.
Resumo
microRNAs (miRNAs) são uma grande família de ~ 22 nucleotídeos (nt) longas moléculas de RNA, que são amplamente expressos em eucariotos 1. Genomas complexos codificam pelo menos centenas de miRNAs, que principalmente inibir a expressão de um vasto número de genes-alvo pós-transcricionalmente 2, 3. miRNAs controlam uma ampla gama de processos biológicos 1. Além disso, a expressão de miRNA alterados tem sido associado com doenças humanas como câncer e miRNAs podem servir como biomarcadores para doenças e prognóstico 4, 5. É importante, portanto, entender a expressão de miRNAs e funções sob diversas condições.
Três abordagens principais têm sido empregadas para expressão perfil de miRNA: real-time PCR, microarranjos, seqüenciamento e profunda. A técnica de microarray miRNA tem a vantagem de ser de alto rendimento, geralmente menos caro, ea maioria das etapas experimentais e análise pode ser carried em um laboratório de biologia molecular na maioria das universidades, as escolas médicas e hospitais associados. Aqui, nós descrevemos um método para a realização de experimentos de microarray miRNA personalizado. Um conjunto de sonda de miRNA serão impressas em lâminas de vidro para produzir microarrays miRNA. RNA é isolado usando um método ou reagente que preserva espécies de pequenos RNA, e então marcadas com um corante fluorescente. Como controle, oligonucleotídeos referência DNA correspondente a um subconjunto de miRNAs também estão marcadas com um corante fluorescente diferente. O DNA de referência servirá para demonstrar a qualidade do slide e hibridação e também será utilizado para a normalização de dados. O RNA e DNA são misturados e hibridizado com uma lâmina de microarray contendo sondas para a maioria dos miRNAs na base de dados. Após a lavagem, o slide é digitalizada para obter imagens e intensidades dos pontos individuais quantificadas. Esses sinais-prima será processada e analisada como os dados da expressão do miRNAs correspondente. Microaslides rray pode ser descascado e regenerado para reduzir o custo de microarrays e para reforçar a coerência das experiências microarray. Os mesmos princípios e procedimentos são aplicáveis a outros tipos de experimentos de microarray personalizado.
Protocolo
1. Impressão de microarrays miRNA personalizado
- Imprimir o microarray slides usando o microarray serviços instalação do núcleo de uma universidade ou uma empresa. A qualidade de microarray de fabricação é um dos fatores mais críticos para o sucesso de um experimento de microarray. Tente alguns serviços, se possível. Idealmente, seria imprimir 5-10 slides de cada vez, e todos os slides parecem idênticos, com bem separados, os pontos individuais.
- Para suporte microarray, usamos as lâminas GAPS II revestido.
- Para sondas de miRNA, usamos o nCode Multi-Species miRNA Microarray Probe Set V2.
- Dissolver todos os oligonucleotídeos em 3 x SSC, 10 mM e quadruply imprimi-los nos slides. Corrigir os slides por irradiação ultravioleta acordo com as instruções para os slides GAAP II. Deslize o rótulo com uma caneta de diamante para marcar a área e laterais com as pontas de prova impressa. Loja em 22 ° C.
2. Preparação de amostras
- Qualquer métodoou reagente pode ser usado para isolar RNA, enquanto preserva pequenos RNAs. Geralmente usamos Trizol (Invitrogen) para extrair RNA total, com quantidade satisfatória e qualidade das preparações de RNA, medido por A 260nm e A 280nm leituras.
- RNA para rotulagem, mix ~ 25 mg de RNA total com 0,5 mg de 5'-PCU-DY547-3 '6 em 1 x tampão (50 mM HEPES, pH 7.8, 20 mM MgCl 2, 10 mg / ml BSA, 10% DMSO), contendo ~ 20 unidades T4 RNA Ligase 1, suplementado com 10 mM DTT ~ e volume ~ 0,02-0,03 final do T4 10 x RNA Ligase um buffer para ATP.
- Permitir a rotulagem para prosseguir no gelo dentro de uma geladeira por 2-24 horas. RNA precipitado com acetato de sódio 0,3 M e 3 volumes de etanol. Para ligação eficiente e precipitação, dissolver RNA total em mais de 2 mg / ml, e manter o volume total de ligadura em ~ 20 mL.
- Se RNA menos está disponível, a quantidade de entrada de RNA e 5'-PCU-DY547-3 'pode ser reduzida.
- Se o RNA é muito diluída, adicione portador tal como o tRNA de levedura para ajudar na precipitação.
- Combinar e rótulo em mg um total de oligonucleotídeos de referência DNA correspondente a um subconjunto de miRNAs em mamíferos usando o Ulysis Alexa Fluor 647 Kit Rotulagem de Ácido Nucleico 6 como um controle para o processo de hibridização. Purificar o DNA rotulados com uma coluna CentriSep e salvar no escuro a -20 ° C.
3. Hibridação de microarrays
- Para utilizar os slides, pela primeira vez, pré-hibridizar os slides em uma solução filtrada de 3 x SSC, 0,1% SDS, BSA 0,2% por 30-60 min a 37 ° C. Submergir em água algumas vezes, então, em isopropanol. Secar as lâminas usando uma centrífuga com um adaptador de slide de 100 g por 5 min a 22 ° C.
Nota: Nós usamos câmaras Corning hibridização microarray e mSeries Erie Científico de Lifterslips para realizar a hibridação microarray.
- Lavar o lifterslips em água, em seguida, em etanol, antes da secagem ao ar. Coloque um slide dentro de uma base da câmara de hibridização de microarrays, e um lifterslip em cima do slide. O lifterslip vai cobrir a área da sonda, com o seu contato com a tiras brancas slide.
- No escuro, girar o precipitado, RNA marcados. Lavá-lo uma vez com etanol 70%, eo ar seco do sedimento. O pellet deve ser avermelhada.
- Prepare uma solução de hibridização contendo 400 mM Na 2 HPO 4 pH 7,0, 0,8% BSA, 5% SDS, 12% formamida 6 com 1/15-1/100 mL do purificado, rotulados de referência DNA (2,4) por amostra de RNA. A quantidade de DNA de referência adicionada depende de quantos diferentes oligonucleotídeos são rotulados (2.4). Se houver mais de 100, em seguida, menos de diluição é necessária.
- Dissolver o sedimento RNA bem com ~ 60 mL da solução de hibridização.
- Adicionar 20 l de água para cada um dos poços de umidificação na base da câmara Corning microarray de hibridização.
- Adicionar tele mistura de RNA e DNA rotulados de referência para o slide. Use a ponta da pipeta fina, suave toque na borda da lifterslip, e permitir que a solução para entrar no espaço entre o lifterslip e deslize através de sucção.
- Coloque a câmara de hibridação tampa sobre a base, em seguida, selar a câmara com clipes de metal.
- Coloque toda a câmara dentro do saco plástico que vem com a cassete da câmara de Corning.
- Coloque a cassete da câmara (s) dentro de um recipiente com papel toalha molhada; cobrir o recipiente com filme plástico e coloque-o dentro de um 37 ° C úmido, cultura de células incubadora para ~ 24 horas. Estas precauções (3.6, 3.9, 3.10) garantir que a solução de hibridização não seca durante a incubação.
4. Pós-processamento de hibridização
- Desmonte a câmara de cassetes, um por um. Slides submergir e na sua lifterslip em 2 x SSC a 22 ° C. O lifterslip caberá naturalmente fora do slide. Coloque-o em 0,8 x SSC. Lavaros slides em 0,8 x SSC duas, três vezes em 0,4 x SSC, 1-2 min no total. Secar as lâminas usando uma centrífuga com um adaptador de slide. Lave o lifterslips com água e guarde para reutilização posterior.
- Digitalizar os slides com qualquer scanner apropriado, por exemplo, a Perkin Elmer 5000 ou ScanArray Molecular Devices Axon GenePix 4000B scanner microarray. Varredura em comprimentos de onda próximo a 547 nm e 647 nm para obter os arquivos de imagem correspondente.
- Use programas como o BlueFuse para quantificar intensidade dos pixels na entrada, arquivos de imagem de 4.2). Inspecionar os pontos individuais com o programa para excluir manchas anormais na microarrays de análise mais aprofundada. Essas manchas anormais geralmente surgem a partir de impressão de slides pobres ou deslize após a manipulação de hibridização.
- Utilizar programas como Excel e GeneSpring para análise de dados e apresentação. Considerações gerais para normalização de dados microarray aplicar, o que está além do escopo deste artigo.
- Uma vez que os sinais satisfatórios são obtidos after 4.3), tira as lâminas de microarrays para reutilização 7. Enxágüe as lâminas em água, em seguida, mergulhar na pré-aquecido, 1 mM NaOH e 0,1 x SSC em um prato de coloração a 62 ° C por 10-20 minutos. Repita a incubação uma vez. Lave o C. slides algumas vezes em água por até 60 minutos com agitação suave a 22 ° Secar as lâminas usando uma centrífuga, e armazenar a 22 ° C.
- Para utilizar os slides regenerados, não é necessário pré-hibridizar-los novamente. Basta lavá-los em água seguido de isopropanol, seco e as lâminas direita antes de hibridização.
5. Resultados representativos:
Temos em grande parte seguido os procedimentos descritos para perfil de expressão de miRNA mundial em milhares de amostras, ou seja, RNAs isolados de zebrafish a espécime humana sob diversas condições. A Figura 1 mostra uma imagem digitalizada de um microarray de demonstrar sinais de hibridação muito precisa e forte na slide. O Relacionados Pearsonsobre os coeficientes técnicos entre réplicas de hibridização de microarrays são ~ 0.99 7, indicando excelente reprodutibilidade.
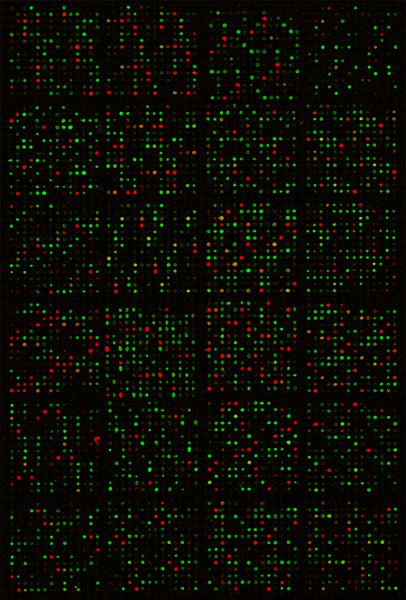
Figura 1 Imagem composta de uma lâmina de microarray miRNA digitalizados após hibridização. Manchas vermelhas resultou de hibridizações pelo DNA de referência, pontos verdes a partir da amostra de RNA DY547-rotulados, enquanto as manchas amarelas eram de hibridizações por ambos DNA e RNA para as mesmas sondas.
Discussão
Apesar dos avanços recentes nas tecnologias de seqüenciamento de profundidade, microarray continua a ser uma opção viável para high-throughput análise de DNA e RNA. Comparado ao seqüenciamento de profundidade, as experiências microarray são mais baratos, e um laboratório de biologia molecular típico pode executar a maioria dos experimentos e análise de dados in-house, o que permite flexibilidade e economiza tempo. No futuro, é provável microarrays adequado para interrogar intensamente conjuntos de genes, p...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
O trabalho foi suportado em parte pelo Instituto Nacional de Abuso de Drogas Center (P50 DA 011.806) e Exército dos Estados Unidos Departamento de Defesa (W81XWH-07-1-0183).
Materiais
| Name | Company | Catalog Number | Comments |
| Itens | Vendedor | Número de catálogo | Comentários |
|---|---|---|---|
| NCode Multi-Species miRNA Microarray Probe Set V2 | Invitrogen | MIRMPS201 | Desenhado com base nos miRBase Release 9.0 (Outubro de 2006). Ele contém ~ 1140 sem modificações, 34-44 nt oligonucleotídeos longos como sondas para voar worm,, peixe-zebra, rato, rato, e miRNAs humanos, e um número de sondas de controle interno, como snoRNAs. As sondas de miRNA são doublets das seqüências complementares de miRNAs maduros, daí o tamanho de ~ 44 nt. Para a análise de um pode se concentrar em miRNAs de um genoma particular (s) de interesse. |
| Trizol | Invitrogen | 15596018 | Temos também utilizado enriquecido, fração de RNA pequeno de rotulagem, embora total de amostras de RNA são mais rápidos e mais fáceis de preparar e de quantificar e adequado para aplicações a jusante como a análise de mRNA. |
| T4 RNA Ligase 1 | New England Biolabs | M0204L | |
| Ulysis Alexa Fluor 647 Kit Rotulagem de Ácido Nucleico | Invitrogen | U21660 | Este kit ou produtos similares podem ser usados para rotular amostras experimentais RNA ou um RNA de controlo (em vez de DNA de controle) também. |
| 5'-PCU-DY547-3 ' | Dharmacon | Feitos | Fração pequena do RNA pode ser igualmente marcada pela ligadura. |
| Colunas CentriSep | Separações Princeton | CS-901 | |
| GAPSII corrediça revestida | Corning | 40004 | Outros tipos de slides podem ser usados também. |
| Hibridização câmaras de microarray | Corning | 2551 ou 40080 | Outros tipos de câmaras de hibridação e lamínulas também deve funcionar. Utilização de máquinas de hibridização comercialmente disponíveis podem reduzir o tempo de hibridização significativamente, por exemplo, a ~ 2 horas. |
| Lifterslips | ThErmo / Erie Scientific | 25X60I-M5439-001-LS | |
| BlueFuse | BlueGenome | ||
| GeneSpring | Agilent |
Referências
- Ambros, V. The functions of animal microRNAs. Nature. 431, 350-355 (2004).
- Friedman, R. C., Farh, K. K., Burge, C. B., Bartel, D. P. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 19, 92-105 (2009).
- Chekulaeva, M., Filipowicz, W. Mechanisms of miRNA-mediated post-transcriptional regulation in animal cells. Curr. Opin. Cell Biol. 21, 452-460 (2009).
- Farazi, T. A., Spitzer, J. I., Morozov, P., Tuschl, T. miRNAs in human cancer. J. Pathol. 223, 102-115 (2011).
- Small, E. M., Olson, E. N. Pervasive roles of microRNAs in cardiovascular biology. Nature. 469, 336-342 (2011).
- Thomson, J. M., Parker, J., Perou, C. M., Hammond, S. M. A custom microarray platform for analysis of microRNA gene expression. Nat. Methods. 1, 47-53 (2004).
- Zhang, X., Xu, W., Tan, J., Zeng, Y. Stripping custom microRNA microarrays and the lessons learned about probe:slide interactions. Anal. Biochem. 386, 222-227 (2009).
- Griffiths-Jones, S., Saini, H. K., van Dongen, S., Enright, A. J. miRBase: tools for microRNA genomics. Nucl. Acids. Res. 36, D154-D158 (2008).
- Landgraf, P. A mammalian microRNA expression atlas based on small RNA library sequencing. Cell. 129, 1401-1414 (2007).
- Chiang, H. R. Mammalian microRNAs: experimental evaluation of novel and previously annotated genes. Genes. Dev. 24, 992-1009 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados