È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una tecnica di iniezione intraperitoneale nel pesce zebra adulto che riduce al minimo i danni al corpo e la mortalità associata
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Viene descritto un nuovo metodo di iniezione intraperitoneale (IP) nel pesce zebra adulto. Quando si maneggiano composti tossici come la doxorubicina, questa procedura è più efficace dei due metodi IP precedentemente riportati. La tecnica è progettata per essere facilmente adottata da ricercatori con esperienza limitata nel modello del pesce zebra.
Abstract
Il pesce zebra adulto (Danio rerio), che è geneticamente accessibile, viene impiegato come prezioso modello di vertebrato per studiare disturbi umani come la cardiomiopatia. L'iniezione intraperitoneale (IP) è un metodo importante che fornisce composti all'organismo per testare gli effetti terapeutici o generare modelli di malattia come la cardiomiopatia indotta da doxorubicina (DIC). Attualmente, esistono due metodi di iniezione IP. Entrambi i metodi hanno limitazioni quando si maneggiano composti tossici come la doxorubicina, che provocano effetti collaterali che si manifestano come gravi danni alla forma del corpo e morte dei pesci. Sebbene queste carenze possano essere superate con un'ampia formazione degli investigatori, è auspicabile un nuovo metodo di iniezione IP che abbia effetti collaterali minimi. In questo caso, viene riportato un metodo di iniezione IP unico in grado di gestire composti tossici. Una funzione cardiaca costantemente ridotta può risultare senza incorrere in una morte significativa dei pesci. La tecnica può essere facilmente padroneggiata dai ricercatori che hanno un'esperienza minima con il pesce zebra adulto.
Introduzione
Il pesce zebra (Danio rerio) ha guadagnato attenzione come modello sperimentale per lo studio delle malattie umane perché questo animale comprende un'elevata omologia genica e di organi con l'uomo, fecondazione esterna, facilità di manipolazione genetica e trasparenza del corpo nella prima maturità, che facilita una miriade di applicazioni di imaging1. A differenza del semplice processo di somministrazione di farmaci direttamente in acqua per embrioni e larve di pesce zebra, la somministrazione di farmaci a pesci zebra adulti presenta un'impresa più complessa e impegnativa2.
Nei pesci adulti, i composti possono essere somministrati attraverso tecniche di somministrazione passiva di farmaci, come la somministrazione diretta in acqua, o attraverso metodi di somministrazione orale di farmaci come il gavaging2. Altri approcci includono il rivestimento del mangime per pesci con i composti e la successiva alimentazione del pesce3 e la somministrazione diretta di farmaci insolubili in acqua a una concentrazione predeterminata, comprese le iniezioni retro-orbitali o intraperitoneali 4,5. La somministrazione intraperitoneale è preferita per gli studi in vivo di modelli di malattia grazie ai suoi distinti vantaggi farmacocinetici6. Questo metodo fornisce un'elevata concentrazione di farmaco e un'emivita prolungata all'interno della cavità peritoneale, offrendo un percorso efficace per la somministrazione del farmaco 7,8. L'approccio è comunemente utilizzato in contesti di ricerca per garantire un assorbimento e una distribuzione ottimali dei farmaci 9. Mentre i metodi basati sull'iniezione si dimostrano efficaci per la somministrazione singola, le iniezioni prolungate e ripetute spesso portano a danni al corpo e infezioni croniche2.
Attualmente, ci sono due metodi di iniezione IP nello zerbafish adulto 4,10. Tuttavia, entrambi i metodi hanno dei limiti nella somministrazione di composti tossici come la doxorubicina, che portano a gravi danni alla forma del corpo e alla mortalità dei pesci. Gli effetti collaterali possono complicare notevolmente l'interpretazione dei dati. Sebbene queste sfide possano essere affrontate con una formazione approfondita10, c'è una chiara necessità di un nuovo metodo di iniezione IP che riduca al minimo gli effetti collaterali.
In questo caso, il nostro obiettivo è quello di sviluppare un nuovo metodo di iniezione IP ottimizzato per l'efficace somministrazione di doxorubicina in zebrafish adulto, facilitando la generazione di modelli affidabili di cardiomiopatia indotta da doxorubicina (DIC) con danni corporei ridotti al minimo e mortalità associata.
Protocollo
Tutte le procedure condotte sono state approvate dal Comitato Istituzionale per la Cura e l'Uso degli Animali della Mayo Clinic, aderendo agli standard delineati nella "Guida per la cura e l'uso degli animali da laboratorio" (National Academies Press, 2011). Tutti i pesci zebra nello studio appartengono al ceppo Wild Indian Karyotype (WIK). I dettagli dei reagenti e delle attrezzature utilizzate per lo studio sono elencati nella tabella dei materiali.
1. Preparazione e conservazione della soluzione madre di doxorubicina
- Ottenere il brodo di doxorubicina da una fonte commerciale.
NOTA: La doxorubicina è sensibile alla luce, quindi acquistala in polvere e conservala in contenitori opachi per proteggerla dall'esposizione alla luce. Eseguire tutti i passaggi per la preparazione della polvere Dox all'interno di una cappa chimica. - Sciogliere completamente la polvere di Dox in acqua distillata e preparare una soluzione madre con una concentrazione finale di 5 mg/mL.
- Aliquotare il brodo dividendolo in provette da 1,5 mL.
- Avvolgere i tubi in un foglio di alluminio per proteggerli dall'esposizione alla luce.
- Conservare la soluzione aliquot Dox a 4 °C per la conservazione a breve termine (<1 mese) o a -20 °C per la conservazione a lungo termine10.
2. Raggruppare i pesci in base al loro peso corporeo
- Raggruppare i pesci con una differenza di peso corporeo inferiore al 10% per la successiva iniezione.
NOTA: Per risparmiare fatica in questa fase, i pesci con una varianza del peso corporeo inferiore al 10% sono classificati come della stessa taglia. - Lasciare digiunare il pesce per 24 ore prima dell'iniezione.
- Anestetizzare il pesce utilizzando acqua embrionale contenente 0,16 mg/mL di tricaina per 1 minuto.
- Togli il pesce dall'acqua con la tricaina e tampona entrambi i lati del corpo del pesce con carta da filtro pulita per rimuovere l'acqua in eccesso.
- Misurare e registrare il peso corporeo di ogni pesce, quindi rimettere prontamente il pesce in una vasca di recupero riempita con acqua dolce del sistema.
NOTA: L'iniezione di Dox è stata eseguita sui pesci dopo aver raggiunto i 3 mesi di età. In questo studio, i ricercatori hanno utilizzato pesci di età compresa tra 3 e 10 mesi. I BW del pesce zebra maturo del ceppo WIK possono variare da 0,2 g a 0,5 g. L'anestesia prolungata per più di 5 minuti, seguita da un'iniezione di Dox, ha portato a un'elevata mortalità dei pesci.
3. Preparazione dell'ago e della stazione per l'iniezione
- Determinare il volume di iniezione della soluzione madre Dox (ad es. 5 mg/mL) necessario per ciascun pesce in base al peso corporeo medio per raggiungere la dose target di 20 μg/g.
- Utilizzare la seguente formula per calcolare il volume di iniezione:
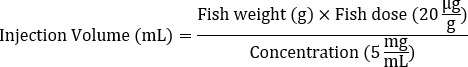
- Aggiungere 1x Hank's Balanced Salt Solution (HBSS) per diluire la soluzione Dox calcolata nella fase 1 per l'iniezione, raggiungendo un volume totale di 5 μl.
NOTA: Utilizzare una soluzione sfusa per ogni gruppo di pesci in base al loro peso corporeo e includere altri 3 pesci in ciascun gruppo per garantire che non vi sia carenza di soluzione iniettabile durante il corso dell'esperimento. - Picchiettare delicatamente la provetta e quindi microcentrifugare brevemente alla massima velocità per raccogliere la soluzione a temperatura ambiente per 10 s.
- Mettere la soluzione preparata sul ghiaccio e proteggerla dall'esposizione alla luce.
- Posizionare una capsula di Petri da 100 mm pulita con una spugna sotto un microscopio da dissezione, quindi regolare la messa a fuoco.
NOTA: La spugna contiene una scanalatura lunga 4 cm. La retrazione elastica della spugna fornirà al pesce supporto e manterrà il corpo del pesce in posizione. La spugna può essere riutilizzata. - Dotare una microsiringa da 10 μl di un ago smussato da 34 g.
- Sciacquare l'ago con 1x tampone HBSS per eliminare eventuali bolle e rimuovere potenziali ostruzioni dalla siringa.
- Misurare 5 μl della soluzione preparata al punto 4 per l'iniezione.
4. Procedura di iniezione IP Dox
- Mettere il pesce adulto in acqua con 0,16 mg/mL di tricaina per 1 minuto per indurre uno stato di incoscienza.
- Posizionare il pesce nella scanalatura della spugna incorporata con l'addome rivolto verso l'alto (Figura 1A).
- Inserire l'ago con un angolo vicino a 0°, partendo dal punto medio della pinna pettorale verso il lato posteriore della cavità cardiaca (Figura 1B).
NOTA: Evitare qualsiasi contatto con il cuore durante la procedura. - Dirigi l'ago verso la coda e vai sotto la pelle argentata.
NOTA: Posizionare l'ago in prossimità della pelle argentata, facendo attenzione a evitare graffi o forature. - Monitorare la punta dell'ago all'interno della cavità addominale durante l'intera operazione (Figura 1C).
NOTA: Evitare di danneggiare il fegato, l'intestino, la vescica natatoria e altri organi. Assicurarsi che l'ago raggiunga la fine dell'intestino, vicino al forame cloacale. - Erogare gradualmente e uniformemente la soluzione di Dox da 5 μl, quindi ritirare lentamente l'ago lungo il percorso originale per evitare perdite (Figura 1D).
- Monitorare la cavità addominale per la presenza di Dox osservando una colorazione rossa della soluzione di Dox (Figura 1E).
- Sposta rapidamente il pesce iniettato in una vasca di attraversamento pulita riempita con acqua fresca del sistema per aiutare il pesce a riprendersi.
NOTA: Tra un'iniezione e l'altra, sciacquare l'ago una volta con 1x tampone HBSS.
5. Gestione del pesce post-iniezione
- Reinserire il pesce nel sistema con la circolazione dopo l'iniezione.
- Digiunare tutti i pesci iniettati per altre 24 ore per facilitarne il recupero.
- Durante la prima settimana, tenete d'occhio i pesci. Rimuovere il pesce deceduto il prima possibile per evitare di infettare gli altri pesci.
NOTA: I decessi di pesci nelle prime 24 ore sono probabilmente dovuti a lesioni fisiche dovute all'iniezione o all'anestesia prolungata. Registra il numero di pesci per generare una curva di sopravvivenza. - Eseguire l'ecocardiografia per fenotipizzare il pesce iniettato con Dox a 56 giorni dopo l'iniezione11.
NOTA: Garantire l'uniformità delle condizioni e delle procedure per il corrispondente gruppo di controllo iniettato con la soluzione HBSS.
Risultati
In precedenza, sono state impiegate due metodiche intraperitoneali (IP) per la somministrazione di doxorubicina in zebrafish adulti 4,10. Nel metodo I, noto anche come metodo di iniezione IP classico come descritto da Kinkel et al.4, l'ago è stato inserito con un angolo di 45° rispetto alla linea mediana tra le pinne pelviche con l'addome rivolto verso l'alto. Nel metodo II, o metodo di iniezione IP alternativo come descritto da Ma et
Discussione
A differenza dei due metodi di iniezione IP esistenti 4,10, il nuovo metodo di iniezione IP è caratterizzato dalle seguenti caratteristiche distintive. In primo luogo, viene utilizzato un angolo di penetrazione dell'ago unico (vicino allo zero); in secondo luogo, l'ago penetra nel pesce attraverso una posizione unica, cioè un foro naturale sulla superficie ventrale di un pesce, che faciliterebbe l'iniezione; e infine, il movimento dell'ago è da anteri...
Divulgazioni
Nessuno.
Riconoscimenti
Questo studio è stato sostenuto dal NIH (HL107304 e HL081753) e dalla Mayo Foundation (Center for Biomedical Discovery and Cardiovascular Research Center) a XX. JL è finanziato dai fondi di ricerca fondamentale per le università centrali della Central South University, n. 56021702. Un ringraziamento speciale a Beninio Gore e Quentin Stevens per aver gestito l'impianto di zebrafish.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
Riferimenti
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126 (2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645 (2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894 (2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858 (2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567 (2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339 (2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479 (2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898 (2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon