Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методика внутрибрюшинной инъекции взрослым рыбкам данио, которая сводит к минимуму повреждение организма и связанную с ним смертность
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описан новый метод внутрибрюшинного (IP) введения взрослым рыбкам данио. При работе с токсичными соединениями, такими как доксорубицин, эта процедура более эффективна, чем два ранее описанных метода IP. Этот метод разработан таким образом, чтобы его можно было легко использовать исследователям с ограниченным опытом работы с моделью рыбок данио.
Аннотация
Взрослая рыбка данио рерио (Danio rerio), которая генетически доступна, используется в качестве ценной модели позвоночных для изучения заболеваний человека, таких как кардиомиопатия. Внутрибрюшинная инъекция (ВП) является важным методом, который доставляет соединения в организм либо для тестирования терапевтических эффектов, либо для создания моделей заболеваний, таких как доксорубицин-индуцированная кардиомиопатия (ДВС-синдром). В настоящее время существует два метода внедрения IP. Оба метода имеют ограничения при работе с токсичными соединениями, такими как доксорубицин, что приводит к побочным эффектам, проявляющимся в виде серьезного повреждения формы тела и гибели рыб. Несмотря на то, что эти недостатки могут быть преодолены путем обширной подготовки следователей, желателен новый метод инъекции IP, который имеет минимальные побочные эффекты. В этой статье сообщается об уникальном методе инъекции IP, который способен работать с токсичными соединениями. Постоянное снижение сердечной функции может привести к значительному падежу рыбы. Методику могут легко освоить исследователи, имеющие минимальный опыт работы со взрослыми рыбками данио.
Введение
Рыбка данио-рерио (Danio rerio) привлекла внимание в качестве экспериментальной модели для изучения болезней человека, потому что это животное включает в себя высокую гомологию генов и органов человека, внешнее оплодотворение, простоту генетических манипуляций и прозрачность тела в раннем возрасте, что облегчаетмножество приложений визуализации. В отличие от простого процесса доставки лекарств непосредственно в воду для эмбрионов и личинок данио-рерио, введение лекарств взрослым рыбкам данио представляет собой более сложную и трудную задачу.
У взрослых рыб соединения могут доставляться с помощью пассивных методов доставки лекарств, таких как прямое введение в воду, или с помощью пероральных методов доставки лекарств, таких как гаваган2. Другие подходы включают покрытие корма рыб соединениями и последующее кормление рыб3, а также непосредственное введение нерастворимых в воде лекарственных препаратов в заданной концентрации, включая ретроорбитальные или внутрибрюшинные инъекции4,5. Внутрибрюшинное введение предпочтительно для исследований in vivo моделей заболеваний из-за его явных фармакокинетических преимуществ6. Этот метод обеспечивает высокую концентрацию препарата и увеличенный период полувыведения в брюшной полости, предлагая эффективный путь доставки препарата 7,8. Этот подход обычно используется в исследовательских целях для обеспечения оптимального абсорбции и распределения лекарственных средств 9. В то время как методы, основанные на инъекциях, оказываются эффективными при однократном родоразрешении, длительные и повторные инъекции часто приводят к повреждению организма и хроническойинфекции.
В настоящее время существует два метода инъекции IP у взрослой рыбы-зерба 4,10. Тем не менее, оба метода имеют ограничения при доставке токсичных соединений, таких как доксорубицин, что приводит к серьезному повреждению формы тела и гибели рыб. Побочные эффекты могут значительно усложнить интерпретацию данных. Несмотря на то, что эти проблемы могут быть решены с помощью интенсивногообучения10, существует явная потребность в новом методе инъекции IP, который сводит к минимуму побочные эффекты.
Наша цель состоит в том, чтобы разработать новый метод инъекции IP, оптимизированный для эффективной доставки доксорубицина взрослым рыбкам данио, способствуя созданию надежных моделей кардиомиопатии (ДВС-синдрома), индуцированной доксорубицином, с минимальным повреждением организма и связанной с ним смертностью.
протокол
Все проводимые процедуры были одобрены Комитетом по уходу за животными и их использованию клиники Майо в соответствии со стандартами, изложенными в «Руководстве по уходу и использованию лабораторных животных» (National Academies Press, 2011). Все рыбки данио, участвовавшие в исследовании, относятся к штамму дикого индийского кариотипа (WIK). Подробная информация о реактивах и оборудовании, использованном для исследования, приведена в Таблице материалов.
1. Приготовление и хранение стокового раствора доксорубицина
- Получите запас доксорубицина из коммерческого источника.
ПРИМЕЧАНИЕ: Доксорубицин светочувствителен, поэтому приобретайте его в виде порошка и храните в непрозрачных контейнерах, чтобы защитить его от воздействия света. Выполните все этапы приготовления порошка Dox в химическом колпаке. - Полностью растворите порошок Dox в дистиллированной воде и приготовьте стоковый раствор с конечной концентрацией 5 мг/мл.
- Аликвотируйте бульон, разделив его на пробирки объемом 1,5 мл.
- Оберните трубки алюминиевой фольгой, чтобы защитить их от воздействия света.
- Хранить раствор аликвота Докс при температуре 4 °С при кратковременном хранении (<1 месяц), или при -20 °С при длительном хранении10.
2. Группировка рыб в соответствии с массой тела
- Сгруппируйте рыбу с разницей в МТ менее 10% вместе для последующего впрыска.
ПРИМЕЧАНИЕ: Чтобы сэкономить усилия на этом этапе, рыба с отклонением BW менее 10% относится к категории одного размера. - Дайте рыбе голодать в течение 24 часов перед инъекцией.
- Обезболите рыб с помощью эмбриональной воды, содержащей 0,16 мг/мл трикаина, в течение 1 минуты.
- Вытащите рыбу из воды с помощью трикаина и промокните обе стороны тела рыбы чистой фильтровальной бумагой, чтобы удалить лишнюю воду.
- Измерьте и запишите МТ каждой рыбы, а затем немедленно верните рыбу в резервуар для восстановления, наполненный пресной водой.
ПРИМЕЧАНИЕ: Инъекция докса проводилась рыбам после достижения 3-месячного возраста. В этом исследовании ученые использовали рыб в возрасте от 3 до 10 месяцев. МТ зрелых рыбок данио рерио штамма WIK может варьироваться от 0,2 г до 0,5 г. Длительная анестезия продолжительностью более 5 минут с последующей инъекцией Dox привела к высокой смертности рыбы.
3. Подготовка иглы и станция для инъекции
- Определите объем ввода исходного раствора Dox (например, 5 мг/мл), необходимый для каждой рыбы, исходя из средней массы тела для достижения целевой дозы 20 г/г.
- Используйте следующую формулу для расчета объема инъекции:
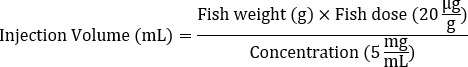
- Добавьте 1x сбалансированный раствор соли Хэнка (HBSS) для разбавления раствора Dox, рассчитанного на шаге 1, для инъекций, достигнув общего объема 5 μл.
ПРИМЕЧАНИЕ: Используйте объемный раствор для каждой группы рыб в зависимости от их МТ и включите еще 3 рыбы в каждую группу, чтобы гарантировать, что не будет недостатка в растворе для инъекций в ходе эксперимента. - Осторожно постучите по пробирке, а затем кратковременно проведите микроцентрифугу на максимальной скорости, чтобы собрать раствор при комнатной температуре в течение 10 секунд.
- Поместите приготовленный раствор на лед и защитите его от воздействия света.
- Поместите чистую чашку Петри диаметром 100 мм с губкой под препарирующий микроскоп, затем отрегулируйте фокус.
ПРИМЕЧАНИЕ: Губка содержит углубление длиной 4 см. Эластичное втягивание губки обеспечит рыбе поддержку и удержит тело рыбы в нужном положении. Губку можно использовать повторно. - Вооружите микрошприц объемом 10 мкл иглой со скошенной массой 34 G.
- Промойте иглу 1x буфером HBSS, чтобы устранить любые пузырьки и удалить потенциальные закупорки из шприца.
- Отмерьте 5 мкл раствора, приготовленного на шаге 4, для инъекции.
4. Процедура инъекции IP Dox
- Поместите взрослую рыбу в воду с 0,16 мг/мл трикаина на 1 минуту, чтобы вызвать состояние потери сознания.
- Расположите рыбу в углублении встроенной губки брюшком вверх (рисунок 1А).
- Введите иглу под углом около 0°, начиная от средней точки грудного плавника по направлению к задней стороне сердечной полости (рис. 1В).
ПРИМЕЧАНИЕ: Избегайте любого контакта с сердцем во время процедуры. - Направьте иглу к хвосту и пройдите под серебристую кожу.
ПРИМЕЧАНИЕ: Расположите иглу в непосредственной близости от серебряной кожи, стараясь не царапать или не прокалывать. - Следите за кончиком иглы в брюшной полости на протяжении всей операции (Рисунок 1C).
ПРИМЕЧАНИЕ: Избегайте повреждения печени, кишечника, плавательного пузыря и других органов. Следите за тем, чтобы игла достигла конца кишечника, рядом с клоакальным отверстием. - Постепенно и равномерно дозируйте 5 мкл раствора Dox, затем медленно извлекайте иглу по исходной траектории, чтобы предотвратить утечку (Рисунок 1D).
- Следите за брюшной полостью на наличие Dox, наблюдая за красной окраской раствора Dox (рисунок 1E).
- Быстро переместите введенную рыбу в чистый резервуар, наполненный пресной водой, чтобы помочь рыбе восстановиться.
ПРИМЕЧАНИЕ: Между инъекциями промойте иглу один раз 1x HBSS буфером.
5. Постинъекционное управление рыбой
- Верните рыбу обратно в систему с циркуляцией после инъекции.
- Заточите всю введенную рыбу еще на 24 часа, чтобы облегчить ее восстановление.
- В течение первой недели внимательно следите за рыбой. Удалите умершую рыбу как можно скорее, чтобы не заразить других рыб.
ПРИМЕЧАНИЕ: Смертельные случаи среди рыб в течение первых 24 часов вероятны из-за физических травм от инъекции или длительной анестезии. Записывайте количество рыб, чтобы построить кривую выживаемости. - Выполните эхокардиографию для фенотипирования рыб, получавших инъекцию Dox, через 56 дней после инъекции11.
Примечание: Обеспечьте единообразие условий и процедур для соответствующей контрольной группы, в которую вводится раствор HBSS.
Результаты
Ранее для введения доксорубицинавзрослым рыбкам данио 4,10 применяли два внутрибрюшинных (ВП) метода. В методе I, также известном как классический метод инъекции IP, описанный Kinkel et al.4, игла вводилась под углом 45° к средней линии между брюшными п...
Обсуждение
В отличие от двух существующих способов внедрения IP 4,10, новый способ внедрения IP характеризуется следующими отличительными особенностями. Во-первых, используется уникальный угол проникновения иглы (близкий к нулю); во-вторых, игла проникает в рыбу чер?...
Раскрытие информации
Никакой.
Благодарности
Это исследование было поддержано NIH (HL107304 и HL081753) и Фондом Майо (Центр биомедицинских открытий и сердечно-сосудистых исследований) компании X.X. J.L. финансируется Фондами фундаментальных исследований для центральных университетов Центрального Южного университета, No 56021702. Особая благодарность Бенинио Гору и Квентину Стивенсу за управление заводом по выращиванию рыбок данио.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
Ссылки
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126 (2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645 (2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894 (2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858 (2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567 (2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339 (2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479 (2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898 (2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены