É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uma técnica de injeção intraperitoneal em peixe-zebra adulto que minimiza os danos corporais e a mortalidade associada
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Um novo método de injeção intraperitoneal (IP) em peixe-zebra adulto é descrito. Ao manusear compostos tóxicos como a doxorrubicina, esse procedimento é mais eficaz do que os dois métodos de IP relatados anteriormente. A técnica foi projetada para ser facilmente adotada por pesquisadores com experiência limitada no modelo de peixe-zebra.
Resumo
O peixe-zebra adulto (Danio rerio), que é geneticamente acessível, está sendo empregado como um valioso modelo de vertebrado para estudar doenças humanas, como a cardiomiopatia. A injeção intraperitoneal (IP) é um método importante que fornece compostos ao corpo para testar efeitos terapêuticos ou gerar modelos de doenças, como a cardiomiopatia induzida por doxorrubicina (CIVD). Atualmente, existem dois métodos de injeção de IP. Ambos os métodos têm limitações ao lidar com compostos tóxicos como a doxorrubicina, que resultam em efeitos colaterais que se manifestam como danos graves à forma do corpo e morte de peixes. Embora essas deficiências possam ser superadas por um extenso treinamento do investigador, é desejável um novo método de injeção de IP que tenha efeitos colaterais mínimos. Aqui, é relatado um método exclusivo de injeção de IP capaz de lidar com compostos tóxicos. A função cardíaca consistentemente reduzida pode resultar sem incorrer em morte significativa de peixes. A técnica pode ser facilmente dominada por pesquisadores que têm experiência mínima com peixes-zebra adultos.
Introdução
O peixe-zebra (Danio rerio) tem ganhado atenção como modelo experimental para o estudo de doenças humanas, pois esse animal engloba alta homologia gênica e orgânica em relação aos humanos, fertilização externa, facilidade de manipulação genética e transparência corporal até a maturidade precoce, o que facilita uma infinidade de aplicações de imagem1. Ao contrário do processo direto de entrega de medicamentos diretamente na água para embriões e larvas de peixe-zebra, a administração de medicamentos a peixes-zebra adultos apresenta um esforço mais intrincado e desafiador2.
Em peixes adultos, os compostos podem ser entregues por meio de técnicas passivas de administração de medicamentos, como administração direta na água, ou por meio de métodos orais de administração de medicamentos, como gavagem2. Outras abordagens incluem revestir alimentos para peixes com os compostos e, posteriormente, alimentar os peixes3, e administração direta de medicamentos insolúveis em água em uma concentração predeterminada, incluindo injeções retroorbitais ou intraperitoneais 4,5. A administração intraperitoneal é preferida para estudos in vivo de modelos de doenças devido às suas vantagens farmacocinéticas distintas6. Esse método proporciona uma alta concentração do fármaco e uma meia-vida prolongada dentro da cavidade peritoneal, oferecendo uma via eficaz para a administração do fármaco 7,8. A abordagem é comumente utilizada em ambientes de pesquisa para garantir a absorção e distribuição ideais de medicamentos 9. Embora os métodos baseados em injeção se mostrem eficientes para administração única, injeções prolongadas e repetidas geralmente levam a danos corporais e infecção crônica2.
Atualmente, existem dois métodos de injeção de IP em zerbafish adultos 4,10. No entanto, ambos os métodos têm limitações ao fornecer compostos tóxicos como a doxorrubicina, levando a graves danos à forma do corpo e à mortalidade dos peixes. Os efeitos colaterais podem complicar significativamente a interpretação dos dados. Embora esses desafios possam ser resolvidos com treinamento extensivo10, há uma clara necessidade de um novo método de injeção de IP que minimize os efeitos colaterais.
Aqui, nosso objetivo é desenvolver um novo método de injeção de IP otimizado para a entrega eficaz de doxorrubicina em peixes-zebra adultos, facilitando a geração de modelos confiáveis de cardiomiopatia induzida por doxorrubicina (CIVD) com danos corporais minimizados e mortalidade associada.
Protocolo
Todos os procedimentos realizados foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Mayo Clinic, aderindo aos padrões descritos no 'Guia para o Cuidado e Uso de Animais de Laboratório' (National Academies Press, 2011). Todos os peixes-zebra do estudo pertencem à cepa Wild Indian Karyotype (WIK). Os detalhes dos reagentes e do equipamento usado para o estudo estão listados na Tabela de Materiais.
1. Preparação e armazenamento da solução-mãe de doxorrubicina
- Obtenha o estoque de doxorrubicina de uma fonte comercial.
NOTA: A doxorrubicina é sensível à luz, portanto, adquira-a em pó e armazene-a em recipientes opacos para protegê-la da exposição à luz. Execute todas as etapas para a preparação do pó Dox dentro de uma capa química. - Dissolva completamente o pó de Dox em água destilada e prepare uma solução de estoque com uma concentração final de 5 mg / mL.
- Alicote o estoque dividindo-o em tubos de 1,5 mL.
- Enrole os tubos em papel alumínio para protegê-los da exposição à luz.
- Armazenar a alíquota da solução Dox a 4 °C para armazenamento a curto prazo (<1 mês) ou a -20 °C para armazenamento a longo prazo10.
2. Agrupar os peixes de acordo com seu peso corporal
- Agrupe os peixes com uma diferença de peso corporal inferior a 10% para injeção subsequente.
NOTA: Para economizar esforço nesta fase, os peixes com menos de 10% de variação do peso corporal são categorizados como do mesmo tamanho. - Deixe o peixe jejuar por 24 horas antes da injeção.
- Anestesiar os peixes com água embrionária contendo 0,16 mg/mL de tricaína por 1 min.
- Retire o peixe da água com tricaína e enxugue os dois lados do corpo do peixe com papel de filtro limpo para remover o excesso de água.
- Meça e registre o BW de cada peixe e, em seguida, devolva imediatamente o peixe a um tanque de recuperação cheio de água doce do sistema.
NOTA: A injeção de Dox foi realizada em peixes após atingirem 3 meses de idade. Neste estudo, os pesquisadores utilizaram peixes de 3 meses a 10 meses de idade. Os BWs do peixe-zebra maduro da linhagem WIK podem variar de 0,2 g a 0,5 g. A anestesia prolongada com duração superior a 5 min, seguida de uma injeção de Dox, levou a uma alta mortalidade de peixes.
3. Preparação da agulha e da estação de injecção
- Determine o volume de injeção da solução-mãe Dox (por exemplo, 5 mg / mL) necessário para cada peixe com base no peso corporal médio para atingir a dose desejada de 20 μg / g.
- Use a seguinte fórmula para calcular o volume de injeção:
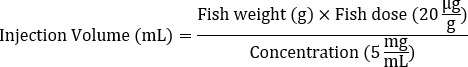
- Adicione 1x Hank's Balanced Salt Solution (HBSS) para diluir a solução Dox calculada na etapa 1 para injeção, atingindo um volume total de 5 μL.
NOTA: Utilize a solução a granel para cada grupo de peixes com base em seu peso corporal e inclua 3 peixes adicionais em cada grupo para garantir que não haja falta de solução injetável durante o curso do experimento. - Bata suavemente no tubo e, em seguida, microcentrifugue brevemente em velocidade máxima para coletar a solução em temperatura ambiente por 10 s.
- Coloque a solução preparada no gelo e proteja-a da exposição à luz.
- Coloque uma placa de Petri limpa de 100 mm com uma esponja embaixo de um microscópio de dissecação e ajuste o foco.
NOTA: A esponja contém uma ranhura de 4 cm de comprimento. A retração elástica da esponja fornecerá suporte ao peixe e manterá o corpo do peixe na posição. A esponja pode ser reutilizada. - Equipar uma microseringa de 10 μL com uma agulha biselada de 34 G.
- Lave a agulha com 1x tampão HBSS para eliminar quaisquer bolhas e eliminar possíveis bloqueios da seringa.
- Meça 5 μL da solução preparada na etapa 4 para a injeção.
4. Procedimento de injeção IP Dox
- Coloque o peixe adulto na água com 0,16 mg/mL de tricaína por 1 min para induzir um estado de inconsciência.
- Posicione o peixe na ranhura da esponja embutida com o abdômen voltado para cima (Figura 1A).
- Insira a agulha com um ângulo próximo a 0°, começando do ponto médio da nadadeira peitoral em direção ao lado posterior da cavidade cardíaca (Figura 1B).
NOTA: Evite qualquer contato com o coração durante o procedimento. - Direcione a agulha para a cauda e passe por baixo da pele prateada.
NOTA: Posicione a agulha próxima à pele prateada, tomando cuidado para evitar arranhões ou piercings. - Monitore a ponta da agulha dentro da cavidade abdominal durante toda a operação (Figura 1C).
NOTA: Evite danificar o fígado, intestinos, bexiga natatória e outros órgãos. Certifique-se de que a agulha atinja o final do intestino, próximo ao forame cloacal. - Dispense gradual e uniformemente a solução Dox de 5 μL e, em seguida, retire lentamente a agulha ao longo do caminho original para evitar qualquer vazamento (Figura 1D).
- Monitore a cavidade abdominal quanto à presença de Dox, observando uma coloração vermelha da solução de Dox (Figura 1E).
- Mova rapidamente o peixe injetado para um tanque de travessia limpo cheio de água fresca do sistema para ajudar o peixe a se recuperar.
NOTA: Entre as injeções, lave a agulha uma vez com 1x tampão HBSS.
5. Gestão pós-injecção dos peixes
- Retorne o peixe ao sistema com circulação após a injeção.
- Jejue todos os peixes injetados por mais 24 horas para facilitar sua recuperação.
- Durante a primeira semana, fique de olho nos peixes. Remova o peixe morto o mais rápido possível para evitar infectar os outros peixes.
NOTA: As mortes de peixes nas primeiras 24 horas são provavelmente devidas a lesões físicas causadas pela injeção ou anestesia prolongada. Registre o número de peixes para gerar uma curva de sobrevivência. - Realizar ecocardiografia para fenotipar os peixes injetados com Dox 56 dias após a injeção11.
NOTA: Garantir a uniformidade nas condições e procedimentos para o grupo de controle correspondente injetado com solução HBSS.
Resultados
Anteriormente, dois métodos intraperitoneais (IP) foram empregados para a administração de doxorrubicina em peixes-zebra adultos 4,10. No método I, também conhecido como método clássico de injeção IP, conforme descrito por Kinkel et al.4, a agulha foi inserida em um ângulo de 45° em relação à linha média entre as nadadeiras pélvicas com o abdome voltado para cima. No método II, ou no método de injeção IP alternativo des...
Discussão
Diferente dos dois métodos de injeção de IP existentes 4,10, o novo método de injeção de IP é caracterizado pelas seguintes características distintas. Em primeiro lugar, é usado um ângulo de penetração da agulha exclusivo (próximo a zero); em segundo lugar, a agulha penetra no peixe através de um local único, ou seja, um orifício natural na superfície ventral de um peixe, o que facilitaria a injeção; e, finalmente, o movimento da agulh...
Divulgações
Nenhum.
Agradecimentos
Este estudo foi apoiado pelo NIH (HL107304 e HL081753) e pela Fundação Mayo (Centro de Descoberta Biomédica e Centro de Pesquisa Cardiovascular) para X.X. J.L. é financiado pelos Fundos de Pesquisa Fundamental para as Universidades Centrais da Universidade Central do Sul, nº 56021702. Agradecimentos especiais a Beninio Gore e Quentin Stevens por gerenciar a instalação de peixe-zebra.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 μL NanoFil-syringe | World Precision Instruments, Inc | NANOFIL | injection tool |
| 34 G needle | World Precision Instruments, Inc | NI34BV-2 | injcetion tool |
| 60 mm Petri dish | fisher scientific/fisherbrand | FB0875713A | placing the sponge |
| Dissecting microscope | Nikon | SMZ800 | Injceting the Dox |
| Doxorubicin hydrochloride | Sigma | D1515-10MG | drug for creating DIC model |
| Echocardiography | VISUAL SONICS | Vevo 3100 | measuring cardiac function |
| Foam Sponge | Jaece Industries | L800-D | placing the fish |
| Hank's balanced salt solution (HBBS) | Thermo Fisher | 14025076 | Vehicle for Dox |
| Microcentrifuge | southernlabware | MyFuge/C1012 | collect the Dox solution |
| Precision Balance Scale | Torbal | AD60 | Digital scales |
| Tricaine | Argent | MS-222 | Anesthetizing fish |
| Tube | Eppendorf | 1.5 mL | storage |
| vevo LAB software | FUJIFILM VISUAL SONICS | 5.6.0 | quantification of the heart |
Referências
- Tavares, B., Lopes, S. S. The importance of Zebrafish in biomedical research. Acta Medica Portuguesa. 26 (5), 583-592 (2013).
- Dang, M., Henderson, R. E., Garraway, L. A., Zon, L. I. Long-term drug administration in the adult zebrafish using oral gavage for cancer preclinical studies. Disease Model Mech. 9 (7), 811-820 (2016).
- Sciarra, J. B., Tyler, A., Kolb, A. A gelatin-based diet for oral dosing juvenile to adult zebrafish (Danio rerio). Lab Animal Sci Prof. , 32-35 (2014).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126 (2010).
- Pugach, E. K., Li, P., White, R., Zon, L. Retro-orbital injection in adult zebrafish. J Vis Exp. (34), e1645 (2009).
- Liu, J., et al. Intraperitoneally delivered mesenchymal stem cells alleviate experimental colitis through THBS1-mediated induction of IL-10-competent regulatory B cells. Front Immunol. 13, 853894 (2022).
- De Smet, L., Ceelen, W., Remon, J. P., Vervaet, C. Optimization of drug delivery systems for intraperitoneal therapy to extend the residence time of the chemotherapeutic agent. The Scientific World Journal. 2013, 720858 (2013).
- Dakwar, G. R., et al. Nanomedicine-based intraperitoneal therapy for the treatment of peritoneal carcinomatosis-Mission possible. Adv Drug Deliv Rev. 108, 13-24 (2017).
- Al Shoyaib, A., Archie, S. R., Karamyan, V. T. Intraperitoneal route of drug administration: should it be used in experimental animal studies. Pharmaceutical Res. 37, 1-17 (2020).
- Ma, X., Ding, Y., Wang, Y., Xu, X. A doxorubicin-induced cardiomyopathy model in adult zebrafish. J Vis Exp. (136), e57567 (2018).
- Wang, L. W., et al. Standardized echocardiographic assessment of cardiac function in normal adult zebrafish and heart disease models. Disease Model Mech. 10 (1), 63-76 (2017).
- Christidi, E., Brunham, L. R. Regulated cell death pathways in doxorubicin-induced cardiotoxicity. Cell Death Dis. 12 (4), 339 (2021).
- Zhu, W., Shou, W., Payne, R. M., Caldwell, R., Field, L. J. A mouse model for juvenile doxorubicin-induced cardiac dysfunction. Pediatric Res. 64 (5), 488-494 (2008).
- Podyacheva, E. Y., Kushnareva, E. A., Karpov, A. A., Toropova, Y. G. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician. Frontiers Pharmacol. 12, 670479 (2021).
- Chaoul, V., et al. Assessing drug administration techniques in zebrafish models of neurological disease. Int J Mol Sci. 24 (19), 14898 (2023).
- Lu, X., Lu, L., Gao, L., Wang, Y., Wang, W. Calycosin attenuates doxorubicin-induced cardiotoxicity via autophagy regulation in zebrafish models. Biomed Pharmacother. 137, 111375 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados