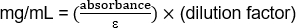Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Panoramica
Fonte: Frances V. Sjaastad1,2, Whitney Swanson2,3e Thomas S. Griffith1,2,3,4
1 Programma di laurea in microbiologia, immunologia e biologia del cancro, Università del Minnesota, Minneapolis, MN 55455
2 Centro di Immunologia, Università del Minnesota, Minneapolis, MN 55455
3 Dipartimento di Urologia, Università del Minnesota, Minneapolis, MN 55455
4 Masonic Cancer Center, Università del Minnesota, Minneapolis, MN 55455
Gli anticorpi policlonali sono definiti come una raccolta di anticorpi diretti contro diversi determinanti antigenici di un antigene o di più antigeni (1). Mentre gli anticorpi policlonali sono potenti strumenti per identificare le molecole biologiche, c'è una limitazione importante: non sono in grado di distinguere tra antigeni che condividono determinanti antigenici. Ad esempio, quando l'albumina sierica bovina viene utilizzata per immunizzare un animale, le cellule B con Ig di superficie diversa risponderanno a diversi determinanti antigenici sull'albumina sierica bovina. Il risultato è una miscela di anticorpi nell'antiserum. Poiché l'albumina sierica bovina condivide alcuni epitopi con l'albumina sierica umana in regioni evolutivamente conservate della proteina, questo antisiero dell'albumina sierica anti-bovina reagirà anche con l'albumina sierica umana. Pertanto, questo antiserum non sarà utile per distinguere tra albumine sieriche bovine e umane.
Sono stati adottati diversi approcci per superare il problema della specificità degli antisieri policlonali. Uno è assorbendo gli anticorpi indesiderati facendo passare l'antiserum attraverso una colonna cromatografica di antigeni immobilizzati (2). Questo metodo è noioso e spesso incapace di rimuovere completamente gli anticorpi indesiderati. Un altro approccio è quello di isolare le singole cellule B produttrici di anticorpi ed espanderle in coltura. Tuttavia, come la maggior parte delle normali cellule non trasformate, le cellule B non sopravvivono in coltura a lungo termine.
Per superare l'incapacità delle cellule B di sopravvivere in coltura, un approccio è quello di preparare un ibridoma a cellule mieloma-B. Nel 1847, Henry Bence-Jones scoprì che i pazienti con mieloma multiplo, un tumore linfoide, producevano una grande quantità di anticorpi (3). Le cellule B in questi pazienti sono diventate maligne e crescono in modo incontrollabile. Poiché le cellule B maligne sono derivate da un singolo clone, sono identiche e producono solo un singolo tipo di anticorpo(cioèun anticorpo monoclonale o mAb). Tuttavia, la maggior parte di queste cellule del mieloma producono anticorpi di specificità sconosciute. Nel 1975, fondendo una cellula di mieloma con una cellula B, Cesar Milstein e Georges Kohler sono riusciti a produrre un ibridoma che può essere coltivato indefinitamente in vitro e produce un numero illimitato di anticorpi monoclonali di nota specificità antigenica (4). Il razionale alla base del loro approccio è quello di combinare le proprietà immortali della cellula mieloma e le proprietà di produzione di anticorpi della cellula B. La loro tecnica ha rivoluzionato la produzione di anticorpi e fornisce un potente mezzo per l'identificazione e la purificazione di molecole biologiche utilizzando anticorpi monoclonali.
Generalmente, la preparazione di un anticorpo monoclonale richiede diversi mesi. La procedura generale include i seguenti passaggi:
- Immunizzazione e screening del titolo anticorpale
- Fusione di cellule B produttrici di anticorpi e cellule di mieloma
- Crescita selettiva dell'ibridoma
- Screening degli ibridomi per la produzione dell'anticorpo monoclonale desiderato
- Clonazione limitando la diluizione - un processo in cui le cellule vengono diluite a una concentrazione per consentire statisticamente di aggiungere meno di 1 cellula ai pozzetti di una piastra a 96 pozzetti. Alcuni pozzedi finiranno con 0 cellule e alcuni avranno 1 cella. I pozzeggi con seme con 1 cellula alla fine cresceranno in una popolazione monoclonale di cellule.
- Crescita dell'ibridoma e preparazione dell'anticorpo monoclonale
Questo protocollo si concentra sull'ultimo passo: la crescita dell'ibridoma e la preparazione dell'anticorpo monoclonale. L'anticorpo viene purificato dal surnatante di coltura mediante precipitazione del solfato di ammonio (spesso indicato come salatura) - un metodo comunemente usato per rimuovere le proteine da una soluzione. Le proteine in soluzione formano legami idrogeno, insieme ad altre interazioni idrofile, con l'acqua attraverso i loro gruppi polari e ionici esposti. Quando vengono aggiunte concentrazioni di ioni piccoli e altamente carichi (come ammonio o solfato), questi gruppi competono con le proteine per legarsi all'acqua. Questo rimuove le molecole d'acqua dalla proteina e diminuisce la sua solubilità, con conseguente precipitazione della proteina.
Procedura
Nota: La tecnica di coltura cellulare sterile deve essere mantenuta quando si maneggiano le cellule di ibridoma e il mezzo in modo sterile (ad esempio, in un armadio di biosicurezza) fino alle fasi di purificazione degli anticorpi.
1. Scongelamento delle cellule di ibridoma congelato
- Incubare il flaconcino contenente le cellule di ibridoma congelate in un bagno d'acqua a 37°C fino a quando non si è appena scongelato (circa 2 minuti).
- Aggiun
Risultati
Utilizzando questo protocollo, abbiamo ottenuto i seguenti risultati con diversi ibridomi:
Ibridoma: RB6-BC5 (ratto anti-topo Ly6C/Ly6G (Gr1) IgG2b, κ mAb)
OD280 - 1,103
(1.103/1.43) (20) = 15,42 mg/ml
Ibridoma: GK1.5 (ratto anti-mouse CD4 IgG2b, κ mAb)
OD280 - 0,485
(0.485/1.43) (20) = 6,78 mg/ml
Log in or to access full content. Learn more about your institution’s access to JoVE content here
Applicazione e Riepilogo
La procedura sopra descritta è un modo semplice e diretto per purificare gli anticorpi monoclonali dal surnatante della coltura dell'ibridoma. È importante ricordare, tuttavia, che il solfato di ammonio precipiterà altre proteine che potrebbero essere nel surnatante di coltura. Di conseguenza, le concentrazioni di anticorpi determinate dalle misurazioni dell'assorbanza sono stime. L'utente potrebbe voler valutare la purezza del campione dializzato eseguendo una piccola quantità su un gel di poliacrilammide SDS. Il mA...
Riferimenti
- Lipman NS, Jackson LR, Trudel LJ, Weis-Garcia F. Monoclonal versus polyclonal antibodies: distinguishing characteristics, applications, and information resources. ILAR Journal, 46 (3), 258-268 (2005).
- Arora S, Ayyar BV, O'Kennedy R. Affinity chromatography for antibody purification Methods Mol Biol. 1129, 497-516 (2014).
- Henry BJ. On a new substance occurring in the urine of a patient with mollities ossium. Philosophical Transactions of the Royal Society of London. 138, 55-62 (1848).
- Köhler G and Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity". Nature. 256, 495-497 (1975).
Vai a...
Video da questa raccolta:

Now Playing
Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.5K Visualizzazioni

Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
92.9K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.9K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
238.1K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.4K Visualizzazioni

Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
78.8K Visualizzazioni

Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.8K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
43.1K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.6K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.2K Visualizzazioni

Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.3K Visualizzazioni

Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.4K Visualizzazioni