Method Article
ランダムDNAライブラリーを使用するプライマーフリーアプタマーの選択
要約
SELEXのプロトコールは、順番にランダムライブラリ領域に隣接する固定プライマー配列を必要とする結合リガンドの再生を必要とするそれぞれの選択の複数のラウンドを、含み。これらの固定プライマー配列は、選択プロセス(偽陽性と陰性)の妨げになることがあります。ここでは、プライマーのないプロトコルを提示する。
要約
アプタマーは、抗体1〜匹敵する親和性を持つターゲットにバインドすることができる高度に構造化されたオリゴヌクレオチド(DNAまたはRNA)です。彼らは、小分子から蛋白質と他の高分子2-4に、ターゲットの多種多様を認識するために指数濃縮(SELEX) によってリガンドの系統進化と呼ばれる試験管内選択プロセスにおけるを通して識別されます。アプタマーは、よくインビボ診断および/または治療用途のために適しているプロパティがあります:優れた特異性と親和性に加えて、それらが容易に合成され、より厳密な処理条件を生き残る、それらは不完全に免疫原性であり、そしてそれらの比較的小さいサイズではの容易な侵入が発生する可能性が組織。
彼らは通常、それぞれの側に〜40 ntの長い無作為地域プラス〜20ヌクレオチドの固定プライマー部位を有する核酸のライブラリーから選択されるので、標準のSELEXプロセスを通じて識別されるアプタマーは、通常、約80ヌクレオチド(nt)を含む。バイオインフォマティクスのアプローチは、固定の配列が選択5の後にアプタマーの構造に大きく貢献していないことを示唆しているが、固定されたプライマー配列は、このように〜ほぼライブラリー配列の50%を含むことができるため、肯定的または否定的選択プロセス3のアプタマーの同定を危険にさらす可能性があります。 。これらの潜在的な問題に対処するために、プライマーの配列は、相補的なオリゴヌクレオチドによってブロックまたはSELEX 6のラウンド中に、異なるシーケンスの途中に切り替え、またはそれらは6月9日NT 7、8にトリミングされているされています。温とグレー9は 、プライマー、フリーのゲノムSELEX法を設計したプライマーの配列は完全に選択する前に、ライブラリから削除され、その後、選択されたゲノム断片の増幅を可能にするために再生した。しかし、テクニックを採用する、ユニークなゲノムライブラリーは、限られた多様性を有している、構築する必要があり、選択のラウンド後の再生は、リニア再増幅のステップに依存しています。また、高効率のパーティショニングを使用して固定されたプライマー配列によって引き起こされる問題を回避する努力は、PCR増幅10に関する問題で満たされている。
我々は大幅にSELEX手続きを簡素化し、効果的プライマー干渉問題11,12を排除プライマーフリー(PF)の選択方法を開発した。プロトコルは、簡単な方法で動作します。ライブラリの中心的なランダムな領域は、余分なフランキング配列なしで精製され、適切なターゲット(精製されたタンパク質またはそのような細胞株などの複雑な混合物に、例えば)にバインドされています。その後、バインドされたシーケンスは、得られた隣接配列と再会し、選択したサブライブラリーを生成するために再増幅されています。例として、ここでは、S100B、黒色腫のためのタンパク質マーカーにアプタマーを選択する。選択の数ラウンド後に10 -8 Mの範囲を、そして我々はアプタマーは、サンドイッチバインディング形式で効果的に機能することを示している-結合アッセイは、10 -7でのKdのを示した。
プロトコル
1。プライマーフリーセレクションプロトコルの簡単な説明
二本鎖DNAライブラリーは、2つのプライマー領域に挟まれた30ヌクレオチドの中心的なランダムなドメイン名を含むように対応するオリゴヌクレオチド(図1、2、ステップ)、、でPCRを用いて構築した。僅かに異なる二つの"プライマーフリー"(PF)のプロトコルが開発されました。二本鎖DNAのライブラリでは、5' - regionはエンドヌクレアーゼNt.BstNBI用エンドヌクレアーゼ"ニック"のサイトが含まれ、この酵素は、dsDNAを認識しますが、DNA基質の片方の鎖だけを切断する。二本鎖DNAライブラリーの3'領域には、3'末端(PF 1)だけでなく、BspMIでCCを残し、dsDNAを認識するだけで、片方の鎖だけを切断するエンドヌクレアーゼNt.BbvCIのための別の"ニック"のサイトを、含まれています(PF 2)追加の3'ヌクレオチドを残して両方の鎖を切断するエンドヌクレアーゼ制限部位、。選択のその後のラウンドのためにPF 2プロトコルを採用し、そして、我々は一般的に最初はPF 1プロトコルを採用しています(下記参照のが容易に選択プロセス中に生成フラグメントを分離するため)。
5' - pN30 - CC - 3'断片(32 + -フラグメントを指定)および5' - pN30 - 3の30 NTの断片(30 + -フラグメントを指定)32 NTは、それぞれNt.BbvCI / NTによって生成された。BstNBIまたは二本鎖DNAのライブラリのBspMI / Nt.BstNBI開裂、およびゲル精製。 32 + -断片は3'末端にCC隣接配列(PF 1)、30ヌクレオチドのランダムなドメインが含まれています。 30 + -フラグメント(PF 2)わずか30 NTランダムドメインのシーケンスで構成されています。 "自己橋"66 - 断片(5'および3'フランキング配列とランダムN30領域を含む)ゲル精製(Nt.BbvCIまたはNt.BstNBIだけアッパー"+"鎖を切る)することにより得た。この自己ブリッジはPF 1プロトコルで直接得られる、または生成され、PF 2プロトコル(図1および2、ステップb)のためにのみNtBbv.CIまたはNt.BstNBIでライブラリーDNAを切断した後、単離することができる。 32 + - または32 + -フラグメントは、フラグメントは、タンパク質や細胞に結合できるように精製された蛋白質または培養メラノーマ細胞とともにインキュベートし、次いで未結合フラグメントは、(図1および2、ステップc)離れて洗浄した。バインドまたは選択されたフラグメントは、プライマー領域の再生成に使用されていました。
ハイブリダイゼーション/ライゲーション反応では、自己のブリッジを作製し、32と同時に精製+ - と30 + -フラグメントの精製、5' -末端のプライマーは、ライブラリーの構築と3'末端プライマーを交換した場合と同じになったまた、3'末端(図1および図2、ステップd)で追加SP6転写プロモーターを含んで一致プライマーと。ハイブリダイゼーション/ライゲーション反応の産物をin vitro RNA転写(図1および2、ステップe) のために使用されていました。 RNAの転写に続いて、連結されたDNAは、(選択されていない自己ブリッジのDNA断片を含む)私は干渉背景の配列を除去するためDNase処理によって消化した。逆転写(RT)- PCRのデータは、プライマー、再生製品が効率的に選択の"ラウンド"(図1および図2、ステップF)を構成する、再増幅されたことが示されている。無RTコントロールPCRで高いサイクル数で示されるバックグラウンドの増幅が完全に追加のDNase Iによる消化によって除去し、我々が日常的に採用して低サイクル数、後に検出可能ではないことができます。
選択中の7ラウンドの後、アプタマーは結合特性のために特徴づけられた。のKdのは、10 -7 10 -8 Mの範囲(図3)のすべてだった。結合アッセイでは、アプタマーの様々なペアは、S100Bタンパク質上の異なるサイトを対象としていることを示し、添加剤の結合を示した。そこで、蛍光タグ付き第二アプタマーを用いて、ガラスマイクロアレイ(Codelinkスライド)、で、50 nmの金ナノ粒子(;図3 AuNPs)に結合された第2のアプタマーを用いて誘導体化金ナノワイヤーの両方で、"サンドイッチ"結合アッセイにおいてアプタマーのペアをテストした。どちらの場合も、結合特異性は高かった。Codelinkのマイクロアレイでは、ないサンドイッチ結合はKdを決定における添加剤の結合は認められなかったアプタマーでは観察されなかった。誘導体化されたナノワイヤーで我々は、実質的に非標的タンパク質への結合、および個々のサンドイッチ複合体がアプタマー結合AuNPs(図3)を介して観察することができるが観察されなかった。
2。材料
2.1。 PFのDNAライブラリーと結合フラグメントの再増幅の世代
詳細は、パンとクローソン、2009年に記載されて、パンら、2008。。
2.2。蛋白質に基づく選定を精製
- 20mMトリス- HCl、pH7.4の
- 32 + -フラグメントと30 + -フラグメント
- 選択バッファー(2.5mMのCaCl 2を 、1Xリン酸のMgCl 2の緩衝生理食塩水の5mM、pH7.4の、ギブコ社)
- Ni - NTAアガロースビーズ(Qiagen社)
- ポリプロピレンカラム(Qiagen社)
- 結合バッファー(50mMののNa 2HPO 4 -のNaH 2 PO 4、pH7.2、150mMのNaCl)
- 結合バッファーでS100Bタンパク質を精製、表明(5μg/μLの)
- フェノール:クロロホルム:IAA(pHは7.9、Ambion社)
- 3 M NAAC、液(pH5.2)
- 100%、および70%エタノール
2.3。 TOPOクローニングと選択した二本鎖DNAライブラリーのシークエンス解析
- 第 7 回ラウンド選択したPCR産物(追加のラウンドは、アプタマーの結合の最適化を継続して行うことができます)
- をpCR2.1 - TOPOベクター(Invitrogen)
- DH5構成細胞(Invitrogen社)
- プラスミドミニキット(キアゲン社)
- M13フォワードプライマー
- InformaxのベクターNTI(Invitrogen社)
2.4。アプタマーの結合特性
- アプタマーとコントロールのオリゴ(N 30 CCとN 30、IDT)
- T4ポリヌクレオチドキナーゼ(New England Biolabs社)
- γ- 32 P - ATP(3000 Ciの/ミリモル、10μCiの/ ml)を
- 結合バッファーで精製S100B(5μg/μLの)
2.5。精製S100Bタンパク質と選択されたアプタマーとサンドイッチ結合アッセイ
- 第1回アプタマーは、Auナノワイヤーは)A.)Codelinkマイクロアレイのスライドまたはbのいずれかに結合させた。
- 精製S100Bのために70μlの0.125μMのどちらかに希釈したタンパク質、)またはbの場合は50μlの1μM)。
- 第2アプタマーは、どちらかA.で標識した)CodelinkアレイスライドのAlexafluor 546、またはb)誘導体化金ナノワイヤーを用いた研究のための50 nmのAuNPsに結合。
3。の方法
3.1。 PF DNAライブラリーの生成
パンら、2008;。アプタマーを選択するための詳細な方法とプロトコルは、パンとクローソン、2009年に見つけることができます。
3.2。精製されたS100Bタンパク質を使用してアプタマーの選択
人間のS100カルシウム結合タンパク質B(S100B.ジーンID#6285)をターゲットとして使用されました。彼の6タグS100Bタンパク質(全長の98アミノ酸は)QIAexpressionistシステムを使用して発現させ、精製した。 (QIAGEN)。必要に応じまたは指示されれば、彼の6 -タグを酵素的に除去することができます。選択のラウンドの間に、各ステップから1μLのサンプルは、全体的な結合効率を決定するために液体シンチレーション計測用に保存されました。
3.2.1。 PF図書館- DNA断片の調製
- 20mMトリス- HCl、pH7.4の40μLの32 +と30 +のフラグメントを再サスペンド。
- ヒート3 85分° C、および37にクールダウンを37℃のインキュベーター℃で3分間
- 選択バッファから760μL(生理食塩水2.5mMのCaCl 2を 、1Xリン酸の5 mMのMgCl 2緩衝液、pH7.4、GIBCO)を追加し、37℃で3分間インキュベート° Cは、その後10分間室温(RT)に備え置かなければならない。
- Ni - NTAアガロースビーズ(QIAGEN)選択バッファとプレ洗浄が含まれているカラムを通過、次に使用するまで室温で保管。
3.2.2。室温でNi - NTAアガロース - ビーズ結合S100Bの準備
- 3秒のためのNi - NTAアガロースビーズ400μLをスピンダウンし、上清を捨てる。
- 穏やかに5回ピペッティングして、結合緩衝液400μL(50mMののNa 2 HPO 4のNaH 2 PO 4、pH7.2、150mMのNaCl)でビーズを洗浄し、スピンダウンし、上清を捨てる。
- 二回ステップ2を繰り返します。
- 精製S100B(5μg/μLの、結合バッファーに懸濁)400μLを加え、穏やかに5回15分の合計3分毎にピペット。
- スピンダウンし、上清を捨てる。
- 軽く3回ピペッティングすることにより結合バッファー400μLでビーズ結合S100Bを洗浄し、スピンダウンし、上清を捨てる。
- 二回ステップ6を繰り返します。
3.2.3。 S100B -結合したアプタマーの選択
- 3.2.1からのビーズ結合S100Bに+ - の断片と30 - + 32を転送する。
- 15分間インキュベートし、穏やかにピペッティングにより穏やかに3分毎に混ぜる。
- 穏やかにピペッティングにより結合バッファー800μLとS100B - DNA複合体を洗浄し、スピンダウンし、上清を捨てる。
- 二回手順3を繰り返します。
3.2.4。 S100B -選択されたアプタマーの回収
- 200μLの20 mM Tris -塩酸液(pH7.4)、85℃の熱で3分間を追加° C、1分間攪拌し、スピンダウンし、上清を新しいチューブに移す。
- 一度ステップ1を繰り返し、そして上清を組み合わせる。
- 以前の出版物(11、12)から9月12日あたりのステップとして、選択されたDNA -フラグメントを精製する。
3.2.5。コンセンサスのアプタマーの配列の同定のためのTOPOのクローニングとシーケンシングの解析
- をpCR2.1 - TOPOベクター(Invitrogen社から)にPCR産物を選択した10 番目のラウンドのクローンを作成します。追加さらに詳細な選択が行われるようにクローニングを行うことができます。
- M13フォワードプライマー(我々はハーシー医療センターで分子遺伝学の中核施設を使用する)とシーケンス40から50までの単一コロニー。
- InformaxのベクターNTI(Invitrogen)を用いて選択された配列の位置を合わせます。
- アラインメントに基づいて、コンセンサス配列を決定する。
- コンセンサスのアプタマーは、統合されたDNAの技術から購入した。
3.3。選択されたアプタマーのペアとサンドイッチ結合アッセイ
3.3.1。マイクロアレイは、フォーマット蛍光標識した第2のアプタマーを用いた。
- コンセンサス1回目のアプタマーは、5' - amineC6部分を合成した。彼らはCodelink推奨プロトコルに従って、)15μMの最終濃度に印刷バッファーに懸濁し、DNAマイクロアレイ施設PSU、ユニバーシティパークにApogent発見マイクログリッドArrayerを使用してCodelink活性化されたスライド(GEヘルスケア/アマシャムバイオサイエンス社)上にスポットした。各スライドは、12アレイで印刷されました。
- ハイブリダイゼーションは2 × 8フォーマットのマイクロアレイハイブリダイゼーションカセット(配列に、TeleChemインターナショナル)で実施した。マイクロアレイのカセットは、蒸発を防ぐため、ヌクレアーゼフリー接着剤シーリングホイル(AlumaSeal II、研究プロダクツ国際)を用いて密封した。
- S100Bタンパク質を70μlの適切な濃度にPBSで希釈し、マイクロアレイのカセットのウェルに適用した。 Codelinkのスライド上に印刷さアプタマーの結合は、室温で1時間だった。カセットのウェルを個別にPBS + 5 mMのMgCl 2(PBSM)で3回洗浄し、過剰な洗浄緩衝液をブロットした。蛍光標識したアプタマーは、70μlの0.125μMにPBSMで希釈した後、℃で3分間、氷上で3分間に続いて85に加熱した。アプタマーは、マイクロアレイのカセットのウェルに適用し、そして室温で1時間インキュベートした。ウェルズは、再び個々にPBSMで3回洗浄した。解体カセットは、その後、広告全体のスライドはPBSMで洗浄した。スライドはその後、徹底的に遠心分離によって乾燥させ、スキャンパッカードバイオサイエンスScanArray 4000XL(パーキンエルマー)を用いてスキャンした。
3.3.2。 50 nmのAuNPsに結合第2アプタマーを用いて誘導体化されたナノワイヤーのフォーマット
ゴールドNWSは(長さは約5μM、直径320nmの)以前に公表されたプロトコール(13、14)以下の多孔質アルミナ膜内に定電流電着により合成した。多孔質膜が解散した場合において、ナノワイヤーは、1 mLのエタノールに再懸濁した。
述べたように、DNAは、統合DNA Technologiesから購入した。金ナノ粒子(50 nm)のテッドペラから購入した。チオール化DNAは1時間0.1 Mリン酸ナトリウムpH8.3中の100mMのDTTで切断してから、セントリ - スピン10カラムで精製した。
ゴールドNWSとNPSにアプタマーの添付ファイル
金ナノワイヤーの50μLのアリコートを0.5mLの非粘着遠心管に入れ、10 mMリン酸緩衝液、300mMのNaCl、pH7.4の中にリンスした。 5'末端(5時10 Tのスペーサー付き'末端)でのチオール化DNAを配線する0.4μMの最終濃度で添加した。サンプルを30分間攪拌し、50 mMリン酸緩衝液、5 mMのMgCl 2、pH7.2の10 mMリン酸緩衝液、300mMのNaCl、pH7.4の3倍で遠心分離(8100 g)で3回リンスした。 DNA被覆線は半分に薄めに100μlのBufferに再懸濁した。
DNA -誘導体化AuNPsは、1 mLの50 nmのAuNPsに50μlの100mMの第2アプタマーを(5'末端に10 Tののスペーサー付き)の追加、37℃に加熱℃で1時間で調製した。加熱に続いて、10mMリン酸ナトリウム緩衝液、1MのNaCl、pH 7.4に0.5時間の間隔で(100μL、150μL、128μLを25μLを2回、続いて)追加されました。コンジュゲートは、使用前に一晩37℃のヒートブロックに残っていた。サンプルは、5 mMのMgCl 2、pH 7.2を、50mMリン酸緩衝液で3回リンスした。コンジュゲートは120μlのBufferに再懸濁した。
NWSでサンドイッチハイブリダイゼーション
DNA被覆線、希釈1μlを、PCRチューブにバッファに追加されました。 S100Bタンパク質またはHtrA1制御のタンパク質(1μg/μLの)を50μlのBuffer(〜10月12日のタンパク質分子は、Auナノワイヤーの表面の平方メートル当たりの付加)に1μMの最終濃度が追加されました。サンプルは〜2時間攪拌します。電線は5 mMのMgCl 2、pH 7.2を、50mMリン酸緩衝液を遠心分離(8100 g)で3回洗浄し、各20μLAuNP / DNA複合体に再懸濁した。ワイヤーは2時間抱合体にボルテックスし、次いで過剰のナノ粒子を除去するために5 mMのMgCl 2、pH 7.2を、50mMリン酸緩衝液を遠心分離(1300 g)で5倍すすいだ。サンプルは、再懸濁し、20μLバッファおよびFE - SEM分析のためのAuコーティングSiウェハ上で乾燥。
ナノワイヤのFE - SEM像は5.00 kVの動作電圧のショットキー電界放出型電子源を用いて走査型電子顕微鏡レオ1530電界放出を使用して得られた。
4。代表的な結果
図1。 5' -プライマーフリー(PF 1)及びプライマーフリー(PF 2)プロトコル。
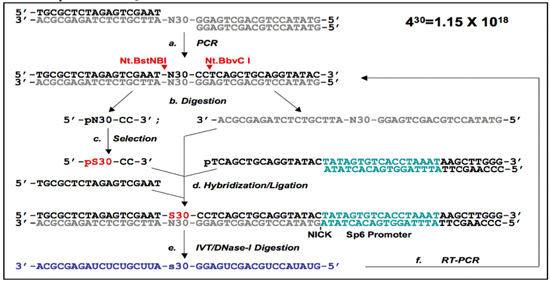
(A)PF 1 DNA -アプタマー選択プロトコル。ライブラリのオリゴヌクレオチドは、()一緒にアニール、及び二本鎖DNAライブラリーを得るためにPCR増幅に供される。 PF一本鎖DNAライブラリーから5'末端プライマーフリー(PF 1)ランダムな領域はNt.BstNBI / Nt.BbvCI消化(切断部位が赤い矢印でマークされている)し、ゲル精製することにより調製され、自己ブリッジ(黒い矢印)をゲル精製(B)によって単離される。選択後(c)に、選択された配列は、(pS30 - CCに指定)、それに対応するオリゴマーと自己ブリッジでハイブリダイズし、以前に削除されたプライマー領域を再生成するために連結される。この段階では、プライマーは3'末端(D)で、SP6プロモーターを含むが導入されています。これは、その後、選択された領域(e)を含むRNAを転写するために使用されます。最後に、RNAは、その後、排他的にRT - PCR(F)、および選択したサブライブラリを使用して(テンプレートDNAが消化される)を再増幅されると、選択の次のラウンドの準備ができています。
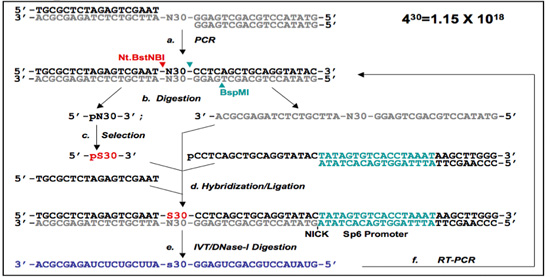
(B)PF 2 DNA -アプタマー選択プロトコル。ライブラリのオリゴヌクレオチドは、()一緒にアニールし、二本鎖DNAライブラリーを得るためにPCR増幅に供される。 PF一本鎖DNAライブラリーからのプライマーフリー(PF 2)ランダムな領域はNt.BstNBI / BspMI消化(切断部位は矢印で示されています)とゲル精製することにより調製される。自己ブリッジは、ゲル精製と相まって、PF 1プロトコルおよび/ またはNt.BstNBI(b)で始まるライブラリのシングル消化のいずれかによって分離されています。選択後(c)に、選択された配列は、(pS30を指定)、それに対応するオリゴマーと自己ブリッジとハイブリダイズし、以前に削除されたプライマー領域を再生成する連結される。 PF 1と同様に、プライマーは3'末端(D)で、SP6プロモーターを含むが導入されています。これは、その後、選択された領域(e)を含むRNAを転写するために使用されます。 RNAは、排他的にRT - PCR(f)を用いて再増幅し、選択したサブライブラリは、選択の次のラウンドの準備ができています。
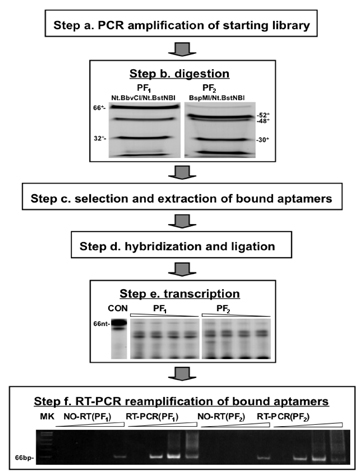
図2。 PF選択プロトコルの実践に模式図と実験結果/縮小。指定の手順は、図1に示すものに対応する。 PCR制限エンドヌクレアーゼで(ステップ)を(ように示される)によって構築されたPFライブラリの消化の後、消化物は、変性条件下で10%ゲル上PAGEにより分離した。 PF 1とPF 2選択のプロトコルで得られた対応するフラグメントは(ステップb)が表示されます。選択後(Cステップ)、結合したアプタマーは、それらに対応するオリゴマーと自己ブリッジとハイブリダイズし、以前に削除されたプライマー領域を再生成する連結される。 3'末端に、プライマーは、32 P標識RNAは、1の連結された製品、0.5、0.25、5μlの反応から0.125μlを用いて転写した。3' -端にSP6プロモーター(ステップd)を含むものを導入、となったされています変性条件下で6%のゲル(Eステップ)をPAGEで分離。転写産物はその後、21または28のPCRサイクルをcDNAに転写し、7の再増幅、14逆に、選択されていないランダムなDNA領域を除去するためDNaseで処理した。製品は、非変性条件下での8%ゲルでPAGEで分離した。 66 NTフラグメントは5'および3'フランキング配列内に再組み込みとして選択したpS30 - CCとpS30配列を含む全長の製品を表します。 PhiX174/HinfIマーカーの移行は、(ステップf)の左側に表示されます。コントロールには、逆転写(RT)ステップの省略が含まれています。このようなサンプルで、製品の少量の高サイクル数で見ることができる、これはおそらく完全に第2(または長時間)DNase処理のステップで除去することができます。
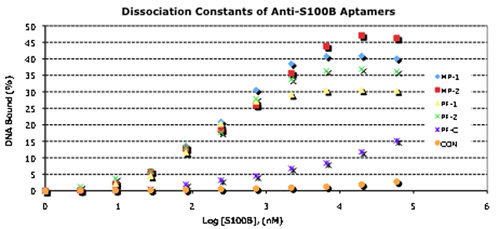
図3。選択されたアプタマーとサンドイッチの形式でそれらのペアを使用するの結合特性。
Kdの定量のためのAの濃度依存性32 P -アプタマーの結合。アプタマーは、5'末端のG - 32 P - ATP(3000Ci/mmol、〜10 MCI)とT4ポリヌクレオチドキナーゼ(New England Biolabs)を用いて標識した、と結合WAsは、前述のように決定する。
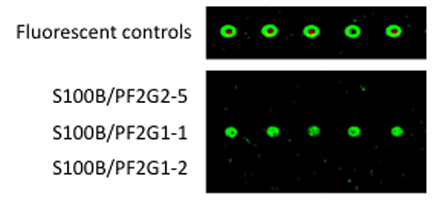
B. 5' -アミン誘導体第1のアプタマーは、マイクロアレイをCodelinkに結合させた。精製S100Bタンパク質が1日アプタマーにバインドされ、スライドが完全にすすぎ、および第2アプタマーは、第1アプタマーにバインドされてAlexaFluor546標識:S100Bの複合体。すすぎを通じて後、蛍光がScanArrayスキャナを用いて定量した。

C. 5' -チオール誘導体化第1のアプタマーは、標準的なチオール化学を用いてAuのナノワイヤーに結合させた。第2のアプタマーは、同じ方法で、50nmのAuNPsに結合させた。精製S100Bタンパク質(左)または精製HtrA1の制御蛋白質は、(右)その後、誘導体化ナノワイヤーを最初にバインドされています。徹底的に洗浄した後、第2アプタマー- 50 nmのAuNPsが続いて第1回-アプタマー-ナノワイヤーにバインドされていた:S100Bの複合体。すすぎを通じて後、結合したサンドイッチ複合体は、電界放出走査型電子顕微鏡を用いて可視化した。スケールバー= 1μmの。
開示事項
謝辞
我々は彼の助けのためのマイクロアレイの中核施設で、クレイグポールに感謝する。この作業は、IMATプログラムからNIH / NCIの助成金#CA118591によってサポートされていました。 SLDは、金融支援のためのペンシルベニアスペースグラントコンソーシアムのフェローシップを認めている。この出版物はまた、ペンシルベニア州立大学の材料研究所ナノファブリケーションネットワークと国立科学財団協力協定第0335765、コーネル大学と国家ナノテクノロジー基盤ネットワーク、によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Tris-HCl | |||
| HotMaster TAQ DNA Polymerase | 5 PRIME | ||
| dNTP Mix | Sigma-Aldrich | ||
| Acrylamide | Fisher Scientific | ||
| UltraPure 10X TBE Buffer | Invitrogen | ||
| Ammonium Persulfate | Bio-Rad | ||
| TEMED | Fisher Scientific | ||
| PhiX174 DNA/Hinf I DNA Marker | Promega Corp. | ||
| Ethidium Bromide | |||
| α-32P-dCTP | |||
| Phenol:ChCl3:IAA | Ambion | ||
| NaCl | |||
| Ethanol | |||
| Restriction Enzymes | New England Biolabs | ||
| Urea | Fisher Scientific | ||
| Photographic Film | ECE Scientific | ||
| PBS | GIBCO, by Life Technologies | ||
| CaCl2 | GIBCO, by Life Technologies | ||
| MgCl2 | GIBCO, by Life Technologies | ||
| Ni-NTA Agarose Beads | Qiagen | ||
| Polypropylene Column | Qiagen | ||
| NaHPO4 | |||
| NaAc | |||
| Detroit-551 cells | |||
| SK-MEL-31 cells | |||
| MEM | |||
| TrypLE Express | GIBCO, by Life Technologies | ||
| T4 DNA Ligase | New England Biolabs | ||
| Dimethyl Sulfoxide | Promega Corp. | ||
| Sp6 RNA Polymerase | Promega Corp. | ||
| RNase-Free DNase I | Promega Corp. | ||
| RNase Inhibitor | Promega Corp. | ||
| SensiScript Reverse Transcriptase | Qiagen | ||
| pCR-2.1-TOPO Vector | Invitrogen | ||
| DH5α Compotent Cells | Invitrogen | ||
| Plasmid Mini Kit | Qiagen | ||
| Vector NTI | Invitrogen | ||
| T4 Polynucleotide Kinase | New England Biolabs | ||
| γ-32P-ATP |
参考文献
- Kulbachinskiy, A. V. Methods for selection of aptamers to protein targets. Biochemistry (Moscow). 72, 1505-1518 (2006).
- Mairal, T. Aptamers: molecular tools for analytical applications. Anal Bioanal Chem. 390, 989-1007 (2008).
- Stoltenburg, R., Reinemann, C., Strehlitz, B. SELEX -- A (r)evolutionary method to generate high-affinity nucleic acid ligands. Biomolec Engineering. 24, 381-403 (2007).
- Que-Gewirth, N. S., Sullenger, B. A. Gene therapy progress and prospects: RNA aptamers. Gene Ther. 14, 283-2891 (2007).
- Cowperthwaite, M. C., Ellington, A. D. Bioinformatic analysis of the contribution of primer sequences to aptamer structures. J Mol Evol. 67, 95-102 (2008).
- Shtatland, T., Gill, S. C., Javornik, B. E. Interactions of Escherichia coli RNA with bacteriophage MS2 coat protein: genomic SELEX. Nucleic Acids Res. 28, E93-E93 (2000).
- Jarosch, F., Buchner, K., Klussmann, S. In vitro selection using a dual RNA library that allows primerless selection. Nucleic Acids Res. 34, E86-E86 (2006).
- Vater, A., Jarosch, F., Buchner, K., Klussmann, S. Short bioactive Spiegelmers to migraine-associated calcitonin gene-related peptide rapidly identified by a novel approach: tailored-SELEX. Nucleic Acids Res. 31, E130-E130 (2003).
- Wen, J. D., Gray, D. M. Selection of genomic sequences that bind tightly to Ff gene 5 protein: primer-free genomic SELEX. Nucleic Acids Res. 32, E182-E182 (2004).
- Musheev, M. U., Krylov, S. N. Selection of aptamers by systematic evolution of ligands by exponential enrichment: addressing the polymerase chain reaction issue. Anal Chim Acta. 564, 91-916 (2006).
- Pan, W. H., Clawson, G. A. Primer-free aptamer selection using a random DNA library. Methods Mol Biol. , (2009).
- Pan, W., Xin, P., Clawson, G. A. Minimal-Primer and Primer-Free SELEX Protocols for Selection of Aptamers from Random DNA Libraries. BioTechniques. 44, 351-360 (2008).
- Nicewarner-Pena, S., Freeman, G., Reiss, B. Submicrometer metallic barcodes. Science. 294, 137-141 (2001).
- JC, H. u. l. t. e. e. n., CR, M. a. r. t. i. n. A general template-based method for the preparation of nanomaterials. J Materials Chem. 7, 1075-1087 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved