Method Article
Primer-Free Selezione aptamero utilizzando una libreria di DNA casuale
In questo articolo
Riepilogo
Protocolli di SELEX comprendono vari cicli di selezione, ognuno dei quali richiedono la rigenerazione di leganti legato, che a loro volta richiedono sequenze primer fisso fiancheggianti le regioni biblioteca casuale. Queste sequenze di innesco fisso può interferire con il processo di selezione (falsi positivi e negativi). Qui vi presentiamo un primer senza protocollo.
Abstract
Aptameri oligonucleotidi sono altamente strutturate (DNA o RNA) che possono legarsi a bersagli con affinità paragonabile agli anticorpi 1. Essi sono identificati attraverso un processo di selezione in vitro chiamato Evolution sistematica dei ligandi di arricchimento esponenziale (SELEX) di riconoscere un'ampia varietà di obiettivi, da piccole molecole di proteine e altre macromolecole 2-4. Aptameri hanno proprietà che sono adatti per diagnostica in vivo e / o applicazioni terapeutiche: Oltre a una buona specificità e affinità, sono facilmente sintetizzata, sopravvivere a condizioni più rigorose di lavorazione, essi sono scarsamente immunogenici, e le loro dimensioni relativamente piccole possono causare la penetrazione di facile tessuti.
Aptameri che sono identificati attraverso il processo di SELEX serie comprende normalmente ~ 80 nucleotidi (nt), dal momento che sono in genere scelti dalle librerie acidi nucleici con ~ 40 nt regioni lungo randomizzato più siti fondo fisso di circa 20 nt su ogni lato. Le sequenze di innesco fisso quindi possono comprendere circa il circa il 50% delle sequenze biblioteca, e quindi possono positivamente o negativamente compromesso identificazione aptameri nel processo di selezione 3, anche se si avvicina bioinformatica suggeriscono che le sequenze fisso non contribuiscono significativamente alla aptamero struttura dopo la selezione 5 . Per affrontare questi problemi potenziali, sequenze primer sono stati bloccati da oligonucleotidi complementari o passati a diverse sequenze a metà strada durante il giro di SELEX 6, o sono stati tagliati a 6-9 nt 7, 8. Wen e grigio 9 progettato un primer senza metodo SELEX genomica, in cui le sequenze di innesco sono stati completamente rimossi dalla libreria prima selezione e sono stati poi rigenerato per consentire l'amplificazione dei frammenti genomici selezionato. Tuttavia, di impiegare la tecnica, una libreria genomica unico deve essere costruita, che possiede la diversità limitato, e la rigenerazione dopo round di selezione si basa su un passo reamplification lineare. In alternativa, i tentativi di aggirare i problemi causati da sequenze primer fissi usando il partizionamento ad alta efficienza sono incontrato con problemi per quanto riguarda l'amplificazione PCR 10.
Abbiamo sviluppato un primer-free (PF) metodo di selezione che semplifica notevolmente le procedure di SELEX ed elimina in modo efficace problemi di fondo-interferenza 11, 12. I protocolli di lavoro in modo semplice. La regione centrale casuale della biblioteca è purificata senza estranei sequenze fiancheggianti ed è destinato a un target adeguato (ad esempio per una proteina purificata o miscele complesse come linee cellulari). Poi le sequenze legate sono ottenuti, riunito con sequenze di accompagnamento, e ri-amplificato per generare secondarie selezionate librerie. Come esempio, qui abbiamo selezionato aptameri a S100B, un marker di proteine per il melanoma. Analisi di legame ha mostrato Kd s nel 10 -7 - 10 -8 gamma M dopo un paio di giri di selezione, e dimostriamo che la aptameri funzionare in modo efficace in un formato panino vincolante.
Protocollo
1. Breve descrizione del Primer-Free protocolli di selezione
Una doppia elica del DNA biblioteca è stata costruita utilizzando la PCR con gli oligonucleotidi corrispondenti (Figura 1 e 2, punto a), che contengono un dominio centrale casuale di 30 nt, fiancheggiata da due regioni primer. Protocolli di due "primer-free" leggermente diverso (PF) sono stati sviluppati. Nella biblioteca dsDNA, il 5'-regione contiene una endonucleasi sito "intaccare" per la Nt.BstNBI endonucleasi; questo enzima riconosce dsDNA ma si unirà un solo filamento di DNA substrato. 3'-regione della biblioteca dsDNA contiene un altro sito "intaccare", per la endonucleasi Nt.BbvCI che riconosce anche dsDNA ma si unirà un solo filo, lasciando un CC a 3'end (PF 1), così come un BspMI endonucleasi sito di restrizione, che si unirà entrambi i filamenti senza lasciare ulteriori 3 'nucleotidi (PF 2). Noi in genere utilizzano il PF 1 protocollo inizialmente (perché è più facile frammenti separati prodotto durante il processo di selezione, vedi sotto), e poi utilizzano il protocollo per PF 2 turni successivi di selezione.
I 32 nt di 5'-PN30-CC-3 'frammento (designato 32 +-frammento) e il 30 nt di 5'-PN30-3' frammento (designato 30 +-frammento) sono stati rispettivamente generate da Nt.BbvCI / Nt . BstNBI o BspMI / Nt.BstNBI scissione della biblioteca dsDNA, e il gel-purificazione. Le 32 +-frammento contiene il 30 domini casuali nt, con una sequenza CC di accompagnamento al 3'-end (PF 1). I 30 +-frammento (PF 2) costituito solo il 30 sequenza casuale dominio nt. L '"auto-ponte" 66 - frammento (contenente il casuale N30 regione con il 5' e 3 'sequenze fiancheggianti) è stato ottenuto da purificazione gel (Nt.BbvCI o Nt.BstNBI tagli solo la parte superiore filone "+"). Questa auto-ponte è ottenuto direttamente nel PF 1 protocollo, oppure può essere generato e isolato dopo aver tagliato il DNA biblioteca con solo NtBbv.CI o Nt.BstNBI per il PF protocollo 2 (Figura 1 e 2, punto b). Il 32 + - +-o 32 frammenti sono stati incubati con le proteine purificate o le cellule di melanoma in coltura per consentire i frammenti si legano alle proteine o le cellule, e poi i frammenti non legato sono state spazzate via (Figura 1 e 2, punto c). I frammenti legati o selezionati sono stati utilizzati per la ri-generazione delle regioni primer.
Nel ibridazione / legatura di reazione, l'auto-ponte è stato prodotto e purificato, allo stesso tempo come il 32 + - + e 30-frammento di depurazione; 5'-end di fondo era lo stesso come la costruzione biblioteca e 3'-end primer sono stati sostituiti con corrispondenti primers che conteneva anche un ulteriore SP6 promotore trascrizione al 3'-end (Figura 1 e 2, punto d). I prodotti della ibridazione / legatura di reazione sono stati poi utilizzati per la trascrizione in vitro di RNA (Figura 1 e 2, e Step). Dopo la trascrizione dell'RNA, il DNA legatura (compresi i non selezionati auto-ponte frammento di DNA) sono stati digeriti con DNasi per rimuovere le sequenze sfondo interferire. La trascrizione inversa (RT)-PCR dati hanno mostrato che il primer-rigenerati prodotti sono stati efficacemente reamplified, costituendo un "giro" di selezione (Figura 1 e 2, punto f). L'amplificazione sfondo mostrata ai numeri ciclo alta nel no-RT controllo PCR può essere completamente rimosso di un ulteriore digestione DNasi I, e non è rilevabile dopo i numeri del ciclo inferiore, che ci impiegano di routine.
Dopo 7 turni di selezione, aptameri sono stati caratterizzati per le proprietà vincolante. Kd erano tutti nella gamma M 10 -7 10 -8 (Figura 3). In saggi vincolante, diverse coppie di aptameri showed vincolante additivo, indicando che si rivolgono siti distinti sulla proteina S100B. Abbiamo quindi testato coppie di aptameri in "sandwich" saggi vincolante, sia su microarray di vetro (diapositive Codelink) con fluorescenza-tagged aptameri secondo, e su nanofili d'oro derivatizzati con aptameri secondo accoppiato a nanoparticelle d'oro 50 nm (AuNPs; Figura 3). In entrambi i casi, specificità di legame è stato alto: Il microarray Codelink, non vincolante panino è stata osservata con aptameri che non presentavano additivo obbligatorio in tutti i determinazioni Kd. Con nanofili derivatizzati abbiamo osservato praticamente nessun legame non bersaglio proteine e complessi panino individuo può essere osservato attraverso il aptamer accoppiamento AuNPs (Figura 3).
2. Materiale
2.1. Generazione di Biblioteca DNA PF e Reamplification Frammenti di Bound
I dettagli sono descritti in Pan e Clawson, 2009; Pan et al, 2008..
2.2. Selezione basata proteine purificate
- 20 mM Tris-HCl, pH 7.4
- 32 + Frammento-e 30 +-Frammento
- Selezione del buffer (2,5 mM CaCl 2, 5 mM MgCl 2 in 1X tampone fosfato, pH 7,4, Gibco)
- Ni-NTA Perline agarosio (Qiagen)
- Polipropilene colonna (Qiagen)
- Binding Buffer (50 mM Na 2HPO 4-NaH 2 PO 4, pH7.2, 150 mM NaCl)
- Espressa, purificata proteina S100B in Binding Buffer (5 mg / mL)
- Fenolo: CHCl3: IAA (pH 7.9, Ambion)
- 3 M NaAc, pH 5,2
- 100%, e il 70% etanolo
2.3. TOPO Clonazione e analisi di sequenziamento delle biblioteche selezionate dsDNA
- 7 ° turno selezionati prodotti di PCR (turni aggiuntivi possono essere eseguite per continuare l'ottimizzazione dei aptamero vincolante)
- pCR2.1-TOPO Vector (Invitrogen)
- DH5 cellule componenti (Invitrogen)
- Plasmide Mini Kit (Qiagen)
- M13 primer forward
- Informax di Vector NTI (Invitrogen)
2.4. Caratteristiche vincolanti del Aptamers
- Oligo aptameri e controllo (CC N 30 e N 30, IDT)
- Polinucleotide chinasi T4 (New England Biolabs)
- γ-32 P-ATP (3000 Ci / mmol, 10 μCi / ml)
- Purificato S100B nel Binding Buffer (5 mg / mL)
2.5. Saggi panino Binding con proteine S100B depurato e Aptamers selezionati
- Il 1 ° aptamero è stato accoppiato a uno a.) Codelink diapositive microarray o b.) nanofili Au.
- Purificata S100B proteine, diluito o 0,125 mM in 70 microlitri di una) o 1 mM in 50 microlitri per b).
- Il 2 ° aptamero era o etichettati con a.) Alexafluor 546 per diapositive serie il Codelink, o b.) accoppiato AuNPs a 50 nm per gli studi con derivatizzati nanofili Au.
3. Metodi
3.1. Generazione di PF DNA Biblioteca
Metodi e protocolli dettagliati per la selezione aptamero può essere trovato in Pan e Clawson, 2009; Pan et al, 2008..
3.2. Aptamero selezione utilizzando proteine purificate S100B
Umano S100 calcio legame con le proteine B (S100B. ID Gene # 6285) è stato usato come bersaglio. La sua proteina S100B 6-tag (98 aminoacidi di lunghezza) è stato espresso e purificato utilizzando il sistema QIAexpressionist. (Qiagen). Se lo si desidera o indicato, il suo 6 tag possono essere rimossi enzimaticamente. Durante il giro della selezione, 1 campione microlitri di ogni passo è stato salvato per scintillazione liquida conteggio per determinare l'efficienza complessiva vincolanti.
3.2.1. Preparazione del PF Biblioteca-DNA Frammenti
- Risospendere il + 32 + e 30 frammenti in 40 ml di 20 mM Tris-HCl, pH 7.4.
- Calore 3 min a 85 ° C e raffreddare a 37 ° C per 3 minuti in un incubatore di 37 ° C.
- Aggiungere 760 microlitri di buffer di selezione (2,5 mM CaCl 2, 5 mM MgCl 2 in 1X tampone fosfato, pH 7,4, GIBCO) e incubare per 3 minuti a 37 ° C, quindi tenere a temperatura ambiente (RT) per 10 min.
- Passare attraverso una colonna contenuta Ni-NTA-agarosio perline (QIAGEN) pre-lavati con tampone selezione, quindi tenere a temperatura ambiente fino al momento dell'uso.
3.2.2. Preparazione del Ni-NTA Agarosio-Bead S100B Bound a RT
- Spin down 400 l di Ni-NTA perline agarosio per 3 sec e scartare il surnatante.
- Lavare le perline con 400 ml di buffer di legame (50 mM Na 2 HPO 4-NaH 2 PO 4, pH7.2, 150 mM NaCl) pipettando gentilmente 5 volte, poi spin down e scartare il surnatante.
- Ripetere 2 step due volte.
- Aggiungere 400 ml di purificato S100B (5 mg / mL, sospese in tampone vincolante) e delicatamente pipetta 5 volte ogni 3 minuti per un totale di 15 min.
- Spin down e scartare il surnatante.
- Lavare il tallone-S100B legato con 400 ml di buffer di legame pipettando gentilmente 3 volte, poi spin down e scartare il surnatante.
- Ripetere il passaggio 6 due volte.
3.2.3. Selezione di S100B legato Aptamers
- Trasferire il 32 + - +-e 30 frammenti dal 3.2.1 al tallone-bound S100B.
- Incubare per 15 minuti e mescolare delicatamente ogni 3 minuti pipettando gentilmente.
- Lavare la S100B-DNA complesso con 800 ml di buffer di legame pipettando gentilmente, poi spin down e scartare il surnatante.
- Ripetere il passaggio 3 due volte.
3.2.4. Recupero del S100B-Selezionato Aptamers
- Aggiungere 200 ul 20 mM Tris-HCl (pH7.4), calore 3 min a 85 ° C, vortice 1 min e spin down, quindi trasferire il surnatante in una nuova provetta.
- Ripetere il passo 1 sola volta, e combinare il supernates.
- Purificare il DNA-frammenti selezionati come passi per 9-12 da pubblicazioni precedenti (11, 12).
3.2.5. TOPO Clonazione e analisi di sequenziamento per l'identificazione di sequenze aptamero Consenso
- Clonare il 10 ° turno selezionati prodotti di PCR in pCR2.1-TOPO vettore (da Invitrogen). SupplementareLa clonazione può essere fatto come ulteriori selezioni vengono eseguite.
- Sequenza 40-50 singole colonie M13 con primer forward (usiamo il Fondo Nucleo Genetica Molecolare presso il Hershey Medical Center).
- Allineare le sequenze selezionate tramite Informax di Vector NTI (Invitrogen).
- Determinare le sequenze consenso sulla base di allineamenti.
- Aptameri consenso sono stati poi acquistati dalle tecnologie di DNA integrato.
3.3. Saggi panino legame con Coppie di Aptamers selezionati
3.3.1. Formato microarray utilizzando fluorescente 2 aptameri nd.
- Consenso Aptamers 1 ° sono stati sintetizzati con un 5'-amineC6 porzione. Essi sono stati sospesi nel buffer di stampa ad una concentrazione finale di 15 mM e macchiato sul Codelink Slides attivato (GE / Amersham Biosciences) utilizzando un Apogent Scoperte microgrid Arrayer nella struttura del DNA Microarray PSU, University Park), seguendo i protocolli Codelink raccomandata. Ogni diapositiva è stata stampata con 12 array.
- Ibridazione è stata effettuata in un cassetto x 2 8 Ibridazione Microarray formato (Array It, TeleChem International). La cassetta Microarray è stato sigillato con nucleasi-free pellicola sigillante adesivo (AlumaSeal II, Research Products International) per evitare l'evaporazione.
- Proteina S100B è stato diluito in PBS alla concentrazione appropriata in 70 microlitri e applicato ai pozzi della cassetta microarray. Il legame con i aptameri stampato sul vetrino Codelink era per 1 ora a temperatura ambiente. I pozzi della cassetta sono stati poi singolarmente lavate 3 volte con PBS + 5 mM MgCl 2 (PBSM) e tampone di lavaggio in eccesso è stata cancellata. Il aptameri fluorescente sono stati diluiti in PBSM a 0,125 mM in 70 microlitri, e poi riscaldato a 85 ° C per 3 minuti seguito da 3 minuti in ghiaccio. Aptameri sono stati applicati ai pozzi della cassetta microarray, e incubate per un'ora a temperatura ambiente. Pozzi sono stati ancora una volta lavati singolarmente 3X con PBSM. La cassetta è stata poi smontata, annuncio l'intera diapositiva è stato risciacquato in PBSM. La slitta è stato poi asciugato per centrifugazione, e scansionate con una scansione Packard Biosciences ScanArray 4000XL (Perkin Elmer).
3.3.2. Derivatizzati nanocavo formato utilizzando 2 ° aptameri accoppiato a 50 nm AuNPs
Oro NWS (~ 5 micron di lunghezza, 320 nm di diametro) sono stati sintetizzati per cataforesi galvanostatic all'interno delle membrane porose di allumina seguenti protocolli precedentemente pubblicato (13, 14). Allo scioglimento della membrana porosa, i nanofili sono stati risospesi in 1 mL di etanolo.
Come già detto, il DNA è stato acquistato da DNA Technologies integrata. Nanoparticelle di oro (50 nm) sono stati acquistati da Ted Pella. DNA tiolati era spaccati con 100 mM DTT di 0,1 pH fosfato di sodio 8,3 M per un'ora e poi purificato in una Centri spin 10 colonne.
Aptamero attaccamento alla NWS Oro e NP
A 50 ml di aliquota nanofili Au è stata posta in un mL 0,5 antiaderente provetta da centrifuga e risciacquati in tampone fosfato 10 mM, 300 mM NaCl, pH 7.4. DNA tiolati al 5 '(con un distanziatore 10 T al 5') è stato aggiunto ad una concentrazione finale di 0,4 mM ai fili. Il campione è stato in agitazione per 30 minuti e poi sciacquate con centrifugazione (8100 g) tre volte con il tampone fosfato 10 mM, 300 mM NaCl, pH 7.4 e tre volte con 50 mM tampone fosfato, 5 mM MgCl 2, pH 7,2. I fili del DNA rivestiti sono stati risospesi in 100 microlitri di buffer di diluire della metà.
DNA derivatizzati AuNPs sono stati preparati aggiungendo 50 microlitri 100 mM 2 ° aptamero (con un distanziatore di 10 T al 5'-end) a 1 ml AuNPs 50 nm e riscaldata a 37 ° C per un'ora. A seguito di riscaldamento, 10 mM tampone fosfato di sodio, 1M NaCl, pH 7.4 è stata aggiunta (25 microlitri due volte, seguita da 100 l, 150 microlitri, e 128 mL) a intervalli di 0,5 ore. I coniugati sono stati lasciati su un blocco di calore 37 ° C durante la notte prima dell'uso. I campioni sono stati sciacquati 3 volte con 50 mM tampone fosfato, 5 mM MgCl 2, pH 7,2. Coniugati sono stati risospesi in 120 microlitri di buffer.
Ibridazione sandwich su NWS
Fili di DNA rivestiti, 1 ml diluito, sono stati aggiunti al tampone in tubi di PCR. Proteina S100B o HtrA1 proteina di controllo (1 mg / mL) è stata aggiunta per una concentrazione finale di 1 mM in 50 microlitri di buffer (~ 10-12 molecole proteiche aggiunto per nanometro quadrato di superficie Au nanowire). I campioni sono stati in agitazione per circa 2 ore. I fili sono stati sciacquati per centrifugazione (8100 g) tre volte con 50 mM tampone fosfato, 5 mM MgCl 2, pH 7.2 e sono stati risospesi in ogni AuNP 20 l / DNA coniugati. I fili erano in agitazione nel coniugati per 2 ore, e poi sono stati sciacquati 5x per centrifugazione (1300 g) con 50 mM tampone fosfato, 5 mM MgCl 2, pH 7,2 per rimuovere l'eccesso di nanoparticelle. I campioni sono stati risospesi in20 microlitri di buffer e secca su wafer di silicio Au rivestiti per FE-SEM analisi.
FE-SEM immagini dei nanofili sono stati ottenuti utilizzando un 1530 Field Emission Leo microscopio elettronico a scansione utilizzando un campo di emissione sorgente di elettroni Schottky ad una tensione di funzionamento 5,00 kV.
4. Rappresentante Risultati
Figura 1. Protocolli il 5'-Primer-Free (PF 1) e Primer-Free (PF 2).
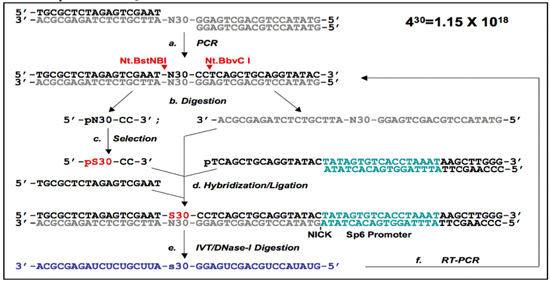
(A) La PF-1 DNA aptamero protocollo di selezione. Gli oligonucleotidi biblioteca sono ricotto insieme, e sottoposto a PCR per produrre un doppio filamento di DNA biblioteca (a). Il 5'-end Primer-free (PF 1) regione casuale dalla PF a singolo filamento di DNA librerie si prepara Nt.BstNBI / Nt.BbvCI digestioni (siti di rottura sono contrassegnate con frecce rosse) e gel-purificazioni, e il sé -bridge (freccia nera) è isolato dalla purificazione gel (b). Dopo la selezione (c), le sequenze selezionate (designato PS30-CC) sono ibridate con le loro corrispondenti oligomeri e l'auto-ponte e legatura di ri-generare le regioni fondo precedentemente rimosso. In questa fase, vengono introdotti primer che contengono un promotore SP6 alla 3'-end (d). Questo viene poi utilizzato per trascrivere l'RNA contiene le regioni selezionate (e). Infine, l'RNA è quindi esclusivamente ri-amplificato (il DNA stampo viene digerito) mediante RT-PCR (f), e la scelta sub-libreria è pronta per la prossima tornata di selezione.
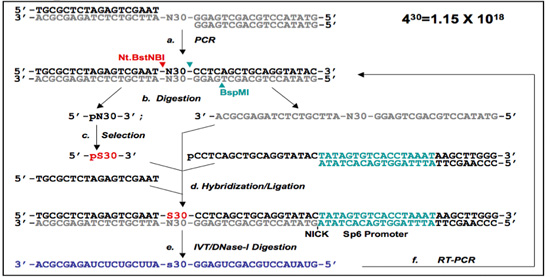
(B) Il PF 2 DNA aptamero protocollo di selezione. Gli oligonucleotidi biblioteca sono ricotto insieme e sottoposti a PCR per produrre un doppio filamento di DNA biblioteca (a). Il primer-free (PF 2) regione casuale dalla PF a singolo filamento di DNA biblioteca si prepara Nt.BstNBI / BspMI digestioni (siti di taglio sono indicati con frecce) e la purificazione del gel. L'auto-ponte è isolato sia dal protocollo PF 1 e / o single-digestione della biblioteca a partire da Nt.BstNBI (b), accoppiato con la purificazione del gel. Dopo la selezione (c), le sequenze selezionate (designato PS30) sono ibridate con le loro corrispondenti oligomeri e l'auto-ponte, e legato per rigenerare le regioni fondo precedentemente rimosso. Come in PF 1, primer vengono introdotti che contengono un promotore SP6 a 3'-end (d). Questo viene poi utilizzato per trascrivere l'RNA contiene le regioni selezionate (e). L'RNA è quindi esclusivamente reamplified con RT-PCR (f), e la scelta sub-libreria è pronta per la prossima tornata di selezione.
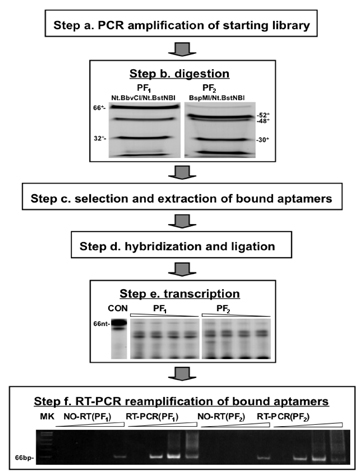
Figura 2. Rappresentazione schematica e risultati sperimentali / riduzione di praticare del protocollo di selezione PF. Designati passi corrispondono a quelli raffigurati nella Figura 1. Dopo la digestione della biblioteca PF costruito mediante PCR (Fase a) con enzimi di restrizione (come indicato), i prodotti digeriti sono stati separati da PAGINA su un gel al 10% in condizioni di denaturazione. I frammenti corrispondenti ottenuti con il PF 1 e PF 2 protocolli di selezione sono indicati (punto b). Dopo la selezione (Passo c), la aptameri legato sono ibridate con le loro corrispondenti oligomeri e l'auto-ponte, e legato per rigenerare le regioni fondo precedentemente rimosso. A 3'-end, primer vengono introdotti che contengono un promotore SP6 a 3'-end (Passo d). RNA 32 P-etichettati sono stati trascritti con prodotti legatura di 1, 0,5, 0,25, 0,125 microlitri da 5 microlitri reazioni, e sono stati separati da PAGINA il 6% gel in condizioni denaturanti (e Step). Le trascrizioni sono state poi trattate con DNasi per rimuovere le regioni non selezionati DNA casuale, inversa trascritto in cDNA, e poi reamplified per 7, 14, 21 o 28 cicli di PCR. I prodotti sono stati separati da PAGINA l'8% gel in condizioni non-denaturanti condizioni. I 66 frammento nt rappresenta il full-length prodotto contenente il selezionati PS30 PS30-CC e sequenze come ri-embedded all'interno di sequenze 5 'e 3' di accompagnamento. La migrazione dei marcatori PhiX174/HinfI è mostrato a sinistra (Punto f). Controlli inclusi omissione di trascrizione inversa (RT) passo. Una piccola quantità di prodotto in tali campioni potevano vedere ai numeri ciclo alto, questo probabilmente può essere completamente eliminato con un secondo (o prolungata) fase di digestione DNasi.
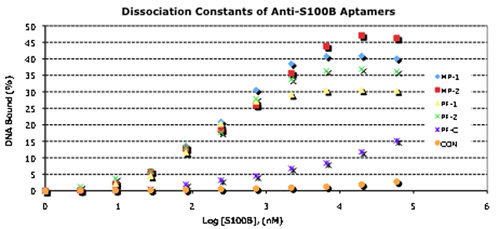
Figura 3. Caratteristiche vincolanti di Aptamers selezionati e il loro utilizzo accoppiati in un formato Sandwich.
A. concentrazione-dipendente 32 P-aptamero Binding per la determinazione Kd. Aptameri sono stati 5'-end etichettati utilizzando g-32 P-ATP (3000Ci/mmol, circa 10 mCi) e la chinasi polinucleotide T4 (New England Biolabs) e WA vincolantes determinato come descritto.
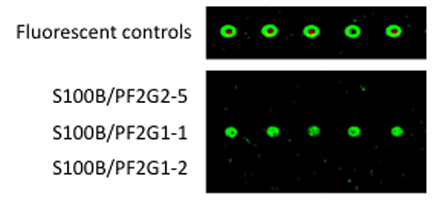
B. 5'-ammina-derivatizzati 1 ° aptameri sono stati accoppiati Codelink microarray. Purificata proteina S100B è stata legata al 1 ° aptamer, le diapositive sono stati sciacquati e AlexaFluor546 marcata 2 ° aptamero era legata al 1 ° aptamer: complessi S100B. Dopo attraverso il risciacquo, fluorescenza è stata quantificata utilizzando uno scanner ScanArray.

C. 5'-tiolo derivatizzati 1 ° aptameri sono stati accoppiati nanofili Au utilizzando le normali chimica tiolo. 2 ° aptameri sono state accoppiate a 50 nm AuNPs nello stesso modo. Purificato proteina S100B (a sinistra) o depurata proteina HtrA1 controllo (a destra) è stato poi legato prima alla nanofili derivatizzati. Dopo un accurato risciacquo, 2 ° aptamer-50 AuNPs nm sono stati successivamente legato alla 1 °-aptamer-nanowire: complessi S100B. Dopo attraverso il risciacquo, complessi sandwich legato sono state visualizzate mediante emissione di campo-microscopia elettronica a scansione. Barre di scala = 1 micron.
Divulgazioni
Riconoscimenti
Ringraziamo Paul Craig presso l'impianto di core Microarray per il suo aiuto. Questo lavoro è stato sostenuto da NIH / NCI concedere # CA118591 dal Programma IMAT. SLD riconosce anche un Pennsylvania Spazio Concessione borse di studio del Consorzio per il sostegno finanziario. Questa pubblicazione è stata sostenuta anche dalla Pennsylvania State University Materials Research Institute Nano Fabrication Rete e la National Science Foundation accordo Cooperative n ° 0335765, National Nanotechnology Network Infrastructure, con la Cornell University.
Materiali
| Name | Company | Catalog Number | Comments |
| Tris-HCl | |||
| HotMaster TAQ DNA Polymerase | 5 PRIME | ||
| dNTP Mix | Sigma-Aldrich | ||
| Acrylamide | Fisher Scientific | ||
| UltraPure 10X TBE Buffer | Invitrogen | ||
| Ammonium Persulfate | Bio-Rad | ||
| TEMED | Fisher Scientific | ||
| PhiX174 DNA/Hinf I DNA Marker | Promega Corp. | ||
| Ethidium Bromide | |||
| α-32P-dCTP | |||
| Phenol:ChCl3:IAA | Ambion | ||
| NaCl | |||
| Ethanol | |||
| Restriction Enzymes | New England Biolabs | ||
| Urea | Fisher Scientific | ||
| Photographic Film | ECE Scientific | ||
| PBS | GIBCO, by Life Technologies | ||
| CaCl2 | GIBCO, by Life Technologies | ||
| MgCl2 | GIBCO, by Life Technologies | ||
| Ni-NTA Agarose Beads | Qiagen | ||
| Polypropylene Column | Qiagen | ||
| NaHPO4 | |||
| NaAc | |||
| Detroit-551 cells | |||
| SK-MEL-31 cells | |||
| MEM | |||
| TrypLE Express | GIBCO, by Life Technologies | ||
| T4 DNA Ligase | New England Biolabs | ||
| Dimethyl Sulfoxide | Promega Corp. | ||
| Sp6 RNA Polymerase | Promega Corp. | ||
| RNase-Free DNase I | Promega Corp. | ||
| RNase Inhibitor | Promega Corp. | ||
| SensiScript Reverse Transcriptase | Qiagen | ||
| pCR-2.1-TOPO Vector | Invitrogen | ||
| DH5α Compotent Cells | Invitrogen | ||
| Plasmid Mini Kit | Qiagen | ||
| Vector NTI | Invitrogen | ||
| T4 Polynucleotide Kinase | New England Biolabs | ||
| γ-32P-ATP |
Riferimenti
- Kulbachinskiy, A. V. Methods for selection of aptamers to protein targets. Biochemistry (Moscow). 72, 1505-1518 (2006).
- Mairal, T. Aptamers: molecular tools for analytical applications. Anal Bioanal Chem. 390, 989-1007 (2008).
- Stoltenburg, R., Reinemann, C., Strehlitz, B. SELEX -- A (r)evolutionary method to generate high-affinity nucleic acid ligands. Biomolec Engineering. 24, 381-403 (2007).
- Que-Gewirth, N. S., Sullenger, B. A. Gene therapy progress and prospects: RNA aptamers. Gene Ther. 14, 283-2891 (2007).
- Cowperthwaite, M. C., Ellington, A. D. Bioinformatic analysis of the contribution of primer sequences to aptamer structures. J Mol Evol. 67, 95-102 (2008).
- Shtatland, T., Gill, S. C., Javornik, B. E. Interactions of Escherichia coli RNA with bacteriophage MS2 coat protein: genomic SELEX. Nucleic Acids Res. 28, E93-E93 (2000).
- Jarosch, F., Buchner, K., Klussmann, S. In vitro selection using a dual RNA library that allows primerless selection. Nucleic Acids Res. 34, E86-E86 (2006).
- Vater, A., Jarosch, F., Buchner, K., Klussmann, S. Short bioactive Spiegelmers to migraine-associated calcitonin gene-related peptide rapidly identified by a novel approach: tailored-SELEX. Nucleic Acids Res. 31, E130-E130 (2003).
- Wen, J. D., Gray, D. M. Selection of genomic sequences that bind tightly to Ff gene 5 protein: primer-free genomic SELEX. Nucleic Acids Res. 32, E182-E182 (2004).
- Musheev, M. U., Krylov, S. N. Selection of aptamers by systematic evolution of ligands by exponential enrichment: addressing the polymerase chain reaction issue. Anal Chim Acta. 564, 91-916 (2006).
- Pan, W. H., Clawson, G. A. Primer-free aptamer selection using a random DNA library. Methods Mol Biol. , (2009).
- Pan, W., Xin, P., Clawson, G. A. Minimal-Primer and Primer-Free SELEX Protocols for Selection of Aptamers from Random DNA Libraries. BioTechniques. 44, 351-360 (2008).
- Nicewarner-Pena, S., Freeman, G., Reiss, B. Submicrometer metallic barcodes. Science. 294, 137-141 (2001).
- JC, H. u. l. t. e. e. n., CR, M. a. r. t. i. n. A general template-based method for the preparation of nanomaterials. J Materials Chem. 7, 1075-1087 (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon