Method Article
랜덤 DNA 라이브러리를 사용하여 뇌관 - 무료 Aptamer 선택
요약
SELEX의 프로토콜 설정에서 임의의 라이브러리 영역을 측면 고정 프라이머 시퀀스를 요구 바운드 리간드의 재생을 필요로 각각의 선택 여러 라운드를 구성. 이러한 고정 프라이머 시퀀스는 선택 프로세스 (잘못된 반응과 제외)을 방해할 수 있습니다. 여기 입문서없는 프로토콜을 제시한다.
초록
Aptamers는 항체 1 비교 동질성과 목표에 바인딩할 수 고도로 구조화된 oligonucleotides (DNA 또는 RNA)입니다. 그들은 작은 분자에서 단백질 및 기타 macromolecules 2-4로 대상의 다양한 인식 지수 농축 (SELEX)의 리간드의 체계적인 진화라는 체외 선정 과정에서를 통해 식별됩니다. Aptamers 잘 생체내 진단 및 / 또는 치료 응용 프로그램에 적합 한 특성을 가지고 있습니다 : 좋은 특이성과 친화력 게다가, 쉽게 합성되며, 더 엄격한 가공 조건을 살아남기, 그들은 제대로 immunogenic하고, 그들의 비교적 작은 크기의 손쉬운 보급률이 발생할 수 있습니다 티슈.
그들은 일반적으로 양쪽에 ~ 40 NT 긴 무작위 지역 플러스 ~ 20 NT의 고정 뇌관 사이트와 핵산 라이브러리에서 선택한 있기 때문에 표준 SELEX 과정을 통해 확인할 수 있습니다 Aptamers는 일반적으로, ~ 80 세포핵 (NT)를 구성. 생물 정보학의 접근 방식은 고정 시퀀스 선택 5시 이후엔 aptamer 구조에 크게 기여하지 않는 것이 좋습니다하지만 고정 뇌관 시퀀스는, 따라서 ~ 거의 라이브러리 시퀀스의 50 %를 구성 수 있으며, 따라서 긍정적 으로든 부정적 으로든 선정 과정 3 aptamers의 신분을 손상시킬 수 . 이러한 잠재적인 문제를 해결하기 위해, 뇌관 시퀀스는 상호 보완 oligonucleotides에 의해 차단된 또는 SELEX 6 라운드 동안 다른 시퀀스의 미드웨이로 전환하거나, 그들은 6-9 NT 7, 8 손질했습니다되었습니다. 웬 앤드 그레이 9, 입문서없는 게놈 SELEX 방법을 설계하는 뇌관 시퀀스 완전히 선택하기 전에 라이브러리에서 제거되었습니다 다음 선택한 게놈 조각의 증폭을 허용하는 생성되었습니다. 그러나 기술을 채용하기 위해 고유의 게놈 라이브러리 구축되어야, 어떤이 제한 다양성을 보유하고, 선택의 라운드 후 재생은 선형 reamplification 단계에 의존합니다. 또한, 고효율 파티션을 사용하여 고정 뇌관 시퀀스로 인한 문제를 회피하기위한 노력은 PCR 증폭 10에 관한 문제 충족하고 있습니다.
우리는 크게 SELEX 절차를 단순화하고 효율적으로 프라이머 - 간섭 문제 11, 12를 제거하는 입문서 무료 (PF) 선택 방법을 개발했습니다. 프로토콜은 간단한 방식으로 작동합니다. 라이브러리의 중앙 무작위 지역 관계없는 측면 순서없이 정화하고 적당한 대상 (정화 단백질이나 세포 라인과 같은 복잡한 혼합물로 예를 들면)에 바인딩됩니다. 그러면 바운드 시퀀스가 얻은 측면 시퀀스와 상봉하고, 선택된 하위 라이브러리를 생성하기 위해 다시 증폭됩니다. 예를 들어, 우리가 S100B, 흑색증의 단백질 마커에 aptamers을 선택했습니다. 선택의 몇 라운드 후 10 -8 M 범위를, 그리고 우리는 aptamers가 샌드위치 바인딩 형식에서 효과적으로 기능 것을 입증 - 바인딩 assays는 10 -7에서 KD S을 보여주었다.
프로토콜
1. 프리머 - 자유 선택 프로토콜의 간략한 설명
더블 좌초된 DNA 라이브러리는 두 뇌관 지역 둘러싸인 30 NT의 중심 임의의 도메인을 포함하는 해당 oligonucleotides (Figure1와 2 단계)와 PCR를 사용하여 건설되었습니다. 두 개의 약간 다른 '뇌관 무료 "(PF) 프로토콜이 개발되었다. dsDNA 라이브러리에서 5' - 영역은 endonuclease Nt.BstNBI에 대한 endonuclease "nicking"사이트를 포함,이 효소는 dsDNA를 인식하지만 DNA 기판의 한 가닥을 클리브스. dsDNA 라이브러리의 3' - 지역도 3'end (PF 1)뿐만 아니라 BspMI에서 CC를 떠나, dsDNA를 인식하지만, 한 가닥을 클리브스 endonuclease Nt.BbvCI에 대한 또 다른 'nicking "사이트를 포함 별도 3 '세포핵 (PF 2) 떠나 모두 긴 클리브스 엔도 뉴 클레 아제 제한 효소 부위. (; 아래 참조 선정 과정에서 생산된 별개의 조각하기 위해 쉽게 때문에), 그리고 선택의 후속 반올림에 대한 PF 두 프로토콜을 채용 우리는 일반적으로 처음 PF 한 프로토콜을 사용합니다.
5' - pN30 - CC - 3 '조각 (32 + - 조각을 지정) 및 5' - pN30 - 3 30 NT'조각 (30 + - 조각을 지정)의 32 NT는 각각 Nt.BbvCI / NT에 의해 생성되었습니다 . BstNBI 또는 dsDNA 라이브러리 BspMI / Nt.BstNBI 절단 및 젤 - 정화. 32 + - 조각의 3' - 끝에 CC 측면 순서 (PF 1) 30 NT 임의의 도메인을 포함하고 있습니다. 30 + - 조각 (PF 2) 만 30 NT 임의의 도메인 순서를로 구성되어 있습니다. "자기 다리"66 - 조각이 (5 '및 3'측면 시퀀스와 함께 임의의 N30 지역을 포함) 겔 정화 (Nt.BbvCI 또는 Nt.BstNBI은 상단 "+"가닥을 삭감)에 의해 얻은 것입니다. 이것은 자기 다리는 PF 1 프로토콜에 직접 취득, 또는 생성 및 PF 두 프로토콜 (그림 1 및 2 단계 B)에 대해서만 NtBbv.CI 또는 Nt.BstNBI와 라이브러리 DNA를 절단 후 격리 수 있습니다. 32 + - 32 + - 조각은 조각은 단백질이나 세포에 바인딩 수 있도록 정화 단백질이나 교양 흑색증 세포와 incubated되었고, 다음 언바운드 파편은 (그림 1 및 2 단계 C) 씻겨했다. 바운드 또는 일부 조각이 뇌관 지역의 다시 생성을 위해 사용되었습니다.
하이브 리다이 제이션 / 결합 반응에서 자기 다리는 제작되었으며 32 동시에 정화 + - 30 + - 조각 정화, 5' - 말단 프라이머는 도서관 건설과 3' 엔드 primers가 교체되었습니다 동일했습니다 또한, 3' - 끝에 추가 SP6 전사 발기인을 (그림 1 및 2 단계 D) 포함 primers 일치와 함께. 하이브 리다이 제이션 / 결합 반응의 제품은 다음 체외 RNA의 전사 (그림 1 및 2 단계 전자)에 사용되었습니다. RNA의 전사에 따라, 출혈도 잡았 DNAs은 (선택되지 않은 자기 다리의 DNA 조각 포함) 나 방해 배경 시퀀스를 제거하는 DNase에 의해 소화했다. 반대 전사 (RT) PCR 데이터는 뇌관 - 재생 제품이 효율적으로 선택의 "둥근"(그림 1 및 2 단계 F)를 구성, reamplified되었다 것으로 나타났습니다. 노 RT PCR 제어 높은 사이클 번호로 표시된 배경 증폭 완전히 추가 DNase I의 소화에 의해 제거하고, 우리가 일상적으로 채용 낮은 사이클 번호, 이후 감지되지하실 수 있습니다.
선택 7 라운드 후, aptamers는 바인딩 속성에 대한 특성화했다. KD가 10 -7 10 -8 M 범위 (그림 3)의 모든되었다. 바인딩 assays에서 aptamers의 여러 쌍들은 S100B 단백질에 대한 별개의 사이트를 타겟으로 나타내는 첨가제 바인딩을 보여주었다. 따라서 찬란 - 태그 둘째 aptamers를 사용하여 유리 microarrays (Codelink 슬라이드)에 50 나노미터의 금 nanoparticles (; 그림 3 AuNPs)에 결합 초 aptamers와 derivatized 금 나노 와이어에 모두, "샌드위치"바인딩 assays에서 aptamers의 쌍 테스트. 두 경우 모두에 결합 특이성 높은되었습니다 Codelink의 microarrays에서 더 샌드위치 바인딩은 KD 결정에 첨가제가 구속력이 오지 않았 aptamers와 함께 관찰되지 않았습니다. derivatized 나노 와이어를 통해 우리는 실질적으로 전혀 아닌 대상 단백질에 바인딩하고, 각각의 샌드위치 단지가 aptamer - 결합 AuNPs (그림 3)를 통해 볼 수 있습니다을 관찰하지 않습니다.
2. 자료
2.1. PF의 DNA 라이브러리와 바운드 조각 Reamplification의 생성
자세한 내용은 이동 및 클로슨 2009에 설명되어 있습니다; 판 외, 2008..
2.2. 단백질 기반 선택 정화
- 20 MM 트리스 - HCL, pH를 7.4
- 32 + - 조각 30 + - 조각
- 선택 버퍼 (살린 2.5 MM CaCl 2, 1X 인산 5 MM MgCl 2 버퍼, 산도 7.4, Gibco)
- NI - NTA 아가로 오스 비즈 (Qiagen)
- 폴리 프로필렌 칼럼 (Qiagen)
- 바인딩 버퍼 (50 MM이 나HPO 4 - 아니 2 PO 4, pH7.2, 150 MM NaCl)
- 표현, 바인딩 버퍼에 S100B 단백질 (5 μg / μL)를 정화
- 페놀 : ChCl3 : IAA (산도 7.9, 앰비온)
- 3 M NaAc, 산도 5.2
- 100 % 및 70 % 에탄올
2.3. 토포 복제하고 선택한 dsDNA 라이브러리의 시퀀싱 분석
- 7 일 내내은 (추가 라운드는 aptamer 바인딩의 최적화를 계속 수행할 수 있습니다) PCR 제품을 선택
- pCR2.1 - 토포 벡터 (Invitrogen)
- DH5 구성 요소 세포 (Invitrogen)
- 플라스미드 미니 키트 (Qiagen)
- M13 앞으로 프라이머
- Informax의 벡터 NTI (Invitrogen)
2.4. Aptamers의 바인딩 특성
- Aptamers 및 제어 oligos (N 30 CC와 N 30, IDT)
- T4 폴리 뉴클레오 타이드의 키나제 (뉴 잉글랜드 Biolabs)
- γ - 32 P - ATP (3000 CI / mmol, 10 μCi / ML)
- 바인딩 버퍼 정화 S100B (5 μg / μL)
2.5. 정화 S100B 단백질과 선택된 Aptamers와 샌드위치 바인딩 Assays
- 1 일 aptamer는 Codelink microarray 슬라이드 또는 B.) 오 나노 와이어가) A. 중 하나에 결합했다.
- 정화 S100B의 70 μl에 0.125 μm의 하나에 희석 단백질) 또는 B 50 μl 1 μm의).
- aptamer는 어느 A.으로 표시했습니다 2 층) Codelink 배열 슬라이드에 대한 Alexafluor 546, 또는 B.)는 derivatized 오 나노 와이어와 연구 50 나노미터 AuNPs에 결합.
3. 방법
3.1. PF DNA 도서관의 생성
판 외, 2008;. aptamer 선택에 대한 자세한 방법과 프로토콜은 이동 및 클로슨 2009에서 찾을 수 있습니다.
3.2. 정화 S100B 단백질을 사용하는 Aptamer 선택
인간 S100 칼슘 결합 단백질 B (S100B. 진 ID # 6285)을 대상으로 사용되었다. 그의 6 태그 S100B 단백질은 (길이 98 아미노산) 표현과 QIAexpressionist 시스템을 사용하여 정화되었다. (QIAGEN). 원하는 또는 표시하는 경우, 그의 6 태그는 효소 제거할 수 있습니다. 선택의 라운드 동안, 각 단계에서 1 μL 시료는 전체 바인딩 효율성을 결정하는 계산 액체 섬광 저장되었습니다.
3.2.1. PF 도서관의 DNA 파편의 준비
- 20 MM 트리스 - HCL, pH를 7.4 40 μL에 32 + 30 + 조각을 다시 일시 중지합니다.
- 열 세 85시 분 ° C, 37로 냉각 ° C 37 ° C. 인큐베이터에서 3 분
- 선택 버퍼 760 μL (살린 2.5 MM CaCl 2, 1X 인산 5 MM MgCl 2 버퍼, 산도 7.4, GIBCO)을 추가하고 37에서 3 분 품어 ° C, 그럼 10 분 실온 (RT)에 보관.
- 예약 씻어 선택 버퍼 후 사용까지 RT에서 계속 니켈 - NTA 아가로 오스 - 구슬 (QIAGEN)를 포함한 열을 통과.
3.2.2. RT에서 니켈 - NTA 아가로 오스 - 비드 바운드 S100B의 준비
- 3 초위한 니켈 - NTA 아가로 오스 비즈 400 μL를 스핀 다운 및 뜨는 폐기하십시오.
- 바인딩 버퍼 400 μL (50 MM 나 2 HPO 4 - 아니 2 PO 4, pH7.2, 150 MM NaCl) 부드럽게 5 번 pipetting하여, 그때 스핀 다운 및 뜨는을 버리고있는 구슬을 씻으십시오.
- 두 단계 2를 반복합니다.
- 정화 S100B (5 μg / μL, 구속력이 버퍼에 정지) 400 μL를 추가하고 부드럽게 5 회 15 분 총 매 3 분 피펫.
- 스핀 다운 및 뜨는 폐기하십시오.
- 부드럽게 3 번 pipetting하여 바인딩 버퍼 400 μL와 비드 - 바운드 S100B 씻으 후 스핀 다운 및 뜨는 폐기하십시오.
- 두 번 6 단계를 반복합니다.
3.2.3. S100B - 바운드 Aptamers의 선택
- 비드 - 바운드 S100B에 + - 조각 3.2.1에서 30 - 32 +를 전송합니다.
- 15 분 품어 부드럽게 pipetting으로 조심스럽게 매 3 분 섞는다.
- 부드럽게 pipetting하여 바인딩 버퍼 800 μL와 S100B - DNA 복합 와시 다음, 스핀 다운 및 뜨는 폐기하십시오.
- 두 단계 3를 반복합니다.
3.2.4. S100B 선택한 Aptamers의 복구
- 200 μL 20 MM 트리스 - HCL (pH7.4), 85에서 열 3 분 ° C, 소용돌이 1 분을 추가하고 스핀 다운, 그리고 새로운 튜브에 뜨는을 전송하기만하면됩니다.
- 일단 1 단계를 반복하고 supernates을 결합.
- 9-12 이전 간행물 (11, 12)에서 당 단계로 선택한 DNA - 조각을 정화.
3.2.5. 토포 복제 및 합의 Aptamer 시퀀스의 식별을위한 시퀀싱 분석
- pCR2.1 - 토포 벡터 (Invitrogen에서)에 PCR 제품을 선택한 10 번째 라운드를 복제. 추가더 이상 선택이 수행으로 복제 할 수 있습니다.
- M13 앞으로 프라이머 (우리가 허시 메디컬 센터에서 분자 유전학의 핵심 시설을 사용)와 시퀀스 40-50 싱글 식민지.
- Informax의 벡터 NTI (Invitrogen)을 사용하여 선택한 시퀀스를 정렬합니다.
- 정렬에 따라 합의 시퀀스를 결정합니다.
- 합의 aptamers는 다음 통합 DNA 기술에서 구입한했다.
3.3. 선택 Aptamers의 쌍이있는 샌드위치 바인딩 Assays
3.3.1. Microarray를 사용 형식은 찬란 2 차 aptamers를 표시.
- 합의 1 일의 Aptamers는 5' - amineC6 잔기로 합성했다. 그들은 Codelink 추천 프로토콜에 따라) 15 μm의의 최종 농도 인쇄 버퍼에 정지 및 DNA Microarray 시설 PSU, 대학 공원에 Apogent 발견 MicroGrid Arrayer를 사용하여 Codelink 활성 슬라이드 (GE 헬스케어 / 애머스햄 Biosciences)에 발견되었다. 각 슬라이드 12 배열을 인쇄했습니다.
- 하이브 리다이 제이션은 2 X 8 형식의 Microarray의 하이브리드화 카세트 (배열 그것을, TeleChem 국제)에서 실시되었다. Microarray 카세트는 증발을 방지하기 위해 nuclease 무료 접착 씰링 호일 (AlumaSeal II, 연구 제품 국제)를 사용하여 봉인된 상태 였어요.
- S100B 단백질은 70 μl의 해당 농도 PBS에 희석하여 microarray의 카세트의 우물에 적용되었다. Codelink 슬라이드에 인쇄된 aptamers에 바인딩은 실온에서 1 시간했습니다. 카세트의 우물 그 다음 개별적으로 PBS + 5 MM MgCl 2 (PBSM)로 3 배 씻어되었고, 초과 씻어 버퍼가 blotted되었습니다. 찬란 분류 aptamers가 70 μl에 0.125 μm의에 PBSM에 희석하고 85 ° C 가열되었다 얼음 3 분 뒤에 3 분. Aptamers는 microarray 카세트의 우물에 적용하고, 실온에 한 시간 동안 incubated되었습니다. 웰스는 다시 개별적으로 PBSM와 배 세탁했다. 카세트 그런 다음 광고 전체 슬라이드 PBSM에 씻어서 되었음 조각했다. 슬라이드 그런 다음 원심 분리에 의해 철저하게 건조하고, 스캔 팩커드 Biosciences ScanArray 4000XL (퍼어킨 엘머)를 사용하여 스캔했습니다.
3.3.2. 50 나노미터 AuNPs에 결합된 2 차 aptamers를 사용하여 Derivatized Nanowire 형식
골드 NWs는 (길이 ~ 5 μm의, 직경 320 나노미터) 이전에 게시된 프로토콜 (13, 14) 다음과 같은 다공성 알루미나 세포막 내에 galvanostatic 전착에 의해 합성되었다. 다공성 막의 해산시, 나노 와이어는 1 ML 에탄올에 resuspended되었습니다.
바와 같이, DNA가 통합 DNA 기술에서 구입한했다. 골드 nanoparticles (50 NM)는 테드 펠라에서 구입한했다. Thiolated DNA 한 시간 동안 0.1 M 나트륨 인산 산도 8.3 100 MM의 DTT로 죽습 다음 Centri - 스핀 10 열에 정화되었다.
골드 NWs 및 NPS에 Aptamer 첨부 파일
오 나노 와이어의 50 μL 나누어지는은 0.5 ML 아닌 스틱 원심 튜브에 배치, 10 MM 인산 버퍼, 300 MM NaCl, pH를 7.4로 씻어서되었습니다. 5 '끝 (5 10 T 스페이서와'엔드)에서 thiolated DNA는 전선 0.4 μm의의 최종 농도에 추가되었습니다. 샘플 30 분 vortexed 후 50 MM 인산 버퍼, 5 MM MgCl 2, pH를 7.2로 10 MM 인산 버퍼, 300 MM NaCl, 산도 7.4 세 시간을 원심 분리 (8천1백그램)으로 세 번 씻어서되었다. DNA 코팅 와이어는 반으로 희석하여 100 μL 버퍼에 resuspended되었습니다.
DNA - derivatized AuNPs는 1 ML 50 나노미터 AuNPs 50 μl 100 MM 2 층 aptamer를 (5' - 끝에 10 T의 공백)를 추가하고 37 ° C 온수 하나 시간에 의해 준비되었다. 가열에 따라, 10 MM 나트륨 인산염 버퍼, 1M NaCl, 산도 7.4 0.5 시간 간격으로 (100 μL, 150 μL, 128 μL 25 μL를 두 번, 다음) 추가되었습니다. conjugates은 하룻밤 사용하기 전에 37 ° C 열 블록에 남아 있었다. 샘플 50 MM 인산 버퍼, 5 MM MgCl 2, pH를 7.2로 3 번 씻어서했다. Conjugates 120 μL 버퍼에 resuspended되었습니다.
NWs에 샌드위치 하이브 리다이 제이션
DNA 코팅 와이어, 희석 1 μL는 PCR 튜브에 버퍼에 추가되었습니다. S100B 단백질이나 HtrA1 제어 단백질 (1 μg / μL)은 50 μL 버퍼 (~ 10-12 단백질 분자가 오 nanowire 표면의 평방 나노미터 당 추가) 1 μm의의 최종 농도에 대한 추가되었습니다. 샘플 ~ 2 시간에 대한 vortexed되었습니다. 전선은 50 MM 인산 버퍼, 5 MM MgCl 2, pH를 7.2로 원심 분리 (8,100그램)으로 세 번 씻어서되었으며 각각 20 μL AuNP / DNA conjugates에 resuspended되었습니다. 전선은 2 시간에 대한 conjugates에 vortexed되었고, 다음 초과 nanoparticles를 제거 50 MM 인산 버퍼, 5 MM MgCl 2, pH를 7.2로 원심 분리 (1천3백g)에서 5 배 씻어서되었습니다. 샘플에 resuspended되었습니다20 μL 버퍼와 FE - SEM 분석을 위해 오 코팅시 웨이퍼에 건조.
나노 와이어의 FE - SEM 이미지는 5.00 KV 운영 전압에서 쇼트키 현장 방출 전자 소스를 사용하여 전자 현미경 레오 1530 전계 방출을 사용하여 얻은되었습니다.
4. 대표 결과
그림 1. 5' - 프리머 - 무료 (PF 1) 프리머 - 무료 (PF 2) 프로토콜.
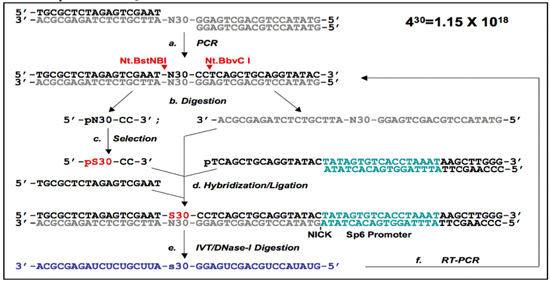
(A) PF 한 DNA - aptamer 선택 프로토콜. 라이브러리 oligonucleotides은 (A) 함께 annealed, 그리고 이중 좌초된 DNA 라이브러리를 항복하는 PCR 증폭을 받게됩니다. PF 단일 좌초된 DNA 라이브러리에서 5' 엔드 입문서 무료 (PF 1) 임의의 지역은 Nt.BstNBI / Nt.BbvCI digestions (절단 사이트가 빨간색 화살촉으로 표시됩니다)과 겔 - purifications으로 준비하고있는 자기 - 브리지 (검은색 화살표)가 젤 정화 (B)에 의해 격리됩니다. 선택 후 (C), 선택한 순서는 (pS30 - CC 지정) 해당 oligomers 및 자기 다리로 hybridized와 이전에 제거 뇌관 영역을 다시 생성하기 위해 출혈도 잡았 있습니다. 이 단계에서, primers는 3' - 끝에 SP6 발기인 (D)를 포함하는 것을 소개하고 있습니다. 이것은 다음 선택된 지역 (E)를 포함하는 RNA를 녹음하는 데 사용됩니다. 마지막으로, RNA는 다음 독점적으로 RT - PCR (F), 그리고 선택한 하위 라이브러리를 사용하여 (템플릿 DNA가 소화) 다시 증폭 것은 선택의 다음 라운드를위한 준비가되었습니다.
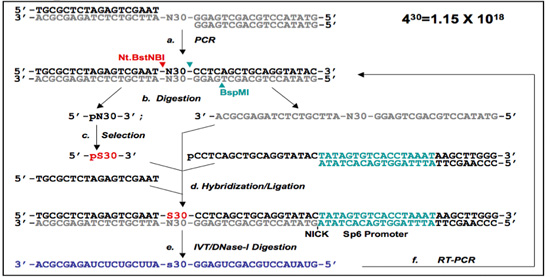
(B) PF 두 DNA - aptamer 선택 프로토콜. 라이브러리 oligonucleotides은 (A) 함께 annealed 및 이중 좌초된 DNA 라이브러리를 항복하는 PCR 증폭을 받게됩니다. PF 단일 좌초된 DNA 라이브러리에서 프라이머 무료 (PF 2) 임의의 지역은 Nt.BstNBI / BspMI digestions (컷 사이트가 화살촉로 표시된 아르)와 젤 정화에 의해 준비가되어 있습니다. 자기 다리는 겔 정화와 결합, PF 한 프로토콜 및 / 또는 Nt.BstNBI (B)로 시작하는 라이브러리의 단일 소화에 의해 중 격리됩니다. 선택 후 (C), 선택한 순서는 (pS30 지정) 해당 oligomers 및 자기 다리 hybridized하고, 이전에 제거된 뇌관 영역을 생성하기 위해 출혈도 잡았 있습니다. PF 1로 primers는 3' - 끝에 SP6 발기인 (D)를 포함하는 것을 소개하고 있습니다. 이것은 다음 선택된 지역 (E)를 포함하는 RNA를 녹음하는 데 사용됩니다. RNA는 다음 독점적으로 RT - PCR (F)을 사용 reamplified하고, 선택된 하위 라이브러리는 선택의 다음 라운드를위한 준비입니다.
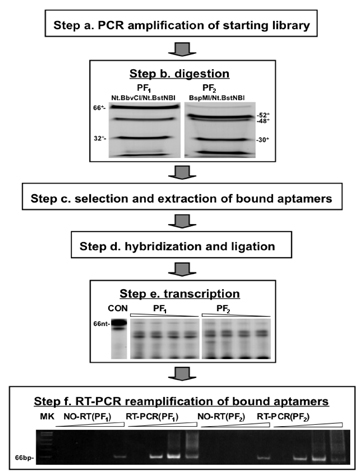
그림 2. PF 선택 프로토콜의 연습을 도식 표현과 실험 결과 / 감소. 지정 단계는 그림 1에 묘사된 것과 일치합니다. PCR 제한 endonucleases과 함께합니다 (표시) (단계)을하여 건설 PF 라이브러리의 소화 후 소화 제품 denaturing 조건 하에서 10 %의 겔에서 페이지로 구분했다. PF 1과 PF이 선택 프로토콜로 얻은 해당 파편이 (B 단계) 표시됩니다. 선택 후 (C 단계), 바운드 aptamers은 해당 oligomers 및 자기 다리 hybridized하고, 이전에 제거된 뇌관 영역을 생성하기 위해 출혈도 잡았 있습니다. 3' - 끝에서 primers는 32 P - 라벨 RNAS는 1의 출혈도 잡았 제품, 0.5, 0.25, 5 μl 반응 0.125 μl를 사용 베꼈는데되었습니다. 3' - 끝에 SP6 발기인 (단계 D)를 포함하는 것을 도입하고, 삼습니다 denaturing 조건 (단계 E)에 따라 6 % 젤의 페이지로 구분. 성적표는 다음 선택되지 않은 임의의 DNA 영역을 제거하기 위해 DNase로 처리했다, cDNA로 베꼈는데 후 7, 14, 21 28 PCR주기 위해 reamplified 역방향. 제품이 아닌 denaturing 조건에서 8 % 젤에 대한 PAGE에 의해 분리되었다. 66 NT의 조각은 5 '과 3'측면 시퀀스 내에서 다시 임베디드로 선택한 pS30 - CC와 pS30 시퀀스를 포함하는 전체 길이 제품을 나타냅니다. PhiX174/HinfI 마커의 마이 그 레이션은 (단계 F) 왼쪽에 표시됩니다. 컨트롤 반대 전사 (RT) 단계의 누락이 포함되어 있습니다. 이러한 샘플에 제품의 소량은 높은 사이클 숫자에서 볼 수 있으며, 이것은 아마도 완전히 두 번째 (또는 연장) DNase의 소화 단계로 제거하실 수 있습니다.
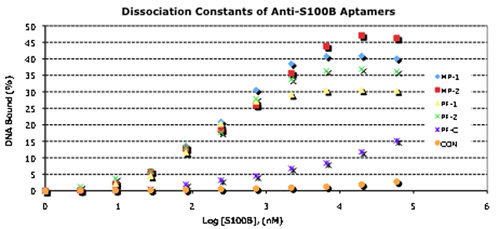
그림 3. 선택된 Aptamers와 샌드위치 형식으로 그들의 이점 이용 바인딩 특성.
KD 결정에 대한 A. 농도에 의존 32 P - Aptamer의 바인딩. Aptamers는 5' 엔드 g - 32 P - ATP (3000Ci/mmol, ~ 10 MCI) 및 T4 폴리 뉴클레오 타이드의 키나제 (뉴잉글랜드 Biolabs)를 사용하여 라벨이 붙지만, 그리고 구속력 WAS는 설명 결정.
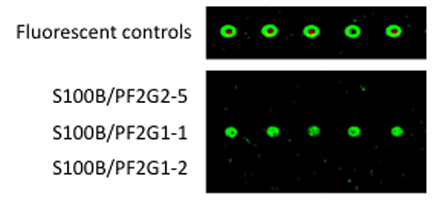
B. 5' - 아민 - derivatized 1 일의 aptamers은 microarrays를 Codelink을 결합했다. 정화 S100B 단백질이 1 일 aptamer에 바인딩했습니다, 슬라이드는 철저히 씻어서되었고, 2 차 aptamer는 1 일 aptamer에 바인딩되었습니다 AlexaFluor546 - 라벨 : S100B의 단지. rinsing를 통해 후, 형광은 ScanArray 스캐너를 사용하여 계량되었습니다.

C. 5' - thiol derivatized 1 일의 aptamers 표준 thiol 화학을 사용하는 오 나노 와이어에 결합했다. 2 차 aptamers은 같은 방식으로 50 나노미터 AuNPs에 결합했다. 정화 S100B 단백질 (왼쪽) 또는 정화 HtrA1 제어 단백질은 (오른쪽) 다음 derivatized 나노 와이어 먼저 바운드되었습니다. 철저한 rinsing 후, 2 차 aptamer - 50 나노미터 AuNPs은 이후 제 1 ST - aptamer - nanowire에 바인딩되었습니다 S100B 단지. rinsing를 통해 후 바운드 샌드위치 단지는 전자 현미경을 스캐닝 현장 방출을 사용하여 시각되었습니다. 스케일 바 = 1 μm의.
공개
감사의 말
우리는 그의 도움을 Microarray 핵심 시설에 크레이그 폴 감사합니다. 이 작품은 IMAT 프로그램에서 NIH / NCI 부여 # CA118591에 의해 지원되었다. SLD는 재정 지원을위한 펜실베니아 공간 부여 컨소시엄 활동을 인정한다. 이 책자는 또한 펜실베니아 주립 대학 재료 연구소 나노 제작 네트워크와 국립 과학 재단 (National Science Foundation) 공동 계약 코넬 대학과 번호 0335765, 국가 나노기술 인프라 네트워크에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Tris-HCl | |||
| HotMaster TAQ DNA Polymerase | 5 PRIME | ||
| dNTP Mix | Sigma-Aldrich | ||
| Acrylamide | Fisher Scientific | ||
| UltraPure 10X TBE Buffer | Invitrogen | ||
| Ammonium Persulfate | Bio-Rad | ||
| TEMED | Fisher Scientific | ||
| PhiX174 DNA/Hinf I DNA Marker | Promega Corp. | ||
| Ethidium Bromide | |||
| α-32P-dCTP | |||
| Phenol:ChCl3:IAA | Ambion | ||
| NaCl | |||
| Ethanol | |||
| Restriction Enzymes | New England Biolabs | ||
| Urea | Fisher Scientific | ||
| Photographic Film | ECE Scientific | ||
| PBS | GIBCO, by Life Technologies | ||
| CaCl2 | GIBCO, by Life Technologies | ||
| MgCl2 | GIBCO, by Life Technologies | ||
| Ni-NTA Agarose Beads | Qiagen | ||
| Polypropylene Column | Qiagen | ||
| NaHPO4 | |||
| NaAc | |||
| Detroit-551 cells | |||
| SK-MEL-31 cells | |||
| MEM | |||
| TrypLE Express | GIBCO, by Life Technologies | ||
| T4 DNA Ligase | New England Biolabs | ||
| Dimethyl Sulfoxide | Promega Corp. | ||
| Sp6 RNA Polymerase | Promega Corp. | ||
| RNase-Free DNase I | Promega Corp. | ||
| RNase Inhibitor | Promega Corp. | ||
| SensiScript Reverse Transcriptase | Qiagen | ||
| pCR-2.1-TOPO Vector | Invitrogen | ||
| DH5α Compotent Cells | Invitrogen | ||
| Plasmid Mini Kit | Qiagen | ||
| Vector NTI | Invitrogen | ||
| T4 Polynucleotide Kinase | New England Biolabs | ||
| γ-32P-ATP |
참고문헌
- Kulbachinskiy, A. V. Methods for selection of aptamers to protein targets. Biochemistry (Moscow). 72, 1505-1518 (2006).
- Mairal, T. Aptamers: molecular tools for analytical applications. Anal Bioanal Chem. 390, 989-1007 (2008).
- Stoltenburg, R., Reinemann, C., Strehlitz, B. SELEX -- A (r)evolutionary method to generate high-affinity nucleic acid ligands. Biomolec Engineering. 24, 381-403 (2007).
- Que-Gewirth, N. S., Sullenger, B. A. Gene therapy progress and prospects: RNA aptamers. Gene Ther. 14, 283-2891 (2007).
- Cowperthwaite, M. C., Ellington, A. D. Bioinformatic analysis of the contribution of primer sequences to aptamer structures. J Mol Evol. 67, 95-102 (2008).
- Shtatland, T., Gill, S. C., Javornik, B. E. Interactions of Escherichia coli RNA with bacteriophage MS2 coat protein: genomic SELEX. Nucleic Acids Res. 28, E93-E93 (2000).
- Jarosch, F., Buchner, K., Klussmann, S. In vitro selection using a dual RNA library that allows primerless selection. Nucleic Acids Res. 34, E86-E86 (2006).
- Vater, A., Jarosch, F., Buchner, K., Klussmann, S. Short bioactive Spiegelmers to migraine-associated calcitonin gene-related peptide rapidly identified by a novel approach: tailored-SELEX. Nucleic Acids Res. 31, E130-E130 (2003).
- Wen, J. D., Gray, D. M. Selection of genomic sequences that bind tightly to Ff gene 5 protein: primer-free genomic SELEX. Nucleic Acids Res. 32, E182-E182 (2004).
- Musheev, M. U., Krylov, S. N. Selection of aptamers by systematic evolution of ligands by exponential enrichment: addressing the polymerase chain reaction issue. Anal Chim Acta. 564, 91-916 (2006).
- Pan, W. H., Clawson, G. A. Primer-free aptamer selection using a random DNA library. Methods Mol Biol. , (2009).
- Pan, W., Xin, P., Clawson, G. A. Minimal-Primer and Primer-Free SELEX Protocols for Selection of Aptamers from Random DNA Libraries. BioTechniques. 44, 351-360 (2008).
- Nicewarner-Pena, S., Freeman, G., Reiss, B. Submicrometer metallic barcodes. Science. 294, 137-141 (2001).
- JC, H. u. l. t. e. e. n., CR, M. a. r. t. i. n. A general template-based method for the preparation of nanomaterials. J Materials Chem. 7, 1075-1087 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유