このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
細胞融合の検出のためのCre - LOX Pの組換えのアプローチインビボでの
要約
時間の経過とともに生物の細胞融合を追跡する方法について説明する。アプローチは、Creを利用しつのloxP再結合は、細胞融合によりルシフェラーゼ発現を誘導する。生成された発光シグナルは、末梢組織で〜1,000細胞の検出の感度バイオフォトニックイメージングシステムを用いて生体内で検出することができます。
要約
融合し、同じタイプの2つ以上のセルの能力は、骨格筋、骨、胎盤を含む多くの複雑な器官を形成し、進化の過程で後生動物に利用されている。現代の研究では、同じタイプの拡張機能を与えるの細胞の融合を示しています。例えば、胎盤のヒューズの栄養膜細胞が合胞体栄養細胞を形成する際に、合胞体栄養細胞はより未融合のトロホブラスト1月4日より母体胎児関門の栄養素やホルモンを輸送することができます。より最近の研究では、異なる種類の細胞の融合は、細胞の運命を導くことを実証。融合による"復帰"または細胞の運命の変更は、いったん細胞培養系に限定されると考えられていた。しかし、幹細胞移植の出現は、私たちが発見につながったと幹細胞を他の人は、in vivoでの体細胞と融合することができ、その融合は、幹細胞の分化5-7を容易にします。従って、細胞融合は、規制プロセスのcですしたがって、細胞の生存と分化を促進するのapableとさらに発展、組織の修復と疾患の病因の中心的な重要性の可能性があります。
適切な技術の不足が)1に、細胞融合の研究をされている制限することで、正確に時間をかけて)、トラックの融合製品を融合製品を識別し、2。ここでは、融合時に生物発光の誘導( 図1)を経由して、両方の制限に対処するために新しいアプローチを提示する、生物発光は 、in vivo 8-15 の高感度で検出することができます私たちは、ホタルルシフェラーゼ(Photinusスピラリス )遺伝子は隣接して配置符号化構造を利用する 。 loxP配列で挟まれた。細胞は、Creリコンビナーゼの蛋白質を発現する細胞でこの遺伝子のヒューズを表現するときは、 つのloxP部位が切断されると停止信号がルシフェラーゼの転写を可能に切除されているが、信号がinduciなので、終止コドンBLE、偽陽性シグナルの発生率は非常に低いです。のCre / loxPをシステム16、17を利用する既存の方法と異なり、我々は"生きて"検出信号を取り込んでいるし、それによって初めて、生体内で細胞融合の動態を追跡する機会を与える。
アプローチを実証するために、普遍的にCreリコンビナーゼを発現するマウスは、floxedストップコドンのルシフェラーゼ下流を表現するための構築物でトランスフェ幹細胞の受信者を務めた。幹細胞は、心筋内注射により移植し、移植生体内の画像解析は、の存在を追跡するために実施された後に時間をかけて心と周囲の組織の融合製品。このアプローチは、開発、疾患や成人の組織修復の任意の段階で任意の組織型における細胞融合を分析するために適合させることができる。
プロトコル
1。ドナー細胞のトランスフェクション
- 収穫間葉系幹細胞(親切に先生Peiman Hemattiから寄贈されたH1胚性幹細胞由来のMSCは、、代わりに、 生体内で融合する仮説任意の種の任意のセルのタイプを利用することができる)70 - 1Xのトリプシンコンフルエント80%(Mediatech、 5分間マナッサスVAは)。α- MEM完全培地(抗生物質フリー、Invitrogen社、カールスバッドカリフォルニア州)18でトリプシンを不活性化する。 5分間300 × gで遠心する。
- 注意深く上清を吸引してから再サスペンドペレットの1X PBS 1mLにと血球計算盤を用いて細胞を数える。
- 1.5 mLの遠心チューブに移す1.5 × 10 6細胞。 5分間300 × gで遠心する。
- 注意深く上清を吸引。 Rバッファー(ネオントランスフェクションシステム、Invitrogen社)とp231 pCMVe - betaAc - STOP - lucを(Addgene、ケンブリッジ、MA)6μgの(濃度2μg/ 5.0 × 10 5細胞)を300μLのペレットを再懸濁します。 Eバッファの代わりに3 mLの(Invitr製造業者のプロトコルごとのエレクトロポレーションのドッキングポート(ネオントランスフェクションシステム、Invitrogen社)にogen)。
- 100μLネオンのピペットチップへの細胞プラスミド溶液を移し、20ミリ秒と1500ボルトの大きさのパルスの持続時間とエレクトロ。場所は、9.7 mLのα- MEM完全培地を含む15 mLコニカルチューブに細胞をエレクトロポ。
- を10mLの総量を得るために1.5を追加で2回とプールトランスフェクトした細胞を繰り返します。 10 mLのα- MEM完全培地を含むT175フラスコに10 mLの細胞懸濁液(1.5 × 10 6細胞)を追加します。エレクトロポレーション後の細胞の生存率はT175あたり約4.5 × 10 5生細胞を得るために、約30%です。
- トランスフェクション後にα- MEM完全培地24時間を変更します。
- 80%コンフルエント(〜2 - - 3日エレクトロポレーション後)収穫は、70細胞をトランスフェクション。血球計算盤を用いて細胞数を実行し、1.0 × 10 6の濃度で細胞を再懸濁α- MEM完全培地のcells/50μL。最小化時の細胞は注入前に細胞死を減らすため懸濁液中で過ごす。
2。心筋内注入
- すべてのセルで構成的に発現するCreリコンビナーゼ(B6.C - TG(CMV - CRE)1Cgn / J、ジャクソン研究所、バーハーバー、するように設計トランスジェニックマウスで(フェニックスファーマシューティカル社、セントジョセフ、ミズーリ)イソフルランで麻酔を誘導するME)。
- バリカンまたは化学的脱毛剤を使用して胸部から髪を削除します。
- 150μLのストローク量で毎分130回の呼吸 - 120マウスの人工呼吸器で18ゲージのカテーテル(ベクトンディッキンソン&カンパニー、フランクリンレイクスNJ)と場所で挿管する。
- これにより、開胸術を生産する第四肋間隙を介して横方向の切開を加えます。
- 心臓の可視化、1 mLシリンジ(Temuroメディカル株式会社、サマセット、ニュージャージー州)を用いてトランスフェクトされた細胞懸濁液の2つの25μL注入し、28ゲージの針(Bectを作る上ディッキンソン&カンパニー、フランクリンレイクスNJ)。心筋内注入を容易にし、臓器に過度の損傷を防ぐために、針の頭〜90度に曲げる。
- 注射後、肋骨や筋肉の層を閉じるには、吸収性縫合糸(例えば、vicryl)を使用します。縫合の皮は4から0ナイロンや絹を使用してクローズ。
- マウスは麻酔と抜管から回復することができます。
- 対照群では、トランスフェクトされていない細胞とトランスフェクト細胞を(代わりに、Creをマウスが融合しがちではないトランスフェクト細胞を受信)受信野生型マウスの同じ濃度を受信するのCreマウスを培地のみ注射を受けたのCreマウスを含める必要があります。
3。バイオフォトニックイメージング
- イメージングの前に5〜15分、腹腔内(IP)の15 mg / mLのD -ルシフェリン(キャリパーライフサイエンス、マサチューセッツ州ホプキントン)のマウスの体重1g当たり10μLを注入する。
- 誘導のために4%でイソフルランを経由してマウスに麻酔を誘発するD 1 - メンテナンス2%。
- フェイスマスクが1の投与によるイメージングボックスで仰臥位の場所をマウス - メンテナンス麻酔用イソフルラン2%(Xenogenバイオフォトニックイメージングシステム、ホプキントン、MA)。いくつかのマウスを同時に撮像することができます。発光シグナルの簡単な比較のための実験用マウスで画像偽のコントロールマウス。
- リビングイメージのソフトウェアを(Xenogen)を使用して、(通常は60秒、結果を参照)、適切な露光時間を設定します。マウスに合わせて感度の変化を防ぐために、画像全体の面積の整合性を保つために、画像の領域を設定します。 4.5センチメートルの被写体の高さを設定します。
- ビューのフィールド内にマウスまたはマウスに対応する発光強度の信号を取得し、変更されていない画像ファイルを保存します。プロセスイメージは、コントロールまたはunmanipulatedマウスに対応したバックグラウンド信号を除去する。背景上の強度値は、動物内で融合細胞に対応しています。強度解析は、リビングの画像ソフト(Xenogen)またはオープンソースの画像解析ソフトウェアを用いて行うことができる。 Typically、関心領域は、(ROI)の動物と実験との間で強度のデータを比較するために選択されています。
4。代表的な結果
Xenogenバイオフォトニックイメージングシステムの感度は、恒常的にC57/BL6マウス(ジャクソン研究所)の心筋に配信されました(231 - LUC - D3H1、Xenogen)ルシフェラーゼ発現する細胞株を決定する。 細胞を1 xの濃度で注入した10 6、1 × 10 3、または1 × 10 1セル。セルの製品納入後、6時間、マウスは、ルシフェリンを腹腔内注射し、Xenogenシステムを用いて画像化した。特定の信号は、1,000細胞(画像化された6マウスの2、 図2)で検出されたが、検出は10,000細胞(画像化された6匹の6)で、より信頼性が高くすることができます。重要なのは、この研究はまた、ルシフェラーゼ発現細胞と信号強度の数との間の大まかな相関関係を確立するのに役立った。
細胞融合を検出し、追跡に記述されたプロトコルの有用性を実証するため、MSCをプラスミドつのloxP -ストップつのloxP -ルシフェラーゼ(Addgene) と Cre発現マウスの心筋に供給されるトランスフェクションした。細胞送達後の約1週間は、マウスが最初にD -ルシフェリンを注入することなく Xenogenシステムを用いて画像化した。予想通り、酵素基質なしで、ない強度の信号が( 図3)は検出されなかった。次に、D -ルシフェリンを腹腔内投与し、ルシフェラーゼの強度に応じた信号を注入したため、細胞融合は、テストされた2つの4のマウスで検出された。同様の信号は、 このケースでは、研究は、心臓と周囲の組織の評価を可能にするために終了しました 。MSC -結合融合製品はin vivoで維持することができます示唆し、1週間後( 図3)検出されたが、一方は想像ができる長期的な分析およびメンテナンス、増殖を追跡するために、より頻繁なイメージングマウスの融合製品の開発は、おそらく移行。
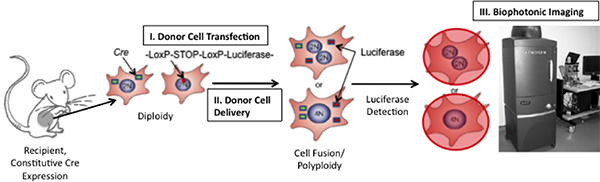
図1。 インビボでの細胞融合を検出する手法の概略図。floxedルシフェラーゼが発現するプラスミドをCreを発現するマウスの細胞と移植された細胞との融合が発生した場合は、ルシフェラーゼを発現されます。ルシフェラーゼは、マウス、次にイメージングマウスをXenogenバイオフォトニックイメージングシステムを用いて(19日から適応)に、酵素基質、D -ルシフェリンを注入することによって検出することができます
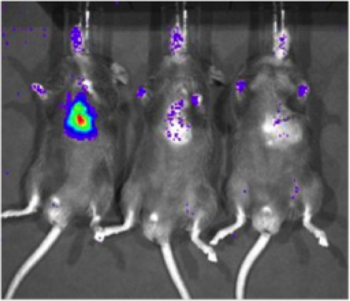
図2。バイオフォトニックイメージングによる心臓組織におけるルシフェラーゼ発現細胞の検出の感度 。構成的に(231 - LUC - D3H1、Xenogen)ルシフェラーゼ発現する細胞株は様々な総細胞数でのC57/BL6マウスの心筋内のスペースに配信されました。マウスの代表的なイメージが再1 × 10 6、1 × 10 3と1 × 10 1細胞を(左から右へ)ceivingことが示され、画像は約6時間注入後に行った。
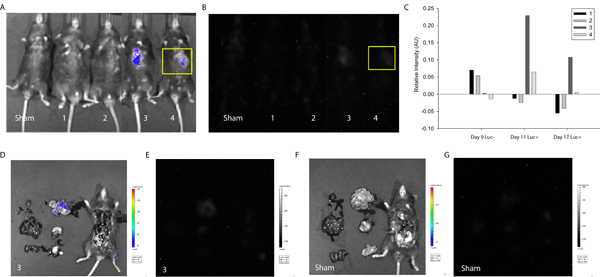
図3。細胞融合の暗示インビボ発光での定量化。MSCは、プラスミドつのloxP -ストップ- loxP部位-ルシフェラーゼおよび Cre発現マウスの心筋に供給されるトランスフェクションした。約1週間と細胞送達後2週間は、Creをマウスに細胞融合を示す発光の強度を測定するためにXenogenバイオフォトニックイメージングシステムを用いて画像化した。偽とマウス1-4の発光の写真と強度の(A)オーバーレイ(左から右へ)細胞送達後17日間。 (B)シャムとマウス1-4の発光の強度(左から右へ)細胞送達後17日間。関心領域は、注射部位と強度のLに相当する(黄色)に選ばれましたevelsはImageJの(フリーソース)ソフト20を使用して測定した。 (C)発光の強度は、全ての実験条件に対して偽マウスの利息の同じ領域に正規化された。一週間で、マウスの3と4は、マウスの細胞と移植MSCの自発的な融合を示唆して正の発光シグナルを示した。信号は2週間後にマウス3に持続した。マウス3に対応する信号の臓器特異的局在を決定するために、胸腔が露出し、主要な臓器が摘出し、画像化した。写真とマウス3の発光の強度の(D)オーバーレイ。小腸における強度信号の局在に注意してください。マウス3の発光の(E)強度。写真と偽マウスの発光の強度の(F)オーバーレイ。偽マウスの発光の(G)強度。
ディスカッション
方法は、小動物を含めて、生物で、初めて、可能にするここで細胞融合の離散的な同定と時間的な分析を説明した。アプローチは、その後のバイオフォトニック画像解析でCre - loxP組換えを兼ね備えています。アプローチだけでなく、細胞 - 細胞融合だけでなく、ウイルスの細胞融合を追跡に適しているので、ウイルス感染を追跡するのに役立つ可能性があります。画像解析は急速であり、そ...
開示事項
利害の衝突は宣言されません。
謝辞
著者らは、寛大にH1のMSC、と博士はティムのハッカー、博士Gouqingソングとウィスコンシン心臓血管生理学の大学の先生ジルコッホを提供するための博士Peiman Hemmatiを(医学科、ウィスコンシン大学マディソン校)に感謝いたしますマウスの手術を行うための中核施設。この作品は、ブライアンフリーマンとNIH R21 HL089679に大学院研究フェローシップを通じて、全米科学財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ネオントランスフェクションシステム | インビトロジェン、カールスバッド、カリフォルニア州 | MPK5000 | |
| ネオン100μLキット | インビトロジェン、カールスバッド、カリフォルニア州 | MPK10025 | RとEバッファが含まれています |
| - MEM粉末 | インビトロジェン、カールスバッド、カリフォルニア州 | 12000-022 | |
| ウシ胎児血清(FBS) | Hyclone、ローガンユタ州 | SH30070.03 | |
| B6.C - TG(CMV - CRE)1Cgn / J | ジャクソン研究所、バーハーバー、ME | 006054 | |
| 10Xトリプシン | フィッシャーサイエンティフィック、フォレストローン、ニュージャージー州 | MT - 25 - 054 - Clを | |
| L -グルタミン | フィッシャーサイエンティフィック、フォレストローン、ニュージャージー州 | 25030-081 | |
| D -ルシフェリン | キャリパーライフサイエンス、マサチューセッツ州ホプキントン | 122796 | |
| Xenogenバイオフォトニックイメージングシステム | キャリパーライフサイエンス、マサチューセッツ州ホプキントン | IVISスペクトラム | |
| ナトリウムBiocarbonate | シグマアルドリッチ、セントルイス、MO | S6014 - 500G | |
| 非必須アミノ酸 | インビトロジェン、カールスバッド、カリフォルニア州 | 11140-050 |
参考文献
- Bernirschke, K. K. P. . Pathology of the Human Placenta. , (2000).
- Hoshina, M., Boothby, M., Boime, I. Cytological localization of chorionic gonadotropin alpha and placental lactogen mRNAs during development of the human placenta. J. Cell. Biol. 93, 190-198 (1982).
- Johansen, M., Redman, C. W., Wilkins, T., Sargent, I. L. Trophoblast deportation in human pregnancy--its relevance for pre-eclampsia. Placenta. 20, 531-539 (1999).
- Redman, C. W., Sargent, I. L. Placental debris, oxidative stress and pre-eclampsia. Placenta. 21, 597-602 (2000).
- Ogle, B. M. Spontaneous fusion of cells between species yields transdifferentiation and retroviral transfer in vivo. FASEB. J. 18, 548-550 (2004).
- Nygren, J. M. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat. Med. 10, 494-501 (2004).
- Nygren, J. M. Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion. Nat. Cell. Biol. 10, 584-592 (2008).
- Kutschka, I. Adenoviral human BCL-2 transgene expression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts. Circulation. 114, I174-I180 (2006).
- Min, J. J. In vivo bioluminescence imaging of cord blood derived mesenchymal stem cell transplantation into rat myocardium. Ann. Nucl. Med. 20, 165-170 (2006).
- Malstrom, S. E., Tornavaca, O., Meseguer, A., Purchio, A. F., West, D. B. The characterization and hormonal regulation of kidney androgen-regulated protein (Kap)-luciferase transgenic mice. Toxicol. Sci. 79, 266-277 (2004).
- Weir, L. R. Biophotonic imaging in HO-1.luc transgenic mice: real-time demonstration of gender-specific chloroform induced renal toxicity. Mutat. Res. 574, 67-75 (2005).
- Rajashekara, G., Glover, D. A., Banai, M., O'Callaghan, D., Splitter, G. A. Attenuated bioluminescent Brucella melitensis mutants GR019 (virB4), GR024 (galE), and GR026 (BMEI1090-BMEI1091) confer protection in mice. Infect. Immun. 74, 2925-2936 (1090).
- Kadurugamuwa, J. L. Noninvasive biophotonic imaging for monitoring of catheter-associated urinary tract infections and therapy in mice. Infect. Immun. 73, 3878-3887 (2005).
- Ryan, P. L., Youngblood, R. C., Harvill, J., Willard, S. T. Photonic monitoring in real time of vascular endothelial growth factor receptor 2 gene expression under relaxin-induced conditions in a novel murine wound model. Ann. N.Y. Acad. Sci. 1041, 398-414 (2005).
- Zhu, L. Non-invasive imaging of GFAP expression after neuronal damage in mice. Neurosci. Lett. 367, 210-212 (2004).
- Noiseux, N. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation. Mol. Ther. 14, 840-850 (2006).
- Ajiki, T. Composite tissue transplantation in rats: fusion of donor muscle to the recipient site. Transplant Proc. 37, 208-209 (2005).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Exp. Hematol. 36, 350-359 (2008).
- Ogle, B. M., Cascalho, M., Platt, J. L. Biological implications of cell fusion. Nat. Rev. Mol. Cell. Biol. 6, 567-575 (2005).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved