Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Cre-LOX P Рекомбинация подход для обнаружения сотовых Fusion В Vivo
В этой статье
Резюме
Метод для отслеживания слияния клеток в живом организме с течением времени описывается. Подход использует Cre- LoxP Рекомбинации, чтобы побудить люциферазы выражение на слияние клеток. Люминесцентный сигнал, генерируемый могут быть обнаружены в живых организмов, использующих Биофотонный систем визуализации с чувствительностью обнаружения ~ 1000 клеток в периферических тканях.
Аннотация
The ability of two or more cells of the same type to fuse has been utilized in metazoans throughout evolution to form many complex organs, including skeletal muscle, bone and placenta. Contemporary studies demonstrate fusion of cells of the same type confers enhanced function. For example, when the trophoblast cells of the placenta fuse to form the syncytiotrophoblast, the syncytiotrophoblast is better able to transport nutrients and hormones across the maternal-fetal barrier than unfused trophoblasts1-4. More recent studies demonstrate fusion of cells of different types can direct cell fate. The "reversion" or modification of cell fate by fusion was once thought to be limited to cell culture systems. But the advent of stem cell transplantation led to the discovery by us and others that stem cells can fuse with somatic cells in vivo and that fusion facilitates stem cell differentiation5-7. Thus, cell fusion is a regulated process capable of promoting cell survival and differentiation and thus could be of central importance for development, repair of tissues and even the pathogenesis of disease.
Limiting the study of cell fusion, is lack of appropriate technology to 1) accurately identify fusion products and to 2) track fusion products over time. Here we present a novel approach to address both limitations via induction of bioluminescence upon fusion (Figure 1); bioluminescence can be detected with high sensitivity in vivo8-15. We utilize a construct encoding the firefly luciferase (Photinus pyralis) gene placed adjacent to a stop codon flanked by LoxP sequences. When cells expressing this gene fuse with cells expressing the Cre recombinase protein, the LoxP sites are cleaved and the stop signal is excised allowing transcription of luciferase. Because the signal is inducible, the incidence of false-positive signals is very low. Unlike existing methods which utilize the Cre/LoxP system16, 17, we have incorporated a "living" detection signal and thereby afford for the first time the opportunity to track the kinetics of cell fusion in vivo.
To demonstrate the approach, mice ubiquitously expressing Cre recombinase served as recipients of stem cells transfected with a construct to express luciferase downstream of a floxed stop codon. Stem cells were transplanted via intramyocardial injection and after transplantation intravital image analysis was conducted to track the presence of fusion products in the heart and surrounding tissues over time. This approach could be adapted to analyze cell fusion in any tissue type at any stage of development, disease or adult tissue repair.
протокол
1. Трансфекция клетки-донора
- Урожай мезенхимальные стволовые клетки (МСК, полученных из H1 эмбриональных стволовых клеток любезно пожертвовал д-р Пейман Hematti; альтернативно, любого типа клеток какого-либо вида гипотетически предохранитель в естественных условиях могут быть использованы), когда 70 - 80%, сливающийся с 1X трипсина (Mediatech, Манассас В.А.) в течение 5 мин. Деактивировать трипсина с α-MEM полной среде (антибиотик бесплатно, Invitrogen, Карловы Вары CA) 18. Центрифуга при 300 мкг в течение 5 мин.
- Тщательно аспирата супернатант и вновь приостановить гранул в 1 мл 1X PBS и считать клетки, используя hemacytometer.
- Передача 1,5 х 10 6 клеток в 1,5 мл трубки центрифуги. Центрифуга при 300 мкг в течение 5 мин.
- Тщательно аспирата супернатант. Ресуспендируют осадок в 300 мкл буфера R (Neon трансфекции системы, Invitrogen) и 6 мкг (2 мкг / 5,0 х 10 5 клеток) P231 pCMVe-betaAc-СТОП-Люк (Addgene, Кембридж, Массачусетс). Место 3 мл буфера E (InvitrOgen) к порту электропорации стыковки в соответствии с протоколом производителя (Neon системы Трансфекция, Invitrogen).
- Передача клеточной плазмиды решение 100 мкл кончика пипетки Неон и electroporate с длительностью импульса 20 мс и величиной 1500 вольт. Место электропорации клеток в 15 мл коническую пробирку, содержащую 9,7 мл α-MEM полной среде.
- Повторите шаг 1,5 еще два раза и бассейн трансфицированных клеток для получения общего объема 10 мл. Добавить 10 мл клеточной суспензии (1,5 х 10 6 клеток), чтобы T175 колбу, содержащую 10 мл α-MEM полной среде. Жизнеспособность клеток после электропорации составляет около 30%, чтобы получить примерно 4,5 х 10 5 жизнеспособных клеток на T175.
- Изменение α-MEM полной среде 24 часа после трансфекции.
- Урожай трансфицированных клеток, когда 70 - 80% сливной (~ 2 - 3 дня после электропорации). Выполните клеток использованием hemacytometer и ресуспендируйте клетки в концентрации 1,0 · 10 6cells/50 мкл α-MEM полной среде. Свернуть клетки времени проводят во взвешенном состоянии, чтобы уменьшить гибель клеток перед инъекцией.
2. Intramyocardial инъекций
- Вызвать наркозом изофлуран (Phoenix Pharmaceuticals, Inc, Санкт-Джозеф, штат Миссури) на трансгенных мышей разработаны для конститутивно выражают Cre рекомбиназы в каждой клетке (B6.C-TG (ЦМВ-CRE) 1Cgn / J, лаборатории Джексона, Бар-Харбор, ME).
- Удалить волосы с груди регионе с помощью машинки для стрижки волос или для удаления химических волос.
- Интубировать с 18 калибр катетера (Becton Dickinson & Co, Франклин озер Нью-Джерси) и место на мышь вентилятором на 120 - 130 вдохов в минуту с инсультом объеме 150 мкл.
- Сделать боковой разрез через четвертом межреберье таким образом производя торакотомии.
- Визуализация сердца, сделать два 25 мкл инъекции трансфицированных суспензии клеток с использованием 1 мл шприц (Temuro Medical Corporation, Сомерсет, штат Нью-Джерси) и 28 иглы (Bectна Дикинсон & Co, Франклин озер Нью-Джерси). Чтобы облегчить intramyocardial впрыска и предотвратить чрезмерное повреждение органа, согните иглу головы ~ 90 градусов.
- После инъекции, используя рассасывающиеся нити (например, Викрил), чтобы закрыть ребра и мышечные слои. Шовный кожи закрыт с помощью 4-0 нейлона или шелка.
- Разрешить мыши, чтобы оправиться от наркоза и экстубации.
- Контрольные группы должны включать Cre мышей, получавших инъекции только средний, Cre мышей, получавших такую же концентрацию untransfected клеток и мышей дикого типа получения трансфицированных клеток (в качестве альтернативы Cre мышей, получавших трансфекции клетки не склонны к предохранитель).
3. Биофотонный изображений
- От пяти до пятнадцати минут, прежде чем изображения, внутрибрюшинно (IP) вводят 10 мкл на грамм мыши массы тела от 15 мг / мл D-люциферин (суппорт Life Sciences, Хопкинтон, Массачусетс).
- Вызвать анестезии на мышах с помощью изофлуран на уровне 4% для индукционныхг 1 - 2% на техническое обслуживание.
- Место мышей спине в области обработки изображений коробки с маской управляющей 1 - 2% изофлуран для поддержания анестезии (Xenogen Биофотонный системы Imaging, Хопкинтон, Массачусетс). Некоторые мыши могут быть отображены одновременно. Изображение фиктивный управления мышью с экспериментальным мышам для легкого сравнения люминесцентного сигнала.
- Использование живой образ программного обеспечения (Xenogen), установить соответствующее время экспозиции (обычно 60 сек, см. результаты). Установить область изображения в соответствии с мышами и сохранить площадь постоянной в течение всего изображения, чтобы предотвратить изменения в чувствительности. Установить предмет высотой в 4,5 см.
- Приобретать интенсивности люминесценции сигнал, соответствующий мыши или мышей в поле зрения и сохранения неизмененных файлов изображений. Обработать изображения, чтобы удалить фон сигнал, соответствующий контроль или unmanipulated мыши. Интенсивность значения выше фона соответствуют плавленого клеток в животных. Интенсивность анализ может быть проведен с использованием живой образ программного обеспечения (Xenogen) или с открытым исходным кодом программное обеспечение для анализа изображений. Тypically, область интереса (ROI) выбран для сравнения интенсивности данных между животными и экспериментов.
4. Представитель Результаты
Для определения чувствительности Xenogen Биофотонный системы Imaging, клеточная линия которого конститутивно выражает люциферазы (231-LUC-D3H1, Xenogen) был доставлен в миокарде C57/Bl6 мышей (Jackson Laboratory). Клетки вводили в концентрации 1 х 10 6, 1 х 10 3, или 1 х 10 1 клеток. Через шесть часов после доставки ячейки, мышам вводили внутрибрюшинно люциферин и отображаемого использованием Xenogen системы. Определенный сигнал могут быть обнаружены с 1000 клеток (2 из 6 мышей отображаемого, Рисунок 2), но обнаружение была более надежной с 10000 клеток (6 из 6 мышей отображаемого). Важно, что это исследование также призван способствовать налаживанию грубая корреляция между числом люциферазы экспрессирующих клеток и интенсивности сигнала.
Чтобы продемонстрировать полезность описанного в протоколе обнаружения и отслеживания слияния клеток, МСК были трансфицированных LoxP-Stop-LoxP-люциферазы плазмиды (Addgene) и доставлен в миокарде Cre экспрессией мышей. Примерно через неделю после доставки ячейки, мыши были впервые отображаемого использованием Xenogen системы без D-люциферин инъекции. Как и ожидалось, без ферментативной субстрата, интенсивность сигнала не было обнаружено (рис. 3). Затем, D-люциферин вводили внутрибрюшинно и сигнал, соответствующий люциферазы интенсивности и, следовательно, слияние клеток был обнаружен в двух из четырех мышей испытания. Аналогичный сигнал был обнаружен неделю спустя (рис. 3), предполагая, MSC-связанных продуктов плавления может быть сохранен в естественных условиях. В этом случае исследование было прекращено, чтобы учесть оценку сердце и окружающие ткани, но можно представить себе долгосрочные анализы и более частые изображения отслеживать техническое обслуживание, распространениег, возможно, миграции продуктов синтеза в организме мышей.
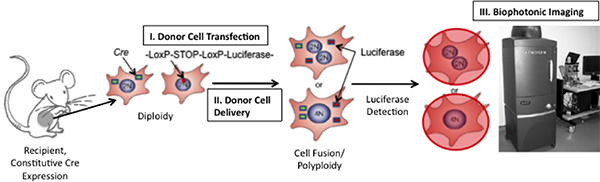
Рисунок 1. Схема Техника для обнаружения слияния клеток в живом организме. Если слияние Cre-экспрессирующих клеток мыши и пересадили клетки, экспрессирующие плазмиды floxed люциферазы происходит, люциферазы выражена не будет. Люциферазы могут быть обнаружены путем введения ферментативной подложки, D-люциферин, в мыши, а затем изображение мыши, используя Xenogen Биофотонный-изображений (Адаптировано из 19)
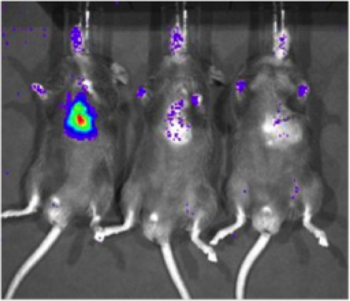
Рисунок 2. Чувствительность обнаружения люциферазы-экспрессирующих клеток в сердечной ткани с Биофотонный изображений. Клеточная линия которого конститутивно выражает люциферазы (231-LUC-D3H1, Xenogen) был доставлен в intramyocardial пространство C57/Bl6 мышей на различных общего количества клеток. Представитель изображения мышей повторноприемной 1 х 10 6, 1 х 10 3 и 1 х 10 1 клеток (слева направо) отображаются, работы с изображениями было проведено около 6 часов после инъекции.
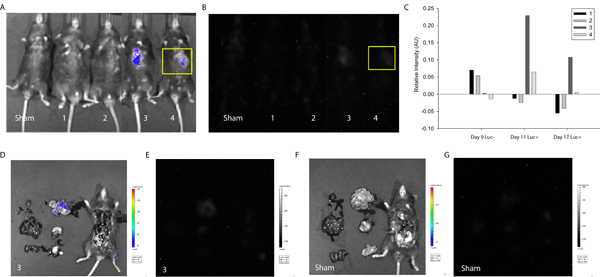
Рисунок 3. Количественная В Vivo Люминесценция Свидетельством слияния клеток. МСК были трансфицированных LoxP-Stop-LoxP-люциферазы плазмиды и доставлены в миокарде Cre экспрессией мышей. Примерно неделю и через две недели после доставки ячейки, Cre мышей были обследованы использованием Xenogen Биофотонный Система визуализации для измерения интенсивности люминесценции указывает на слияние клеток. (А) Наложение фотографии и интенсивность свечения притворство и мышей 1-4 (слева направо) через 17 дней после доставки ячейки. (В) Интенсивность свечения притворство и мышей 1-4 (слева направо) через 17 дней после доставки ячейки. Интересующей нас области был выбран (желтый), соответствующие места инъекции и интенсивность лevels определяли с помощью ImageJ (бесплатный источник) программного обеспечения 20. (C) Интенсивность свечения была нормализована к той же области интереса на фиктивный мыши для всех экспериментальных условиях. На одну неделю, мышей 3 и 4 показало положительный сигнал люминесценции свидетельствует спонтанные слияния клетка мыши и трансплантированных МСК. Сигнал упорно мыши 3 на две недели. Для определения конкретных органов локализации сигнала, соответствующего мыши 3, грудной полости, был разоблачен и первичные органы вырезали и образ. (D) Наложение фотографии и интенсивность свечения мыши 3. Обратите внимание, локализации интенсивности сигнала в тонком кишечнике. (E) Интенсивность свечения мыши 3. (F) Наложение фотографии и интенсивность свечения фиктивный мыши. (G) Интенсивность свечения фиктивный мыши.
Обсуждение
Описанный здесь метод позволяет, в первый раз, дискретные идентификации и временной анализ слияния клеток в организме, в том числе мелких животных. Подход сочетает Cre-LoxP рекомбинации с последующей Биофотонный анализа изображений. Подход поддаются отслеживанию не только клеточного сли...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить д-ра Пейман Хеммати (Департамент медицины, Университет Висконсин-Мэдисон) для предоставления щедро H1 МСК, и доктор Тим Хакер, доктор Gouqing песни и г-жа Джилл Кох из университета Висконсина сердечно-сосудистой физиологии Основной фонд для выполнения операции мыши. Работа выполнена при поддержке Национального научного фонда через стипендий Исследование Брайана Фримен и НИЗ R21 HL089679.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Neon трансфекции системы | Invitrogen, Карлсбад, Калифорния | MPK5000 | |
| Neon 100 мкл Kit | Invitrogen, Карлсбад, Калифорния | MPK10025 | Содержит R и E буфера |
| MEM-порошка | Invitrogen, Карлсбад, Калифорния | 12000-022 | |
| Эмбриональной бычьей сыворотки (FBS) | Hyclone, Логан UT | SH30070.03 | |
| B6.C-TG (ЦМВ-CRE) 1Cgn / J | Лаборатории Джексона, Bar Harbor, ME | 006054 | |
| Трипсин 10X | Fisher Scientific, Forest Lawn, Нью-Джерси | МТ-25-054-Cl | |
| L-глютамин | Fisher Scientific, Forest Lawn, Нью-Джерси | 25030-081 | |
| D-люциферин | Caliper Life Sciences, Хопкинтон, М. А. | 122796 | |
| Xenogen Биофотонный-изображений | Caliper Life Sciences, Хопкинтон, М. А. | ИВИС спектра | |
| Натрий Biocarbonate | Sigma Aldrich, Сент-Луис, Миссури | S6014-500G | |
| Номера для незаменимых аминокислот | Invitrogen, Карлсбад, Калифорния | 11140-050 |
Ссылки
- Bernirschke, K. K. P. . Pathology of the Human Placenta. , (2000).
- Hoshina, M., Boothby, M., Boime, I. Cytological localization of chorionic gonadotropin alpha and placental lactogen mRNAs during development of the human placenta. J. Cell. Biol. 93, 190-198 (1982).
- Johansen, M., Redman, C. W., Wilkins, T., Sargent, I. L. Trophoblast deportation in human pregnancy--its relevance for pre-eclampsia. Placenta. 20, 531-539 (1999).
- Redman, C. W., Sargent, I. L. Placental debris, oxidative stress and pre-eclampsia. Placenta. 21, 597-602 (2000).
- Ogle, B. M. Spontaneous fusion of cells between species yields transdifferentiation and retroviral transfer in vivo. FASEB. J. 18, 548-550 (2004).
- Nygren, J. M. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat. Med. 10, 494-501 (2004).
- Nygren, J. M. Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion. Nat. Cell. Biol. 10, 584-592 (2008).
- Kutschka, I. Adenoviral human BCL-2 transgene expression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts. Circulation. 114, I174-I180 (2006).
- Min, J. J. In vivo bioluminescence imaging of cord blood derived mesenchymal stem cell transplantation into rat myocardium. Ann. Nucl. Med. 20, 165-170 (2006).
- Malstrom, S. E., Tornavaca, O., Meseguer, A., Purchio, A. F., West, D. B. The characterization and hormonal regulation of kidney androgen-regulated protein (Kap)-luciferase transgenic mice. Toxicol. Sci. 79, 266-277 (2004).
- Weir, L. R. Biophotonic imaging in HO-1.luc transgenic mice: real-time demonstration of gender-specific chloroform induced renal toxicity. Mutat. Res. 574, 67-75 (2005).
- Rajashekara, G., Glover, D. A., Banai, M., O'Callaghan, D., Splitter, G. A. Attenuated bioluminescent Brucella melitensis mutants GR019 (virB4), GR024 (galE), and GR026 (BMEI1090-BMEI1091) confer protection in mice. Infect. Immun. 74, 2925-2936 (1090).
- Kadurugamuwa, J. L. Noninvasive biophotonic imaging for monitoring of catheter-associated urinary tract infections and therapy in mice. Infect. Immun. 73, 3878-3887 (2005).
- Ryan, P. L., Youngblood, R. C., Harvill, J., Willard, S. T. Photonic monitoring in real time of vascular endothelial growth factor receptor 2 gene expression under relaxin-induced conditions in a novel murine wound model. Ann. N.Y. Acad. Sci. 1041, 398-414 (2005).
- Zhu, L. Non-invasive imaging of GFAP expression after neuronal damage in mice. Neurosci. Lett. 367, 210-212 (2004).
- Noiseux, N. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation. Mol. Ther. 14, 840-850 (2006).
- Ajiki, T. Composite tissue transplantation in rats: fusion of donor muscle to the recipient site. Transplant Proc. 37, 208-209 (2005).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Exp. Hematol. 36, 350-359 (2008).
- Ogle, B. M., Cascalho, M., Platt, J. L. Biological implications of cell fusion. Nat. Rev. Mol. Cell. Biol. 6, 567-575 (2005).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены