É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A Cre-Lox Abordagem Recombinação P para Detecção de fusão celular In Vivo
Neste Artigo
Resumo
Um método para controlar a fusão de células de organismos vivos ao longo do tempo é descrito. A abordagem utiliza Cre- LoxP para induzir a expressão luciferase sobre fusão celular. O sinal luminoso gerado pode ser detectado nos organismos vivos utilizando sistemas de imagens biofotônica com uma sensibilidade de detecção de ~ 1.000 células nos tecidos periféricos.
Resumo
A capacidade de duas ou mais células do mesmo tipo para fundir tem sido utilizado em metazoários ao longo da evolução para formar muitos órgãos complexos, incluindo o músculo esquelético, ossos e placenta. Estudos contemporâneos demonstram fusão de células do mesmo tipo confere função melhorada. Por exemplo, quando as células do trofoblasto do fusível placenta para formar o sinciciotrofoblasto, o sinciciotrofoblasto é mais capaz de transportar nutrientes e hormônios através da barreira materno-fetal do trofoblasto não fundido 1-4. Estudos mais recentes demonstram a fusão de células de diferentes tipos pode direcionar o destino da célula. A "reversão" ou modificação do destino da célula por fusão já foi pensado para ser limitada a sistemas de cultura de células. Mas o advento do transplante de células-tronco levou à descoberta por nós e outras que as células-tronco podem se fundir com as células somáticas in vivo e que a fusão facilita a diferenciação de células-tronco 5-7. Assim, fusão celular é um processo regulado capable de promover a sobrevivência e diferenciação celular e, portanto, poderia ser de importância central para o reparo, o desenvolvimento de tecidos e até mesmo a patogênese da doença.
Limitar o estudo da fusão celular, é a falta de tecnologia apropriada a 1) identificar com precisão produtos de fusão e 2) produtos de fusão faixa ao longo do tempo. Aqui apresentamos uma nova abordagem para abordar tanto limitações através da indução de bioluminescência em fusão (Figura 1);. Bioluminescência pode ser detectado com alta sensibilidade in vivo 15/08 Nós utilizamos uma construção que codifica a luciferase do firefly (Photinus pyralis) gene colocado adjacente ao um códon de parada flanqueado por seqüências LoxP. Quando as células expressando este gene fusível com células expressando a proteína Cre recombinase, os sites são clivados e LoxP o sinal de parada é retirado permitindo a transcrição de luciferase. Como o sinal é inducible, a incidência de falsos-positivos sinais é muito baixa. Ao contrário dos métodos já existentes, que utilizam o sistema Cre / LoxP 16, 17, foi incorporado um "viva" sinal de detecção e, assim, pagar pela primeira vez a oportunidade de acompanhar a cinética de fusão celular in vivo.
Para demonstrar a abordagem, os camundongos ubiquitously expressar Cre recombinase serviu como receptores de células-tronco transfectadas com uma construção para expressar a jusante luciferase de um códon de parada floxed. Células-tronco foram transplantadas via injeção intramiocárdica e depois do transplante de análise de imagem intravital foi conduzido para rastrear a presença de produtos de fusão no coração e tecidos circundantes ao longo do tempo. Esta abordagem pode ser adaptada para analisar fusão celular em qualquer tipo de tecido, em qualquer estágio da doença, desenvolvimento ou reparação de tecidos adultos.
Protocolo
1. Transfection célula doadora
- Células-tronco mesenquimais da colheita (MSCs derivadas de células-tronco embrionárias H1 gentilmente doados pelo Dr. Peiman Hematti, alternativamente, qualquer tipo de célula de qualquer espécie a hipótese de fundir in vivo pode ser empregado), quando 70-80% confluente com 1X tripsina (Mediatech, Manassas VA) por 5 min. Inativar tripsina com α-MEM médio completo (livre de antibióticos, Invitrogen, Carlsbad CA) 18. Centrifugar a 300 xg por 5 min.
- Aspirar cuidadosamente o sobrenadante e re-suspensão pellet em 1 ml de 1X PBS e contagem de células usando um hemocitômetro.
- Transferência de 1,5 x 10 6 células para um tubo de centrífuga de 1,5 mL. Centrifugar a 300 xg por 5 min.
- Aspirar cuidadosamente o sobrenadante. Ressuspender pellet em 300 mL de R Buffer (Sistema de Transfection Neon, Invitrogen) e 6 mg (2 mg / 5,0 x 10 5 células) da P231 pCMVe-betaAc-STOP-luc (Addgene, Cambridge, MA). Colocar 3 mL de tampão de E (InvitrOgen) à porta docking eletroporação por protocolo do fabricante (Sistema de Transfection Neon, Invitrogen).
- Transferência de células-plasmídeo solução para a ponta da pipeta de 100 L Neon e electroporate com uma duração de pulso de 20 ms e uma magnitude de 1,5 mil volts. Coloque electroporated células em um tubo cônico de 15 mL contendo 9,7 mL meio α-MEM completo.
- Repita o passo 1,5 e duas vezes mais células transfectadas piscina para produzir um volume total de 10 mL. Adicione o 10 mL de suspensão celular (1,5 x 10 6 células) para um balão contendo 10 mL T175 α-MEM médio completo. Viabilidade celular após a eletroporação é de aproximadamente 30%, para produzir cerca de 4,5 x 10 5 células viáveis por T175.
- Alterar α-MEM completo médio de 24 horas após transfecção.
- Colheita transfectadas células quando 70-80% confluentes (~ 2-3 dias após eletroporação). Realizar contagem de células usando um hemocitômetro e ressuspender as células em uma concentração de 1,0 x 10 6cells/50 mL de α-MEM médio completo. Células minimizar o tempo gasto em suspensão para reduzir a morte das células antes da injeção.
2. Injeção intramiocárdico
- Induzir a anestesia por isoflurano (Phoenix Pharmaceuticals, Inc., St. Joseph, MO) em camundongos manipulados geneticamente para expressar constitutivamente Cre recombinase em cada célula (B6.C-Tg (CMV-CRE) 1CGN / J, Jackson Laboratory, Bar Harbor, ME).
- Remover os pêlos da região do tórax usando cortar cabelo ou removedor de pêlos químicos.
- Entubar com um cateter de calibre 18 (Becton Dickinson & Co, Franklin Lakes NJ) e colocar no ventilador do mouse no 120-130 respirações por minuto, com um volume de 150 mL acidente vascular cerebral.
- Fazer incisão lateral em todo o quarto espaço intercostal produzindo assim uma toracotomia.
- Visualizando o coração, fazer duas injeções 25 mL de suspensão de células transfectadas com uma seringa de 1 mL (Temuro Medical Corporation, Somerset, NJ) e agulha de calibre 28 (EBICTem Dickinson & Co, Franklin Lakes NJ). Para facilitar a injeção intramiocárdica e evitar danos excessivos ao órgão, dobre a cabeça agulha ~ 90 graus.
- Após a injeção, use suturas absorvíveis (por exemplo, vicryl) para fechar as costelas e as camadas musculares. Sutura de pele fechada com nylon ou seda 4-0.
- Permitir mouse para recuperar da anestesia e extubação.
- Grupos de controle devem incluir ratos Cre recebendo injeções único meio, ratos Cre receber a mesma concentração de células e camundongos untransfected tipo selvagem que receberam células transfectadas (alternativamente, os ratos que receberam células transfectadas Cre não propensas a fusível).
3. Imagem biofotônica
- De cinco a quinze minutos antes de imagem, por via intraperitoneal (IP) injetar 10 mL por grama de peso do mouse corpo de 15 mg / mL D-luciferina (Caliper Life Sciences, Hopkinton, MA).
- Induzir a anestesia em camundongos através de isoflurano em 4% para a indução de umd 1 - 2% para a manutenção.
- Camundongos lugar supina na caixa de imagem com máscara administração 1 - 2% de isoflurano para anestesia de manutenção (Imaging System Xenogen biofotônica, Hopkinton, MA). Vários ratos podem ser visualizados simultaneamente. Imagem do rato do grupo controle experimental com ratos para facilitar a comparação do sinal luminescente.
- Usando software Vivendo Imagem (Xenogen), definir o tempo de exposição adequado (normalmente 60 segundos, ver Resultados). Definir área de imagem para caber ratos e manter consistente ao longo da área de imagem para evitar alterações na sensibilidade. Definir a altura sujeita a 4,5 cm.
- Adquirir sinal de luminescência intensidade correspondente ao mouse ou ratos dentro do campo de visão e salvar arquivos de imagem não modificado. Imagens processo para remover sinal de fundo correspondente a um controle ou mouse não-manipulado. Valores de intensidade acima do fundo correspondem a células fundidas dentro do animal. Análise de intensidade pode ser realizado utilizando software Vivendo Imagem (Xenogen) ou open source software de análise de imagem. Typically, uma região de interesse (ROI) é selecionado para comparar os dados de intensidade entre os animais e experimentos.
4. Resultados representante
Para determinar a sensibilidade do Sistema de Imagem Xenogen biofotônica, uma linha celular que expressa constitutivamente luciferase (231-LUC-D3H1, Xenogen) foi entregue para o miocárdio de ratos C57/Bl6 (Jackson Laboratory). Células foram injetadas em concentrações de 1 x 10 6, 1 x 10 3, ou 1 x 10 1 células. Seis horas após a entrega das células, os camundongos foram injetados intraperitonealmente com a luciferina e fotografada usando o sistema Xenogen. Um sinal específico pode ser detectado com 1.000 células (2 de 6 camundongos com imagens, Figura 2), mas a detecção é mais confiável, com 10.000 células (6 de 6 ratos com imagens). Importante, este estudo também serviu para estabelecer uma correlação aproximada entre o número de células que expressam luciferase e da intensidade do sinal.
Para demonstrar a utilidade do protocolo descrito na detecção e rastreamento de fusão celular, MSCs foram transfectadas com o plasmídeo LoxP-Stop-LoxP-luciferase (Addgene) e entregues para o miocárdio de Cre-expressando camundongos. Aproximadamente uma semana após o parto celular, as cobaias foram primeiro fotografada usando o sistema Xenogen sem D-luciferina injeção. Como esperado, sem o substrato enzimático, nenhum sinal foi detectado intensidade (Figura 3). Em seguida, D-luciferina foi injetada por via intraperitoneal e um sinal correspondente a intensidade luciferase e, portanto, fusão celular foi detectado em duas das quatro camundongos testados. Um sinal semelhante foi detectado uma semana depois (Figura 3), sugerindo produtos MSC-coupled de fusão pode ser mantida in vivo. Neste caso, o estudo foi interrompido para permitir a avaliação de coração e de tecido circundante, mas pode-se imaginar a longo prazo análises e imagens mais freqüentes para acompanhar a manutenção proliferação, umad migração, talvez, de produtos de fusão em camundongos.
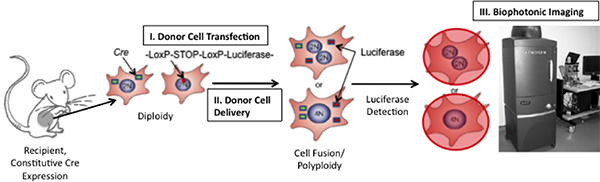
Figura 1. Esquemático da técnica para detectar a fusão celular in vivo. Se a fusão entre Cre-expressando células de camundongo e células transplantadas expressando um plasmídeo floxed luciferase ocorre, luciferase será expressa. Luciferase podem ser detectados através da injeção do substrato enzimático, D-luciferina, para o rato e, em seguida, imagens do mouse através de um Sistema de Imagem Xenogen biofotônica (Adaptado de 19)
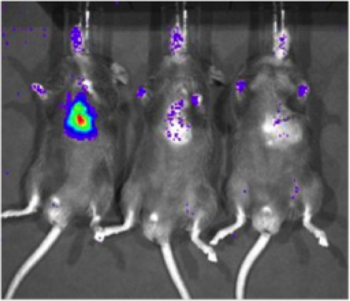
Figura 2. Sensibilidade de detecção de luciferase células que expressam no tecido cardíaco com imagens biofotônica. A linha de células que constitutivamente expressa luciferase (231-LUC-D3H1, Xenogen) foi entregue ao espaço intramiocárdico de C57/Bl6 ratos em vários números de células total. Imagens representativas dos camundongos retentes para perceber 1 x 10 6, 1 x 10 3 e 1 x 10 1 células (da esquerda para a direita) são mostrados, a imagem foi conduzida aproximadamente 6 horas após a injeção.
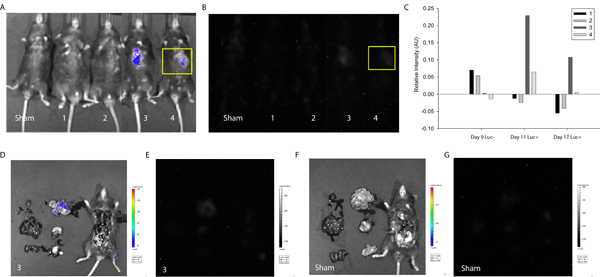
Figura 3. Na quantificação da luminescência Vivo indicativa de fusão celular. MSCs foram transfectadas com o LoxP-Stop-LoxP-luciferase plasmídeo e entregue para o miocárdio de Cre-expressando camundongos. Aproximadamente uma semana e duas semanas após o parto celular, ratos Cre foram fotografadas usando o Sistema de Imagem Xenogen biofotônica para medir a intensidade da luminescência indicativo de fusão celular. (A) Sobreposição de fotografia e intensidade da luminescência de farsa e camundongos 1-4 (esquerda para a direita) dias após o parto 17 células. (B) A intensidade da luminescência de farsa e camundongos 1-4 (esquerda para a direita) dias após o parto 17 células. A região de interesse foi selecionada (amarelo) correspondente ao local da injeção e intensidade levels foram determinados utilizando software ImageJ (fonte livre) 20. (C) A intensidade da luminescência foi normalizado para a mesma região de interesse na farsa do mouse para todas as condições experimentais. Menos uma semana, 3 e 4 ratos mostrou sinal de luminescência positivos sugerindo a fusão espontânea de uma célula do rato e MSC transplantado. O sinal persistiu em mouse de 3 em duas semanas. Para determinar a localização de órgãos específicos do sinal correspondente ao mouse de 3, a cavidade torácica foi exposto e principais órgãos extirpados e imagens. (D) Sobreposição de fotografia e intensidade da luminescência do mouse 3. Localização nota de intensidade de sinal no intestino delgado. (E) A intensidade da luminescência do mouse 3. (F) sobreposição de fotografia e intensidade da luminescência da farsa mouse. (G) A intensidade da luminescência de sham mouse.
Discussão
O método descrito aqui permite, pela primeira vez, a identificação discreta e análise temporal da fusão celular em organismos, incluindo animais de pequeno porte. A abordagem combina Cre-LoxP recombinação com análise de imagem subseqüentes biofotônica. A abordagem é passível de rastreamento não só a fusão célula-célula, mas também do vírus na célula-fusion e assim pode ser útil para rastrear infecções virais. Análise de imagem é rápida e é possível de várias imagens de pequenos animais simul...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Peiman Hemmati (Departamento de Medicina da Universidade de Wisconsin-Madison) para oferecer generosamente as CTMs H1, e Dr. Hacker Tim, Dr. Gouqing Song e Ms. Jill Koch, da Universidade de Wisconsin Fisiologia Cardiovascular Facilidade núcleo para realização de cirurgias mouse. Este trabalho foi financiado pela National Science Foundation através de uma Bolsa de Investigação Pós-Graduação de Brian Freeman e R21 NIH HL089679.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Neon Sistema Transfection | Invitrogen, Carlsbad, CA | MPK5000 | |
| Kit Neon 100 L | Invitrogen, Carlsbad, CA | MPK10025 | Contém R e E do buffer |
| a-MEM em pó | Invitrogen, Carlsbad, CA | 12000-022 | |
| De soro fetal bovino (FBS) | Hyclone, Logan UT | SH30070.03 | |
| B6.C-Tg (CMV-CRE) 1CGN / J | Jackson Laboratory, Bar Harbor, ME | 006054 | |
| Tripsina 10X | Fisher Scientific, Forest Lawn, NJ | MT-25-054-Cl | |
| L-Glutamina | Fisher Scientific, Forest Lawn, NJ | 25030-081 | |
| D-Luciferina | Caliper Life Sciences, Hopkinton, MA | 122796 | |
| Xenogen Imaging System biofotônica | Caliper Life Sciences, Hopkinton, MA | Spectrum IVIS | |
| Biocarbonate de sódio | Sigma Aldrich, St. Louis, MO | S6014-500G | |
| Não-essenciais Aminoácidos | Invitrogen, Carlsbad, CA | 11140-050 |
Referências
- Bernirschke, K. K. P. . Pathology of the Human Placenta. , (2000).
- Hoshina, M., Boothby, M., Boime, I. Cytological localization of chorionic gonadotropin alpha and placental lactogen mRNAs during development of the human placenta. J. Cell. Biol. 93, 190-198 (1982).
- Johansen, M., Redman, C. W., Wilkins, T., Sargent, I. L. Trophoblast deportation in human pregnancy--its relevance for pre-eclampsia. Placenta. 20, 531-539 (1999).
- Redman, C. W., Sargent, I. L. Placental debris, oxidative stress and pre-eclampsia. Placenta. 21, 597-602 (2000).
- Ogle, B. M. Spontaneous fusion of cells between species yields transdifferentiation and retroviral transfer in vivo. FASEB. J. 18, 548-550 (2004).
- Nygren, J. M. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat. Med. 10, 494-501 (2004).
- Nygren, J. M. Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion. Nat. Cell. Biol. 10, 584-592 (2008).
- Kutschka, I. Adenoviral human BCL-2 transgene expression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts. Circulation. 114, I174-I180 (2006).
- Min, J. J. In vivo bioluminescence imaging of cord blood derived mesenchymal stem cell transplantation into rat myocardium. Ann. Nucl. Med. 20, 165-170 (2006).
- Malstrom, S. E., Tornavaca, O., Meseguer, A., Purchio, A. F., West, D. B. The characterization and hormonal regulation of kidney androgen-regulated protein (Kap)-luciferase transgenic mice. Toxicol. Sci. 79, 266-277 (2004).
- Weir, L. R. Biophotonic imaging in HO-1.luc transgenic mice: real-time demonstration of gender-specific chloroform induced renal toxicity. Mutat. Res. 574, 67-75 (2005).
- Rajashekara, G., Glover, D. A., Banai, M., O'Callaghan, D., Splitter, G. A. Attenuated bioluminescent Brucella melitensis mutants GR019 (virB4), GR024 (galE), and GR026 (BMEI1090-BMEI1091) confer protection in mice. Infect. Immun. 74, 2925-2936 (1090).
- Kadurugamuwa, J. L. Noninvasive biophotonic imaging for monitoring of catheter-associated urinary tract infections and therapy in mice. Infect. Immun. 73, 3878-3887 (2005).
- Ryan, P. L., Youngblood, R. C., Harvill, J., Willard, S. T. Photonic monitoring in real time of vascular endothelial growth factor receptor 2 gene expression under relaxin-induced conditions in a novel murine wound model. Ann. N.Y. Acad. Sci. 1041, 398-414 (2005).
- Zhu, L. Non-invasive imaging of GFAP expression after neuronal damage in mice. Neurosci. Lett. 367, 210-212 (2004).
- Noiseux, N. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation. Mol. Ther. 14, 840-850 (2006).
- Ajiki, T. Composite tissue transplantation in rats: fusion of donor muscle to the recipient site. Transplant Proc. 37, 208-209 (2005).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Exp. Hematol. 36, 350-359 (2008).
- Ogle, B. M., Cascalho, M., Platt, J. L. Biological implications of cell fusion. Nat. Rev. Mol. Cell. Biol. 6, 567-575 (2005).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados