Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Cre-Lox P Rekombination Ansatz für den Nachweis von Cell Fusion In Vivo
In diesem Artikel
Zusammenfassung
Ein Verfahren zur Zellfusion in lebenden Organismen im Laufe der Zeit verfolgen wird beschrieben. Der Ansatz nutzt Cre- LoxP Rekombination Luciferaseexpression auf Zellfusion induzieren. Die Lumineszenz-Signal erzeugt wird, kann in lebenden Organismen mit biophotonischen Imaging-Systeme mit einer Nachweisempfindlichkeit von ~ 1.000 Zellen im peripheren Gewebe nachgewiesen werden.
Zusammenfassung
Die Fähigkeit von zwei oder mehr Zellen des gleichen Typs zu verschmelzen hat in Metazoen im Laufe der Evolution verwendet worden, um viele komplexe Organe, einschließlich der Skelettmuskulatur, Knochen-und Plazenta bilden. Zeitgenössische Studien zeigen Fusion von Zellen des gleichen Typs verleiht erweiterte Funktion. Zum Beispiel, wenn die Trophoblastzellen der Plazenta Sicherung der Synzytiotrophoblasten Form ist die Synzytiotrophoblasten besser in der Lage, Nährstoffe und Hormone in der mütterlichen und fötalen Barriere als ungesichert Trophoblasten 1-4 transportieren. Neuere Studien zeigen, Verschmelzung von Zellen verschiedener Typen können Zellschicksal lenken. Die "Rückkehr" oder Modifikation von Zellen Schicksal durch die Fusion war einst als begrenzt an Zellkulturen. Aber das Aufkommen der Stammzelltransplantation führte zur Entdeckung von uns und anderen, dass Stammzellen mit somatischen Zellen in vivo Sicherung und dass die Fusion erleichtert Stammzell-Differenzierung 5-7. So ist Zellfusion einem geregelten Prozess capable fördern das Überleben der Zelle und die Differenzierung und somit könnte von zentraler Bedeutung für die Entwicklung, die Reparatur von Gewebe und auch die Pathogenese der Krankheit zu sein.
Die Begrenzung der Untersuchung von Zell-Fusion, ist der Mangel an geeigneten Technologien zu 1) genau zu identifizieren Fusion Produkten und zu 2) verfolgen Fusion Produkte im Laufe der Zeit. Hier präsentieren wir einen neuen Ansatz für beide Einschränkungen über die Induktion von Biolumineszenz auf Fusion (Abbildung 1)-Adresse,. Biolumineszenz mit hoher Empfindlichkeit in vivo 8-15 erkannt werden wir nutzen ein Konstrukt, das die Firefly-Luciferase (Photinus pyralis)-Gen benachbart zu ein Stop-Codon durch loxP-Sequenzen flankiert. Wenn Zellen Expression dieses Gens Sicherung mit Zellen, die Cre-Rekombinase-Protein, das loxP-Stellen gespalten werden und das Stopp-Signal wird herausgeschnitten ermöglicht die Transkription von Luciferase. Da das Signal induciBLE, ist die Inzidenz von falsch-positive Signale sehr gering. Im Gegensatz zu bestehenden Verfahren, die die Cre / loxP-Systems 16, 17 zu nutzen, haben wir eine "lebende" Erfassungssignals integriert und damit zum ersten Mal die Gelegenheit, um die Kinetik der Zellfusion in vivo verfolgen leisten.
Zur Demonstration der Vorgehensweise, Mäuse ubiquitär exprimiert die Cre-Rekombinase als Empfänger von Stammzellen mit einem Konstrukt zu Luciferase hinter einem floxed Stop-Codon ausdrückliche transfizierten serviert. Stammzellen wurden über intramyokardialen Injektion transplantiert und nach der Transplantation intravital Bildanalyse wurde durchgeführt, um die Anwesenheit von track Fusion-Produkte in das Herz und die umgebenden Gewebe im Laufe der Zeit. Dieser Ansatz könnte angepasst Zellfusion in jedem Gewebetyp analysieren in jedem Stadium der Entwicklung, Krankheit oder adultem Gewebe zu reparieren.
Protokoll
1. Donor Zelltransfektion
- Ernte-mesenchymale Stammzellen (MSCs aus H1 embryonalen Stammzellen freundlicherweise von Dr. Peyman Hematti gespendet abgeleitet, alternativ jeden Zelltyp jeder Art angenommen, dass sie in vivo-Sicherung eingesetzt werden könnten), wenn 70 bis 80% konfluent mit 1X Trypsin (Mediatech, Manassas VA) für 5 min. inaktivieren Trypsin mit α-MEM Vollmedium (Antibiotikum frei, Invitrogen, Carlsbad CA) 18. Zentrifuge bei 300 xg für 5 min.
- Sorgfältig Überstand absaugen und resuspendieren Pellet in 1 ml 1X PBS und Zählen von Zellen unter Verwendung eines Hämozytometers.
- Transfer 1,5 x 10 6 Zellen in ein 1,5 ml Zentrifugenröhrchen. Zentrifuge bei 300 xg für 5 min.
- Vorsichtig absaugen Überstand. Pellet in 300 ul R Buffer (Neon Transfektion System, Invitrogen) und 6 pg (2 ug / 5,0 x 10 5 Zellen) von P231 pCMVe-betaAc-STOP-luc (Addgene, Cambridge, MA). Platz 3 ml E-Puffer (Invitrogen) in die Elektroporation Docking-Anschluss per Protokoll des Herstellers (Neon Transfektion System, Invitrogen).
- Transfer-Zell-Plasmid-Lösung für ein 100 ul Neon Pipettenspitze und elektroporieren mit einer Pulsdauer von 20 ms und einer Höhe von 1500 Volt. Legen Sie elektroporiert Zellen in ein 15 mL konische Röhrchen mit 9,7 mL α-MEM Vollmedium.
- Wiederholen Sie Schritt 1.5 zwei weitere Male und Pool transfizierten Zellen auf ein Gesamtvolumen von 10 ml zu erhalten. Fügen Sie die 10 mL Zellsuspension (1,5 x 10 6 Zellen), eine T175 Flasche mit 10 ml α-MEM Vollmedium. Die Lebensfähigkeit der Zellen nach der Elektroporation ist etwa 30% auf ca. 4,5 x 10 5 vitale Zellen pro T175 liefern.
- Ändern α-MEM Vollmedium 24 Stunden nach der Transfektion.
- Ernte transfizierter Zellen bei 70 bis 80% konfluent (~ 2 bis 3 Tage nach der Elektroporation). Führen Zellzahl unter Verwendung eines Hämozytometers und Zellen in einer Konzentration von 1,0 x 10 6Zellen/50 ul von α-MEM Vollmedium. Minimieren der Zeit Zellen verbringen in Suspension zum Zelltod zu reduzieren, um vor Injektion.
2. Intramyokardialen Injection
- Induzieren Anästhesie durch Isofluran (Phoenix Pharmaceuticals, Inc., St. Joseph, MO) an transgenen Mäusen entwickelt, um konstitutiv Cre-Rekombinase in jeder Zelle (B6.C-Tg (CMV-cre) 1CGN / J, Jackson Laboratory in Bar Harbor, ME).
- Entfernen Sie Haare aus Brustbereich mit Haarschneidemaschinen oder chemische Haarentferner.
- Intubieren mit einem 18-Gauge-Katheter (Becton Dickinson & Co, Franklin Lakes NJ) und am Maus-Ventilator bei 120 bis 130 Atemzüge pro Minute mit einem Hubvolumen von 150 ul.
- Machen seitlichen Schnitt über dem vierten Interkostalraum wodurch eine Thorakotomie.
- Visualisierung des Herzens, machen zwei 25 ul Injektionen von transfizierten Zellsuspension mit einer 1 ml-Spritze (Temuro Medical Corporation, Somerset, NJ) und 28-Gauge-Nadel (BECTauf Dickinson & Co, Franklin Lakes NJ). Zur Erleichterung der intramyokardialen Injektion und verhindern, dass übermäßige Schäden an der Orgel, biegen Sie die Nadel Kopf ~ 90 Grad.
- Nach der Injektion verwenden resorbierbares Nahtmaterial (zB Vicryl) an den Rippen und Muskelschichten zu schließen. Suture Haut geschlossen mit 4-0 Nylon oder Seide.
- Lassen Sie Maus, um aus der Narkose und Extubation erholen.
- Kontrollgruppen sollten Cre Mäusen, die mittel-Injektionen nur, Empfangen Cre Mäusen die gleiche Konzentration an transfizierten Zellen und Wildtyp-Mäusen, die transfizierten Zellen (alternativ erhalten Cre Mäusen transfizierten Zellen nicht anfällig für Sicherung).
3. Biophotonic Imaging
- Fünf bis 15 Minuten vor der Belichtung, intraperitoneal (IP) zu injizieren 10 l pro Gramm Maus Körpergewicht von 15 mg / mL D-Luciferin (Caliper Life Sciences, Hopkinton, MA).
- Induzieren Anästhesie an Mäusen über Isofluran bei 4% für Induktion eind 1 bis 2% für die Wartung.
- Legen Mäuse in Rückenlage in der Bildgebung Box mit Gesichtsmaske Verwaltung von 1 bis 2% Isofluran zur Aufrechterhaltung der Narkose (Xenogen Biophotonic Imaging System, Hopkinton, MA). Mehrere Mäuse können gleichzeitig abgebildet werden. Bild sham Kontroll-Maus mit experimentellen Mäuse für einen einfachen Vergleich der Lumineszenz-Signal.
- Mit Lebens-Image Software (Xenogen), setzen entsprechende Belichtungszeit (in der Regel 60 Sekunden, siehe Ergebnisse). Set Bereich des Bildes, Mäuse fit und halten Bereich konsequent über Imaging, um Änderungen in der Empfindlichkeit zu verhindern. Set unterliegen Höhe von 4,5 cm.
- Erwerben Sie Lumineszenzintensität entsprechendes Signal Maus oder Mäuse im Sichtfeld und speichern unveränderten Bilddateien. Bild bearbeiten zu entfernen Hintergrund entsprechendes Signal an eine Steuerung oder unmanipulierten Maus. Intensity-Werte über dem Hintergrund zu fusionierenden Zellen innerhalb des Tieres entsprechen. Intensity-Analyse kann unter Verwendung Wohnen Image Software (Xenogen) oder Open-Source-Bildanalyse-Software. Typically, einer Region of Interest (ROI) wird ausgewählt, um die Intensität von Daten zwischen Tieren und Experimenten zu vergleichen.
4. Repräsentative Ergebnisse
Zur Bestimmung der Empfindlichkeit des Xenogen Biophotonic Imaging System, eine Zelllinie, die konstitutiv exprimiert Luziferase (231-LUC-D3H1, Xenogen) wurde in den Herzmuskel des C57/BL6-Mäusen (Jackson Laboratory) geliefert. Die Zellen wurden in einer Konzentration von 1 x gespritzt 10 6, 1 x 10 3, oder 1 x 10 1 Zellen. Sechs Stunden nach Zell Lieferung, Mäuse wurden intraperitoneal mit Luciferin injiziert und abgebildet mit den Xenogen System. Ein spezifisches Signal konnte mit 1.000 Zellen (2 von 6 Mäusen abgebildet, Abbildung 2) nachgewiesen werden, aber Detektion wurde mehr zuverlässig mit 10.000 Zellen (6 von 6 Mäusen abgebildet). Wichtig ist, dass diese Studie diente auch dazu, eine grobe Korrelation zwischen Anzahl der Luciferase-exprimierenden Zellen und Signalintensität zu etablieren.
Um den Nutzen des beschriebenen Protokolls bei der Aufdeckung und Verfolgung Zellfusion zu demonstrieren, wurden MSCs mit den loxP-Stop-loxP-Luciferase-Plasmid (Addgene) transfiziert und an das Myokard des Cre-exprimierenden Mäusen. Etwa eine Woche nach Zell Lieferung, wurden Mäuse ersten abgebildet mit den Xenogen System ohne D-Luciferin Injektion. Wie zu erwarten, ohne die enzymatische Substrat wurde keine Intensität detektiert (Abbildung 3). Als nächstes wurde D-Luciferin intraperitoneal und ein entsprechendes Signal Luciferase Intensität injiziert und damit Zellfusion wurde in zwei von vier Mäusen getestet erkannt. Ein ähnliches Signal gefunden wurde eine Woche später (Abbildung 3), was darauf hindeutet MSC-coupled Fusionsprodukte in vivo aufrechterhalten werden kann. In diesem Fall wird die Studie beendet wurde, für die Auswertung des Herzens und des umgebenden Gewebes ermöglichen, aber man könnte sich vorstellen, längerfristig Analysen und häufiger Bildgebung zur Erhaltung, Vermehrung Titel in derd vielleicht Migration von Fusion-Produkte in Mäusen.
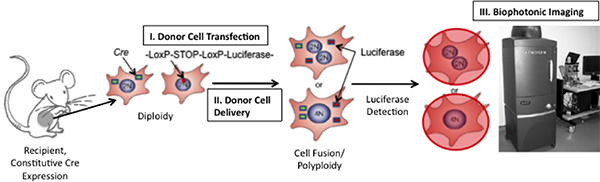
Abbildung 1. Schematische Darstellung der Technik to Cell Fusion in vivo nachzuweisen. Wenn Fusion zwischen Cre-exprimierenden Zellen der Maus und transplantierten Zellen, die ein floxed Luciferase Plasmid auftritt, Luciferase exprimiert werden. Luciferase kann durch die Injektion der enzymatischen Substrat, D-Luciferin, in die Maus und dann die Abbildung der Maus über einen Xenogen Biophotonic Imaging System (Übernommen von 19) erkannt werden
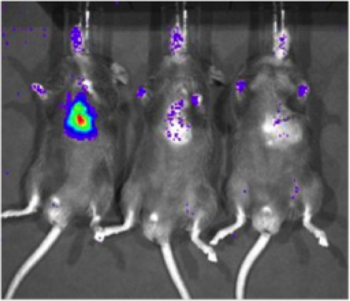
Abbildung 2. Die Empfindlichkeit der Detektion von Luciferase-exprimierenden Zellen im Herzgewebe mit biophotonischen Bildgebung. Eine Zelllinie, die konstitutiv exprimiert Luziferase (231-LUC-D3H1, Xenogen) war es, die intramyokardialen Raum C57/BL6-Mäusen an verschiedenen insgesamt Zellzahlen geliefert. Repräsentative Bilder von Mäusen receiving 1 x 10 6, 1 x 10 3 und 1 x 10 1-Zellen (von links nach rechts) gezeigt wurde Bildgebung ca. 6 Stunden nach der Injektion durchgeführt.
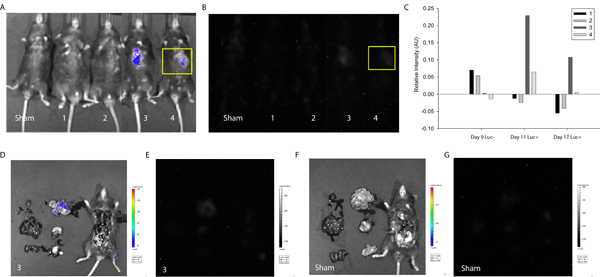
Abbildung 3. Die Quantifizierung der In-vivo-Lumineszenz Indikativ of Cell Fusion. MSCs wurden mit der loxP-Stop-loxP-Luciferase-Plasmid und an das Myokard des Cre-exprimierenden Mäusen transfiziert. Etwa eine Woche und zwei Wochen nach Lieferung Zelle wurden Cre Mäusen abgebildet mit den Xenogen Biophotonic Imaging System, um die Intensität der Lumineszenz bezeichnend für Zellfusion zu messen. (A) Überlagerung von Bild und Intensität der Lumineszenz von Schein-und Mäuse 1-4 (von links nach rechts) 17 Tage nach Lieferung Zelle. (B) Intensität der Lumineszenz von Schein-und Mäuse 1-4 (von links nach rechts) 17 Tage nach Lieferung Zelle. Eine Region von Interesse ausgewählt wurde (gelb) entspricht der Injektionsstelle und Intensität levels wurden mittels ImageJ (kostenlos source) Software 20. (C) Die Intensität der Lumineszenz wurde auf die gleiche Region von Interesse am sham Maus für alle experimentellen Bedingungen normalisiert. In einer Woche, zeigten die Mäuse 3 und 4 positive Lumineszenzsignal darauf hindeutet, spontane Fusion einer Maus Zelle und transplantierten MSC. Das Signal blieb in der Maus 3 auf 2 Wochen. Um festzustellen, Organ-spezifische Lokalisation des Signals entsprechend Maus 3 wurde die Brusthöhle ausgesetzt und primären Organe herausgeschnitten und abgebildet. (D) Überlagerung von Bild und Intensität der Lumineszenz der Maus 3. Hinweis Lokalisierung von Intensität Signal in den Dünndarm. (E) Intensität der Lumineszenz der Maus 3. (F) Überlagerung von Bild und Intensität der Lumineszenz von Schein-Maus. (G) Intensität der Lumineszenz von Schein-Maus.
Diskussion
Die hier beschriebene Methode ermöglicht es, zum ersten Mal, diskrete Identifikation und zeitliche Analyse von Zell-Fusion in Organismen, einschließlich der kleinen Tiere. Der Ansatz kombiniert Cre-loxP Rekombination mit anschließender biophotonischen Bildanalyse. Der Ansatz ist offen für Tracking nicht nur Zell-Zell-Fusion, sondern auch Virus-Zell-Fusion und so könnte sich als nützlich erweisen für die Verfolgung von viralen Infektionen. Die Bildanalyse ist schnell und es ist möglich, Bild mehrere kleine Tiere ...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren bedanken sich bei Dr. Peyman Hemmati (Department of Medicine, University of Wisconsin-Madison) für die großzügige Bereitstellung der H1 MSCs und Dr. Tim Hacker, Dr. Gouqing Song und Frau Jill Koch von der University of Wisconsin Kardiovaskuläre Physiologie danken Core Facility für die Durchführung von Operationen mit der Maus. Diese Arbeit wurde von der National Science Foundation durch eine Graduate Research Fellowship an Brian Freeman und NIH R21 HL089679 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz | Firma | Katalog-Nummer | Kommentare |
| Neon Transfektionssystem | Invitrogen, Carlsbad, CA | MPK5000 | |
| Neon 100 ul Kit | Invitrogen, Carlsbad, CA | MPK10025 | Enthält R und E Buffer |
| a-MEM-Pulver | Invitrogen, Carlsbad, CA | 12000-022 | |
| Fetal Bovine Serum (FBS) | Hyclone, Logan UT | SH30070.03 | |
| B6.C-Tg (CMV-cre) 1CGN / J | Jackson Laboratory in Bar Harbor, ME | 006054 | |
| Trypsin 10X | Fisher Scientific, Forest Lawn, NJ | MT-25 bis 054-Cl | |
| L-Glutamin | Fisher Scientific, Forest Lawn, NJ | 25030-081 | |
| D-Luciferin | Caliper Life Sciences, Hopkinton, MA | 122796 | |
| Xenogen Biophotonic Imaging System | Caliper Life Sciences, Hopkinton, MA | IVIS Spectrum | |
| Sodium Biocarbonate | Sigma Aldrich, St. Louis, MO | S6014-500G | |
| Nicht-essentielle Aminosäuren | Invitrogen, Carlsbad, CA | 11140-050 |
Referenzen
- Bernirschke, K. K. P. . Pathology of the Human Placenta. , (2000).
- Hoshina, M., Boothby, M., Boime, I. Cytological localization of chorionic gonadotropin alpha and placental lactogen mRNAs during development of the human placenta. J. Cell. Biol. 93, 190-198 (1982).
- Johansen, M., Redman, C. W., Wilkins, T., Sargent, I. L. Trophoblast deportation in human pregnancy--its relevance for pre-eclampsia. Placenta. 20, 531-539 (1999).
- Redman, C. W., Sargent, I. L. Placental debris, oxidative stress and pre-eclampsia. Placenta. 21, 597-602 (2000).
- Ogle, B. M. Spontaneous fusion of cells between species yields transdifferentiation and retroviral transfer in vivo. FASEB. J. 18, 548-550 (2004).
- Nygren, J. M. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat. Med. 10, 494-501 (2004).
- Nygren, J. M. Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion. Nat. Cell. Biol. 10, 584-592 (2008).
- Kutschka, I. Adenoviral human BCL-2 transgene expression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts. Circulation. 114, I174-I180 (2006).
- Min, J. J. In vivo bioluminescence imaging of cord blood derived mesenchymal stem cell transplantation into rat myocardium. Ann. Nucl. Med. 20, 165-170 (2006).
- Malstrom, S. E., Tornavaca, O., Meseguer, A., Purchio, A. F., West, D. B. The characterization and hormonal regulation of kidney androgen-regulated protein (Kap)-luciferase transgenic mice. Toxicol. Sci. 79, 266-277 (2004).
- Weir, L. R. Biophotonic imaging in HO-1.luc transgenic mice: real-time demonstration of gender-specific chloroform induced renal toxicity. Mutat. Res. 574, 67-75 (2005).
- Rajashekara, G., Glover, D. A., Banai, M., O'Callaghan, D., Splitter, G. A. Attenuated bioluminescent Brucella melitensis mutants GR019 (virB4), GR024 (galE), and GR026 (BMEI1090-BMEI1091) confer protection in mice. Infect. Immun. 74, 2925-2936 (1090).
- Kadurugamuwa, J. L. Noninvasive biophotonic imaging for monitoring of catheter-associated urinary tract infections and therapy in mice. Infect. Immun. 73, 3878-3887 (2005).
- Ryan, P. L., Youngblood, R. C., Harvill, J., Willard, S. T. Photonic monitoring in real time of vascular endothelial growth factor receptor 2 gene expression under relaxin-induced conditions in a novel murine wound model. Ann. N.Y. Acad. Sci. 1041, 398-414 (2005).
- Zhu, L. Non-invasive imaging of GFAP expression after neuronal damage in mice. Neurosci. Lett. 367, 210-212 (2004).
- Noiseux, N. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation. Mol. Ther. 14, 840-850 (2006).
- Ajiki, T. Composite tissue transplantation in rats: fusion of donor muscle to the recipient site. Transplant Proc. 37, 208-209 (2005).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Exp. Hematol. 36, 350-359 (2008).
- Ogle, B. M., Cascalho, M., Platt, J. L. Biological implications of cell fusion. Nat. Rev. Mol. Cell. Biol. 6, 567-575 (2005).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten