Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une approche recombinaison Cre-Lox P pour la détection de la fusion cellulaire In Vivo
Dans cet article
Résumé
Une méthode pour suivre la fusion cellulaire dans les organismes vivants au cours du temps est décrite. L'approche utilise Cre- LoxP pour induire l'expression de luciférase après la fusion cellulaire. Le signal luminescent généré peut être détecté dans les organismes vivants en utilisant des systèmes d'imagerie bio photonique avec une sensibilité de détection de ~ 1000 cellules dans les tissus périphériques.
Résumé
La capacité de deux ou plusieurs cellules d'un même type de fusionner a été utilisé chez les métazoaires long de l'évolution de former de nombreux organes complexes, y compris le muscle squelettique, les os et le placenta. Les études contemporaines montrent la fusion de cellules du même type confère fonction améliorée. Par exemple, lorsque les cellules trophoblastiques du fusible du placenta pour former le syncytiotrophoblaste, le syncytiotrophoblaste est mieux en mesure de transporter les nutriments et les hormones à travers la barrière foeto-maternelle de trophoblastes non fusionnée 1-4. Des études plus récentes démontrent la fusion de cellules de différents types peuvent diriger le destin des cellules. Le "retour" ou la modification du destin cellulaire par fusion était autrefois considérée comme limitée aux systèmes de culture cellulaire. Mais l'avènement de la transplantation de cellules souches conduit à la découverte par nous et d'autres que les cellules souches peuvent fusionner avec les cellules somatiques in vivo et que la fusion facilite la différenciation des cellules souches 5-7. Ainsi, la fusion cellulaire est un processus réglementé capable de promouvoir la survie et la différenciation cellulaire et pourrait donc être d'une importance centrale pour le développement, la réparation des tissus et même la pathogénie de la maladie.
Limiter l'étude de la fusion cellulaire, est le manque de technologie appropriée pour 1) identifier précisément les produits de fusion et à 2) des produits de fusion suivre dans le temps. Nous présentons ici une nouvelle approche pour répondre à la fois les limites via l'induction de la bioluminescence lors de la fusion (figure 1);. Bioluminescence peuvent être détectés avec une haute sensibilité in vivo 8-15 Nous utilisons une construction codant pour la luciférase de luciole (Photinus pyralis) gène placé à côté de un codon stop flanqué de séquences LoxP. Lorsque les cellules exprimant ce gène avec fusible de cellules exprimant la protéine recombinase Cre, les sites loxP sont clivés et le signal d'arrêt est excisé permettant la transcription de la luciférase. Parce que le signal est inducibles, l'incidence des faux positifs signaux est très faible. Contrairement aux méthodes existantes qui utilisent le système Cre / LoxP 16, 17, nous avons intégré un signal «vivant» de détection et ainsi permettre pour la première fois la possibilité de suivre la cinétique de la fusion cellulaire in vivo.
Afin de démontrer l'approche, les souris exprimant la recombinase Cre omniprésent servi en tant que bénéficiaires des cellules souches transfectées avec une construction d'exprimer la luciférase en aval d'un codon stop floxés. Les cellules souches ont été transplantés par injection intra-myocardique et après analyse de transplantation d'image intravitale a été menée pour vérifier la présence des produits de fusion dans le cœur et les tissus environnants au cours du temps. Cette approche pourrait être adaptée pour analyser la fusion cellulaire dans n'importe quel type de tissu, à tout stade de développement, la maladie ou la réparation des tissus adultes.
Protocole
1. La transfection de la cellule donneuse
- Récolte des cellules souches mésenchymateuses (CSM, dérivée de cellules souches embryonnaires H1 fournie gracieusement par le Dr Peiman Hematti, ou alternativement, tout type de cellule d'une espèce quelconque hypothèse de fusionner in vivo pourraient être employées) où 70 - 80% confluence avec 1X trypsine (Mediatech, Manassas VA) pendant 5 min. Désactiver la trypsine avec α-MEM milieu complet (antibiotique libre, Invitrogen, Carlsbad CA) 18. Centrifuger à 300 xg pendant 5 min.
- Aspirer délicatement le surnageant et remettre en suspension le culot dans 1 ml de PBS 1X et compter les cellules en utilisant un hématimètre.
- Transfert de 1,5 x 10 6 cellules dans un tube à centrifuger de 1,5 ml. Centrifuger à 300 xg pendant 5 min.
- Aspirer délicatement le surnageant. Resuspendre le culot dans 300 ul de tampon R (système de transfection Néon, Invitrogen) et 6 mg (2 mg / 5,0 x 10 5 cellules) de P231 pCMVe-betaAc-STOP-Luc (Addgene, Cambridge, MA). Placer 3 ml de tampon E (InvitrOgen) dans le port d'amarrage électroporation selon le protocole du fabricant (système de transfection Néon, Invitrogen).
- Transfert cellulaire plasmide solution à un embout 100 Neon pipette ul et électroporation avec une durée d'impulsion de 20 ms et d'une magnitude de 1500 volts. Placez électroporées cellules dans un tube de 15 ml conique contenant 9,7 ml α-MEM milieu complet.
- Répétez l'étape 1.5 deux fois supplémentaires et les cellules transfectées piscine pour donner un volume total de 10 ml. Ajouter 10 ml de la suspension cellulaire (1,5 x 10 6 cellules) dans un flacon contenant 10 mL T175 α-MEM milieu complet. La viabilité des cellules après l'électroporation est d'environ 30%, pour donner environ 4,5 x 10 5 cellules viables par T175.
- Changer α-MEM milieu complet 24 heures après transfection.
- Récolte des cellules transfectées où 70 à 80% confluentes (~ 2 - 3 jours après l'électroporation). Effectuer le nombre de cellules en utilisant un hématimètre et remettre les cellules à une concentration de 1,0 x 10 6cells/50 uL d'α-MEM milieu complet. Minimisez le temps passer cellules en suspension afin de réduire la mort cellulaire avant l'injection.
2. Injection intramyocardique
- Induire une anesthésie par isoflurane (Phoenix Pharmaceuticals, Inc, Saint Joseph, MO) sur des souris transgéniques conçues pour exprimer constitutivement la recombinase Cre dans chaque cellule (B6.C-Tg (CMV-cre) 1Cgn / J, Jackson Laboratory, Bar Harbor, ME).
- Enlever les poils de la région de la poitrine à l'aide tondeuses à cheveux ou épilateur chimique.
- Intuber avec un cathéter de calibre 18 (Becton Dickinson & Co, Franklin Lakes New Jersey) et les placer sur un ventilateur de souris à 120 à 130 respirations par minute avec un volume d'éjection systolique de 150 uL.
- Faire une incision latérale dans le quatrième espace intercostal, produisant ainsi une thoracotomie.
- Visualisation du cœur, faire deux injections 25 pl de suspension de cellules transfectées avec un seringue de 1 mL (Temuro Medical Corporation, dans le Somerset, NJ) et une aiguille de calibre 28 (Bectsur Dickinson & Co, Franklin Lakes New Jersey). Pour faciliter l'injection intra-myocardique et prévenir des dommages excessifs à l'orgue, plier la tête de l'aiguille à 90 degrés.
- Après l'injection, l'utilisation des sutures résorbables (par exemple, Vicryl) pour fermer les côtes et les couches musculaires. Suture cutanée fermée à l'aide de nylon 4-0 ou en soie.
- Laissez la souris pour récupérer de l'anesthésie et l'extubation.
- Les groupes de contrôle devrait inclure des souris Cre recevant des injections moyennes seulement, les souris Cre recevoir la même concentration de cellules non transfectées et les souris de type sauvage recevant des cellules transfectées (alternativement, les souris recevant des cellules transfectées Cre pas enclin à fusibles).
3. D'imagerie bio photonique
- Cinq à quinze minutes avant l'imagerie, par voie intrapéritonéale (IP) d'injecter 10 uL par gramme de poids corporel de souris de 15 mg / ml D-luciférine (Caliper Life Sciences, Hopkinton, MA).
- Induire une anesthésie sur des souris via l'isoflurane à 4% pour l'induction uneD 1 - 2% pour la maintenance.
- Placez la souris en position couchée dans la boîte de l'imagerie avec un masque facial administrer 1 - 2% d'isoflurane pour l'anesthésie de maintenance (système d'imagerie bio photonique de Xenogen, Hopkinton, MA). Plusieurs souris peuvent être imagés simultanément. La souris de contrôle d'image avec des souris expérimentales simulacre pour faciliter la comparaison des signaux luminescents.
- En utilisant le logiciel image vivante (Xenogen), mis le temps d'exposition approprié (typiquement 60 sec, voir résultats). Réglez la zone de l'image pour s'adapter à des souris et de garder tout au long d'imagerie zone cohérente pour empêcher toute modification de la sensibilité. Régler la hauteur de l'objet à 4,5 cm.
- Acquérir intensité du signal de luminescence correspondant à la souris ou des souris dans le champ de vision et d'enregistrer des fichiers image non modifiée. Traiter les images de retirer le signal de fond correspondant à un contrôle ou une souris non manipulés. Les valeurs d'intensité de fond ci-dessus correspondent aux cellules fusionnées au sein de l'animal. Analyse de l'intensité peut être effectuée à l'aide du logiciel Image habitable (Xenogen) ou ouvrir le logiciel d'analyse source de l'image. Tabituellement, une région d'intérêt (ROI) est sélectionnée pour comparer les données d'intensité entre les animaux et les expériences.
4. Les résultats représentatifs
Pour déterminer la sensibilité du système d'imagerie biophotonique Xenogen, une lignée cellulaire qui exprime constitutivement la luciférase (LUC-231-D3H1, Xenogen) a été remis au myocarde de souris C57/BL6 (Jackson Laboratory). Les cellules ont été injectées à des concentrations de 1 x 10 6, 1 x 10 3, ou 1 x 10 cellules 1. Six heures après la livraison des cellules, les souris ont été injectées par voie intrapéritonéale avec luciférine et imagée en utilisant le système Xenogen. Un signal spécifique a pu être détecté avec 1000 cellules (2 de 6 souris imagé, figure 2), mais la détection est plus fiable avec 10 000 cellules (6 de 6 souris imagé). Surtout, cette étude a également servi à établir une corrélation grossière entre le nombre de cellules exprimant la luciférase et l'intensité du signal.
Pour démontrer l'utilité du protocole décrit dans la détection et le suivi de la fusion cellulaire, cellules souches mésenchymateuses ont été transfectées avec le plasmide LoxP-Stop-LoxP-luciférase (Addgene) et livrés au niveau du myocarde de Cre-exprimant les souris. Environ une semaine après la livraison des cellules, les souris ont d'abord été imagées en utilisant le système Xenogen sans D-luciférine injection. Comme prévu, sans le substrat enzymatique, aucun signal d'intensité a été détecté (Figure 3). Ensuite, D-luciférine a été injectée par voie intrapéritonéale et un signal correspondant à l'intensité de la luciférase et donc la fusion cellulaire a été détecté dans deux des quatre souris testées. Un signal similaire a été détecté une semaine plus tard (figure 3), suggérant des produits de fusion MSC couplé peut être maintenue in vivo. Dans ce cas, l'étude a été arrêtée pour permettre l'évaluation du cœur et des tissus environnants, mais on pourrait envisager à plus long terme analyses et d'imagerie plus fréquentes pour suivre l'entretien, la prolifération uneD peut-être la migration des produits de fusion chez les souris.
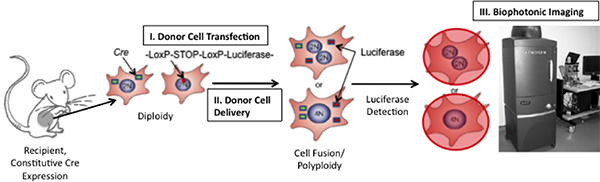
Figure 1. Schéma de la technique pour détecter la fusion cellulaire in vivo. Si la fusion entre les cellules exprimant la Cre-souris et des cellules transplantées exprimant un plasmide floxés luciférase survient, la luciférase sera exprimé. Luciférase peut être détectée par l'injection du substrat enzymatique, D-luciférine, dans la souris et ensuite d'imagerie de la souris en utilisant un système d'imagerie biophotonique Xenogen (Adapté de 19)
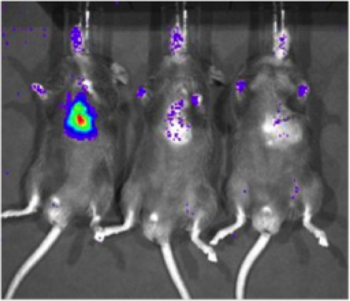
Figure 2. Sensibilité de la détection de cellules exprimant la luciférase dans le tissu cardiaque à l'imagerie biophotonique. Une lignée cellulaire qui exprime constitutivement la luciférase (LUC-231-D3H1, Xenogen) a été livré à l'espace intra-myocardique de souris C57/BL6 à différents nombre total de cellules. Des images représentatives de souris receiving 1 x 10 6, 1 x 10 3 et 1 x 10 1 cellules (de gauche à droite) sont présentées, l'imagerie a été réalisée à environ 6 heures après l'injection.
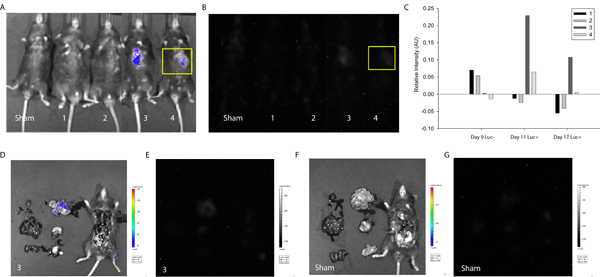
Figure 3. Quantification de la luminescence Vivo indicatif de la fusion cellulaire. MSC ont été transfectées avec le LoxP-Stop-LoxP-luciférase plasmide et livrés à l'myocarde de Cre-exprimant les souris. Environ une semaine et deux semaines après l'accouchement de cellules, les souris Cre ont été imagées en utilisant le système d'imagerie biophotonique Xenogen pour mesurer l'intensité de la luminescence indicatif de la fusion cellulaire. (A) Superposition de la photographie et l'intensité de la luminescence de l'imposture et de souris 1-4 (de gauche à droite) jours après la livraison 17 cellules. (B) l'intensité de la luminescence du simulacre et de souris 1-4 (de gauche à droite) jours après la livraison 17 cellules. Une région d'intérêt a été sélectionné (jaune) correspondant au site d'injection et l intensité deevels ont été déterminés en utilisant ImageJ (source libre) de logiciels 20. (C) Intensité de luminescence a été normalisée à la même région d'intérêt sur le simulacre de la souris pour toutes les conditions expérimentales. À une semaine, les souris 3 et 4 montrent signal de luminescence positifs suggérant fusion spontanée d'une cellule de la souris et le MSC transplantées. Le signal a persisté dans la souris 3 moins deux semaines. Pour déterminer la localisation des organes spécifiques du signal correspondant à la souris 3, la cavité thoracique a été exposé et les organes primaires excisée et imagée. (D) Superposition de la photographie et l'intensité de la luminescence de la souris 3. Notez la localisation du signal d'intensité dans l'intestin grêle. (E) Intensité de luminescence de la souris 3. (F) Superposition de la photographie et l'intensité de la luminescence de l'imposture de la souris. (G) Intensité de luminescence du simulacre de la souris.
Discussion
La méthode décrite ici permet, pour la première fois, l'identification et l'analyse temporelle discrète de la fusion cellulaire dans les organismes, y compris les petits animaux. L'approche combine Cre-LoxP de recombinaison avec l'analyse d'image ultérieures biophotonique. L'approche est susceptible d'être suivi non seulement fusion cellule-cellule, mais aussi fusion virus-cellule et ainsi pourraient se révéler utiles pour le suivi des infections virales. L'analyse des images est ...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier le Dr Peiman Hemmati (Département de médecine, Université de Wisconsin-Madison) pour avoir généreusement fourni les MSC H1, et le Dr Tim Hacker, le Dr Song et Gouqing Mme Jill Koch de l'Université du Wisconsin physiologie cardiovasculaire Facilité de base pour les opérations chirurgicales de la souris. Ce travail a été soutenu par la National Science Foundation grâce à une bourse de recherche supérieures à Brian Freeman et NIH R21 HL089679.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Système de transfection Neon | Invitrogen, Carlsbad, CA | MPK5000 | |
| Neon 100 Kit uL | Invitrogen, Carlsbad, CA | MPK10025 | Contient R et E Tampon |
| une-MEM en poudre | Invitrogen, Carlsbad, CA | 12000-022 | |
| Sérum fœtal bovin (FBS) | Hyclone, Logan UT | SH30070.03 | |
| B6.C-Tg (CMV-cre) 1Cgn / J | Jackson Laboratory, Bar Harbor, ME | 006054 | |
| 10X Trypsine | Fisher Scientific, Forest Lawn, NJ | MT-25-054-Cl | |
| L-glutamine | Fisher Scientific, Forest Lawn, NJ | 25030-081 | |
| D-luciférine | Caliper Life Sciences, Hopkinton, MA | 122796 | |
| Système d'imagerie bio photonique de Xenogen | Caliper Life Sciences, Hopkinton, MA | Spectre IVIS | |
| Biocarbonate sodium | Sigma-Aldrich, St. Louis, MO | S6014-500G | |
| Non essentiels Acides aminés | Invitrogen, Carlsbad, CA | 11140-050 |
Références
- Bernirschke, K. K. P. . Pathology of the Human Placenta. , (2000).
- Hoshina, M., Boothby, M., Boime, I. Cytological localization of chorionic gonadotropin alpha and placental lactogen mRNAs during development of the human placenta. J. Cell. Biol. 93, 190-198 (1982).
- Johansen, M., Redman, C. W., Wilkins, T., Sargent, I. L. Trophoblast deportation in human pregnancy--its relevance for pre-eclampsia. Placenta. 20, 531-539 (1999).
- Redman, C. W., Sargent, I. L. Placental debris, oxidative stress and pre-eclampsia. Placenta. 21, 597-602 (2000).
- Ogle, B. M. Spontaneous fusion of cells between species yields transdifferentiation and retroviral transfer in vivo. FASEB. J. 18, 548-550 (2004).
- Nygren, J. M. Bone marrow-derived hematopoietic cells generate cardiomyocytes at a low frequency through cell fusion, but not transdifferentiation. Nat. Med. 10, 494-501 (2004).
- Nygren, J. M. Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion. Nat. Cell. Biol. 10, 584-592 (2008).
- Kutschka, I. Adenoviral human BCL-2 transgene expression attenuates early donor cell death after cardiomyoblast transplantation into ischemic rat hearts. Circulation. 114, I174-I180 (2006).
- Min, J. J. In vivo bioluminescence imaging of cord blood derived mesenchymal stem cell transplantation into rat myocardium. Ann. Nucl. Med. 20, 165-170 (2006).
- Malstrom, S. E., Tornavaca, O., Meseguer, A., Purchio, A. F., West, D. B. The characterization and hormonal regulation of kidney androgen-regulated protein (Kap)-luciferase transgenic mice. Toxicol. Sci. 79, 266-277 (2004).
- Weir, L. R. Biophotonic imaging in HO-1.luc transgenic mice: real-time demonstration of gender-specific chloroform induced renal toxicity. Mutat. Res. 574, 67-75 (2005).
- Rajashekara, G., Glover, D. A., Banai, M., O'Callaghan, D., Splitter, G. A. Attenuated bioluminescent Brucella melitensis mutants GR019 (virB4), GR024 (galE), and GR026 (BMEI1090-BMEI1091) confer protection in mice. Infect. Immun. 74, 2925-2936 (1090).
- Kadurugamuwa, J. L. Noninvasive biophotonic imaging for monitoring of catheter-associated urinary tract infections and therapy in mice. Infect. Immun. 73, 3878-3887 (2005).
- Ryan, P. L., Youngblood, R. C., Harvill, J., Willard, S. T. Photonic monitoring in real time of vascular endothelial growth factor receptor 2 gene expression under relaxin-induced conditions in a novel murine wound model. Ann. N.Y. Acad. Sci. 1041, 398-414 (2005).
- Zhu, L. Non-invasive imaging of GFAP expression after neuronal damage in mice. Neurosci. Lett. 367, 210-212 (2004).
- Noiseux, N. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation. Mol. Ther. 14, 840-850 (2006).
- Ajiki, T. Composite tissue transplantation in rats: fusion of donor muscle to the recipient site. Transplant Proc. 37, 208-209 (2005).
- Trivedi, P., Hematti, P. Derivation and immunological characterization of mesenchymal stromal cells from human embryonic stem cells. Exp. Hematol. 36, 350-359 (2008).
- Ogle, B. M., Cascalho, M., Platt, J. L. Biological implications of cell fusion. Nat. Rev. Mol. Cell. Biol. 6, 567-575 (2005).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon