Method Article
ヒトドナー目からブルッフ膜の濃縮
要約
Identifying proteins specifically associated with Bruch’s membrane in human eyes is an important step in understanding the biochemical mechanisms behind eye diseases such as age-related macular degeneration. This protocol describes how to enrich this sheet of extracellular matrix for down-stream biochemical analysis.
要約
加齢黄斑変性症(AMD)は、先進国における視力障害の主な原因です。この疾患は、中心視力の喪失、黄斑と呼ばれる網膜の中心部の破壊によって現れます。初期のAMDは、このような地理的萎縮症(AMDを乾燥)または血管新生(滲出型AMD)などの後期AMDに進行させることができるソフトドルーゼンと呼ばれる小さな、黄色がかった病変が存在することを特徴とします。臨床変化は十分に記載されており、AMDのリスクを与えるの遺伝的影響の理解がこれまで以上に詳細になっていますが、主要な進歩を欠いている一つの領域は、遺伝的リスクの生化学的影響を理解することです。これは、ブルッフ膜、血液供給からの物質の生物学的フィルタおよび網膜色素上皮(RPE)細胞単層が存在する足場として機能し、非常に薄い細胞外マトリックスの生化学を理解する上で困難に部分的に起因しています。ドルーゼンFブルッフ膜及びその存在中にORMは、RPE細胞への栄養素の流れが中断されます。唯一の他のタンパク質は、それとの対話方法を実際にブルッフ膜のタンパク質組成を調査し、によって、研究者は、ドルーゼンの形成、AMDとその後の視力喪失の発展を支える生化学的機序を解明するために望むことができます。本稿では、それが下流の生化学的解析のために使用され、これはすでにブルッフ膜の生化学の理解をどのように変化しているかの例を提供することができるように、全体のブルッフ膜、または単に黄斑領域のいずれかからを豊かにするための方法論を詳しく説明します。
概要
眼科研究の死後、人間の眼組織の使用は、眼疾患の病因の理解のための貴重な資源です。人間のドナーの目の分析は、西側世界1における失明の主な原因である加齢黄斑変性症(AMD)を、支える仕組みを見極めるために重要な貢献をしてきました。世界的に、AMDはすべての失明の約8.7%を占め、ますます高齢化と、それは2020年2によって1.96億人に影響を与えると予測されています。AMDは、中心視力の低下をもたらし、患者の自立と生活の質に大きな影響を持っています3。早期のAMDは、ドルーゼンの形成によって特徴づけられ、それは、地図状萎縮(時々「ドライ」AMDとも呼ばれる)、または脈絡膜血管新生に進行することができる(また、血管新生または「ウェット」AMDとも呼ばれます)。抗VEGF注射は血管新生AMDのそれの私の視力を安定させるか、改善することができる一方で治癒的じゃないし、現在では、何の治療は、地図状萎縮のために存在しません。
特定の遺伝的変異体は、AMDリスク4変更することが示されている一方で- 8を 、以下では、これらの変異体は、生化学的レベルでの黄斑にどのような影響を与えるかについては知られています。 AMDの病因に重要なサイトでは、ブルッフ膜です。このような構成と様々な研究内のドルーゼンのフォームは、AMD 9でブルッフ膜とその周辺補体活性化の証拠を提供しました。ブルッフ膜は、脈絡膜から網膜色素上皮(RPE)細胞を分離し、細胞外マトリックスのシートであり、約4ミクロンの厚さです。ブルッフ膜は、脈絡毛細管枝に合流する、有窓毛細血管及びこれへの外部を含んで脈絡膜の層は、より大きな血管10( 図1A)を含む層です。
ブルッフ膜は、追加のpentilaminarシートであります細胞外マトリックス(ECM)、そしてこの方法は、主に脱細胞化および赤血球のない根本的な脈絡(以下、ブルッフ膜を豊かにするという)のECMとともに、ブルッフ膜を分離する方法について説明します。濃縮されたブルッフ膜は、次いで、ウェスタンブロッティング及び組織学の実験に使用しました。また、単に目の黄斑領域から、ブルッフ膜を豊かにするための方法論は、AMDの生化学的側面を調査したものに特に興味を持ってもらえるでしょうこれは、記載されています。
プロトコル
研究目的のために同意ヒト眼組織は、移植のために角膜の除去後マンチェスターロイヤル眼科病院アイバンクから入手しました。研究のためのヒト組織の使用は、ヒト組織法(2004)のガイドラインに従った、と大学の研究倫理委員会の承認を得て(11305を参照します)。
全体ブルッフ膜の1濃縮
- 1%の消毒剤(V / V)の周りと解剖顕微鏡下にワークスペースをきれいにした後、70%(v / v)のエタノールで拭いてください。
- 次のことを確認し、手にしている:1つの新しい使い捨てメス、2滅菌細胞スクレーパー(一般的に、組織培養で使用される)とピンセットの3組(A、B、Cのようここに記載されているが、材料のリストを参照)。
- 後で使用するために蓋を保持し、使い捨てペトリ皿に目の地球儀を置きます。新しい使い捨てメスを使用して、フラットなMOの作成に干渉する可能性がある、任意の残留視神経を削除組織のUNT。次に、第3部(黄斑ブルッフ膜の濃縮)に進む黄斑領域をカットしない場合は4切開が均等に、4つの象限を作成するために間隔をあけてください。
- 最も内側の感覚神経網膜(NSR)から、脈絡膜と強膜(白目)を通して - 切開は、眼組織の深さ全体を通って延びていることを確認してください。切開を視神経にアイカップのマージンから目のラウンドのすべての方法を継続します。これは、アイカップは、( 図1B参照 )を平坦化することができるようになります。
- グリップに硝子体とその下のNSRを大きなピンセットBを使用し、中心に向かって移動し、周囲から始まる離れた網膜色素上皮(RPE)から、この組織を引っ張る、(脈絡膜剥離を防止するために)ピンセットAを用いて平坦化されたアイカップの1象限を開催開いたアイカップの、その後反対側へ。通常、常に硝子体とNSRの両方が一つと切り離しませ。 scalpeを使用してください視神経乳頭にアンカーの残留NSRを切除するリットル。
- ここでも、ピンセットAを使用して所定の位置に組織の1象限を保持しながら、ゆっくりとアイカップの内面全体からRPE単層を取り除くために、無菌の細胞スクレーパーを使用しています。これらの細胞は、容易に取り外し、暗褐色着色塊として見ることができます。優しくアイカップから離れて外れRPE細胞を洗浄するために、PBSですすいでください。
- 次に、静かにすべての4目の象限から(ブルッフ膜および脈絡膜の両方を含む)上にある暗赤色の組織を剥離するためにピンセットAを使用しています。きれいな皿に切除した組織を置きます。
- 優しく組織をこすりするために第2のスクレーパーを使用し、所定の位置に切除した組織を保持するために、1つのセルスクレーパーの平坦化エッジを使用しました。以上の組織を回して繰り返し、できるだけ多くの余分な材料を除去します。最終的には、半透明の膜が残ります。これはぞんざいに濃縮ブルッフ膜です。 20X倍率の少なくとも解剖顕微鏡の使用でありますブルッフ膜の脈絡膜と充実の除去を助けるのに不可欠。
- パスツールピペットを使用して、簡単に1.5ミリリットルマイクロ遠心チューブに膜を配置する前に残留脈絡膜および血液を除去するために、超純水でブルッフ膜をすすぎます。
- ( 図2参照)を任意の汚染細胞物質を溶解を助けるために約1mlの超純水と渦簡単に(約15秒)で濃縮されたブルッフ膜を一時停止します。膜をペレット化し、上清をオフに吸引するために30秒間500×gでサンプルを遠心。
注:残りの濃縮ブルッフ膜は、後の使用のために-80℃で、今の可溶化のために準備(下のセクション2で説明したように)、またはストレージです。
全体エンリッチドブルッフ膜およびウェスタンブロット分析の2可溶化
- 500μlの8 Mウルの組織を浸漬することによって、濃縮されたブルッフ膜からタンパク質を抽出します1.5mlの微小管( 図3A)で、室温で6時間EA。
- 残りの細胞外物質をペレット化し、10分間10,000×gで遠心分離し、可溶化サンプル。上清を除去し、3500ダMWCO透析膜に転送し、その後、4℃で16時間透析をPBS 1Lにサンプルを配置します。
- 各サンプルについて、タンパク質の分離ビーズの40μlを添加し、室温で30分間サンプル/ビーズミックス(回転ミキサーで20 rpm)を回転させます。
- ビーズをペレット化するため5分間万×gで遠心分離サンプル。上清を除去し、30μlの2倍のサンプルローディングバッファー(65.8 mMトリス塩酸、pHが6.8、2.1%SDS、26.3%(w / v)のグリセロール、0.01%ブロモフェノールブルー、3%のβメルカプトエタノール)中のビーズに結合したタンパク質を可溶化。
- 10分間100℃でサンプルをインキュベートした後、残りのビーズをペレットに5分間万×gで遠心します。
- プレキャストへの放出されたタンパク質が含まれている上清をロードし、SDS-タンパク質分離のためのページ勾配ゲル(素材リストを参照してください)。
- 例えば一般的な染色プロトコル、クマシーブルーを用いて分離されたタンパク質バンドを可視化。
- 簡潔には、ゲルにブリリアントブルー染色(0.1%ブリリアントブルー(w / v)で、50%メタノール、10%氷酢酸、40%水)の20 mLを加え、そして穏やかに撹拌しながら室温で30分間インキュベート。
- 染色溶液を廃棄し、バックグラウンド染色は、染色されたタンパク質バンドの可視化を可能にするのに十分になるまで脱イオン水を用いて染色したゲルを洗浄します。
- 以下に説明するように代替的には、転送は、ウェスタン分析のためにニトロセルロースへのタンパク質バンドを分離しました。
- 転送は、転送バッファにおける半乾燥転写装置(25 mMトリス、192 mMグリシン、10%[v / v]のメタノール)を用いて2.5時間、80 mAでニトロセルロース膜上のタンパク質バンドを分離しました。
- 10 mlのPBS、10%で膜をブロック目の前に4℃で16時間、ミルク、0.02%(w / v)のBSA(w / v)のタンパク質検出のための所望の一次抗体の電子付加。
注意:ここでは例として、図3Cは、補体カスケード、H因子様タンパク質1(FHL-1)のレギュレータをプローブ3つの別々のドナーからの可溶化ブルッフ膜の代表的なイムノブロットを示しています。
3.濃縮黄斑ブルッフ膜の
- 前述のように1.3 - 手順1.1に従ってください。
- NSRは、所定の位置にまだであるが、中央の黄斑領域( 図4を参照)を表し、黄色の中心窩の着色を探します。無菌の6mm生検パンチを使用して、中心窩領域の上に置き、しっかりと黄斑にカット。
- 生検パンチ刃の端にアイカップの縁からメスで別々の切開を行い、所定の位置に生検パンチを維持した後、ピンセットBを用いて、きれいな生検を達成するために、周囲の目材をはがします。
- ピンセットCを使用して、削除しますきれいなペトリ皿のふたにパンチと場所からの組織の6ミリメートルディスク。解剖顕微鏡下でペトリ皿の蓋と黄斑パンチを配置します。
- (生検の精度を推定するために黄色の中心窩の染色のために確認してください)薄いNSRディスクを取り出します。静かにRPE細胞を除去するために、無菌の細胞スクレーパーを使用してください。
- ピンセットAのチップを使用して強膜を介し黄斑ディスクを固定し、再びゆっくりとピンセットCを使用して、脈絡膜とブルッフ膜複合体を剥がし、ブルッフ膜から不要な脈絡膜および血液物質を除去するために、セルスクレーパーを使用しています。
- 1.5mlの微小管に黄斑ブルッフ膜を配置し、1ミリリットルの超純水に懸濁します。任意の汚染細胞物質を溶解するのに役立つ簡単にボルテックス(約15秒)。膜をペレット化し、上清をオフに吸引するために30秒間500×gでサンプルを遠心。
注:黄斑から単離された濃縮されたブルッフ膜は、現在のプロテオミクスのために使用することができるANユーザの好みの消化プロトコルを使用してalysis。
結果
プロトコルは、ブルッフ膜の分離に富んでブルッフ膜の結果を生成するために、上記の脈絡膜毛細血管のECMおよびRPE( 図2)の全てを含む細胞/細胞破片のほとんどが削除されます。水に濃縮されたブルッフ膜の洗浄は、残りの脈絡膜細胞を溶解における重要なステップです。脈絡膜の廃棄時に加わる圧力がブルッフ膜( 図2B)のように定義された領域の中にいくつかの残りの細胞核の一部を圧縮するために表示されます。
濃縮されたブルッフ膜の可溶化は、タンパク質含有量の下流の分析を可能にします。 4使用して可溶化濃縮ブルッフ膜のタンパク質バンドの分離 - 12%勾配SDS-PAGEゲルを、タンパク質含有量を特定するために、それ自体で有用ではないながら、アーカンソー血液タンパク質を汚染最小化するためにこの技術の能力を実証ん電子非特異的に結合した( 図3B)。この点において、タンパク質ゲルの実行から1顕著な不在は、そうでなければ、解釈するのブロッティング、その後の西洋のがより困難になる場合があり、ヒト血清アルブミン(〜66 kDaの)のかなりのバンドである。図2に示した濃縮されたブルッフ膜の組織学的分析もサポートしていますこの。実際、以前に11を説明し、作業の一環として、個々のドナーのシリーズからブルッフ膜は、ウェスタンブロッティング( 図3C)を介して特異的な抗体を用いたタンパク質の数についてプローブした可溶化。ここに示す例では、補体因子H(FH)と呼ばれ、先天性免疫の155 kDaのレギュレータに対する抗体(OX23と呼ぶ)12が使用され、独立した3〜ブルッフ膜試料中の低分子量バンドの存在を実証しました。ドナー( 図3C)。これは、その後、因子H様タンパク質1(FHL-1)であることが判明します、49 kDaのタンパク質FHに関連し、同じ遺伝子13のスプライス変化から生じます。 FHL-1は、ブルッフ膜11に存在する主要な補体調節因子であることが表示されます。
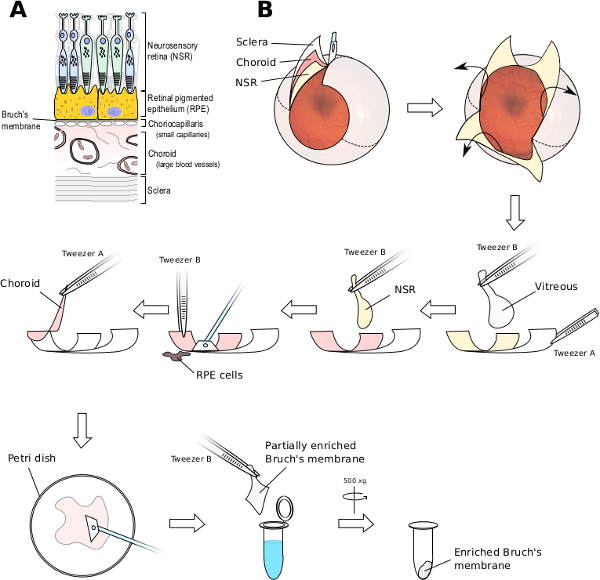
ブルッフ膜の人間の眼と充実の図1解剖。(A)ブルッフ膜は、細胞外マトリックスの障壁です。脈絡膜は、連続的に(脈絡膜毛細血管と呼ばれる)ブルッフ膜に合流有窓毛細血管の層を含み、これらは、生理学的に光受容体細胞をサポートする網膜色素上皮(RPE)細胞単層から(大血管を含む)、脈絡膜の残りの部分を分離します神経感覚網膜(NSR)のヒトへのアイカップ(B)は、4つの切開部は、それがフラットマウントを作成するために開くことができるように作られています。ザ・硝子体は、ピンセットを用いて除去することができます。 NSRは、硝子体と一緒にオフに来るかもしれませんが、また、ピンセットを用いて除去することができます。細胞スクレーパーは、それがまだ脈絡膜や強膜に固定されている間ブルッフ膜からRPE細胞層を除去するために使用されます。ブルッフ膜/脈絡膜複合体を離れて強膜から剥離し、新しい細胞スクレーパーを使用して、外側の脈絡膜を除去することができることができます。超純水で最終洗浄は、残りの細胞物質を溶解する。 この図の拡大版をご覧になるにはこちらをクリックしてください。
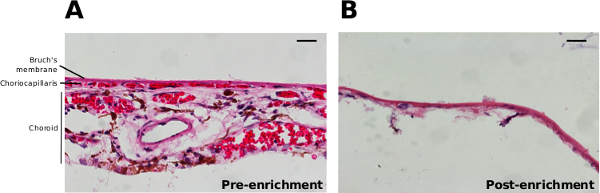
図2.超純ワシントン州ブルッフ膜及び洗浄から外側の脈絡膜構造を削り取るブルッフ膜と、(A)の前脈絡。H&E染色した切片の組織学および後(B)濃縮されたブルッフ膜を生成するために、ター。スケールバーは20μmでを表す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
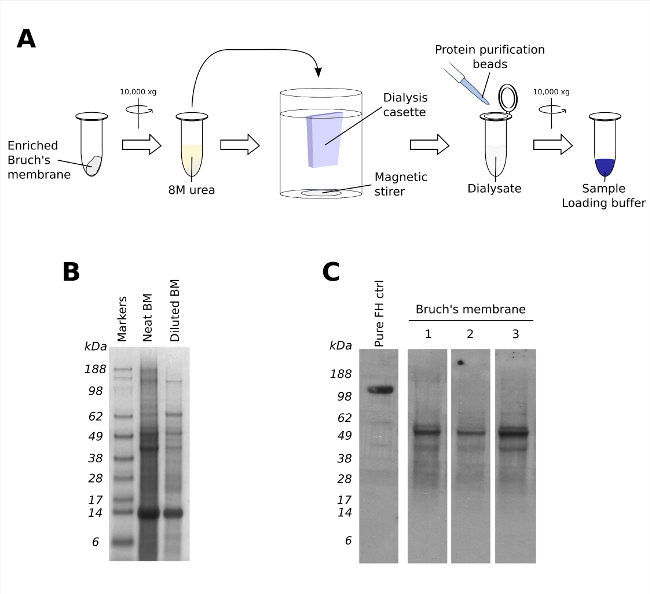
タンパク質含量の分析について濃縮ブルッフ膜の図3.可溶化。(A)タンパク質をPBSに対して透析される前に、室温で6時間8 M尿素中でインキュベートすることにより、濃縮されたブルッフ膜から抽出することができます。ウエスタン分析のために、全体のブルッフ膜の透析液からのタンパク質は、タンパク質分離ビーズを用いて、サンプルローディング緩衝液を減少させるレムリで煮沸することによって溶出して単離することができる。(B)代表的なクマシーブルーニート希釈可溶化ブルッフ両方の膜を示す、SDS-PAGEゲルを染色(BM)方法Dを用いて。(A)に傍接した(C)3個々のドナーからの可溶化ブルッフ膜の代表的なウエスタンブロット(レーン1から3)。H因子様タンパク質1(FHL-1)についてプローブの拡大版を表示するには、こちらをクリックしてくださいこの図。
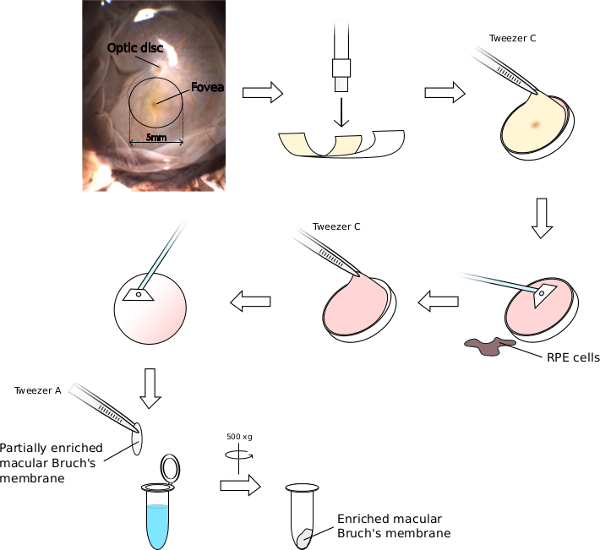
黄斑から濃縮ブルッフ膜の図4の単離。黄斑領域が容易に黄色の上にある中心窩の着色、及び隣接する視神経乳頭への近さによって識別することができ、5mmの領域です。ガイドとして窩を使用して、6ミリメートル黄斑組織ブロックを切り出すために、フラットマウントされ、人間の目には6ミリメートルの生検パンチを配置します。その上のNSRを削除し、切除した黄斑からRPE細胞を削り取ります。残りのブルッフ膜/脈絡膜複合することができますnは離れて強膜から剥離され、徹底的に溶解超純水に浸漬することにより細胞材料を残り、脈絡膜を除去するための掻き取り。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここでは、ウェスタンブロッティング11、質量分析および修正ウッシングチャンバー11,14を利用ブルッフ膜の拡散特性を含むその後の分析を可能にする、さらなる分析のためのブルッフ膜の濃縮を記述する。重要なステップは、a)は、眼の内面を徹底的に削れと洗浄がブルーフが崩壊させることなく、すべてのRPE細胞B)根底にある脈絡膜の繰り返しと慎重スクレイピングを除去し、超純水で切除したブルッフのC)の洗浄が含ま残留細胞の溶解を確実にします。濃縮されたブルッフ膜は、プロテオーム解析のために利用される場合さらに、尿素処理によるタンパク質の抽出は、例えば、機械的な均質化のような他の方法と比較して、この弾力性の組織を破壊するのに最も有効です。濃縮されたブルッフ膜の組織学は、脈絡膜毛細血管のECMは削除されませんを示しています。これは、元になることですpentilaminarブルッフ膜の外層としてpectedは脈絡毛細管内皮細胞の基底膜により形成されています。実際、変更が終末補体複合体/膜攻撃複合体(MAC)15の堆積を含む、AMDで、この中に発生すると脈絡膜毛細血管のECMは残っていることが有利で あり得ます。それは強膜、脈絡膜、及びブルッフ膜の存在下で切断した場合ブルッフ膜の詳細な組織学的分析のために、その構造がよく保存されることに留意すべきです。実際、 図2に示す組織学は、単に、この原稿に記載された技術に起因する濃縮度を実証することを意図しています。
黄斑ブルッフの濃縮は、NSR、特に窩が損傷していないことを確認して、アイカップを慎重に解剖が必要です。それ以外の場合は、識別や黄斑のので、分離はできません。 TISSUの整合性Eはまた、このプロセスに重要であり、それが48時間、死後時間下のサンプルを使用することが推奨されます。必要な濃縮の程度は、ドナー間で変化し、ドナーの年齢、死後時間、および任意の眼病変の存在によって影響され得ます。濃縮という用語の使用がこのメソッドを使用して「精製」またはブルッフ膜の「分離」は、単純に不可能であるということで、技術の限界を認めるで意図的です。確かに、脈絡膜毛細血管のECMがブルッフ膜に合流完全な分離が不可能であることを考えます。
それぞれの眼組織の生化学的変化を理解することは、眼疾患の進行を理解する上で不可欠です。ブルッフ膜のこのユニークな濃縮は、このような理解を促進し、現在進行中の研究は、AMDの異なる段階で質量分析法を用いて濃縮された黄斑ブルッフ膜のプロテオームを検討していますAMDの分子病態の理解を改善するために、異なる遺伝子型を有する被験者から発信サンプルインチ既にここに記載の技術は、正常ブルッフ膜11における優勢な補体調節因子としてFHL-1を同定するために使用され、濃縮されたブルッフ膜上のさらなる研究は、AMDの分子病理学に多くの新たな洞察をもたらす可能性があります。
開示事項
The authors declare that they have no competing financial interests.
謝辞
著者は博士アイザックザンブラーノとヒトドナー眼組織の供給のためのマンチェスター眼科病院アイバンクのスタッフ、そしてH&E染色された画像のためのライフサイエンス組織学施設の学部のミスター・ピートウォーカーを承認したいと思います。特別な感謝を顕微鏡で彼の助けのために氏ロジャー・メドウズに行きます。 SJCは、医学研究審議会(MRC)キャリア開発フェローシップ(MR / K024418 / 1)の受信者であると著者らはまた、視力(1866)と黄斑社会のために戦う、MRC(G0900538とK004441)から、他の最近の研究資金を認めます。
資料
| Name | Company | Catalog Number | Comments |
| Auxillary objective 0.5X | GT-Vision Ltd | 3638 | Useful (but not essential) for lower magnification imaging of whole eye flat-mount |
| Biopsy Punch 6 mm | Oncall Medical Supplies | SCH-33-36 | 6mm Biopsy Punches |
| Bovine serum albumin | Sigma - Aldrich | A3059 | |
| Bromophenol Blue | Sigma - Aldrich | B0126 | |
| Cell scrapers | Sarstedt | 83.183 | For membrane enrichment |
| CyroPure Cyrovials | Sarstedt | 72.38 | |
| Disposable Scalpels | Fisher Scientific | 12387999 | Sterile, individually wrapped Swann-Morton scalpels. |
| Dual Gooseneck LED spot lights on 30 cm arms | GT-Vision Ltd | 0153 | Flexible light source essential for dissection and imaging |
| Dulbecco’s Phosphate Buffered Saline | Sigma - Aldrich | D8537 | Used to prevent macula drying out and during membrane enrichment. |
| (A) Forceps | Scientific Laboratory Supplies | INS4280 | (A) Fine (100 mm) and straight |
| (B) Forceps | Scientific Laboratory Supplies | INS4272 | (B) Broad and blunt (150 mm). Useful for lifting large portions of sample |
| (C) Forceps | Scientific Laboratory Supplies | INS4323 | (C) Straight fine points |
| Glycerol | Sigma - Aldrich | G1345 | |
| Glycine | Sigma - Aldrich | B0126 | |
| GXCAM 5 digital colour camera & GT-Vision software | GT-Vision Ltd | 1122 | |
| Methanol | Sigma - Aldrich | M/4000/17 | |
| Nitrocellulose membrane | Life Technologies | NP0007 | |
| NuPAGE Novex 4 - 12% Bis-Tris Protein Gels | Life Technologies | NP0322BOX | |
| Petri dish | Sterilin | 101VR20 | 90 mm, used as a dish for samples |
| Protein isolation beads (Strataclean resin) | Agilent | 400714-61 | |
| SDS | Bio-Rad | 161-0301 | |
| Stereozoom microscope GXMXTL3T (magnification range 7X - 45X) | GT-Vision Ltd | 5595 | Stereozoom microscope attached to boom stand for ease of use during dissection |
| Tris-HCl | Sigma - Aldrich | T3253 |
参考文献
- Coleman, H. R., Chan, C. -C., Ferris, F. L., Chew, E. Y. Age-related macular degeneration. Lancet. 372, 1835-1845 (2008).
- Wong, W. L., et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: A systematic review and meta-analysis. Lancet Glob Health. 2 (2), e106-e116 (2014).
- Coleman, A. L., et al. Impact of age-related macular degeneration on vision-specific quality of life: Follow-up from the 10-year and 15-year visits of the study of osteoporotic fractures. Am J Ophthalmol. 150 (5), 683-691 (2010).
- Hageman, G. S., et al. A common haplotype in the complement regulatory gene factor H (HF1/CFH) predisposes individuals to age-related macular degeneration. Proc Natl Acad Sci U S A. 102 (20), 7227-7232 (2005).
- Klein, R. J., et al. Complement factor H polymorphism in age-related macular degeneration. Science. 308 (5720), 385-389 (2005).
- Haines, J. L., et al. Complement factor H variant increases the risk of age-related macular degeneration. Science. 308 (5720), 419-421 (2005).
- Edwards, A. O., Ritter, R., Abel, K. J., Manning, A., Panhuysen, C., Farrer, L. A. Complement factor H polymorphism and age-related macular degeneration. Science. 308 (5720), 421-424 (2005).
- Fritsche, L. G., et al. Seven new loci associated with age-related macular degeneration. Nat Genet. 45 (4), 433-439 (2013).
- Clark, S., Bishop, P. Role of Factor H and Related Proteins in Regulating Complement Activation in the Macula, and Relevance to Age-Related Macular Degeneration. J Clin Med. 4 (1), 18-31 (2014).
- Booij, J. C., Baas, D. C., Beisekeeva, J., Gorgels, T. G. M. F., Bergen, A. A. B. The dynamic nature of Bruch’s membrane. Prog Retin Eye Res. 29 (1), 1-18 (2010).
- Clark, S. J., et al. Identification of factor H-like protein 1 as the predominant complement regulator in Bruch’s membrane: implications for age-related macular degeneration. J Immunol. 193 (10), 4962-4970 (2014).
- Sim, E., Palmer, M. S., Puklavec, M., Sim, R. B. Monoclonal antibodies against the complement control protein factor H (beta 1 H). Biosci Rep. 3 (12), 1119-1131 (1983).
- Ripoche, J., Day, A. J., Harris, T. J., Sim, R. B. The complete amino acid sequence of human complement factor H. Biochem J. 249 (2), 593-602 (1988).
- Moore, D. J., Clover, G. M. The effect of age on the macromolecular permeability of human Bruch’s membrane. Invest Ophthalmol Vis Sci. I. 42 (12), 2970-2975 (2001).
- McHarg, S., Clark, S. J., Day, A. J., Bishop, P. N. Age-related macular degeneration and the role of the complement system. Mol Immunol. 67 (1), 43-50 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved