Method Article
なぜ定量事項:での表現型のキャラクタリゼーション
要約
Morphology, size and location of intracellular organelles are evolutionarily conserved and appear to directly affect their function. Understanding the molecular mechanisms underlying these processes has become an important goal of modern biology. Here we show how these studies can be facilitated by the application of quantitative techniques.
要約
形態形成上のほとんどの研究は、特定の遺伝子と遺伝的経路の破壊によってどのように影響されるか、解剖学的特性の定性的な記述に依存しています。遺伝子操作は、表現型効果の範囲を生成し、変動があっても、対照群内の個体間に観察されるが、定量的な説明はほとんど、実行されません。新興の証拠は、細胞小器官の形態、大きさや位置が細胞の機能と生存の以前に過小評価、まだ基本的な役割を果たしていることを示しています。ここでは、 ショウジョウバエの幼虫の神経筋接合部(NMJ)で表現型の定量分析を実行するためのステップバイステップの手順を提供します。我々は、バイオイメージング技術と組み合わせて、いくつかの信頼性の免疫組織化学的マーカーを使用し、形態学的には、特定の細胞プロセス上の遺伝子変異の効果を調べるために分析します。特に、我々は、nの形態、大きさ及び位置に影響を与える表現型の定量分析に焦点を当てますショウジョウバエの幼虫の横紋筋肉内uclei。 ショウジョウバエ幼虫NMJは、健康と病気の両方の構造や神経筋システムの機能を、根底にある分子メカニズムを研究する貴重な実験モデルです。しかし、ここで説明する方法は、他のシステムに拡張することができます。
概要
Qualitative analysis restricts the focus of most experimental studies to the examination of genetic manipulations leading to large phenotypic effects or to phenotypes that are not amenable to quantification, e.g., absence/presence. Quantification of phenotypes is not usually performed and variations present within members of a phenotypic group are not taken into consideration. Additionally, without mathematical descriptions of morphologies, it may be difficult to determine whether fine scale phenotypic changes are the result of genetically induced alterations or whether observed changes are simply due to random fluctuations.
We propose that for an accurate and unbiased analysis of phenotypic defects due to gene disruption, quantitative methodologies should accompany more traditional qualitative approaches. Quantitative evaluation of phenotypes is particularly beneficial for structures such as synapses that present a high degree of variability due to their intrinsic morphological and functional plasticity. We have selected examples of quantitative analyses applied to areas of investigation with which we are most familiar, namely the Drosophila larval neuromuscular junctions (NMJs). However, concepts and principles apply equally well to other experimental systems.
The larval NMJ is an excellent model system to study synaptic development and function because of the highly stereotyped nature of its structure. Each hemi-segment of the larval neuromuscular system contains 32 identifiable motor neurons forming synaptic contacts with their postsynaptic target muscle. Every hemi-segment also contains a fixed number of muscles visible as multinucleated fibers attached to the internal surface of the cuticle1. Another advantage of using the larval neuromuscular system is the power and versatility of Drosophila genetics that easily allows the generation of a number of mutant alleles and the possibility to modify gene expression in a time- and tissue-restricted manner. Finally, 75% of the human genes causing a disease have an evolutionarily conserved orthologue in Drosophila2. Indeed, entire genetic pathways are conserved between flies and humans. Because of this, the Drosophila larval neuromuscular system is a very popular experimental model to elucidate the molecular mechanisms underlying a number of human diseases including amyotrophic lateral sclerosis (ALS)1.
Here we show that the availability of several reliable immuno-histochemical markers, combined with bio-imaging techniques and accurate morphometric analyses can describe anatomical traits that are likely to play an important functional role3,4,5. Among the cellular processes that are amenable to quantitative analyses, we focus on changes in shape, size and position of intracellular structures such as the nuclei. All these are processes that we know very little about.
The challenge for molecular geneticists in the coming decades will be to extend our current knowledge by analyzing the effect of genetic mutations that produce very subtle phenotypic defects. Quantitative methodologies that allow researchers to meticulously explore the effects of genetic mutations can provide a more comprehensive understanding of how genotypes relate to phenotypes, especially for poorly understood cellular processes.
プロトコル
1.実験の準備
注:セクション2と3での解剖と免疫組織化学の手順は3-6が、変更を加えた参考文献に従って行われます。
- 1Xリン酸緩衝生理食塩水(PBS)、0.1%トリトンX-100を含有するPBS(PBT)を準備します。氷の上に保管しておいてください。
- ブアン固定液を準備します(15ピクリン酸:10ホルムアルデヒド:1氷酢酸)。この試薬は新鮮ください。
- きれいなステンレス鋼minutienピンと細かい鉗子を選択します。
- 5センチメートルペトリ皿にシルガードディスクを含む解剖プレートを準備します。
第三齢幼虫のNMJの2解剖
- 細かいブラシでバイアルまたはボトルから第三齢幼虫をさまよう選び、残留食べ物を洗い流すために4℃でPBSを含む2センチメートルペトリ皿に入れます。
- 解剖プレートのシルガード面の上に1幼虫を置き、それがPOSITIであることを確認してください2つの長手方向の気管チューブが上に表示されるようにその背側を上にしてoned。
- ピンを保持するために鉗子を使用して、右の口のフックの下で、その前端に幼虫を突き止めます。できるだけ多くの幼虫を伸ばし、その後部がダウンして終了ピン。
- プレートの壁に到達するのに十分なPBS生理食塩水を加え、完全に幼虫を浸します。
- 同じ遺伝子型の他の幼虫のために2.3の手順2.1から手順を繰り返します。シングル5センチメートルペトリ皿の解剖プレートは簡単に8幼虫まで収容することができます。
- 顕微解剖ハサミを使用して、少し背のキューティクルを持ち上げ、ピンの近くに後部端に小さな水平切開を行います。
- 切開部にはさみを入れ、すべての方法気管の2つの縦管の間の正中線に沿って前端に幼虫を切りました。正中線のカットはちょうどキューティクルを通過すると、上の筋肉を切断を回避するのに十分な表面的であることを確認してください腹側。
- 各端部で、左右両側に2つのノッチをカットします。
- 前方切開部の両側に2本のピンを配置することにより、フィレットを開きます。後端で同じことを繰り返します。ピンを配置すると、離れて体壁を広げていることを確認してください。
- 鉗子とPBS生理食塩水を使用して内臓を一掃。無傷の中枢神経系を残します。ゆっくりとそれが完全に延伸されるまで、コーナーピンと幼虫を伸ばすが、筋肉は、このプロセスの間に引き裂かれていないことを確認してください。
- 同じ解剖プレート上の他の幼虫のために同じ解剖手順を繰り返します。
- すべての内臓を除去するために、PBS生理食塩水で3回洗浄します。
- ブアン固定液を含むPBSを交換し、10分間室温で残します。
- PBTで数回洗浄します。
- 慎重にピンを取り外し、免疫染色のために1.5ミリリットルマイクロ遠心チューブに今かなり剛性であるすべての準備を、転送します。
筋肉や筋核に特異的な抗体でショウジョウバエのNMJの3免疫組織化学染色
- 迅速にPBTで幼虫の切り身をすすぎます。
- 一定の撹拌下で2時間、PBTに10%正常ヤギ血清(NGS)とインキュベートすることによって準備をブロックします。
- 2時間:(500 1の濃度で)とモルモット抗DVAP抗体と:NGSの5%を含むPBTにおける解剖のNMJのセットと(500 1の濃度で)ウサギ抗ラミン抗体をインキュベート室温または4ºCで一晩。抗ラミン染色は筋核の輪郭を検出しながら、抗DVAP抗体は、横紋筋肉を染色します。
- 過剰に抗体を除去するために、PBTに一度すぐに洗います。 PBTは15分ごとにバッファ変更することにより、2時間、PBTで洗浄します。
- 1で5%NGSおよび蛍光標識二次抗体を含有するPBT中のサンプルをインキュベートする:室温で2時間500希釈を。同じ試料C異なる発色団と結合した二次抗体が使用されている場合、同時に複数の抗体を用いた染色に供されます。
- 二次抗体を除去し、PBTバッファごとに15分を変更することで、2時間、PBTで洗います。
- 筋核の内部を染色するには、PBSでサンプル3回洗浄し、以下の手順に従います。
- PBSで千をし、一定の撹拌下で20分間インキュベート:1の希釈でTO-PRO-3核マーカーを追加します。このマーカーは、本研究で使用されているが、任意の他の商業的に入手可能な核マーカーを使用することもできます。
- マウントする前にPBSで素早く3回洗浄します。
スライド4.マウントサンプル
- 1.5ミリリットルマイクロ遠心管から鉗子でサンプルをピックアップし、処理スライド上に置きます。
- マイクロ解剖ハサミを使用することにより、ヘッドとフィレットの尾をカットし、その内面アップを続けます。
- 目を準備電子互いから約1cmの距離できれいなスライドの両側にセルローステープの3ストリップを周りにラップすることによって、スライドをマウントします。カバースリップは、2つのストリップの上に配置されると、ギャップは、サンプルの平坦化が回避され、その生成されます。構造物の三次元ボリュームレンダリングを行うことになっている場合、これは重要です。
- 3セルローステープストリップとの間の取り付けスライドの真ん中にマウンティング培地約20μlの小滴を入れてください。
- きれいなピンセットでマウンティング培地を拡散した後、内面アップを維持、マウント培地にマウントスライドに解剖幼虫をドラッグします。 4または5の列にそれらをマウントしてみてください。
- ゆっくり取付スライドの上にカバースリップを削除し、空気の泡が発生しないことを確認してください。透明なマニキュア液でスライドを密閉します。サンプルは撮影前に少なくとも10分間乾燥させます。
イメージング用5.共焦点設定
注:E倒立顕微鏡:この研究で提示される画像は、Ti上に集積ニコンA1R共焦点ユニットを使用して撮影されています。しかし、488ナノメートルの波長領域で使用可能な3レーザユニットの最小を有する任意の共焦点顕微鏡、561 nmおよび642 nmおよび3チャネル検出システムは、この目的に適しています。
- レーザー、検出器ユニット、水銀球、ステージコントローラ、顕微鏡とPCをONにしてください。制御ソフトウェアを起動して、ステージホルダーのスライドを固定します。
- 、より高速イメージングを行うことを選択し、20Xの対物レンズを用いて試料の利息(ROI)の全ての領域をマークします。
- 慎重60X高倍率の対物レンズ(60XプランアポVC / NA 1.4 OIL)にノーズピースを振ります。
- 対物レンズにイマージョンオイルの滴を置き、コンピュータ上のXYZの概要ウィンドウからマークされたROIのいずれかを選択します。
- 以下の光学設定を使用して撮影を開始します。最初のダイクロイックミラーを選択:48分の405を8/561/640。発光フィルタは、チャンネル1、チャンネル3でのロングパスフィルターが650nmとチャンネル2と642 nmレーザーで50分の595発光フィルターと561 nmのレーザーでNMを525/50と488 nmのレーザーを選択します。
- 画像取得を開始する前に、次のスキャン設定を使用します。ガルバノスキャナを選択します。スキャン方向:一方向;スキャン速度:毎秒0.5コマ。
- チャネルブリードスルーを回避するために、チャネル・シリーズを選択します。
- 1エアリー単位にピンホールのサイズを調整します。スキャンし、レーザパワー検出ゲインを調整し、画素の彩度とバックグラウンドレベルを回避するために、各チャネルに対して適切にオフセット。
- ROIとスライドの準備すべてのためにボクセルサイズ0.2×0.2×0.5μmの3を使用してのzスタックを取得します。画像はデコンボリューションに供される場合には、0.06のx 0.06のx 0.15μmの3にボクセルサイズを設定します。
- .nd2ファイル形式またはの.ics形式で画像を保存します。
横紋内の核間の距離の6計算60;最近隣分析の手法による筋肉
- この分析のために、筋肉を視覚化し、ラミン抗体および核を強調するために核マーカーとするDVAP抗体で染色した幼虫の体壁の筋肉を表示する共焦点画像を使用しています。
- 核の間の最も近い距離を推定するために、画像解析ソフトウェア( 例えば 、IMARIS)のMeasurementProモジュール内の測定ポイントを使用しています。画像解析のための他の同様のソフトウェアアプリケーションは、同じ目的のために使用することができます。
- 共焦点画像を開きます。 、ソフトウェアアイコンをダブルクリックを開始します。ドラッグアンドアリーナに共焦点zスタック画像をドロップします。
- 自動的にメニューツールバーアイコンの下に、サーパスビューでそれらを開くために、画像をダブルクリック
 。ビューエリア、プロパティエリアをリストオブジェクトとオブジェクト:サーパスビューは、3つの主要なワークスペースパネルを持っています。
。ビューエリア、プロパティエリアをリストオブジェクトとオブジェクト:サーパスビューは、3つの主要なワークスペースパネルを持っています。 - トンボリュームレンダリングを作成します。メニューアイコン3DビューをクリックしてHREEチャンネル画像
 。
。 - 新規追加測定ポイントのアイコンをクリックしてください
 から オブジェクトは、ツールバーやオブジェクトのプロパティエリアに表示されます作成ウィザードに従ってください。
から オブジェクトは、ツールバーやオブジェクトのプロパティエリアに表示されます作成ウィザードに従ってください。 - 作成ウィザードから、最初の[編集]タブを選択し、特定のチャネル。核を強調するために、核マーカーまたはラミンチャネルのいずれかを選択します。
- キーボードのEscキー]タブを押して、選択モードへのポインタを設定します。
- 画像内の指定された核を含むように、マウスホイールで3Dカーソルボックスのサイズを調整します。同じ核のShiftキーとマウスの左クリックを保持することにより、測定点を追加します。
- 前の手順を繰り返して、同じ筋肉に近く核上の第二の点を追加します。行が自動的に2点と測定された距離との間に描かれています 2つの核が表示されます。 2つの核間の距離は、現在のタブの統計>詳細>距離データの下のオブジェクトのプロパティエリアで統計的変数として記録されています。
- 指定された核を取り巻く全ての核のために6.10までの手順6.6から手順を繰り返します。
- 統計から>収集したすべての測定点を表示詳細>距離データは、最短距離を選択します。
- ファイルにタブ表示に書き出し統計をクリックして
 オブジェクトのプロパティエリアの下で入手可能な、データがスプレッドシートに保存されます。
オブジェクトのプロパティエリアの下で入手可能な、データがスプレッドシートに保存されます。 - 他の周囲の核のためにと遺伝子型あたりの筋線維の選択された数の同じ手順を繰り返します。
- スプレッドシートファイルにエクスポートされたデータを使用して、以下の式を使用して筋肉のすべてのM個の平均最短距離(DのAVE)を計算します 。
OAD / 53821 / 53821eq1.jpg "/>
Diはiは0からNまで変化し、Nは筋肉ごとに分析した核の数で与えられた核iに対する隣接核への最短距離です。 JへJ = 0の値の総和は、= mは分析筋のMの数を示します。 - また、使用 最近傍核への平均距離を推定するスポット至近距離にスポット作成ウィザードとスポット。このために、Matlabの拡張モジュールが必要とされます。
- アリーナ、3Dボリューム画像上の1つの特定の画像をダブルクリックして、表示領域に表示されます。オブジェクトの作成アイコンをクリックし、新しいスポットを追加
 オブジェクトツールバーから。
オブジェクトツールバーから。 - オブジェクトのプロパティエリアでの作成ウィザードで、オプションをスキップ自動作成、編集手動]をクリックします。
- ラミンまたは核を表示するための核マーカーチャネルのいずれかを選択します。
- LEF Shiftキーを押しながらクリック画像内の特定の筋肉の全ての核にトンのマウスボタン。すべての核上のスポットが表示されます。
- オブジェクトのプロパティエリアの[ツール]タブの下にリストされているスポット至近距離にスポットを選択します。結果モードとMatlabの窓の下でスポットの統計を選択して表示されます。
- [統計]タブの下で、詳細、その後、特定の値を選択します。 Distminをクリックし、すべての核の最小距離の値が表示されます。
- スプレッドシートファイルにデータをエクスポートし、筋肉あたりのこれらの距離の平均値を計算します。与えられた遺伝子型のすべての筋肉のための手順を繰り返します。
- アリーナ、3Dボリューム画像上の1つの特定の画像をダブルクリックして、表示領域に表示されます。オブジェクトの作成アイコンをクリックし、新しいスポットを追加
7. ショウジョウバエ幼虫の体壁の筋肉内核の形状を決定します
- この分析のため、ラミンと核を可視化するための核マーカーで染色体壁筋の共焦点画像を使用しています。
- 筋核の形状を評価するために、測定球形(SURの比として定義されます顔核の表面積に与えられた核と同じ体積の球の面積)または楕円(長球/扁平楕円とスフェロイドを区別する)。
- 前述のように画像を開きます。オブジェクトツールバーのアイコンをクリックして新しいサーフェスを追加
 。
。 - オブジェクトプロパティエリアに表示されます作成ウィザードでは、核を表示するには、ソースチャンネルとして核マーカー染色を選択します。
- 閾値としてオプション絶対強度を設定します。核のほとんどが閾値曲線上の値を変更することにより、滑らかで、過負荷になっていないレンダリングを示していることを確認してください。同時に、同じ曲線を使用して、任意の核に穴の存在または不完全なマスクを避けます。
- 使用 表面レンダリングの任意のノイズを排除するFilterツール。新しく作成された表面層、スプリットの編集タブの下で、または正しく再されている核の表面をマージndered。
- スプレッドシートファイルにエクスポート[統計]タブで入手可能である表面レンダリング核の楕円率と真球度の値。
- 円形度(C)はCのように定義される代わりに、核の真円度を測定するためにImageJのまたはフィジーソフトウェアを使用
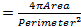 。ゼロに近づく値はますます細長い形状を示している一方の値が完全な円を表します。
。ゼロに近づく値はますます細長い形状を示している一方の値が完全な円を表します。 - メニュー画像>スタック> Zプロジェクトからのzスタックの最大強度の投影を作成します。最大強度に投影タイプを設定します。
- チャンネルを分割し、核マーカーチャネルを選択します。
- メインメニューから、[画像]を選択>>しきい値を調整します。
- セグメント強度閾値を調整することにより、核。近くの核は、単一のユニットとしてセグメント化されている場合は、核を切断する工程>バイナリ>流域ツールをクリックしてください。
- メインメニューから、[編集]> [S]を選択選挙>選択範囲を作成します。
- >ツール> ROI Managerを分析メニューをクリックすることで、ROI Managerに、選択したすべてのROIを追加します。 ROIマネージャウィンドウで[追加]をクリックします。同じウィンドウ内で[その他]> [分割]を選択します。
- 分析>セット測定における形状記述子を選択します。 ROIマネージャウィンドウでタブをクリックします 測定します。これは、選択したすべての核の真円度値のリストが表示されます。
- また、核の体積を測定サブセクション7.3から7.7に記載されているように核マーカー染色チャネルを使用してサーフェス作成ウィザードに従います。
特定のタンパク質の核内局在化を評価するために、 ショウジョウバエの幼虫ボディ壁筋肉内の選択された核の8 3Dボリュームレンダリング
- 核マーカーとし、ラミンとDVAPに特異的な抗体で染色した体壁の筋肉を報告使用共焦点画像。
- ソフトウェアおよびSELを開始することによって画像を開きます。電気ショック療法を分析しようとする特定の核。これは、メインメニューの編集>作物3Dを選択することによって行うことができます。
- サブセクション7.3から7.7に記載されているようにラミンチャネルを使用してサーフェス作成ウィザードに従ってください。
- 表面が作成されると、オブジェクトのプロパティエリアで[編集]をクリックし、核の内部の信号を分離するためにすべてのマスクを選択します。これは、新しいウィンドウを作成します。
- チャンネルを選択ドロップダウンメニューからDVAP信号を選択します。ゼロに表面の外でオプションセットのボクセルをクリックすることで、核の内側DVAP免疫反応性の信号を選択します。新しいマスクされたチャネルが作成され、選択のための表示調整ウィンドウで利用可能です。
- 核内部の信号の存在を可視化するためには、追加アイコンを新しいクリッピング平面をクリックすることで、輪郭面を作成します
 オブジェクトツールバーから。
オブジェクトツールバーから。 - 対話的クリッピングの角度を調整飛行機や核内部の信号の分布を可視化する立場。
結果
ALSは、具体的には横紋筋7の進行と致命的な麻痺につながる運動ニューロンに影響を与える変性疾患です。ヒトVAMP関連タンパク質B(hVAPB)におけるミスセンス変異は、ALSの種類8 8-12を含む運動ニューロン疾患の範囲を引き起こします。 hVAPB遺伝子におけるミスセンス変異(V234I)は、最近、ヒト13における典型的なALSの一つのケースで同定されています。その病原性の可能性を評価するために、我々は、疾患の原因となる変異(DVAP-V260I)を運ぶhVAPB ショウジョウバエオルソログDVAPを発現するトランスジェニックハエを生成しました。この導入遺伝子の発現は、UAS / GAL4系と筋固有のドライバのBG57-GAL4 14,15を使用して、筋肉を標的としました。 DVAP-V260Iトランスジェニック発現の効果を比較し、野生型DVAPタンパク質16の異なるレベルで発現する他の二つの導入遺伝子(DVAP-WT1とDVAP-WT2)、のそれに対比しました。モルeは具体的には、DVAP免疫反応性の増加は、同じ信号16のDVAP-V260IおよびDVAP-WT1の展示匹敵すると低いレベルながらDVAP-WT2ラインのコントロールに比べて2.2倍高いです。
核の変化は、加齢とパーキンソン病17,18を含むいくつかの神経変性疾患と関連しています。 ALS8のための私達のフライモデルが核アーキテクチャ、位置や大きさの変化を示しているかどうかを評価するために、我々は、核マーカーおよび核膜を可視化抗ラミン抗体19-22、との適切な遺伝子型の横紋筋肉内核を染色しました。筋肉を強調表示するには、DVAP特異的抗体はまた、同じ試料( 図1)に加えました。共焦点画像を収集し、詳細な形態学的分析は、画像分析ソフトウェアを用いて行きました。対照筋において、核は均一に筋肉に沿って分布されることが見出されました筋肉を表現DVAP-V260IおよびDVAP-WTにいる間の繊維は、核が密接に関連したクラスター( 図1)で再配布する傾向を示します。
我々は、すべての遺伝子型の筋線維に沿って核の分布を定量的に評価を行うために最近隣分析を行いました。最近隣分析は、最初に与えられた核の中心部や他のすべての周囲の核の中心との距離を測定することにより、すべての核のための最も近い隣人を識別します。この手順は、次いで、筋繊維に沿って他のすべての核に対して繰り返されます。最後に、特定の筋肉内の核との間の最短距離は、すべての核とその最も近い隣人の最短距離を平均することによって計算されます。 ( 図2A - C)。対照と比較して、DVAP-V260I導入遺伝子または導入遺伝子のいずれかのいずれかを発現する筋肉は、野生型タンパク質を過剰発現します、結果として、核が密接にクラスターに関連すると思われる、核間の平均最短距離の劇的な減少を提示し。アレルDVAP-V260Iを引き起こすALSの影響が最も強いDVAP-WT2導入遺伝子は、( 図1および図2D)を用いる場合であっても、野生型タンパク質の過剰発現に関連したよりも深刻です。
DVAP-V260IまたはDVAP-WTのいずれかの導入遺伝子の過剰発現はまた、細長い構造( 図1)と変形核で生じた核アーキテクチャの深刻な悪化を示します。この構造的収差は円形が式Cによって定義されたImageJソフトウェアを用いて定量しました。  、真円とC = 0無限に細長いポリゴンを表すC = 1とすべての核の長さの比に幅を測定します。 CONTRでトランスジェニック変異体では、円形の必然的損失を伴う形状の変化は、この値( 図1及び図3)からの大きな逸脱を引き起こしながら、明確な丸い形状を呈するオール核は、Cは1に等しいです。
、真円とC = 0無限に細長いポリゴンを表すC = 1とすべての核の長さの比に幅を測定します。 CONTRでトランスジェニック変異体では、円形の必然的損失を伴う形状の変化は、この値( 図1及び図3)からの大きな逸脱を引き起こしながら、明確な丸い形状を呈するオール核は、Cは1に等しいです。
また、ALS原因対立遺伝子がDVAP-WT導入遺伝子( 図4)と比較して、この表現型を誘導することで、より効率的であると思われるが、筋肉が同じ導入遺伝子の発現において、核は、対照と比較してマークされ、拡大核体積を表示することがわかりました。
ほぼすべての神経変性疾患は、病原性タンパク質を含有する凝集体の細胞内蓄積によって特徴付けられます。我々は、3D再構成および核のボリュームレンダリングを行ったし、我々は筋肉変異導入遺伝子を発現しているか、野生型タンパク質を過剰発現するには、DVAPの免疫反応性がクラスター形成されていることがわかっNDそれらのいくつかはまた、核( 図5)に局在していること。逆に、コントロールのNMJで、DVAPの免疫反応性はかすかに筋線維全体に分散され、核16から除外されます。
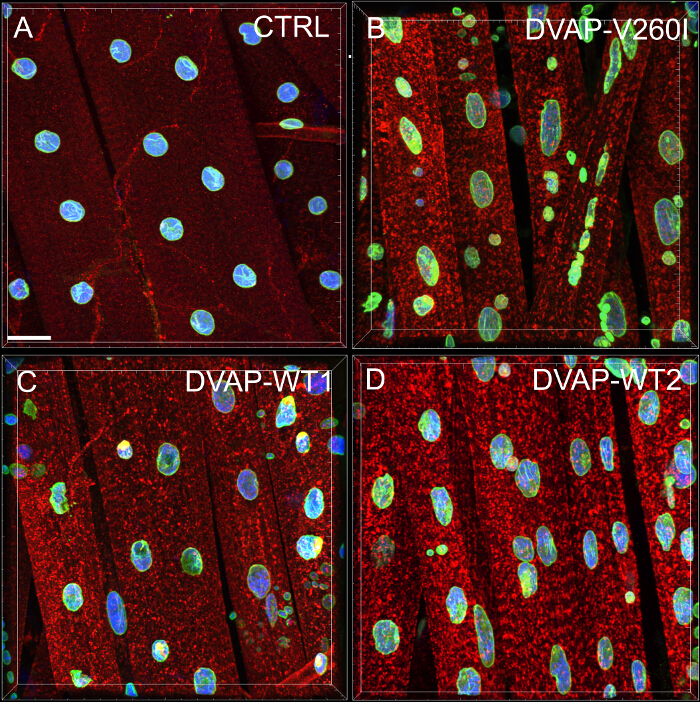
図1:WT DVAP-またはDVAP-260Iの導入遺伝子のいずれかを発現する横紋筋肉内筋核の共焦点画像 (A)BG57-GAL4 / +コントロール、(B)BG57; DVAP-V260I、(C)BG57; DVAP-WT1。および(D)BG57;示された導入遺伝子を発現しているDVAP-WT2の筋肉は、DVAP(赤信号)に特異的な抗体で染色されたラミン(緑信号)と核(青色信号)を可視化するための核特異的マーカーです。スケールバー=30μmで表示するには、こちらをクリックしてください。この図の拡大版。
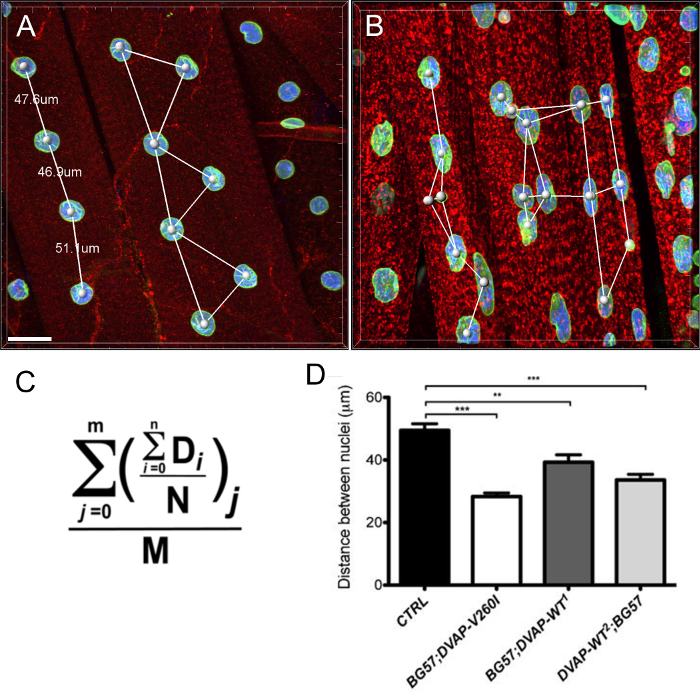
図2:核とその単一の最も近い隣接間の平均距離を決定するために、最も近い隣人分析 (B)代表的な結果は、(A)のコントロールと比較した場合、DVAP-WT2導入遺伝子を過剰発現する筋肉に変更された核の位置を示します。示された遺伝子型の筋肉の平均核の距離が(C)式を用いて推定し、データ(D)に報告されています。幼虫のNMJは、DVAP(赤信号)に特異的な抗体で染色したラミン(緑)、核マーカー(青色信号)とされています。アスタリスクは統計的有意性を示しています。 *** P <0.001、** P <0.01。この実験の統計分析とANOVA検定を使用した一方向およびTukeyのmultipの下に報告されたすべての実験について遺伝子型間の差異は、ANOVA試験により有意であることが判明した場合ルの比較試験は、事後検定として適用しました。エラーバーはSEMを表します。スケールバー=30μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
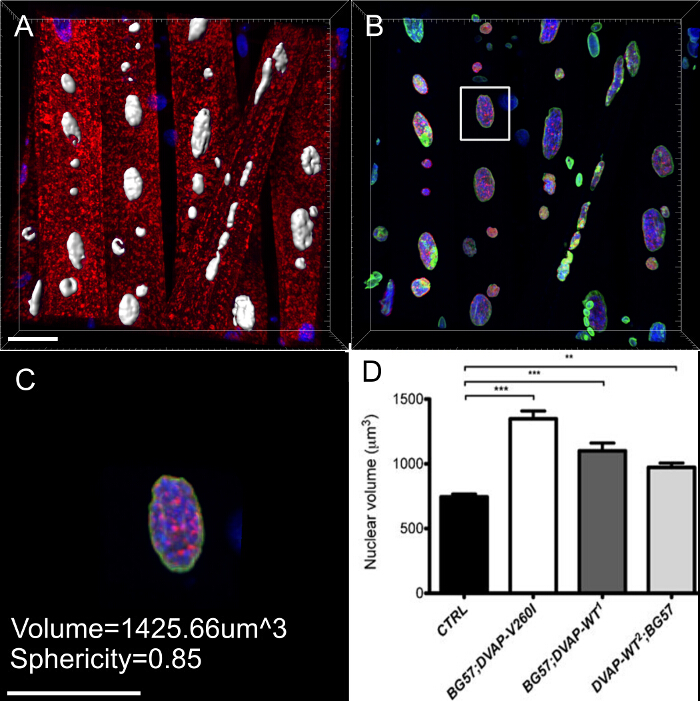
図 3: 核体積の計算における代表的なステップを示す画像 (A)表面作成ウィザードを使用してセグメント化された核を示す代表的な画像。画像の境界で核が無視されました。周囲のDVAP染色後の核DVAP信号を示す(B)の画像は、核マーカーチャネルで作成した表面を使用することによりマスクされています。 (C)表面層は、追加のパラメータの情報を提供します核体積及び球形度を含みます。様々な遺伝子型の核ボリューム上の(D)データ。アスタリスクは統計的有意性を示しています。切開のNMJ抗DVAP抗体(赤シグナル)、抗ラミン抗体(緑色シグナル)および核マーカー(青色信号)で染色しました。 *** P <0.001、** P <0.01。エラーバーはSEMを表します。スケールバー=30μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
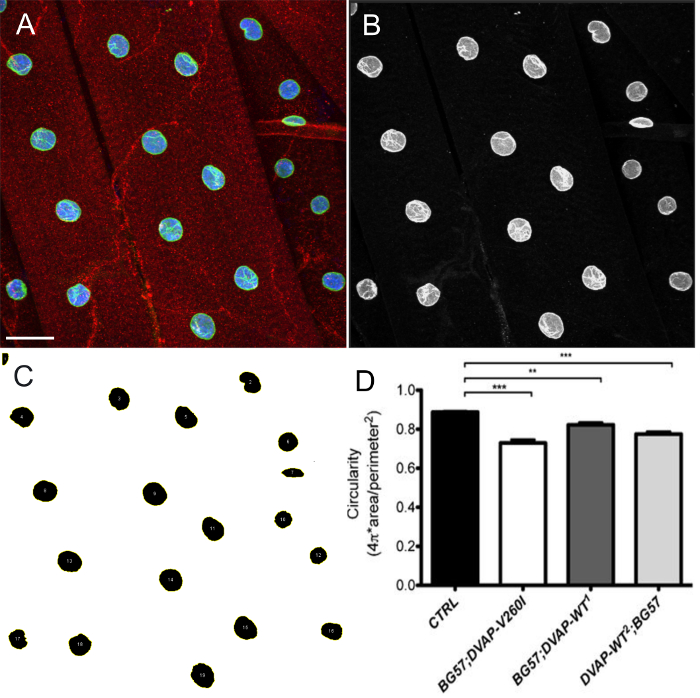
図4:ImageJ のによる核形状の推定における代表的なステップを示す画像。 画像の最大強度投影は、筋肉内の核の真円度を推定するためのImageJを用いて分析しました。 (A)投影の代表例プロトコルのステップ7.9のように、3チャネル画像の。 (B)チャネルが分割され、核マーカーチャネルが選択されたプロトコルのステップ7.10を示す画像。 (C)セグメントにImageJの中の核とROIマネージャープラグインを強度閾値を適用した後、関心のあるすべての核が選択することができ、その形状は、形状記述子を介して測定していることを示す代表的な画像(7.11から7.15ステップ)。 (D)は、種々の遺伝子型の円形の定量。緑が核を概説し、ラミン染色に対応している幼虫のNMJで、赤信号はDVAP染色を示しています。すべての核の内部が原因で核マーカーでの染色に青色で標識されています。アスタリスクは統計的有意性を示しています。 *** P <0.001、** P <0.01。エラーバーはSEMを表します。スケールバー=30μmの彼女をクリックしてくださいeは、この図の拡大版を表示します。
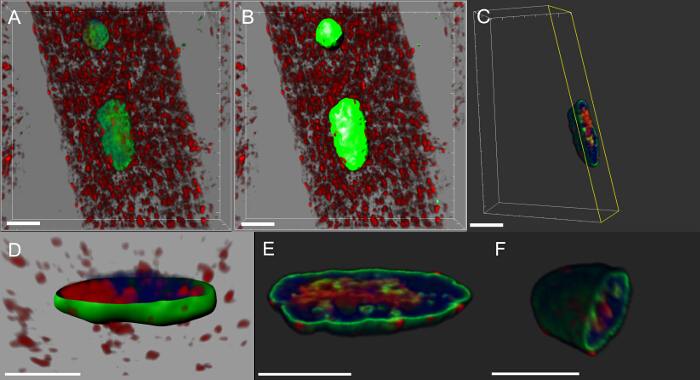
図5:筋核のボリュームレンダリングの作成 で特定のステップを示す画像 。 (A)DVAPタンパク質(赤)、ラミン(緑)、DNAマーカー(青色)で染色した筋肉の3D強度ブレンドビューを示す画像。 (B)セグメントに核ラミンチャネルを使用して生成された表面層を表す画像。 (C)表面層を選択核外DVAP信号をマスクするために使用された核を表す画像。黄色でハイライト表示は画像に追加されたクリッピング平面です。ビューと位置のその角度は、対話的に核の内部信号の分布を可視化するために調節することができます。 (D)USIを作成した核の表面層の断面図を報告画像ngのラミンチャンネルがマスクされていないDVAPと核マーカー信号と合併しました。 (EおよびF)は、同じ核の追加の区分ボリュームレンダリング。スケールバー=10μmで、この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
過去には、内および実験群間の形態学的変動はほとんど考慮されませんでした。しかし、定量的な方法の適用は、現在の形態および解剖学的な形態の数学的記述の比較研究におけるノルムが計算されますなってきています。定量の使用は、特定の細胞プロセスに対して遺伝子操作の影響を評価する際に分析し、形態学的変化を検出する能力を高める上で、これらの変更が記載されている精度を向上させるのに有望です。また、定量的データの統計分析は、私たちが表現型との間に観察された差が有意であるかどうかを評価することができます。
横紋筋では、核は明確な丸みを帯びた構造を示し、均等に筋線維に沿って分布しています。確立およびサイズ、形状および核の構造を維持する分子メカニズムは知られていないが、これらの核の特徴は、おそらく、TでありますO筋機能を制御する基本的な役割を果たしています。実際、いくつかの筋疾患は、筋肉内核の形態や位置を制御する遺伝子の変異によって引き起こされます。細胞内の核の形状及び分布の機能的重要性は、筋肉に限定されるものではありません。証拠を蓄積すると、核内の欠陥はまた、パーキンソン病18,24などの神経変性疾患と関連していることを示しています。さらに、当社は、小胞体とミトコンドリアを含む他の細胞小器官の形態、大きさや細胞内分布は、機能的結果を有していてもよいことを理解し始めています。例えば、ミトコンドリアの形態の変化は、視神経萎縮型-1(OPA1)とシャルコー・マリー・トゥースタイプ2Aの神経障害25などの神経障害に関連しています。
これらの重要なプロセスの根底にある分子メカニズムを解明するプロセスを支援するために、我々は、高解像度の共焦点を結合することを提案しますイメージングソフトウェアおよび形態計測を使用してデータを定量的操作は筋繊維内の形状、大きさ、および核の場所にどのように影響するかの遺伝子を評価するために分析します。一緒にショウジョウバエの幼虫における神経筋システムの高度紋切り自然とショウジョウバエ遺伝学のパワーと汎用性は、幼虫のNMJに分析のこのタイプのために特に適した実験モデルを作ります。幼虫のNMJでは、表現型分析はのNMJの数が同じフライ内で研究することができると同じであっても識別可能なNMJは、異なる遺伝子型3,4のハエとの間で比較することができ、正確な形態計測分析を可能にする単一シナプスの解像度で行うことができます。
ショウジョウバエ幼虫NMJにおける核の位置、形状、大きさの表現型の特徴は、筋肉内の筋肉と核をハイライト抗体を用いて解剖のNMJの免疫染色を行うことによって開始します。 THIで概説したプロトコルでsの紙、筋核は全体の筋肉を染色するDVAPする特異的核内部とを有する抗体を強調核マーカーで、ラミン、核膜のマーカーに対するポリクローナル抗体で染色しました。これらの実験で使用ラミン抗体は、親切にポールフィッシャー19~22によって提供されたが、抗ラミン抗体の代替源を使用することができます。さらに、核膜のための具体的な他の抗体の数は、市販されています。筋肉は抗アクチンまたは抗チューブリン抗体で染色して可視化することができながら、最後に、DAPIやヨウ化プロピジウム、核マーカーは、もご利用いただけます。この実験手順において使用されるもの以外の抗体が使用される場合、免疫染色プロトコルは、固定条件と新しい抗体の作業濃度を最適化する必要があるれる余分なステップを必要とします。このプロトコルにおける1つの重要なステップは、ボリュームレンダリングを分析する必要がある場合は特に、目でありますスライド上のサンプルの電子実装。この場合には、試験片が押しつぶさ取得しないように、スライドとカバーガラスの間にスペーサーを含めることが重要です。カバーガラスの両側にスライドに巻き付けセルローステープの3つのバンドは、スペーサーを作る簡単な方法を表します。
ImageJのは、2D画像のために用いたが、3Dマルチチャンネル画像のほとんどが、この論文で提示分析、理由は、その社内可用性のIMARISを使用して行われました。しかしながら、他の同様の市販のソフトウェアパッケージは、これらの用途に使用することができます。
いくつかのオープンソース(例えば、ImageJの、CellProfiler、Vaa3D、アイシー、KNIMEなど)と共焦点画像の分析に利用可能な商用ソフトウェアプラットフォームがあります。 ImageJの26、フィジー27として知られているNIHまたはそのより強化されたバージョンからのフリーソフトウェアは、世界的なイメージングcommuniために利用可能なインポートフィルタ、マクロやプラグインの数が多いですTY。これらのプラグインのほとんどは、スライス・バイ・スライス方法で情報を処理に焦点を当てています。マルチチャンネル3D画像の可視化と分析に利用可能なプラグインもあります。しかし、それらは多くの場合、特定のタスクのために設計されており、ユーザーが自分のニーズにこれらのプラグインを拡張したり、適応する必要があるかもしれません。一方、商用プラットフォームは、比較的経験の浅いユーザーをターゲットにし、多くの場合、信じられないほどの速度で画像処理タスクの容易に使用できる、広いカバレッジに焦点を当てています。
このプロトコルで概説定量的表現型解析と一緒に実験手順は、細胞小器官の形態および細胞内でのそれらの分布を制御する分子機構の解明に役立つことができます。しかしながら、このアプローチは、特定のエンドポイントでこれらのプロセスを分析する明らか限界があります。細胞小器官の形態および分布を制御するプロセスは非常に動的であるために、異なる細胞TYとの間だけでなく、変化させる可能性があります発達または生理学的状態に応じて、同じセル内のPESも。この分析のさらなる実装は、細胞小器官の形態及び位置の変化を経時的にモニターされることを可能にするタイムラプスイメージングによって表されることになります。
開示事項
The authors have nothing to disclose.
謝辞
We are grateful to Dr. Andrea Chai for her insightful comments on the manuscript. This work was supported by the Wellcome Trust (grant number: Pennetta8920) and by the Motor Neuron Disease Association (grant number: Pennetta6231).
資料
| Name | Company | Catalog Number | Comments |
| Micro-Forceps 0.3 mm x 0.25 mm | Fine Science Tools | 11030-12 | |
| Sylgard dissection plates | SIGMA-ALDRICH | 76103 | Mix the pre-weighed elastomer base with curing agent. Poor the mixture into a 5 cm Petri dish. Let cure it at 60 °C for at least 24 hr |
| Stainless/Steel Minutien Pins 0.1 mm diameter | Fine Science Tools | 26002-10 | |
| Microdissection scissors (ultra-fine) | Fine Science Tools | 15200-00 | |
| 1x PBS (Phosphate Buffered Saline). Composition: 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7 | NaH2PO4 (SIGMA-S8282), Na2HPO4 (SIGMA-S7907), NaCl (SIGMA-S7653) | ||
| Bouin's Solution. Composition: Picric Acid, Formaldehyde, Acetic Acid (15:10:1) | Picric Acid (SIGMA 197378), Formaldehyde (F8775), Acetic Acid (SIGMA-1005706) | ||
| 1x PBT (Phosphate Buffered Saline with Triton). 1x PBS + 0.1% Triton | Triton-X100. SIGMA-T8787 | ||
| Normal Goat Serum | SIGMA | G9023 | |
| Guinea Pig anti-DVAP antibody | Provided by Dr. Giuseppa Pennetta (University of Edinburgh, UK). Use at 1:200 dilution in 5% NGS | ||
| Rabbit anti-HRP (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at 1:500 dilution in PBT containing 5% NGS |
| Rabbit anti-Lamin antibody | Provided by Dr. Paul Fisher (State Univeristy of New York at Stony Brook). Use at 1:500 dilution in PBT containing 5% NGS | ||
| TO-PRO-3 | Molecular Probes | T3605 | |
| Goat anti-rabbit antibody, Alexa Fluor488, conjugated | Jackson ImmunoResearch | bs-295G-A555-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Goat anti-guinea pig IgG antibody, Cy3, conjugated | Jackson ImmunoResearch | bs-0358G-Cy3-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Vectashield mounting medium for fluorescence | Vector laboratories | H-1000 |
参考文献
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Curr. Opin. Neurobiol. 17 (1), 35-42 (2007).
- Fortini, M. E., Skupski, M. P., Boguski, M. S., Hariharan, I. K. A survey of human disease gene counterparts in the Drosophila genome. J. Cell Biol. 150 (2), 23-30 (2000).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. JoVE. (24), (2009).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. JoVE. (25), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Ling, S. C., Polymenidou, M., Cleveland, D. W. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 79 (3), 416-438 (2013).
- Nishimura, A. L., et al. A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am J Hum Genet. 75 (5), 822-831 (2004).
- Chen, H. J., et al. Characterization of the properties of a novel mutation in VAPB in familial amyotrophic lateral sclerosis. J Biol Chem. 285 (51), 40266-40281 (2010).
- Funke, A. D., et al. The P56S mutation in the VAPB gene is not due to a single founder: the first European case. Clin Genet. 77 (3), 302-303 (2010).
- Millecamps, S., et al. SOD1,ANG,VAPB,TARDBP, and FUS mutations in familial amyotrophic lateral sclerosis: genotype-phenotype correlations. J Med. Genet. 47 (8), 554-560 (2010).
- Landers, J. E., et al. New VAPB deletion variant and exclusion of VAPB mutations in familial ALS. Neurology. 70 (14), 1179-1185 (2008).
- Van Blitterswijk, M., et al. VAPB and C9orf72 mutations in 1 familial amyotrophic lateral sclerosis patient. Neurobiol Aging. 33 (12), 2951-2954 (2012).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Budnik, V., et al. Regulation of synapse structure and function by the Drosophila tumor suppressor gene dlg. Neuron. 17 (4), 627-640 (1996).
- Sanhueza, M., Zechini, L., Gillespie, T., Pennetta, G. Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles. Biol Open. 3 (1), 59-71 (2014).
- Worman, H. J., Ostlund, C., Wang, Y. Diseases of the nuclear envelope. Cold Spring Harb Perspect Biol. 2 (2), a000760 (2010).
- Liu, G. H., et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature. 491 (7425), 603-607 (2012).
- Pennetta, G., Hiesinger, P. R., Fabian-Fine, R., Meinertzhagen, I. A., Bellen, H. J. Drosophila VAP-33A directs bouton formation at neuromuscular junctions in a dosage-dependent manner. Neuron. 35 (2), 291-306 (2002).
- Fisher, P. A., Berrios, M., Blobel, G. Isolation and characterization of a proteinaceous subnuclear fraction composed of nuclear matrix, peripheral lamina, and nuclear pore complexes from embryos of Drosophila melanogaster. J Cell Biol. 92 (3), 674-686 (1982).
- Smith, D. E., Fisher, P. A. Identification, developmental regulation, and response to heat shock of two antigenically related forms of a major nuclear envelope protein in Drosophila embryos: application of an improved method for affinity purification of antibodies using polypeptides immobilized on nitrocellulose blots. J Cell Biol. 99 (1), 20-28 (1984).
- Smith, D. E., Gruenbaum, Y., Berrios, M., Fisher, P. A. Biosynthesis and interconversion of Drosophila nuclear lamin isoforms during normal growth and in response to heat shock. J Cell Biol. 105 (2), 771-790 (1987).
- Puckelwartz, M. J., et al. Disruption of nesprin-1 produces an Emery Dreifuss muscular dystrophy-like phenotype in mice. Hum Mol Genet. 18 (4), 607-620 (2009).
- Tsujikawa, M., Omori, Y., Biyanwila, J., Malicki, J. Mechanism of positioning the cell nucleus in vertebrate photoreceptors. Proc Natl Acad Sci USA. 104 (37), 14819-14824 (2007).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nat Rev Mol Cell Biol. 11 (12), 872-884 (2010).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved