Method Article
상기 표현형의 특성을 : 정량이 중요한 이유
요약
Morphology, size and location of intracellular organelles are evolutionarily conserved and appear to directly affect their function. Understanding the molecular mechanisms underlying these processes has become an important goal of modern biology. Here we show how these studies can be facilitated by the application of quantitative techniques.
초록
형태 형성에 대한 대부분의 연구는 특정 유전자와 유전자 경로의 장애에 의해 영향을받는 방법을 해부학 적 특성의 질적 설명에 의존하고 있습니다. 유전자 조작이 표현형 효과의 범위를 생산하고 변형도 제어 그룹 내에서 개인들 사이에서 관찰되지만 정량적 설명은 거의 수행되지 않습니다. 증거를 신흥 형태, 크기 및 세포 소기관의 위치가 세포 기능과 생존에 이전에 과소, 아직 근본적인 역할을한다는 것을 보여줍니다. 여기에서 우리는 초파리 애벌레 신경 근육 접합부 (NMJ)에서 표현형의 정량 분석을 수행하기위한 단계별 지침을 제공합니다. 우리는 바이오 이미징 기술 및 형태 학적 특정 세포 과정에 유전자 돌연변이의 효과를 조사하는 분석과 함께 신뢰할 수있는 여러 면역 조직 화학적 마커를 사용한다. 특히, 형태, 크기 및 (N)의 위치에 영향을 미치는 표현형의 정량 분석에 집중uclei 초파리 유충의 가로 무늬 근육 내. 초파리 애벌레 NMJ 건강과 질환에서 두 구조 및 신경 근육 시스템의 기능을, 기초가되는 분자 메카니즘을 조사하기 위해 유용한 실험적 모델이다. 그러나, 여기에서 설명하는 방법은 다른 시스템으로 확장 될 수있다.
서문
Qualitative analysis restricts the focus of most experimental studies to the examination of genetic manipulations leading to large phenotypic effects or to phenotypes that are not amenable to quantification, e.g., absence/presence. Quantification of phenotypes is not usually performed and variations present within members of a phenotypic group are not taken into consideration. Additionally, without mathematical descriptions of morphologies, it may be difficult to determine whether fine scale phenotypic changes are the result of genetically induced alterations or whether observed changes are simply due to random fluctuations.
We propose that for an accurate and unbiased analysis of phenotypic defects due to gene disruption, quantitative methodologies should accompany more traditional qualitative approaches. Quantitative evaluation of phenotypes is particularly beneficial for structures such as synapses that present a high degree of variability due to their intrinsic morphological and functional plasticity. We have selected examples of quantitative analyses applied to areas of investigation with which we are most familiar, namely the Drosophila larval neuromuscular junctions (NMJs). However, concepts and principles apply equally well to other experimental systems.
The larval NMJ is an excellent model system to study synaptic development and function because of the highly stereotyped nature of its structure. Each hemi-segment of the larval neuromuscular system contains 32 identifiable motor neurons forming synaptic contacts with their postsynaptic target muscle. Every hemi-segment also contains a fixed number of muscles visible as multinucleated fibers attached to the internal surface of the cuticle1. Another advantage of using the larval neuromuscular system is the power and versatility of Drosophila genetics that easily allows the generation of a number of mutant alleles and the possibility to modify gene expression in a time- and tissue-restricted manner. Finally, 75% of the human genes causing a disease have an evolutionarily conserved orthologue in Drosophila2. Indeed, entire genetic pathways are conserved between flies and humans. Because of this, the Drosophila larval neuromuscular system is a very popular experimental model to elucidate the molecular mechanisms underlying a number of human diseases including amyotrophic lateral sclerosis (ALS)1.
Here we show that the availability of several reliable immuno-histochemical markers, combined with bio-imaging techniques and accurate morphometric analyses can describe anatomical traits that are likely to play an important functional role3,4,5. Among the cellular processes that are amenable to quantitative analyses, we focus on changes in shape, size and position of intracellular structures such as the nuclei. All these are processes that we know very little about.
The challenge for molecular geneticists in the coming decades will be to extend our current knowledge by analyzing the effect of genetic mutations that produce very subtle phenotypic defects. Quantitative methodologies that allow researchers to meticulously explore the effects of genetic mutations can provide a more comprehensive understanding of how genotypes relate to phenotypes, especially for poorly understood cellular processes.
프로토콜
1. 실험 준비
참고 : 해부 및 2 항에서 면역 조직 화학 절차 및 3 만 수정과, 참조 3-6에 따라 수행된다.
- 1X 인산 완충 생리 식염수 (PBS), 0.1 % 트리톤 X-100을 함유하는 PBS (PBT)를 준비한다. 얼음에 보관하십시오.
- Bouin의 정착 준비 (15 피크르산을 10 포름 알데히드 : 1 빙초산). 이 시약은 신선합니다.
- 깨끗한 스테인레스 스틸 minutien 핀과 미세 집게를 선택합니다.
- 5cm의 페트리 접시에 실 가드 디스크를 포함 해부 접시를 준비합니다.
셋째-령 애벌레 NMJs 2. 해부
- 유리 병 또는 미세 브러시와 병에서 세 번째 령 애벌레를 방황 선택하고 거리에 잔류 음식을 씻어 4 ° C PBS를 포함하는 2cm 페트리 접시에 배치합니다.
- 해부 판의 실 가드 표면의 상단에 하나의 유충을 배치하고 positi 있는지 확인최대 두 개의 종 방향 기관 튜브 상단에 보이도록 그것의 등쪽면에 +1.
- 집게를 사용하여, 핀을 잡고 오른쪽 입 후크 아래의 앞쪽 끝 부분에 유충을 고정합니다. 가능한 한 유충을 스트레칭과 후방 아래로 종료 핀.
- 플레이트의 벽에 도달하기에 충분한 PBS의 생리 식염수를 추가하고 완전히 애벌레를 체험.
- 동일한 유전자형의 다른 유충에 대한 2.3 단계 2.1의 절차를 반복합니다. 단일 5cm 페트리 접시 해부 판은 쉽게 8 유충까지 수용 할 수 있습니다.
- 마이크로 해부 가위를 사용하여, 약간 지느러미 표피를 들어 올려 핀 근처의 후방 끝 부분에 작은 수평 절개를합니다.
- 기관의 두 종 책자 사이의 중간 선을 따라 앞쪽 끝으로 유충에게 모든 방법을 절단, 절개로 가위를 삽입합니다. 정중선 인하 단지 표피를 통과하는과에 근육을 통해 절단 방지하기 위해 충분한 표면 있는지 확인복부 쪽.
- 각 단부에서 좌우 양측에 두 개의 노치를 잘랐다.
- 전방 절개의 양쪽에 두 개의 핀을 배치하여 필렛을 엽니 다. 후방 엔드와 같은 반복합니다. 핀을 배치 할 때, 떨어져 몸 벽을 전파해야합니다.
- 집게와 PBS의 생리 식염수를 사용하여 내부 장기를 청소합니다. 그대로 중추 신경계를 남겨주세요. 조심스럽게 완전히 뻗어 될 때까지 코너 핀 유충을 스트레칭이지만 근육이 과정에서 찢어지지되어 있는지 확인하십시오.
- 같은 해부 접시에 다른 유충에 대해 동일한 해부 절차를 반복합니다.
- 모든 내부 장기를 제거하기 위해 PBS 식염수로 3 회 씻는다.
- Bouin의 정착으로 PBS를 교체하고 10 분 동안 실온에서 둡니다.
- PBT 여러 번 씻으십시오.
- 조심스럽게 핀을 제거하고 면역 염색을위한 1.5 ml의 마이크로 원심 분리기 튜브에 지금 아주 단단한있는 모든 준비를, 전송할 수 있습니다.
근육과 Myonuclei에 대한 특정 항체와 초파리 NMJs 3. 면역 조직 화학적 염색
- 신속 PBT에서 애벌레 필렛을 씻어.
- 일정하게 교반하면서 2 시간 동안 PBT 10 % 정상 염소 혈청 (NGS)와 함께 배양하여 준비를 차단합니다.
- PBT 5 NGS %의과 (1 농도의 500)은 토끼 항 라민 항체를 함유하는 해부 NMJs 세트 부화 2 시간 동안 및 (500 (1)의 농도) 기니피그 항 DVAP 항체 실온에서 또는 4 박 ºC에서. 안티 라민 얼룩이 myonuclei의 윤곽을 검출한다 항 DVAP 항체 선 형상 근육 얼룩.
- 과량의 항체를 제거하기 위해 PBT 번 빨리 씻으십시오. PBT는 15 분마다 버퍼 변경하여 2 시간 동안 PBT에 씻으십시오.
- PBT는 1에서 5 % NGS와 형광 표지 된 이차 항체를 함유하는 샘플을 품어 : 실온에서 500 희석 2 시간을. 같은 샘플 C상이한 발색단와 접합 이차 항체가 사용되는 경우, 동시에 다수의 항체 염색을 실시한다.
- 이차 항체를 제거하고 PBT는 15 분마다 버퍼 변경하여 2 시간 동안 PBT에 씻는다.
- myonuclei는 PBS로 샘플을 세 시간을 씻고 다음과 같이 진행의 내부를 얼룩하려면 :
- PBS에서 1,000 일정한 교반하면서 20 분 동안 품어 : 1의 희석에 TO-PRO-3 핵 마커를 추가합니다. 이 마커는 본 연구에서 사용되지만, 다른 시판되는 핵 마커도 사용될 수있다.
- 설치하기 전에 PBS에서 빠르게 세 번 씻으십시오.
슬라이드 4. 설치 샘플
- 1.5 ml의 마이크로 원심 분리기 튜브에서 집게로 샘플을 들고 처리 슬라이드를 내려 놓습니다.
- 마이크로 해부 가위를 사용하여 머리와 필렛의 꼬리를 잘라 내부 표면 위로를 유지합니다.
- 일을 준비즉 서로로부터 약 1 cm의 거리에서 깨끗한 슬라이드 양쪽 셀룰로스 테이프의 세 개의 스트립을 감싸하여 슬라이드 마운팅. 커버 슬립은 두 개의 스트립의 상단에 위치되고 나면, 간극이 샘플의 평탄화 피할가 생성된다. 구조물의 3 차원 볼륨 렌더링을 만들 수있는 경우에 중요하다.
- 세 셀룰로스 테이프 스트립의 장착 슬라이드의 중간에 장착 매체의 약 20 μL의 작은 방울을 넣어.
- 깨끗한 집게로 설치 매체를 확산 한 후, 내부 표면 위로 유지, 설치 매체에 장착 슬라이드로 해부 유충을 끕니다. 네 다섯의 행을 탑재하려고.
- 조심스럽게 장착 슬라이드의 상단에 커버 슬립을 삭제하고 기포가 생성되지 않습니다 있는지 확인하십시오. 투명 네일 광택 슬라이드를 밀봉합니다. 샘플 이미징 전에 적어도 10 분 동안 건조 시키십시오.
이미징 5. 공 촛점 설정
참고 : E 거꾸로 현미경 : 본 연구에서 제시 한 이미지는 티타늄에 통합 니콘 A1R 공 촛점 장치를 사용하여 촬영하고 있습니다. 그러나, 488 내지 561 nm 내지 642 nm이고, 3 채널의 검출 계의 파장 영역에서 3 개의 레이저 유닛 최소 모든 공 초점 레이저 주사 현미경은 이러한 목적에 적합하다.
- 레이저, 검출기 유닛, 수은 전구, 무대 컨트롤러, 현미경 및 PC의 전원을 켭니다. 컨트롤 소프트웨어를 시작하고 무대 홀더에 슬라이드를 고정합니다.
- 영상은 빠른 선택하게하고, 20X 목표를 사용하여 샘플에 대한이자 (ROI)의 모든 영역을 표시합니다.
- 조심스럽게 60X 높은 배율 대물 렌즈 (60X 계획 아포 VC / NA 1.4 OIL)에 코 받침 이요 스윙.
- 대물 렌즈에 액침 오일 방울을 넣고 컴퓨터 XYZ 개요 창에서 ROI 표시 중 하나를 선택한다.
- 다음 광학 설정을 사용하여 촬영을 시작 : 첫 번째 다이크로 익 미러를 선택 48분의 405을8/561/640. 배기 필터는 채널 1, 채널 3의 긴 패스 필터 650 nm의와 채널 2 및 642 nm의 레이저에 50분의 595 방출 필터와 561 nm의 레이저에 나노를 525/50와 488 nm의 레이저를 선택합니다.
- 이미지 수집을 시작하기 전에 다음과 같은 스캔 설정을 사용하여 갈바 노 스캐너를 선택합니다; 스캔 방향 : 하나의 방법; 스캔 속도 : 초당 0.5 프레임입니다.
- 채널 블리드 스루를 방지하기 위해 채널 시리즈를 선택합니다.
- 1 통풍 장치에 핀 구멍의 크기를 조절합니다. 스캔, 레이저 전력, 검출 이득을 조정하고, 화소 채도 배경 수준을 방지하기 위해 각 채널에 대해 적절한 오프셋.
- ROI 영역 및 슬라이드 준비 모든 복셀 크기 0.2 × 0.2 × 0.5 μm의 3을 사용하여 Z-스택을 획득. 이미지가 디컨 볼 루션을 실시 할 경우 다음 0.06 X 0.06 X 0.15 μm의 3 복셀의 크기를 설정합니다.
- .nd2 파일 형식 또는 .ics 인 형식으로 이미지를 저장합니다.
선 형상 내에서 핵 사이의 거리 6. 계산60, 가장 가까운 이웃 분석의 방법에 의해 근육
- 이 분석을 위해, 근육을 시각화하는 DVAP의 항체 및 라민 항체와 핵을 강조하기 위해 핵 마커로 염색 애벌레 몸 벽 근육을 표시하는 공 초점 이미지를 사용합니다.
- 핵 사이의 가장 가까운 거리를 추정하기 위해, 화상 해석 소프트웨어 (예 Imaris)의 MeasurementPro 모듈 내에 측정 포인트를 사용한다. 이미지 분석을위한 다른 유사한 소프트웨어 애플리케이션은 동일한 목적을 위해 사용될 수있다.
- 공 촛점 이미지를 엽니 다. 소프트웨어 아이콘을 더블 클릭을 시작합니다. 드래그 앤 경기장에 공 촛점 Z - 스택 이미지를 놓습니다.
- 이미지를 더블 클릭하면 자동으로 메뉴의 도구 모음 아이콘 아래 능가보기에서 열 수 있습니다
 . 보기 영역 속성 영역에서 개체와 개체 다음 능가보기는 세 가지 주요 작업 공간 패널을 보유하고 있습니다.
. 보기 영역 속성 영역에서 개체와 개체 다음 능가보기는 세 가지 주요 작업 공간 패널을 보유하고 있습니다. - 볼륨 렌더링 t 만들기메뉴 아이콘 3D보기를 클릭하여 HREE 채널 이미지
 .
. - 추가 새로운 측정 포인트 아이콘을 클릭
 ~로부터 개체 도구 모음 및 개체 속성 영역에 표시되는 생성 마법사를 따릅니다.
~로부터 개체 도구 모음 및 개체 속성 영역에 표시되는 생성 마법사를 따릅니다. - 생성 마법사에서 첫 번째 편집 탭을 선택하고 특정 채널. 핵 마커 나 핵을 강조하는 라민 채널을 선택합니다.
- 키보드의 Esc 키 탭을 눌러 선택 모드로 포인터를 설정합니다.
- 이미지에서 소정 핵을 포함하도록 마우스 휠 차원 커서 상자의 크기를 조정한다. 같은 핵의 Shift 키와 마우스 왼쪽 클릭을 개최하여 측정 지점을 추가합니다.
- 이전 단계를 반복하여 동일한 근육에 가까운 핵의 두 번째 점을 추가합니다. 라인이 자동으로 두 지점 및 상기 측정 된 거리를 사이에 그려진 두 핵이 표시됩니다. 두 핵 사이의 거리는 이제 탭 통계> 상세> 거리 데이터에서 개체 속성 영역에서 통계적 변수로 기록된다.
- 주어진 핵을 둘러싼 모든 핵에 대해 6.10로 단계 6.6에서 절차를 반복합니다.
- 통계> 수집 된 모든 측정 포인트를 표시 상세한> 거리 데이터는 최단 거리를 선택에서.
- 파일에 탭 표시에 수출 통계를 클릭하여
 개체 속성 영역에서 사용할 수, 데이터를 스프레드 시트에 저장됩니다.
개체 속성 영역에서 사용할 수, 데이터를 스프레드 시트에 저장됩니다. - 다른 주변 핵과 유전자형 당 근육 섬유의 선택된 번호에 대해 동일한 절차를 반복한다.
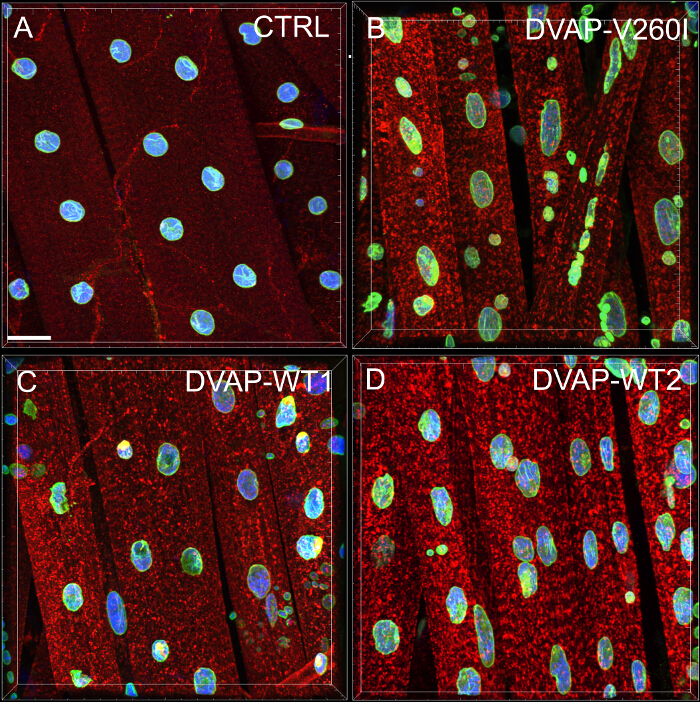
- 스프레드 시트 파일에 보낸 데이터를 사용하여 다음의 방정식을 사용하여 근육의 모든 M 번호 평균 최단 거리 (D 아베)을 계산한다 :
OAD / 53821 / 53821eq1.jpg "/>
디 내가 0에서 N으로 변화하고 N 근육별로 분석 핵의 수를 주어진 핵 난의 이웃 핵에 최단 거리이다. J의 값의 합산 = 0 내지 j = m 분석 근육 M 번호를 나타낸다. - 또한, 사용 관광 명소 작성 마법사와 관광 명소에 관광 명소 가장 가까운 거리가 가장 가까운 이웃 핵의 평균 거리를 추정한다. 이를 위해 매트랩 확장 모듈이 필요하다.
- 아레나와 3 차원 볼륨 이미지에서 하나의 특정 이미지를 더블 클릭은보기 영역에 표시됩니다. 개체 생성 아이콘을 클릭하고 새로운 관광 명소를 추가
 개체 도구 모음에서.
개체 도구 모음에서. - 개체 속성 영역에서 생성 마법사에서 옵션 건너 뛰기 자동 생성, 수동으로 편집을 클릭합니다.
- 라민 또는 핵을 표시 핵 마커 채널을 선택합니다.
- LEF Shift 키를 클릭이미지의 특정 근육의 모든 핵에 t 마우스 버튼을 클릭합니다. 모든 핵에 자리가 나타납니다.
- 관광 명소에 관광 명소 개체 속성 영역에서 도구 탭 아래에 나열된 가장 가까운 거리를 선택합니다. 결과 모드와 매트랩 창에서 선택 관광 명소 통계가 나타납니다.
- 통계 탭에서 상세하고 구체적인 값을 선택합니다. Distmin을 클릭하고 모든 핵의 최소 거리의 값이 표시됩니다.
- 스프레드 시트 파일에 데이터를 내보내고 근육 당이 거리의 평균을 계산합니다. 특정 유전자형의 모든 근육의 절차를 반복합니다.
- 아레나와 3 차원 볼륨 이미지에서 하나의 특정 이미지를 더블 클릭은보기 영역에 표시됩니다. 개체 생성 아이콘을 클릭하고 새로운 관광 명소를 추가
7. 초파리 애벌레의 몸 벽 근육 내 핵의 모양을 결정
- 이 분석을 위해, 라민과 핵을 시각화하는 핵 마커로 염색 몸 벽 근육의 공 촛점 이미지를 사용합니다.
- myonuclei 측정 된 구형의 형상을 평가 (수르의 비로 정의표면 핵의 영역) 또는 타원율 (에 주어진 핵와 같은 볼륨 구형의 얼굴 영역 / 편원 늘어난 타원체와 타원체) 구분합니다.
- 전술 한 바와 같이 이미지를 연다. 새로운 표면은 추가 개체 도구 모음 아이콘을 클릭
 .
. - 개체 속성 영역에 표시되는 생성 마법사의 핵을 표시하기 위해 소스 채널로 핵 마커 염색을 선택합니다.
- 임계 값과 옵션 절대 강도를 설정합니다. 핵의 대부분이 임계 곡선 값을 변경하여 평활하지 과부하 렌더링을 보여주는 것을 확인. 동시에, 동일한 곡선을 사용하는 핵 구멍이나 불완전 마스크의 존재를 피한다.
- 사용 필터 도구는 표면 렌더링 소음을 제외합니다. 새로 생성 된 표면 층, 분할의 편집 탭에서 또는 잘못되어 다시 핵 표면을 병합ndered.
- 스프레드 시트로 내보내기 통계 탭에서 사용할 수있는 표면 렌더링 핵의 타원과 구형 값을 파일.
- 원형도 (C)는 C로 정의되는 경우 또는, 핵의 원형도를 측정하는 ImageJ에 피지 나 소프트웨어를 사용하여
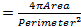 . 제로에 근접한 값이 더욱 긴 형상을 나타내는 반면 하나의 값은 완벽한 원형을 나타낸다.
. 제로에 근접한 값이 더욱 긴 형상을 나타내는 반면 하나의 값은 완벽한 원형을 나타낸다. - 메뉴 이미지> 스택> Z 프로젝트에서 Z 스택의 최대 강도 예측을 만듭니다. 최대 밝기로 설정 투사형.
- 채널 분할 및 핵 마커 채널을 선택합니다.
- 메인 메뉴에서 이미지>> 임계 값을 조정합니다.
- 세그먼트 강도 임계치를 조정하여 핵. 인근 핵이 하나의 단위로 분할하는 경우> 프로세스에 핵을 분리하는 이진> 유역 도구를 클릭합니다.
- 주 메뉴에서 편집> S를 선택선거> 선택을 만듭니다.
- > 도구> 투자 수익 (ROI) 관리자를 분석 메뉴를 클릭하여 ROI 관리자에 선택된 모든 ROI를 추가합니다. 투자 수익 (ROI) 관리자 창에서 추가를 클릭합니다. 같은 창 내에서 추가> 분할을 선택합니다.
- 분석> 설정 측정의 모양 기술자를 선택합니다. 투자 수익 (ROI) 관리자 창에서 탭을 클릭합니다 법안. 이는 선택된 모든 핵의 원형도 값의리스트를 표시한다.
- 또한, 핵 볼륨을 측정하는 하위 섹션 7.3-7.7에 설명 된대로 핵 마커 염색 채널을 사용하여 표면 생성 마법사를 따라합니다.
특정 단백질의 핵내 현지화를 평가하는 초파리 애벌레 몸 벽 근육 내에서 선정 핵 8. 3D 볼륨 렌더링
- 핵 마커 및 라민과 DVAP에 특이적인 항체로 염색 신체 벽의 근육을보고 공 초점 이미지를 사용합니다.
- 소프트웨어 및 셀프를 시작하여 이미지를 엽니 다요법 특정 핵 분석한다. 이 메인 메뉴 항목 편집> 자르기 3D를 선택하여 수행 할 수 있습니다.
- 항 7.3-7.7에 설명 된대로 라민 채널을 사용하여 표면 생성 마법사를 따릅니다.
- 표면이 생성되면, 개체 속성 영역에서 편집을 클릭 한 다음 핵 내부의 신호를 분리하기 위해 모든 마스크를 선택합니다. 이것은 새로운 창을 만듭니다.
- 선택 채널 드롭 다운 메뉴에서 선택 DVAP 신호. 제로로 표면 이외의 옵션 설정 복셀을 클릭하여 핵 내부의 DVAP 면역 반응 신호를 선택합니다. 새로운 마스크 채널 생성 및 선택의 표시 조정 창에서 사용할 수 있습니다.
- 핵 내부 신호의 존재를 시각화하려면 추가 아이콘을 새로운 클리핑 평면을 클릭하여 윤곽 평면을 생성
 개체 도구 모음에서.
개체 도구 모음에서. - 대화 형 클리핑의 각도를 조정평면 핵 내부의 신호의 분포를 시각화하는 위치.
결과
ALS는 특히 가로 무늬 근육 (7)의 진보적이고 치명적인 마비로 이어지는 운동 신경에 영향을 미치는 퇴행성 질환이다. 사람 VAMP 관련 단백질 B (hVAPB)의 과오 돌연변이 ALS 형 8월 8일부터 12일까지 포함한 운동 신경 질환의 범위를 야기한다. hVAPB 유전자에 과오 돌연변이 (V234I)는 최근 인간 (13)의 전형적인 ALS 1 예에서 발견되었습니다. 그 병원성 잠재력을 평가하기 위해, 우리는 질병을 유발하는 돌연변이 (DVAP-V260I)를 운반하는 hVAPB 초파리 orthologue DVAP를 발현하는 형질 전환 초파리를 생성합니다. 이러한 유전자의 발현은 UAS / GAL4 시스템 및 근육 특정 드라이버 BG57 - GAL4 14,15을 이용하여 근육에 타겟팅 하였다. DVAP-V260I 유전자 발현의 효과는 비교 야생형 DVAP 단백질 (16)의 다른 레벨을 표현하는 두 개의 다른 유전자 (DVAP-WT1과 DVAP-WT2)의 대조 하였다. MOR전자 구체적으로는, DVAP 면역 반응의 증가가 DVAP-WT2 라인 컨트롤에보다 높은 2.2 배입니다 동안 동일한 신호 (16)의 DVAP-V260I 및 DVAP-WT1 전시회 비교 및 낮은 수준.
핵 변경은 노화 및 파킨슨 병 (17, 18)를 포함한 여러 신경 퇴행성 질환과 관련되어있다. ALS8에 대한 우리의 비행 모델이 핵 구조, 위치 및 크기의 변화를 나타내는 여부를 평가하기 위해, 우리는 핵 마커 및 핵 봉투를 시각화 방지 라민 항체 19-22로 해당 유전자형의 가로 무늬 근육 내의 핵을 염색. 근육을 강조하기 위해, DVAP 특정 항체는 또한 동일한 샘플 (그림 1)에 추가되었습니다. 공 촛점 이미지를 수집하고, 상세한 형태 계측 학적 분석은 이미지 분석 소프트웨어를 사용하여 수행 하였다. 제어 근육, 핵 균일 근육 따라 분포 것으로 나타났다근육을 표현 DVAP-V260I 및 DVAP-WT에있는 동안 섬유, 핵은 밀접하게 관련 클러스터 (그림 1)에 재분배하는 경향을 나타낸다.
우리는 모든 유전형의 근섬유 따라 핵의 분포의 정량적 평가를 수행하기 위하여 가장 가까운 이웃 분석을 실시 하였다. 가장 가까운 이웃 분석 먼저 주어진 핵의 중심과 다른 모든 핵 주위의 중심 사이의 거리를 측정하여 모든 핵에 대한 가장 가까운 이웃을 식별한다. 이 절차는 다음 근섬유 따라 다른 모든 핵 반복된다. 마지막으로, 특정 근육 내 핵 사이의 최단 거리가, 모든 핵 및 가장 가까운 이웃들의 최단 거리를 평균하여 산출된다. (그림 2A - C). 대조군과 비교하여, V260I DVAP - 트랜스 또는 야생형 단백질을 과발현하는 형질 전환 유전자 중 어느 하나를 발현하는 근육, 결과적으로, 핵 밀접 클러스터에 관련된 것으로 나타나 핵 사이의 평균 거리는 최단의 극적인 감소를 제공하고. 대립 DVAP-V260I 유발 ALS의 효과는 강한 DVAP-WT2 유전자는 (도 1 및도 2D)를 사용하더라도, 야생형 단백질의 과발현과 관련된 것보다 더 심각하다.
DVAP-V260I 또는 DVAP-WT 중 유전자의 과발현은 연장 된 구조 (그림 1)과 변형 된 핵의 결과로 핵 건축의 심각한 저하를 나타낸다. 이 구조는 원형 수차가 식 C에 의해 정의 된 ImageJ에 소프트웨어를 사용하여 정량 하였다  , C = 1은 완전한 원을 나타내는 및 C = 0으로 무한히 긴 다각형으로 모든 핵의 길이 비의 폭을 측정한다. 제어 방식에서형질 변이체에 원형 형상과 그에 따른 손실의 변화가이 값 (도 1 및도 3)로부터 상당한 편차가 발생하는 동안 별개의 둥근 모양을 나타내는 올 핵, C 1과 동일하다.
, C = 1은 완전한 원을 나타내는 및 C = 0으로 무한히 긴 다각형으로 모든 핵의 길이 비의 폭을 측정한다. 제어 방식에서형질 변이체에 원형 형상과 그에 따른 손실의 변화가이 값 (도 1 및도 3)로부터 상당한 편차가 발생하는 동안 별개의 둥근 모양을 나타내는 올 핵, C 1과 동일하다.
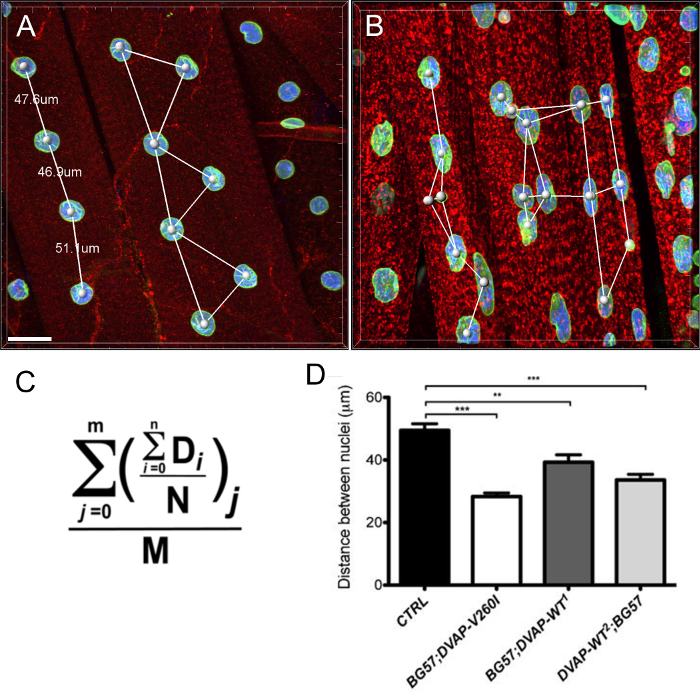
우리는 또한 ALS의 원인이 대립 유전자가 DVAP-WT의 유전자 (그림 4)에 비해이 표현형을 유도에 더 효율적인 것으로 보인다 있지만 동일한 유전자를 발현하는 근육, 핵, 컨트롤에 비해 표시 확대 핵 볼륨을 표시 한 것으로 나타났습니다.
거의 모든 신경 퇴행성 질환은 병원성 단백질을 함유하는 응집체의 세포 내 축적을 특징으로한다. 우리는 3 차원 재구성 및 핵의 볼륨 렌더링을 만든 우리는 근육 돌연변이 유전자를 발현 또는 야생형 단백질을 과발현에, DVAP의 면역 반응성이 클러스터을 형성 것을 발견ND 그들 중 일부는 또한 핵 (도 5)로 지역화되었는지. 반대로, 제어 NMJs에서 DVAP 면역 반응성이 희미 근섬유 통해 분산되고, 핵 (16)로부터 제외된다.
. 그림 1 : DVAP-WT 또는 DVAP-260I의 유전자를 발현 양상紋근육 내 myonuclei의 공 초점 이미지 (A) BG57-GAL4 / + 제어, (B) BG57, DVAP-V260I, (C) BG57, DVAP-WT1 및 (D) BG57, 표시된 유전자를 발현하는 DVAP-WT2 근육은 DVAP (적색 신호), 라민 (녹색 신호)에 대한 구체적이고 핵 (파란색 신호)를 시각화하는 핵 특정 마커 항체로 염색된다. 스케일 바 = 30 μm의 을 보려면 여기를 클릭하십시오이 그림의 더 큰 버전.
도 2 : 인접 이웃 분석은 핵 및 하나의 가장 가까운 이웃 사이의 평균 거리를 결정 (B)을 DVAP-WT2 유전자 과발현 근육 변경된 핵의 위치를 나타내는 대표 결과 (A)에서 대조군과 비교했을 때.. 표시된 유전자형 근육 핵 평균 거리 (C)의 식을 이용하여 추정하고, 데이터 (D)에보고된다. 애벌레 NMJs는 DVAP (적색 신호), 라민 (녹색)에 대한 특정 항체와 핵 마커 (파란색 신호)로 염색된다. 별표는 통계적 유의성을 나타낸다. *** P <0.001, ** P <0.01. 통계적 실험 분석 및 일방향 ANOVA 테스트 이하보고 된 모든 실험에서 사용 하였다와 Tukey에의 multip 들어유전자형 사이의 차이는 ANOVA test를 유의미 때 르 비교 테스트는 사후 검사로 도포 하였다. 오차 막대는 SEM을 나타냅니다. 스케일 바 = 30 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3 :. 핵 볼륨의 계산에 대표 단계를 보여주는 이미지 (A) 표면 생성 마법사를 사용하여 분할 핵을 보여주는 대표 이미지. 이미지의 국경에서 핵은 무시되었다. 주변 DVAP 염색 후의 핵 DVAP 신호를 나타내는 (B) 화상은 핵 마커 채널에서 생성 된 표면의 사용에 의해 마스킹되었다. (C) 표면 층은 추가 매개 변수의 정보를 제공합니다핵 볼륨 및 구형도 포함된다. 다양한 유전자형의 핵 볼륨 (D) 데이터. 별표는 통계적 유의성을 나타낸다. 해부 NMJs는 안티 DVAP 항체 (적색 신호), 안티 - 라민 항체 (녹색 신호) 및 핵 마커 (파란색 신호)로 염색 하였다. *** P <0.001, ** P <0.01. 오차 막대는 SEM을 나타냅니다. 스케일 바 = 30 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
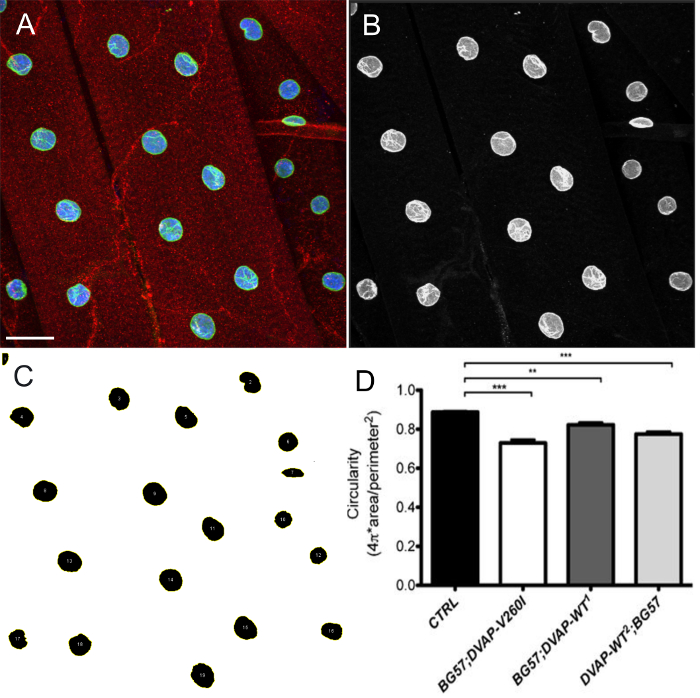
그림 4 : 이미지 ImageJ에 핵 모양의 추정 대표 단계를 보여주는. 화상의 최대 강도 투영을 근육 내 핵의 원형도를 추정 ImageJ에 사용하여 분석 하였다. (A) 강도 돌기의 대표적인프로토콜의 단계 7.9에서와 같이 세 개의 채널 이미지. 채널 분할되는 프로토콜 및 핵 마커 채널의 단계를 도시 7.10 (B) 이미지가 선택된다. ImageJ에에서 세그먼트에 핵 및 투자 수익 (ROI) 관리자 플러그인을 강도 임계 값을 적용한 후, 관심의 모든 핵이 선택 될 수 있고, 그 형상은 형상 설명을 측정 보여주는 (C) 대표 이미지 (7.11-7.15 단계). 다양한 유전자형의 원형 (D) 부량. 녹색이 핵을 설명하고 라민 염색에 해당하는 동안 애벌레 NMJs에서 적색 신호가 DVAP 염색을 나타냅니다. 모든 핵의 내부 인해 핵 마커 염색에 파란색으로 표시됩니다. 별표는 통계적 유의성을 나타낸다. *** P <0.001, ** P <0.01. 오차 막대는 SEM을 나타냅니다. 스케일 바 = 30 μm의 그녀를 클릭하세요전자는이 그림의 더 큰 버전을 볼 수 있습니다.
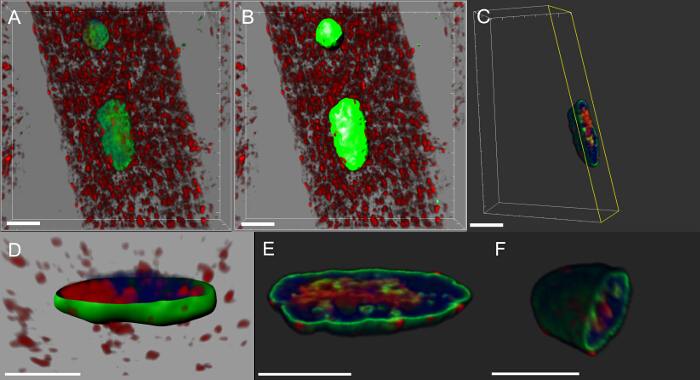
그림 5 : myonuclei의 볼륨 렌더링의 창조의 특정 단계를 보여주는 이미지. 3D 강도를 보여주는 (A) 이미지 DVAP 단백질 (빨간색)의 라민 (녹색) 및 DNA 마커 (파란색)로 염색 근육의보기를 혼합. (B) 세그먼트에 핵을 라민 채널을 이용하여 생성 된 표면 층을 나타내는 이미지. (C) 표면층 선택된 핵 바깥 DVAP 신호를 마스킹하기 위해 사용되고있는 핵을 나타내는 이미지. 노란색으로 강조 이미지에 추가 된 클리핑 평면이다. 조회 및 위치의 각도 대화식 핵 내부 신호의 분포를 시각화하기 위해 조정될 수있다. (D) 핵 표면층 생성 USI 단면도보고 이미지NG 라민 채널 마스킹 DVAP 핵 마커 신호와 합병했다. (E와 F) 같은 핵의 추가 단면 볼륨 렌더링. 스케일 바 = 10 μm의 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
과거에는 내 실험 집단 간의 형태 학적 변화는 거의 고려되지 않았다. 그러나, 양적 방법의 응용 프로그램은 이제 형태와 해부학 적 형태의 수학적 설명을 비교 연구의 표준이 계산되고있다. 정량의 사용은 특정 세포 과정에 유전자 조작의 효과를 평가하는 분석, 형태 학적 변화를 감지 할 수있는 능력을 향상에 이러한 변경 사항이 설명되어있는 정확성을 개선 약속을 개최합니다. 또한, 정량적 데이터의 통계 분석은 우리가 표현형 사이 관찰 차이가 중요 여부를 평가 할 수 있습니다.
가로 무늬 근육에서 핵은 별개의 둥근 구조를 나타내고 균등하게 근육 섬유를 따라 배포됩니다. 구축 및 크기, 모양 및 핵의 구조를 유지하는 분자 메커니즘은 알려져 있지 않지만, 이러한 핵 기능은 가능성이 t이다오 근육 기능을 제어에 근본적인 역할을한다. 사실, 여러 근육 병증은 근육 내에서 핵의 형태와 위치를 조절하는 유전자의 돌연변이에 의해 발생합니다. 모양 및 세포 내의 핵의 분포의 기능적 중요성이 근육에 한정되지 않는다. 축적 된 증거 핵 결함 또한 파킨슨 병 18,24 같은 신경 퇴행성 질환과 관련되어 있음을 나타낸다. 또한, 우리는 그 형태, 크기 및 소포체 기능적인 결과를 초래할 수있다 미토콘드리아를 포함하여 다른 세포 소기관의 세포 내 분포를 감사하기 시작했다. 예를 들어, 미토콘드리아 형태의 변화는 이러한 시신경 위축의 유형 1 (OPA1)과 샤르코 - 마리 - 투스 형 2A 신경 병증 (25)과 같은 신경 학적 장애와 관련이있다.
이러한 중요한 과정의 기초가되는 분자 메카니즘을 해명 과정을 돕기 위해, 고해상도 촛점을 결합 제안이미징 소프트웨어 및 형태 학적 데이터와 정량적 유전자 조작 근육 섬유 내의 핵의 형상, 크기 및 위치에 미치는 영향을 평가하기 위해 분석한다. 초파리 애벌레의 신경 근육 시스템의 높은 박힌 자연과 전원과 함께 초파리 유전학의 다양성은 애벌레 NMJ에게 분석이 유형에 적합 실험 모델을합니다. 애벌레 NMJs에서 표현형 분석 NMJs의 번호가 동일한 플라이에서 연구 될 수 있으며, 심지어 같은 식별 NMJ 다른 유전자형 3,4의 플라이 사이에 비교 될 수있는 정확한 형태 학적 분석을 허용하는 하나의 시냅스 해상도로 수행 될 수있다.
초파리 애벌레 NMJ에서 핵의 위치, 모양과 크기의 표현형 특성은 근육 내의 근육과 핵을 강조 항체와 해부 NMJs의 면역 염색을 수행하여 시작합니다. 프로토콜에서 생에 설명의 종이, myonuclei 전체 근육을 얼룩 DVAP하는 특정 핵 인테리어와 함께 항체를 강조 핵 마커, 라민, 핵 봉투의 마커에 대한 클론 항체로 염색 하였다. 이 실험에 사용 된 항체는 라민 친절 폴 피셔 19-22에서 제공되었지만 항 라민 항체의 다른 소스가 사용될 수있다. 또한, 핵막에 대한 특정 항체의 다른 다수 시판되고있다. 근육이 안티 굴지 또는 항 - 튜 불린 항체로 염색하여 시각화 할 수있는 동안 마지막으로, DAPI와 프로피 듐 요오드화 핵 마커,도 사용할 수 있습니다. 이 실험 절차에서 사용되는 것 이외의 항체가 사용되는 경우, 면역 프로토콜 정착 조건으로 새로운 작업 항체 농도가 최적화 될 필요가있는 여분의 단계가 필요할 것이다. 볼륨 렌더링 분석 할 필요 특히이 프로토콜에서 하나의 중요한 단계는 일이다전자 슬라이드의 샘플의 설치. 이 경우, 슬라이드 시험편 으깨되지 않도록 커버 슬립 사이에 스페이서를 포함하는 것이 중요하다. 커버 슬립의 양쪽에 슬라이드 감싸 셀룰로스 테이프의 세 밴드는 스페이서를 만드는 쉬운 방법을 나타냅니다.
ImageJ에이 2D 이미지에 사용 된 반면, 3D 멀티 채널 이미지의 대부분은이 논문에서 제시된 분석, 때문에 사내 가용성 Imaris을 사용하여 수행 하였다. 그러나, 임의의 다른 유사한 상용 소프트웨어 패키지는 이들 애플리케이션에 사용될 수있다.
공 초점 이미지의 분석에 사용할 수 (예, ImageJ에, CellProfiler, Vaa3D, 얼음, KNIME과 다른 사람에 대한) 여러 오픈 소스 및 상용 소프트웨어 플랫폼이 있습니다. ImageJ에 (26), 피지 (27)로 알려진 NIH 또는 그 이상의 개선 된 버전의 무료 소프트웨어는 전 세계 영상 COMMUNI 사용할 수 가져 오기 필터, 매크로 및 플러그인의 큰 숫자를 가지고타이. 이러한 플러그인 대부분 슬라이스 - 바이 슬라이스 방식의 정보 처리에 초점을 맞추고있다. 멀티 3D 이미지의 시각화 및 분석을 위해 사용할 플러그인이있다. 그러나, 그들은 종종 특정 작업을 위해 설계되었으며, 사용자는 자신의 필요에이 플러그인을 확장하거나 적응해야 할 수도 있습니다. 한편, 상업 플랫폼은 비교적 경험이없는 사용자를 대상으로 종종 놀라운 속도로 화상 처리 작업을 용이하게 사용이 넓은 범위에 집중된다.
이 프로토콜에 설명 된 양적 표현형 분석과 함께 실험 절차는 세포 기관의 형태 및 세포 내에서의 분포를 제어하는 분자 메커니즘을 해명에 도움이됩니다. 그러나,이 접근법은 특정 엔드 포인트에서 이러한 프로세스를 분석 명백한 한계가있다. 형태 및 세포 소기관의 분포를 제어하는 과정은 매우 역동적 될 및뿐만 아니라 다른 세포 타이 사이에서 변화 할 가능성이있다발달 또는 생리적 상태에 따라 같은 셀 내의 PES뿐만 아니라. 이러한 분석의 추가의 구현은 세포 소기관의 형태 및 위치의 변화가 시간에 걸쳐 모니터링 될 수있게 시간 경과 영상으로 표시된다.
공개
The authors have nothing to disclose.
감사의 말
We are grateful to Dr. Andrea Chai for her insightful comments on the manuscript. This work was supported by the Wellcome Trust (grant number: Pennetta8920) and by the Motor Neuron Disease Association (grant number: Pennetta6231).
자료
| Name | Company | Catalog Number | Comments |
| Micro-Forceps 0.3 mm x 0.25 mm | Fine Science Tools | 11030-12 | |
| Sylgard dissection plates | SIGMA-ALDRICH | 76103 | Mix the pre-weighed elastomer base with curing agent. Poor the mixture into a 5 cm Petri dish. Let cure it at 60 °C for at least 24 hr |
| Stainless/Steel Minutien Pins 0.1 mm diameter | Fine Science Tools | 26002-10 | |
| Microdissection scissors (ultra-fine) | Fine Science Tools | 15200-00 | |
| 1x PBS (Phosphate Buffered Saline). Composition: 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7 | NaH2PO4 (SIGMA-S8282), Na2HPO4 (SIGMA-S7907), NaCl (SIGMA-S7653) | ||
| Bouin's Solution. Composition: Picric Acid, Formaldehyde, Acetic Acid (15:10:1) | Picric Acid (SIGMA 197378), Formaldehyde (F8775), Acetic Acid (SIGMA-1005706) | ||
| 1x PBT (Phosphate Buffered Saline with Triton). 1x PBS + 0.1% Triton | Triton-X100. SIGMA-T8787 | ||
| Normal Goat Serum | SIGMA | G9023 | |
| Guinea Pig anti-DVAP antibody | Provided by Dr. Giuseppa Pennetta (University of Edinburgh, UK). Use at 1:200 dilution in 5% NGS | ||
| Rabbit anti-HRP (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at 1:500 dilution in PBT containing 5% NGS |
| Rabbit anti-Lamin antibody | Provided by Dr. Paul Fisher (State Univeristy of New York at Stony Brook). Use at 1:500 dilution in PBT containing 5% NGS | ||
| TO-PRO-3 | Molecular Probes | T3605 | |
| Goat anti-rabbit antibody, Alexa Fluor488, conjugated | Jackson ImmunoResearch | bs-295G-A555-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Goat anti-guinea pig IgG antibody, Cy3, conjugated | Jackson ImmunoResearch | bs-0358G-Cy3-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Vectashield mounting medium for fluorescence | Vector laboratories | H-1000 |
참고문헌
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Curr. Opin. Neurobiol. 17 (1), 35-42 (2007).
- Fortini, M. E., Skupski, M. P., Boguski, M. S., Hariharan, I. K. A survey of human disease gene counterparts in the Drosophila genome. J. Cell Biol. 150 (2), 23-30 (2000).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. JoVE. (24), (2009).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. JoVE. (25), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Ling, S. C., Polymenidou, M., Cleveland, D. W. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 79 (3), 416-438 (2013).
- Nishimura, A. L., et al. A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am J Hum Genet. 75 (5), 822-831 (2004).
- Chen, H. J., et al. Characterization of the properties of a novel mutation in VAPB in familial amyotrophic lateral sclerosis. J Biol Chem. 285 (51), 40266-40281 (2010).
- Funke, A. D., et al. The P56S mutation in the VAPB gene is not due to a single founder: the first European case. Clin Genet. 77 (3), 302-303 (2010).
- Millecamps, S., et al. SOD1,ANG,VAPB,TARDBP, and FUS mutations in familial amyotrophic lateral sclerosis: genotype-phenotype correlations. J Med. Genet. 47 (8), 554-560 (2010).
- Landers, J. E., et al. New VAPB deletion variant and exclusion of VAPB mutations in familial ALS. Neurology. 70 (14), 1179-1185 (2008).
- Van Blitterswijk, M., et al. VAPB and C9orf72 mutations in 1 familial amyotrophic lateral sclerosis patient. Neurobiol Aging. 33 (12), 2951-2954 (2012).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Budnik, V., et al. Regulation of synapse structure and function by the Drosophila tumor suppressor gene dlg. Neuron. 17 (4), 627-640 (1996).
- Sanhueza, M., Zechini, L., Gillespie, T., Pennetta, G. Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles. Biol Open. 3 (1), 59-71 (2014).
- Worman, H. J., Ostlund, C., Wang, Y. Diseases of the nuclear envelope. Cold Spring Harb Perspect Biol. 2 (2), a000760 (2010).
- Liu, G. H., et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature. 491 (7425), 603-607 (2012).
- Pennetta, G., Hiesinger, P. R., Fabian-Fine, R., Meinertzhagen, I. A., Bellen, H. J. Drosophila VAP-33A directs bouton formation at neuromuscular junctions in a dosage-dependent manner. Neuron. 35 (2), 291-306 (2002).
- Fisher, P. A., Berrios, M., Blobel, G. Isolation and characterization of a proteinaceous subnuclear fraction composed of nuclear matrix, peripheral lamina, and nuclear pore complexes from embryos of Drosophila melanogaster. J Cell Biol. 92 (3), 674-686 (1982).
- Smith, D. E., Fisher, P. A. Identification, developmental regulation, and response to heat shock of two antigenically related forms of a major nuclear envelope protein in Drosophila embryos: application of an improved method for affinity purification of antibodies using polypeptides immobilized on nitrocellulose blots. J Cell Biol. 99 (1), 20-28 (1984).
- Smith, D. E., Gruenbaum, Y., Berrios, M., Fisher, P. A. Biosynthesis and interconversion of Drosophila nuclear lamin isoforms during normal growth and in response to heat shock. J Cell Biol. 105 (2), 771-790 (1987).
- Puckelwartz, M. J., et al. Disruption of nesprin-1 produces an Emery Dreifuss muscular dystrophy-like phenotype in mice. Hum Mol Genet. 18 (4), 607-620 (2009).
- Tsujikawa, M., Omori, Y., Biyanwila, J., Malicki, J. Mechanism of positioning the cell nucleus in vertebrate photoreceptors. Proc Natl Acad Sci USA. 104 (37), 14819-14824 (2007).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nat Rev Mol Cell Biol. 11 (12), 872-884 (2010).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유