Method Article
Почему Количественное вопросы: Определение характеристик фенотипов на
В этой статье
Резюме
Morphology, size and location of intracellular organelles are evolutionarily conserved and appear to directly affect their function. Understanding the molecular mechanisms underlying these processes has become an important goal of modern biology. Here we show how these studies can be facilitated by the application of quantitative techniques.
Аннотация
Большинство исследований морфогенеза полагаются на качественные описания того, как анатомическое черты страдают от нарушения специфических генов и генетических путей. Количественные описания редко выполняются, хотя генетические манипуляции производят ряд фенотипических эффектов и изменения наблюдаются даже у лиц, находящихся в контрольной группе. Все новые данные показывают, что морфология, размер и расположение органелл играют ранее недооцененной, тем не менее фундаментальную роль в клеточной функции и выживания. Здесь мы предлагаем шаг за шагом инструкции для выполнения количественного анализа фенотипов у дрозофилы личиночной нервно - мышечного соединения (НМС). Мы используем несколько надежных иммуногистохимическое маркеров в сочетании с методами био-визуализации и морфометрического анализа для изучения влияния генетических мутаций на специфических клеточных процессов. В частности, мы обратили внимание на количественный анализ фенотипов влияющих морфологии, размера и положения пuclei в поперечно - полосатых мышцах личинок дрозофилы. Дрозофилы личиночной НМС является ценным экспериментальная модель для изучения молекулярных механизмов , лежащих в основе структуры и функции нервно - мышечной системы, как в отношении здоровья и болезни. Тем не менее, методики мы описываем здесь могут быть распространены и на другие системы, а также.
Введение
Qualitative analysis restricts the focus of most experimental studies to the examination of genetic manipulations leading to large phenotypic effects or to phenotypes that are not amenable to quantification, e.g., absence/presence. Quantification of phenotypes is not usually performed and variations present within members of a phenotypic group are not taken into consideration. Additionally, without mathematical descriptions of morphologies, it may be difficult to determine whether fine scale phenotypic changes are the result of genetically induced alterations or whether observed changes are simply due to random fluctuations.
We propose that for an accurate and unbiased analysis of phenotypic defects due to gene disruption, quantitative methodologies should accompany more traditional qualitative approaches. Quantitative evaluation of phenotypes is particularly beneficial for structures such as synapses that present a high degree of variability due to their intrinsic morphological and functional plasticity. We have selected examples of quantitative analyses applied to areas of investigation with which we are most familiar, namely the Drosophila larval neuromuscular junctions (NMJs). However, concepts and principles apply equally well to other experimental systems.
The larval NMJ is an excellent model system to study synaptic development and function because of the highly stereotyped nature of its structure. Each hemi-segment of the larval neuromuscular system contains 32 identifiable motor neurons forming synaptic contacts with their postsynaptic target muscle. Every hemi-segment also contains a fixed number of muscles visible as multinucleated fibers attached to the internal surface of the cuticle1. Another advantage of using the larval neuromuscular system is the power and versatility of Drosophila genetics that easily allows the generation of a number of mutant alleles and the possibility to modify gene expression in a time- and tissue-restricted manner. Finally, 75% of the human genes causing a disease have an evolutionarily conserved orthologue in Drosophila2. Indeed, entire genetic pathways are conserved between flies and humans. Because of this, the Drosophila larval neuromuscular system is a very popular experimental model to elucidate the molecular mechanisms underlying a number of human diseases including amyotrophic lateral sclerosis (ALS)1.
Here we show that the availability of several reliable immuno-histochemical markers, combined with bio-imaging techniques and accurate morphometric analyses can describe anatomical traits that are likely to play an important functional role3,4,5. Among the cellular processes that are amenable to quantitative analyses, we focus on changes in shape, size and position of intracellular structures such as the nuclei. All these are processes that we know very little about.
The challenge for molecular geneticists in the coming decades will be to extend our current knowledge by analyzing the effect of genetic mutations that produce very subtle phenotypic defects. Quantitative methodologies that allow researchers to meticulously explore the effects of genetic mutations can provide a more comprehensive understanding of how genotypes relate to phenotypes, especially for poorly understood cellular processes.
протокол
1. Экспериментальная подготовка
Примечание: Вскрытия и процедуры иммуно-Гистохимия в разделах 2 и 3 выполняются в соответствии с рекомендациями 3-6, но с некоторыми изменениями.
- Приготовьте 1х фосфатно-буферном солевом растворе (ФБР) и ФБР, содержащим 0,1% Тритон-X 100 (ПБТ). Держите их на льду.
- Подготовка закрепитель Буэна (15 пикриновой кислоты: 10 Формальдегид: 1 Ледяная уксусная кислота). Сделайте этот реагент в свежем виде.
- Выберите чистый из нержавеющей стали minutien булавки и тонких щипцов.
- Подготовьте рассечение пластины, содержащие диск Sylgard в 5 см чашку Петри.
2. Рассечение третьей возрастной стадии личинок NMJs
- Возьмите блуждающих личинок третьей возрастной стадии из флакона или бутылки с тонкой кистью и поместить их в чашку 2 см Петри, содержащую 4 ° C PBS, чтобы вымыть остаточное пищу прочь.
- Положите одну личинку на верхней части Sylgard поверхности пластины рассечение и убедитесь, что это positioned с дорзальной стороной вверх так, что две продольные трахеи трубки видны на вершине.
- Используя пинцет, чтобы удерживать штифт, придавить личинку вниз на ее переднем конце, прямо под рот трубку. Stretch личинку, как много, насколько это возможно и пин-код его задний конец вниз.
- Добавьте достаточное количество физиологического раствора PBS для достижения стенки пластины и полностью погружать личинку.
- Повторите процедуру с шагом 2.1 до 2.3 для других личинок одного и того же генотипа. Один 5 см чашку Петри рассечение пластина может легко вместить до 8 личинок.
- Использование микро-рассечение ножницами, слегка приподнимите спинной кутикулу и сделать небольшой горизонтальный разрез на заднем конце вблизи штифта.
- Вставьте ножницы в разрез, разрезать личинка весь путь к переднему концу вдоль средней линии между двумя продольными трактах трахеи. Убедитесь в том, что сокращение средней линии достаточно поверхностным, чтобы просто пройти через кутикулу и избежать резки через мышцы набрюшная сторона.
- На каждом конце, разрезать на две ступени как с левой и правой сторон.
- Открыть филе путем размещения двух штифтов на обеих сторонах передней разреза. Повторите то же самое с задним концом. При размещении контактов, убедитесь, чтобы распространить стенки тела друг от друга.
- Очистите внутренние органы с помощью щипцов и PBS физиологического раствора. Оставьте центральную нервную систему без изменений. Осторожно растягивать личинку с угловыми штырьками, пока она не будет полностью растянуты, но убедитесь, что мышцы не рвутся во время этого процесса.
- Повторите ту же процедуру, рассечение для других личинок на том же самом секционном пластине.
- Мытье с PBS физиологическим раствором три раза, чтобы удалить все внутренние органы.
- Заменить PBS с фиксаторе Буэна и оставить при комнатной температуре в течение 10 мин.
- Промыть несколько раз с PBT.
- Осторожно удалите булавки и передать все препараты, которые в настоящее время довольно жесткие, в 1,5 мл микро-центрифужные пробирки для иммуно-окрашивания.
3. Иммуно-гистохимические Окрашивание Drosophila NMJs с использованием антител , специфических для мышц и миоядер
- Быстро промыть личиночной филе в PBT.
- Блок подготовки путем инкубирования с 10% нормальной козьей сыворотки (NGS) в PBT в течение 2 ч при постоянном перемешивании.
- Выдержите набор рассеченных NMJs в ПБТ, содержащий 5% NGS и кролика с анти-ламин антитела (в концентрации 1: 500) и с морской свинки против DVAP антителом (в концентрации 1: 500) в течение 2 часов при комнатной температуре или при температуре 4 ° С в течение ночи. Анти-DVAP антитело окрашивает полосатых мышц в то время как анти-ламин окрашивание обнаруживает контур миоядер.
- Вымойте один раз быстро PBT для удаления антител в избытке. Стирать в PBT в течение 2 часов, изменяя ПБТ буфера каждые 15 мин.
- Инкубируйте образцы в ПБТ, содержащий 5% NGS и флуоресцентно меченого вторичного антитела в разведении 1: 500 в течение 2 ч при комнатной температуре. Те же образцы сподвергаться окрашиванию с несколькими антителами, в то же время, если вторичные антитела, конъюгированные с различными хромофоров используются.
- Удалите вторичные антитела и мыть в PBT в течение 2 часов, изменяя ПБТ буфера каждые 15 мин.
- Для того, чтобы окрасить внутреннюю часть миоядер мыть образцов три раза с PBS и действуйте следующим образом:
- Добавьте ядерный маркер TO-PRO-3 при разведении 1: 1000 в PBS и инкубировать в течение 20 мин при постоянном перемешивании. Этот маркер, используемый в этом исследовании, но и любой другой коммерчески доступный ядерный маркер может использоваться также.
- Промыть быстро три раза в PBS перед монтажом.
4. Монтаж Образцы на слайдах
- Выберите образцы с пинцетом из 1,5 мл микро-центрифуге трубки и уложить их на перерабатывающий слайде.
- С помощью микро-рассечение ножницами, отрезать голову и хвост филе и держать их внутреннюю поверхность вверх.
- Приготовьте тысе крепления слайдов, обернув вокруг трех полос целлюлозы ленты на каждой стороне чистого скольжения на расстоянии около 1 см друг от друга. После того, как покровное расположен на верхней части двух полосок, разрыв будет сгенерирован, что позволит избежать сплющивание образцов. Это очень важно, если трехмерные объемные визуализации структур должны быть сделаны.
- Поместите небольшую каплю около 20 мкл монтажной среды в середине монтажной зацепляются между тремя целлюлозной Кусочки ленты.
- После нанесения монтажной среды с чистым пинцетом, перетащить расчлененный личинки к монтажному горкой в монтажную среду, поддерживая внутреннюю поверхность вверх. Попробуйте установить их в ряды по четыре или пять.
- Осторожно опустить крышку скольжения на верхней части крепежной горкой и убедитесь, что пузырьки воздуха не генерируются. Печать слайд с прозрачным лаком для ногтей. Пусть образцы высохнуть в течение, по крайней мере за 10 минут до визуализации.
5. Настройки Конфокальные для работы с изображениями
Примечание: Изображения, представленные в данном исследовании, взяты с помощью конфокальной блок Nikon A1R интегрированный на титан: E инвертированным микроскопом. Тем не менее, любой конфокальный микроскоп с минимумом 3 лазерных блоков, имеющихся в диапазонах длин волн 488 нм, 561 нм и 642 нм и системы обнаружения 3 канала подходит для этой цели.
- Включите лазер, блок детектора, ртутные лампочки, контроллер этап, микроскоп и ПК. Запустите программное обеспечение управления и закрепите слайд на держателе ступени.
- Для того, чтобы изображения быстрее, выберите и отметьте все регионы интереса (ROI) на образце с использованием объектива 20X.
- Тщательно качаться носика к 60X более высокое увеличение объектива (60X Plan Apo VC / NA 1.4 OIL).
- Поместите каплю иммерсионного масла на объектив и выбрать один из отмеченного ROI из окна обзора XYZ на компьютере.
- Начало обработки изображений с помощью следующих оптических параметров: Выберите первый дихроичное зеркало: 405/488/561/640. Выберите 488 нм лазер с фильтром эмиссии 525/50 нм в канале 1, 561 нм лазер с фильтром эмиссии 595/50 в канале 2 и 642 нм лазер с длиной фильтра верхних частот 650 нм в канале 3.
- Используйте следующие настройки сканирования перед началом захвата изображения: Выберите Galvano сканер; Направление сканирования: один путь; Скорость сканирования: 0,5 кадра в секунду.
- Выберите серию каналов, чтобы избежать канала проступание.
- Отрегулируйте размер точечную до 1 воздушной единицы. Сканирование и регулировать мощность лазера, усиление обнаружения и смещения соответственно для каждого канала, чтобы избежать насыщения пикселей и уровень фона.
- Приобретать Z-стеки, используя размер воксела 0,2 х 0,2 х 0,5 мкм 3 для всех трансформирования и подготовке слайдов. Если изображения будут подвергнуты деконволюции затем установить размер воксела 0,06 х 0,06 х 0,15 мкм 3.
- Сохранение изображений в формате .nd2 файла или .ics формате.
6. Расчет расстояния между ядрами в исчерчена60; Мышцы по методу ближайшего соседа Анализ
- Для этого анализа используют конфокальной изображения, отображающие личиночных мышц стенки тела окрашивали антителами DVAP визуализировать мышцы и с Ламин антителами и ядерного маркера, чтобы выделить ядра.
- Для оценки ближайшего расстояния между ядрами, используйте точки измерения в модуле MeasurementPro программного обеспечения для анализа изображений (например, Imaris). Другие аналогичные приложения программного обеспечения для анализа изображений могут быть использованы для тех же целей.
- Откройте конфокальной изображения. Для начала, сделайте двойной щелчок на значке программы. Перетащите конфокальной изображений Z-стека в Арене.
- Дважды щелкните на изображение, чтобы автоматически открыть их в превзойдет View, под значком инструмента меню бара
 , Surpass View состоит из трех основных рабочих областей панели: View Area, список объектов и свойств объектов Area.
, Surpass View состоит из трех основных рабочих областей панели: View Area, список объектов и свойств объектов Area. - Создание объема оказываемых тHREE канал изображения, нажав на иконку меню 3D View
 ,
, - Нажмите на иконку Добавить Точки измерения
 из Объекты панели инструментов и следуйте указаниям мастера создания, который отображается в Object Properties Area.
из Объекты панели инструментов и следуйте указаниям мастера создания, который отображается в Object Properties Area. - От мастера создания выберите вкладку Правка, а затем конкретный канал. Выберите либо ядерный маркер или Ламин канал, чтобы выделить ядра.
- Установите указатель в режим выбора, нажав на вкладку Esc на клавиатуре.
- Отрегулируйте размер курсора коробки 3D с колесом мыши, чтобы содержать данное ядро в изображении. Добавить точку измерения, удерживая клавишу Shift, и щелчок левой кнопкой мыши на том же ядре.
- Добавьте вторую точку на соседнем ядре на той же мышцы, повторяя предыдущие шаги. Линия автоматически обращается между двумя точками и измеренное расстояние между отображается два ядра. Расстояние между двумя ядрами теперь записывается в виде статистической переменной в объекте Свойства зоны на вкладке Статистика> Подробные данные> Расстояние.
- Повторите процедуру с шагом 6.6 до 6.10 для всех ядер, окружающих данное ядро.
- Из статистики> Детальный> Расстояние данные, отображающие все собранные точки измерения, выберите самое короткое расстояние.
- При нажатии на экспорт статистики на вкладке Отображение в файл
 доступны под Свойства объекта области, данные будут сохранены в электронной таблице.
доступны под Свойства объекта области, данные будут сохранены в электронной таблице. - Повторите ту же процедуру для других окружающих ядер и для выбранного числа мышечных волокон на генотип.
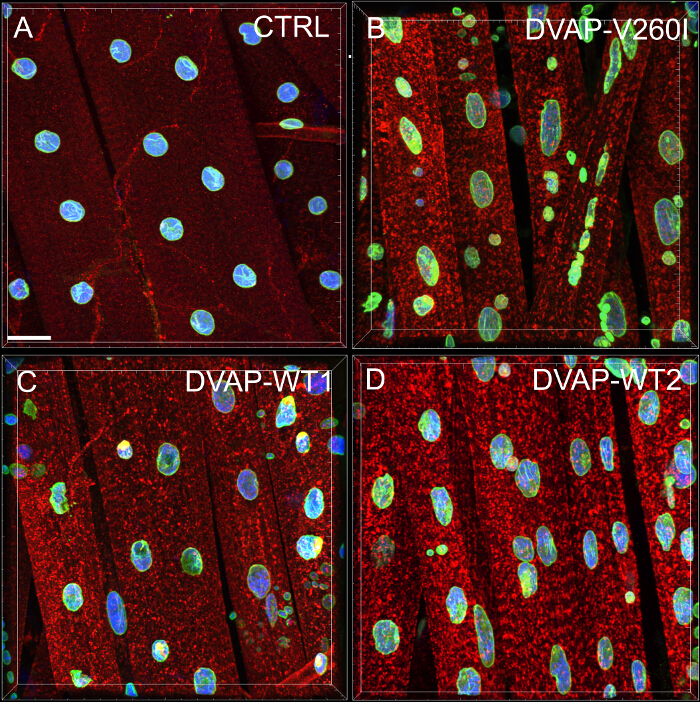
- Использование экспортированных данных в файл электронной таблицы, вычислить среднее кратчайшее расстояние (D AVE) для всех М числа мышц , используя следующее уравнение:
OAD / 53821 / 53821eq1.jpg "/>
Ди является кратчайшим расстоянием до соседнего ядра для данного ядра я, где я колеблется от 0 до N и N есть число ядер, проанализированных на мышцы. Суммирование значений от J = 0 J = т указывает на число М анализируемых мышц. - В качестве альтернативы, используйте Пятна мастера создания и пятна Пятна Наименьшее расстояние, чтобы оценить среднее расстояние до ближайшего соседнего ядра. Для этого, модуль расширения Matlab необходим.
- Двойной щелчок по одному конкретному изображению на Арене и 3D-образа тома будет отображаться в зоне просмотра. Нажмите на иконку создания объекта и добавить новые места
 на панели инструментов Объекты.
на панели инструментов Объекты. - От мастера создания в объекте Properties Area, выберите опцию Пропустить автоматического создания, редактирования вручную.
- Выберите либо Lamin или маркерный канал для отображения ядерного ядра.
- Сдвиг и нажмите ЛЕФT кнопку мыши на всех ядрах определенной мышцы в изображении. Появится пятно на каждом ядре.
- Выберите Пятна к пятнам Наименьшее расстояние отображены на вкладке Инструменты в объекте Свойства зоны. Появится Select Spots Статистика в режиме результата и окна Matlab.
- На вкладке Статистика, выберите подробные и конкретные значения. Нажмите на Distmin и появятся значения минимальных расстояний для каждого ядра.
- Экспорт данных в файл электронной таблицы и вычислить среднее значение этих расстояний на мышцы. Повторите эту процедуру для всех мышц данного генотипа.
- Двойной щелчок по одному конкретному изображению на Арене и 3D-образа тома будет отображаться в зоне просмотра. Нажмите на иконку создания объекта и добавить новые места
7. Определение формы ядер внутри стенки тела Мышцы дрозофилы Личинка
- Для этого анализа используют конфокальной изображения стенки тела мышц, окрашенных с ламина и ядерного маркера для визуализации ядер.
- Для того, чтобы оценить форму миоядер, мера сферичности (определяется как отношение СюрЛицо площадь сферы с тем же объемом, что и данное ядро, к площади поверхности ядра) или эллиптичности (различие между сплющенных / вытянутых эллипсоидов и сфероидов).
- Открыть изображение, как описано выше. Нажмите на иконку на панели инструментов Объекты Добавить Поверхности
 ,
, - В мастере создания, который отображается в Object Properties Area, выберите маркер окрашивания ядерный в качестве источника канала для отображения ядра.
- Установите параметр абсолютной интенсивности в качестве порогового значения. Убедитесь в том, что большинство ядер показывают гладкую и не перегруженный рендеринга, изменив значение на пороговой кривой. В то же время, избежать присутствия отверстий или неполной маски для любого ядра, используя ту же самую кривую.
- Использовать Фильтр инструмент, чтобы исключить любой шум в визуализации поверхности. На вкладке Правка вновь созданного поверхностного слоя, Split или Объединить ядер поверхностей, которые неправильно повторноndered.
- Экспорт в электронную таблицу файл эллиптичности и сферичности значения поверхностных визуализации ядер, которые доступны на вкладке Статистика.
- В качестве альтернативы, использовать ImageJ или Fiji программное обеспечение для измерения округлость ядер, где округлость (С) определяется как C
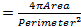 , Значение одного представляет собой идеальный круг в то время как значение приближается к нулю показывает все более вытянутую форму.
, Значение одного представляет собой идеальный круг в то время как значение приближается к нулю показывает все более вытянутую форму. - Создание максимальных проекций Интенсивность г штабелей из меню Изображения> Стеки> Z проекта. Установить тип проекции для Max интенсивности.
- Разделение каналов и выберите канал ядерного маркера.
- В главном меню, выберите Image> Adjust> Threshold.
- Сегмент ядра, регулируя порог интенсивности. Если соседние ядра сегментированы как единое целое, нажмите Process> Binary> водораздела инструмент для отключения ядер.
- В главном меню, выберите Правка> SВыборы> Создать выбор.
- Добавить все выбранные трансформирования к ROI Manager, нажав на меню Анализ> Инструменты> ROI Manager. В окне ROI Manager, щелкните Add. В том же окне выберите Дополнительно> Split.
- Выберите дескрипторы формы в Analyze> Набор измерений. В окне ROI Manager, щелкните на вкладке Мера. Это будет отображать список значений округлость всех выбранных ядер.
- Кроме того, для измерения объема ядра, следуют мастера создания поверхности с использованием маркера окрашивания канала ядерного, как описано в пунктах 7,3-7,7.
8. 3D Том визуализаций Selected ядер внутри стенки тела Мышцы дрозофилы личиночной для оценки внутриядерными локализации специфического белка
- Использование конфокальной изображения отчетности стенки тела мышцы окрашивали с ядерным маркером и с антителами, специфичными к ламина и DVAP.
- Откройте изображения, инициируя программное обеспечение и СельЭСТ специфическое ядро для анализа. Это можно сделать, выбрав пункт главного меню Edit> Crop 3D.
- Следуйте мастер создания поверхности с использованием Ламин канала, как описано в подразделе 7,3-7,7.
- После того, как поверхность создается, нажмите на Edit в свойств объектов области, а затем выберите Mask Все для выделения сигнала внутри ядра. Это создает новое окно.
- Выберите сигнал DVAP из выпадающего меню Select Channel. Выберите иммунореактивности сигнал DVAP внутри ядра, щелкнув на опции Set вокселей вне поверхности к нулю. Новый канал замаскированным создан и доступен в окне регулировки дисплея для выбора.
- Для того, чтобы визуализировать присутствие сигнала внутри ядра создают контур самолета, нажав на иконку Add New Clipping Plane
 на панели инструментов Объекты.
на панели инструментов Объекты. - Интерактивное регулировать угол вырезкойПлоскость и ее положение, чтобы визуализировать распределение сигнала внутри ядра.
Результаты
ALS является дегенеративным заболеванием специфически влияющих моторные нейроны , ведущие к прогрессивной и фатальной паралич поперечно - полосатых мышц 7. Миссенс мутации в человеческом VAMP-ассоциированный белок B (hVAPB) вызывают целый ряд заболеваний двигательных нейронов , включая ALS типа 8 8-12. Миссенс - мутации (V234I) в гене hVAPB был недавно идентифицирован в одном случае типичных ALS у человека 13. Для того, чтобы оценить его патогенный потенциал, мы получили трансгенных мух , выражающие hVAPB Drosophila ортолог DVAP несущий болезнетворный мутации (DVAP-V260I). Экспрессия этого трансгена была направлена на мышцы с помощью системы UAS / GAL4 и мышцы-специальный драйвер BG57-GAL4 14,15. Эффект трансгенной экспрессии DVAP-V260I сравнивали и противопоставлены , что из двух других трансгенов (DVAP-WT1 и DVAP-ленте WT2), которые выражают различные уровни белка DVAP 16 дикого типа. Morе конкретно увеличение DVAP иммунореактивности в 2,2 раза выше , чем в контрольной группе для DVAP-WT2 линии в то время как DVAP-V260I и DVAP-WT1 демонстрируют сопоставимые и более низкие уровни одного и того же сигнала 16.
Ядерные изменения были связаны со старением и нескольких нейродегенеративных заболеваний , в том числе 17,18 болезни Паркинсона. Для того, чтобы оценить , обладает ли наша муха модель ALS8 изменения в ядерной архитектуры, положение и размер, мы окрашивают ядра в полосатых мышц соответствующих генотипов с ядерным маркером и анти-ламин антитела 19-22, который визуализирует ядерной оболочки. Чтобы выделить мышцы, A DVAP-специфическое антитело также добавляли к тем же образцам (рисунок 1). Конфокальные изображения были собраны и подробный анализ морфометрических были выполнены с использованием программного обеспечения для анализа изображений. В мышцах контрольных, было установлено, быть равномерно распределены вдоль мышцы ядраволокна в то время как в DVAP-V260I и DVAP-WT выражения мышц, ядра проявляют тенденцию к перераспределению в тесно связанных между собой кластеры (Рисунок 1).
Мы провели анализ ближайшего соседа, чтобы выполнить количественную оценку распределения ядер вдоль мышечных волокон каждого генотипа. Ближайшим соседом анализ сначала идентифицирует ближайшего соседа для каждого ядра путем измерения расстояния между центром данного ядра и центра любого другого окружающего ядра. Эта процедура повторяется для каждого другого ядер вдоль мышечных волокон. И, наконец, самое короткое расстояние между ядрами в пределах определенной мышце, рассчитывается путем усреднения кратчайшие расстояния каждого ядра и его ближайших соседей. (Рисунок 2А - С). По сравнению с контрольной группой, мышцы экспрессирующие либо DVAP-V260I трансген или любой из трансгенов с гиперэкспрессией белка дикого типа, Представляют собой значительное снижение среднего кратчайшего расстояния между ядрами и, как следствие, зародыши-видимому, тесно связаны в кластерах. Эффект БАС вызывает аллель DVAP-V260I является более серьезным , чем связанные с избыточной экспрессии белка дикого типа, даже если самый сильный DVAP-WT2 трансген используется ( На рисунке 1 и 2D).
Сверхэкспрессия либо DVAP-V260I или DVAP-WT трансгенов также демонстрирует серьезное ухудшение ядерной архитектуры , что приводит к деформированных ядер с удлиненной структуры (рисунок 1). Эта структурная аберрация определяли количественно с помощью программного обеспечения ImageJ, в котором круглость определяется по формуле C  , Которые измеряют отношением ширины к длине каждого ядра с C = 1, представляющий собой идеальный круг и С = 0 бесконечно вытянутая полигон. В ContrЯдра ола , проявляющие четкую круглую форму, С равна 1 , в то время как в трансгенных мутантов изменение формы с последующей потерей округлости, вызывает существенное отклонение от этого значения (рисунок 1 и рисунок 3).
, Которые измеряют отношением ширины к длине каждого ядра с C = 1, представляющий собой идеальный круг и С = 0 бесконечно вытянутая полигон. В ContrЯдра ола , проявляющие четкую круглую форму, С равна 1 , в то время как в трансгенных мутантов изменение формы с последующей потерей округлости, вызывает существенное отклонение от этого значения (рисунок 1 и рисунок 3).
Мы также обнаружили , что в мышцах , выражающих те же трансгены, ядра отображения отмечен увеличенный объем ядра по сравнению с контрольной группой , хотя и вызывающий аллель ALS оказывается более эффективным индуктором этот фенотип по сравнению с трансгенов DVAP-WT (рисунок 4).
Почти все нейродегенеративные заболевания характеризуются внутриклеточным накоплением агрегатов, содержащих патогенный белок. Мы сделали 3D-реконструкций и объем визуализации ядер, и мы обнаружили, что в мышцах, экспрессирующих мутантный трансген или избыточно экспрессирующих белок дикого типа, DVAP иммуно-реактивности образуются кластерыго , что некоторые из них были также локализованы в ядрах (рисунок 5). И наоборот, в контрольных NMJs, DVAP иммуно-реактивности слабо рассредоточены по всей мышечных волокон и исключается из ядра 16.
. Рисунок 1: конфокальной образы миоядер внутри полосатых мышц , выражающих либо DVAP-WT или трансгены DVAP-260I (A) BG57-Gal4 / + контроль, (B) BG57; DVAP-V260I, (C) BG57; DVAP-WT1 и (D) BG57; мышцы DVAP-WT2 , экспрессирующие указанные трансгены окрашивали антителами , специфичными для DVAP (красный сигнал), ламин (зеленый сигнал) и с ядерным специфического маркера для визуализации ядер (синий сигнал). Шкала бар = 30 мкм Пожалуйста , нажмите здесь для просмотраБольшая версия этой фигуры.
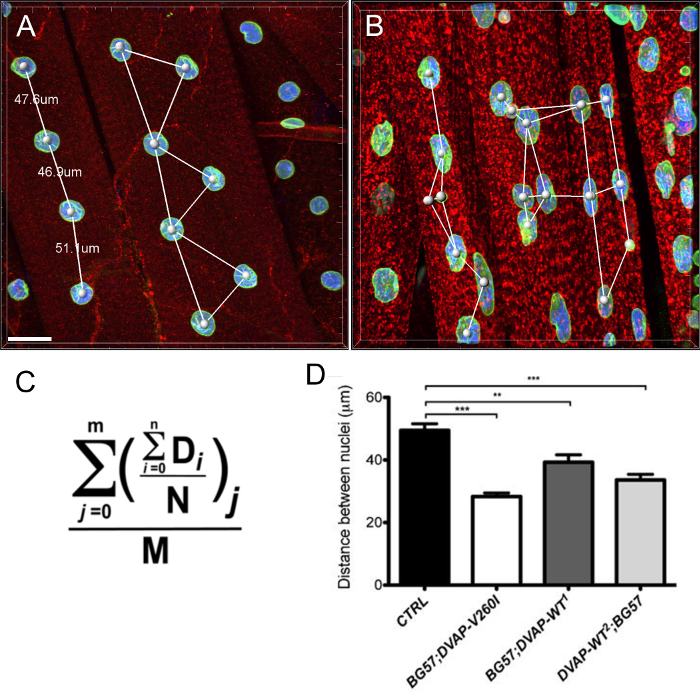
Рисунок 2: Ближайший сосед анализ , чтобы определить среднее расстояние между ядром и его единственным ближайшим соседом (B) Представитель результаты , показывающие измененное ядерное позиционирование в мышцах сверхэкспрессирующими DVAP-WT2 трансгена по сравнению с контрольной группой в (А).. Среднее ядерное расстояние в мышцах указанных генотипов оценивали с помощью формулы , приведенной в (C) , и данные представлены в (D). Личиночные NMJs окрашивали антителами, специфичными для DVAP (красный сигнал), ламин (зеленый) и с ядерным маркером (синий сигнал). Звездочки означают статистическую значимость. *** Р <0,001, ** Р <0,01. Для статистического анализа этого эксперимента и использовали все эксперименты, представленные ниже теста ANOVA односторонний и MULTIP Тьюкисравнительный тест ле был применен в качестве теста ретроспективном, когда были обнаружены различия между генотипами быть значительным тестом ANOVA. Усы представляют собой SEM. Шкала бар = 30 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рис . 3: Изображения , показывающие типичные шаги при расчете объема ядра (А) Представитель изображение , показывающее сегментированные ядра с помощью мастера создания поверхности. Ядра на границе изображений были проигнорированы. (B) Изображение показывает сигнал ядерной DVAP после окружающего DVAP окрашивания был замаскирован с помощью поверхности , образованной в канале ядерного маркера. (С) Поверхностный слой содержит информацию о дополнительных параметрахв том числе ядерного объема и сферичности. (D) Данные о ядерном объеме различных генотипов. Звездочки означают статистическую значимость. Препарированные NMJs окрашивали анти-DVAP антител (красный сигнал), анти-Ламин антител (зеленый сигнал) и ядерного маркера (синий сигнал). *** Р <0,001, ** Р <0,01. Усы представляют собой SEM. Шкала бар = 30 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
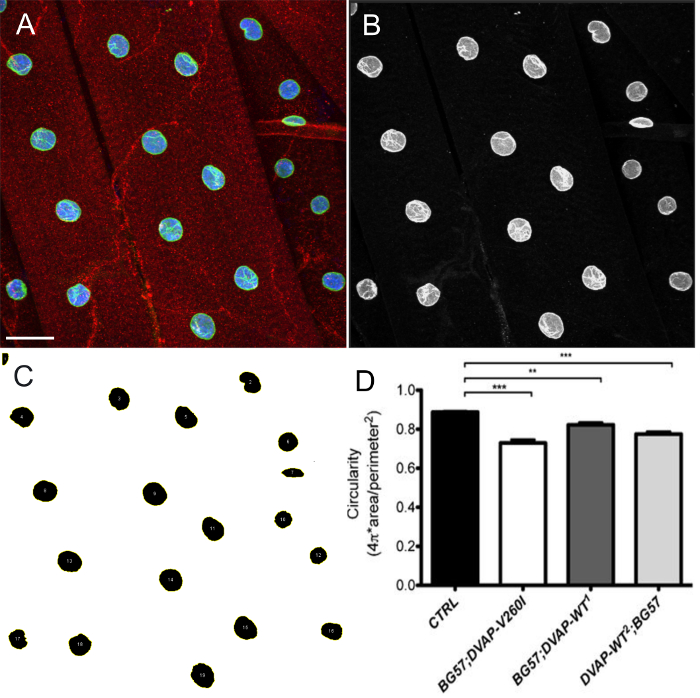
Рисунок 4: Изображения показывая типичные шаги в оценке формы ядра с помощью ImageJ. Максимальная интенсивность проекции изображений были проанализированы с использованием ImageJ для оценки округлость ядер в мышцах. (A) Типичный пример проекции интенсивностииз трех канала изображения, как на шаге 7.9 протокола. (B) Изображение показывает шаг 7.10 протокола , в котором расщепляются каналы и канал ядерного маркера выбран. (C) Представитель изображение , показывающее , что после применения пороговой интенсивности для сегмента ядер и менеджер ROI плагин в ImageJ, могут быть выбраны все ядра интерес , и их форма измеряется с помощью дескрипторы формы (шаги 7,11-7,15). (D) Количественное округлости различных генотипов. На личиночной НМС, красный сигнал указывает DVAP окрашивание в то время как зеленые контуры ядра и соответствует ламина окрашивания. Внутри каждого ядра помечен синим цветом из-за окрашивания с ядерным маркером. Звездочки означают статистическую значимость. *** Р <0,001, ** Р <0,01. Усы представляют собой SEM. Шкала бар = 30 мкм Пожалуйста , нажмите еее, чтобы просмотреть большую версию этой фигуры.
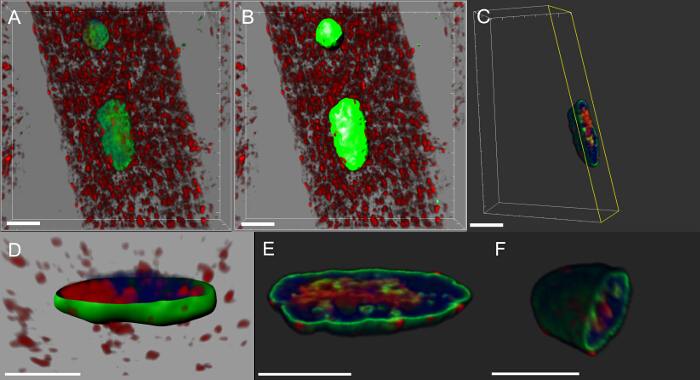
Рисунок 5: Изображения , показывающие конкретные шаги в создании объемных рендеры миоядер. (A) Изображение показывает 3D интенсивности смешивается вид мышц , окрашенных с белком DVAP (красного цвета), тем ламин (зеленый) и ДНК - маркера (синий). (Б) изображение , представляющее собой поверхностный слой , созданный с использованием канала ламин к сегменту ядра. (C) , изображение , представляющее собой ядро , в котором поверхностный слой был использован для маскировки сигнала DVAP за пределами выбранного ядра. Подсвечивается желтым цветом, что было добавлено к изображению вырезка плоскости. Его угол обзора и положение можно в интерактивном режиме регулировать, чтобы визуализировать распределение сигнала внутри ядра. (D) Изображение сообщая вид в поперечном сечении поверхности ядра слой , созданный USIнг канал ламин слилась с немаскированный DVAP и сигналов ядерного маркера. (E и F) Дополнительные секционного объема визуализаций одного и того же ядра. Шкала бар = 10 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
В прошлом, морфологические вариации внутри и между экспериментальными группами редко принимается во внимание. Тем не менее, применение количественных методов в настоящее время становится нормой в сравнительных исследованиях морфологии и математического описания анатомических форм вычисляются. Использование количественного анализа при оценке влияния генетических манипуляций на специфических клеточных процессов, перспективны в укреплении нашей способности выявлять морфологические изменения и в повышении точности, с которой эти изменения описаны. Кроме того, статистический анализ количественных данных позволяет оценить, насколько наблюдаемые различия между фенотипами являются значительными.
В поперечно-полосатых мышц, зародыши обнаруживают отчетливую округлую структуру и равномерно распределены вдоль мышечного волокна. Хотя молекулярные механизмы установления и поддержания размера, формы и архитектуры ядер не известны, эти ядерные возможности, скорее всего, то играют фундаментальную роль в контроле мышечной функции. Действительно, несколько миопатии вызваны мутациями в генах, регулирующих морфологию и положение ядер в мышцах. Функциональное значение формы и распределения ядер в клетке не ограничивается мышцами. Накопленные данные показывают , что ядерные дефекты также связаны с нейродегенеративных заболеваний , таких как болезнь Паркинсона 18,24. Кроме того, мы начинаем понимать, что морфология, размер и внутриклеточное распределение других органелл, включая эндоплазматический ретикулум и митохондрии могут иметь функциональные последствия. Например, изменения в митохондриальной морфологии связаны с неврологическими расстройствами , такими как 1- го типа атрофией зрительного нерва (OPA1) и Шарко-Мари-Тута типа 2A нейропатии 25.
Для оказания помощи в процессе выяснении молекулярных механизмов, лежащих в основе этих важных процессов, мы предлагаем совместить с высоким разрешением конфокальнойданных с помощью программного обеспечения визуализации и морфометрического анализа количественно оценить, как генетические манипуляции могут повлиять на форму, размер и расположение ядер в мышечных волокон. Мощность и универсальность дрозофилы генетики вместе с весьма стереотипное характер нервно - мышечной системы у личинок дрозофилы делают личиночной NMJ экспериментальную модель особенно подходит для такого рода анализов. На личиночной NMJs, анализ фенотипической может быть выполнена в одном разрешении синапса , позволяющей точный анализ морфометрического где ряд NMJs можно изучать в то же муха и даже тот же опознаваемый НМС можно сравнивать между мухами разных генотипов 3,4.
Фенотипическая характеристика положения, формы и размера ядерного на дрозофилы личиночной NMJ начинает выполняя иммунное расчлененный NMJs с антителами , которые подчеркивают мышцы и ядра внутри мышц. В протоколе указано в This бумага, миоядер окрашивают поликлональными антителами против ламина, маркера ядерной оболочки, с ядерным маркером подсветкой внутри ядра и антителами, специфичными к DVAP окрасить всю мышцу. Эти Ламин антитела , используемые в этих экспериментах , были любезно предоставлены Paul Fisher 19-22 , но могут быть использованы альтернативные источники анти-ламин антител. Кроме того, ряд других антител, специфичных для ядерной оболочки являются коммерчески доступными. И, наконец, ядерные маркеры, такие как DAPI и пропидийиодидом, также доступны в то время как мышцы могут быть визуализированы с помощью окрашивания анти-актина или анти-тубулина антителами. Если другие, чем те, которые используются в этой экспериментальной методике, антитела используют протокол иммунное потребует дополнительных-шагов, которые должны будут быть оптимизированы условия фиксации и рабочие концентрации для новых антител. Одним из наиболее важных шагов в этом протоколе, особенно когда объем визуализации необходимо проанализировать, является йе крепление образцов на слайде. В этом случае важно, чтобы включать в себя прокладками между предметным и покровным так, что образцы не раздавлены. Три полосы целлюлозы ленты, обернутой вокруг скользят по обе стороны от покровного стекла представляют собой простой способ изготовления проставки.
В то время как ImageJ использовали для 2D-изображений, большинство из многоканального 3D анализ изображения в данной работе, были сделаны с использованием Imaris из-за его доступности в доме. Тем не менее, любой другой аналогичный коммерческий пакет программного обеспечения может использоваться для этих приложений.
Есть несколько открытым исходным кодом (например, ImageJ, CellProfiler, Vaa3D, ледяная, KNIME и другие) и коммерческие программные платформы для анализа конфокальных изображений. ImageJ 26, свободное программное обеспечение от НИЗ или его более расширенная версия, известная как Fiji 27, имеет большое количество импортных фильтров, макросов и плагинов , доступных для всемирной Коммуний визуализациити. Большинство этих плагинов сосредоточены на обработке информации, по кусочку каждого конкретного среза способом. Есть также плагины, доступные для визуализации и анализа многоканальных изображений 3D. Тем не менее, они часто предназначены для конкретной задачи, и пользователи, возможно, потребуется расширить или адаптировать эти плагины к своим собственным потребностям. С другой стороны, коммерческие платформы нацелены относительно неопытных пользователей и часто сосредоточены на простоту в использовании, широкий охват задач обработки изображений с невероятной скоростью.
Экспериментальная процедура вместе с количественным анализом фенотипического, изложенной в данном протоколе, может помочь в выяснении молекулярных механизмов, контролирующих органелл морфологии и их распределение в пределах соты. Тем не менее, этот подход имеет очевидное ограничение анализа этих процессов в определенном конечной точке. Процесс контроля морфологии и распределения органелл, вероятно, будет очень динамичным и варьировать не только между различными клеток TyПЭС, но и в той же клетке в зависимости от развития или физиологического состояния. Дальнейшее осуществление этого анализа будет представлен Промежуток времени визуализации, что позволяет изменения в органелл морфологии и состоянии контролировать с течением времени.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
We are grateful to Dr. Andrea Chai for her insightful comments on the manuscript. This work was supported by the Wellcome Trust (grant number: Pennetta8920) and by the Motor Neuron Disease Association (grant number: Pennetta6231).
Материалы
| Name | Company | Catalog Number | Comments |
| Micro-Forceps 0.3 mm x 0.25 mm | Fine Science Tools | 11030-12 | |
| Sylgard dissection plates | SIGMA-ALDRICH | 76103 | Mix the pre-weighed elastomer base with curing agent. Poor the mixture into a 5 cm Petri dish. Let cure it at 60 °C for at least 24 hr |
| Stainless/Steel Minutien Pins 0.1 mm diameter | Fine Science Tools | 26002-10 | |
| Microdissection scissors (ultra-fine) | Fine Science Tools | 15200-00 | |
| 1x PBS (Phosphate Buffered Saline). Composition: 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7 | NaH2PO4 (SIGMA-S8282), Na2HPO4 (SIGMA-S7907), NaCl (SIGMA-S7653) | ||
| Bouin's Solution. Composition: Picric Acid, Formaldehyde, Acetic Acid (15:10:1) | Picric Acid (SIGMA 197378), Formaldehyde (F8775), Acetic Acid (SIGMA-1005706) | ||
| 1x PBT (Phosphate Buffered Saline with Triton). 1x PBS + 0.1% Triton | Triton-X100. SIGMA-T8787 | ||
| Normal Goat Serum | SIGMA | G9023 | |
| Guinea Pig anti-DVAP antibody | Provided by Dr. Giuseppa Pennetta (University of Edinburgh, UK). Use at 1:200 dilution in 5% NGS | ||
| Rabbit anti-HRP (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at 1:500 dilution in PBT containing 5% NGS |
| Rabbit anti-Lamin antibody | Provided by Dr. Paul Fisher (State Univeristy of New York at Stony Brook). Use at 1:500 dilution in PBT containing 5% NGS | ||
| TO-PRO-3 | Molecular Probes | T3605 | |
| Goat anti-rabbit antibody, Alexa Fluor488, conjugated | Jackson ImmunoResearch | bs-295G-A555-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Goat anti-guinea pig IgG antibody, Cy3, conjugated | Jackson ImmunoResearch | bs-0358G-Cy3-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Vectashield mounting medium for fluorescence | Vector laboratories | H-1000 |
Ссылки
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Curr. Opin. Neurobiol. 17 (1), 35-42 (2007).
- Fortini, M. E., Skupski, M. P., Boguski, M. S., Hariharan, I. K. A survey of human disease gene counterparts in the Drosophila genome. J. Cell Biol. 150 (2), 23-30 (2000).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. JoVE. (24), (2009).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. JoVE. (25), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Ling, S. C., Polymenidou, M., Cleveland, D. W. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 79 (3), 416-438 (2013).
- Nishimura, A. L., et al. A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am J Hum Genet. 75 (5), 822-831 (2004).
- Chen, H. J., et al. Characterization of the properties of a novel mutation in VAPB in familial amyotrophic lateral sclerosis. J Biol Chem. 285 (51), 40266-40281 (2010).
- Funke, A. D., et al. The P56S mutation in the VAPB gene is not due to a single founder: the first European case. Clin Genet. 77 (3), 302-303 (2010).
- Millecamps, S., et al. SOD1,ANG,VAPB,TARDBP, and FUS mutations in familial amyotrophic lateral sclerosis: genotype-phenotype correlations. J Med. Genet. 47 (8), 554-560 (2010).
- Landers, J. E., et al. New VAPB deletion variant and exclusion of VAPB mutations in familial ALS. Neurology. 70 (14), 1179-1185 (2008).
- Van Blitterswijk, M., et al. VAPB and C9orf72 mutations in 1 familial amyotrophic lateral sclerosis patient. Neurobiol Aging. 33 (12), 2951-2954 (2012).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Budnik, V., et al. Regulation of synapse structure and function by the Drosophila tumor suppressor gene dlg. Neuron. 17 (4), 627-640 (1996).
- Sanhueza, M., Zechini, L., Gillespie, T., Pennetta, G. Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles. Biol Open. 3 (1), 59-71 (2014).
- Worman, H. J., Ostlund, C., Wang, Y. Diseases of the nuclear envelope. Cold Spring Harb Perspect Biol. 2 (2), a000760 (2010).
- Liu, G. H., et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature. 491 (7425), 603-607 (2012).
- Pennetta, G., Hiesinger, P. R., Fabian-Fine, R., Meinertzhagen, I. A., Bellen, H. J. Drosophila VAP-33A directs bouton formation at neuromuscular junctions in a dosage-dependent manner. Neuron. 35 (2), 291-306 (2002).
- Fisher, P. A., Berrios, M., Blobel, G. Isolation and characterization of a proteinaceous subnuclear fraction composed of nuclear matrix, peripheral lamina, and nuclear pore complexes from embryos of Drosophila melanogaster. J Cell Biol. 92 (3), 674-686 (1982).
- Smith, D. E., Fisher, P. A. Identification, developmental regulation, and response to heat shock of two antigenically related forms of a major nuclear envelope protein in Drosophila embryos: application of an improved method for affinity purification of antibodies using polypeptides immobilized on nitrocellulose blots. J Cell Biol. 99 (1), 20-28 (1984).
- Smith, D. E., Gruenbaum, Y., Berrios, M., Fisher, P. A. Biosynthesis and interconversion of Drosophila nuclear lamin isoforms during normal growth and in response to heat shock. J Cell Biol. 105 (2), 771-790 (1987).
- Puckelwartz, M. J., et al. Disruption of nesprin-1 produces an Emery Dreifuss muscular dystrophy-like phenotype in mice. Hum Mol Genet. 18 (4), 607-620 (2009).
- Tsujikawa, M., Omori, Y., Biyanwila, J., Malicki, J. Mechanism of positioning the cell nucleus in vertebrate photoreceptors. Proc Natl Acad Sci USA. 104 (37), 14819-14824 (2007).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nat Rev Mol Cell Biol. 11 (12), 872-884 (2010).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены