Method Article
Pourquoi Quantification Matters: Caractérisation des phénotypes au
Dans cet article
Résumé
Morphology, size and location of intracellular organelles are evolutionarily conserved and appear to directly affect their function. Understanding the molecular mechanisms underlying these processes has become an important goal of modern biology. Here we show how these studies can be facilitated by the application of quantitative techniques.
Résumé
La plupart des études sur la morphogenèse reposent sur des descriptions qualitatives de la façon dont les traits anatomiques sont affectés par la perturbation des gènes spécifiques et des voies génétiques. descriptions quantitatives sont rarement réalisées, bien que les manipulations génétiques produisent une gamme d'effets phénotypiques et variations sont observées même chez les individus au sein des groupes de contrôle. De nouvelles preuves montrent que la morphologie, la taille et l'emplacement des organites jouent un rôle précédemment sous-estimé, mais fondamental dans la fonction et la survie cellulaire. Ici , nous fournissons des instructions étape par étape pour effectuer des analyses quantitatives des phénotypes au larvaire de la jonction neuromusculaire Drosophila (NMJ). Nous utilisons plusieurs marqueurs immunohistochimiques fiables combinés avec des techniques de bio-imagerie et analyses morphométriques pour examiner les effets des mutations génétiques sur les processus cellulaires spécifiques. En particulier, nous nous concentrons sur l'analyse quantitative des phénotypes affectant la morphologie, la taille et la position de nuclei dans les muscles striés des larves de Drosophila. La Drosophile larvaire JNM est un modèle expérimental intéressant d'étudier les mécanismes moléculaires sous - jacents de la structure et la fonction du système neuromusculaire, à la fois en matière de santé et de la maladie. Cependant, les méthodes que nous décrivons ici peuvent être étendues à d'autres systèmes.
Introduction
Qualitative analysis restricts the focus of most experimental studies to the examination of genetic manipulations leading to large phenotypic effects or to phenotypes that are not amenable to quantification, e.g., absence/presence. Quantification of phenotypes is not usually performed and variations present within members of a phenotypic group are not taken into consideration. Additionally, without mathematical descriptions of morphologies, it may be difficult to determine whether fine scale phenotypic changes are the result of genetically induced alterations or whether observed changes are simply due to random fluctuations.
We propose that for an accurate and unbiased analysis of phenotypic defects due to gene disruption, quantitative methodologies should accompany more traditional qualitative approaches. Quantitative evaluation of phenotypes is particularly beneficial for structures such as synapses that present a high degree of variability due to their intrinsic morphological and functional plasticity. We have selected examples of quantitative analyses applied to areas of investigation with which we are most familiar, namely the Drosophila larval neuromuscular junctions (NMJs). However, concepts and principles apply equally well to other experimental systems.
The larval NMJ is an excellent model system to study synaptic development and function because of the highly stereotyped nature of its structure. Each hemi-segment of the larval neuromuscular system contains 32 identifiable motor neurons forming synaptic contacts with their postsynaptic target muscle. Every hemi-segment also contains a fixed number of muscles visible as multinucleated fibers attached to the internal surface of the cuticle1. Another advantage of using the larval neuromuscular system is the power and versatility of Drosophila genetics that easily allows the generation of a number of mutant alleles and the possibility to modify gene expression in a time- and tissue-restricted manner. Finally, 75% of the human genes causing a disease have an evolutionarily conserved orthologue in Drosophila2. Indeed, entire genetic pathways are conserved between flies and humans. Because of this, the Drosophila larval neuromuscular system is a very popular experimental model to elucidate the molecular mechanisms underlying a number of human diseases including amyotrophic lateral sclerosis (ALS)1.
Here we show that the availability of several reliable immuno-histochemical markers, combined with bio-imaging techniques and accurate morphometric analyses can describe anatomical traits that are likely to play an important functional role3,4,5. Among the cellular processes that are amenable to quantitative analyses, we focus on changes in shape, size and position of intracellular structures such as the nuclei. All these are processes that we know very little about.
The challenge for molecular geneticists in the coming decades will be to extend our current knowledge by analyzing the effect of genetic mutations that produce very subtle phenotypic defects. Quantitative methodologies that allow researchers to meticulously explore the effects of genetic mutations can provide a more comprehensive understanding of how genotypes relate to phenotypes, especially for poorly understood cellular processes.
Protocole
1. Préparation expérimentale
Note: dissections et procédures immuno-histochimie dans les sections 2 et 3 sont effectuées selon les références 3-6, mais avec des modifications.
- Préparer 1x solution saline tamponnée au phosphate (PBS) et du PBS contenant 0,1% de Triton-X 100 (PBT). Gardez-les sur de la glace.
- Préparer le fixateur de Bouin (15 Acide picrique: 10 Formaldéhyde: 1 acide acétique glacial). Faire de ce réactif frais.
- Sélectionnez acier inoxydable propre broches minuties et une pince fine.
- Préparer des plaques de dissection contenant un disque Sylgard dans un plat de 5 cm de Pétri.
2. Dissection du troisième stade larvaire NMJs
- Choisissez errance des larves de troisième stade à partir d'un flacon ou une bouteille avec un pinceau fin et placez-les dans un plat de 2 cm de Pétri contenant 4 ° C PBS pour laver la nourriture résiduelle loin.
- Placez une larve sur le dessus de la surface de Sylgard de la plaque de dissection et assurez-vous qu'il est positionné avec sa face dorsale de façon à ce que les deux tubes trachéaux longitudinaux sont visibles sur la partie supérieure.
- À l'aide des pinces pour tenir la broche, la broche la larve vers le bas à son extrémité antérieure, à droite sous le crochet de la bouche. Étirez la larve autant que possible et épingler son extrémité postérieure vers le bas.
- Ajouter suffisamment PBS solution saline pour atteindre les parois de la plaque et immerger complètement la larve.
- Répéter la procédure des étapes 2.1 à 2.3 pour les autres larves du même génotype. Un seul 5 cm Petri plaque plat de dissection peut facilement accueillir jusqu'à 8 larves.
- En utilisant les ciseaux micro-dissection, soulevez légèrement la cuticule dorsale et faire une petite incision horizontale à l'extrémité postérieure près de la broche.
- Insérez des ciseaux dans l'incision, couper la larve tout le chemin à l'extrémité antérieure le long de la ligne médiane entre les deux voies longitudinales de la trachée. Assurez-vous que les coupes médianes sont assez superficielles juste passer à travers la cuticule et pour éviter de couper à travers les musclesla face ventrale.
- A chaque extrémité, couper deux encoches sur les deux côtés droit et gauche.
- Ouvrir le filet en plaçant deux broches sur les deux côtés de l'incision antérieure. Répétez la même chose avec la fin postérieure. Lorsque vous placez les broches, assurez-vous de répandre la paroi du corps de l'autre.
- Nettoyer les organes internes à l'aide de pinces et PBS solution saline. Laissez le système nerveux central intact. Étirez délicatement la larve avec des épingles de coin jusqu'à ce qu'il soit complètement étiré mais assurez-vous que les muscles ne sont pas déchirés pendant ce processus.
- Répétez la même procédure de dissection pour les autres larves sur la même plaque de dissection.
- Laver avec du PBS solution saline trois fois pour éliminer tous les organes internes.
- Remplacer le PBS avec le fixateur de Bouin et le laisser à température ambiante pendant 10 min.
- Laver plusieurs fois avec PBT.
- Retirez soigneusement les broches et de transférer tous les préparatifs, qui sont maintenant assez rigide, dans un tube de 1,5 ml de micro-centrifugeuse pour immuno-coloration.
Coloration 3. Immuno-histochimie de Drosophila NMJs avec des anticorps spécifiques pour les muscles et les myonuclei
- Rincer rapidement les filets larvaires en PBT.
- Bloquer les préparatifs en incubant avec 10% de sérum de chèvre normal (NGS) en PBT pendant 2 heures sous agitation constante.
- Incuber un ensemble de NMJs disséqué dans du PBT contenant 5% de NGS et un anticorps de lapin anti-lamine (à une concentration de 1: 500) et avec un anticorps anti-DVAP Guinée porc (à une concentration de 1: 500) pendant 2 heures à température ambiante ou à 4 ° C pendant une nuit. L'anticorps anti-taches DVAP les muscles striés tandis que la coloration de l'anti-lamine détecte le contour de myonuclei.
- Laver une fois rapidement PBT pour éliminer les anticorps en excès. Laver à PBT pendant 2 heures en changeant le PBT tampon toutes les 15 min.
- Incuber les échantillons dans du PBT contenant 5% de NGS et des anticorps secondaires marqués par fluorescence à la dilution 1: 500 pendant 2 h à température ambiante. Les mêmes échantillons cêtre soumis à une coloration avec des anticorps multiples en même temps si des anticorps secondaires conjugués avec des chromophores différents sont utilisés.
- Retirer les anticorps secondaires et laver PBT pendant 2 heures en changeant le PBT tampon toutes les 15 min.
- Pour colorer l'intérieur des myonuclei laver les échantillons trois fois avec du PBS et procéder comme suit:
- Ajouter le marqueur nucléaire TO-PRO-3, à une dilution de 1: 1000 dans du PBS et on incube pendant 20 min sous agitation constante. Ce marqueur est utilisé dans cette étude, mais tout autre marqueur nucléaire disponible dans le commerce peut être utilisée aussi bien.
- Laver rapidement trois fois dans PBS avant le montage.
4. Les échantillons de montage sur les diapositives
- Choisissez les échantillons avec des pinces du tube de 1,5 ml de micro-centrifugeuse et les déposer sur une lame de traitement.
- En utilisant des ciseaux micro-dissection, couper la tête et la queue des filets et de garder leur surface interne vers le haut.
- Préparer ee montage diapositive en enroulant autour de trois bandes de ruban de cellulose de chaque côté d'une lame propre à une distance d'environ 1 cm les uns des autres. Une fois que la lamelle est positionnée au-dessus des deux bandes, un espace est généré qui permette d'éviter l'aplatissement des échantillons. Ceci est crucial si les rendus de volume en trois dimensions des structures doivent être faites.
- Mettre une petite goutte d'environ 20 pi du milieu de montage au milieu de la glissière de montage entre les trois bandes de ruban de cellulose.
- Après la diffusion du milieu de montage avec une pince propre, faites glisser les larves disséquées à la glissière de montage dans le milieu de montage, en gardant la surface interne vers le haut. Essayez de les monter en rangées de quatre ou cinq.
- déposer délicatement une lamelle sur le dessus de la glissière de montage et assurez-vous qu'il n'y a pas de bulles d'air sont générées. Sceller la lame avec du vernis à ongles transparent. Laissez les échantillons sécher pendant au moins 10 minutes avant l'imagerie.
5. Paramètres confocale pour l'imagerie
Remarque: Les images présentées dans cette étude sont prises en utilisant une unité de confocal Nikon A1R intégré sur un Ti: Microscope E inversé. Cependant, tout confocal avec un minimum de 3 unités laser qui sont disponibles dans les régions de longueurs d'onde de 488 nm, 561 nm et 642 nm et un système de détection 3 de canal est adapté à cet effet.
- Allumez les lasers, l'unité de détecteur, ampoule de mercure, contrôleur de scène, microscope et le PC. Démarrez le logiciel de contrôle et de sécuriser la glissière sur le support de la scène.
- Pour rendre l'imagerie plus rapide, sélectionner et marquer toutes les régions d'intérêt (ROI) sur l'échantillon en utilisant un objectif 20X.
- balancer délicatement l'embout du 60X plus fort grossissement objectif (60X Plan Apo VC / NA 1.4 OIL).
- Déposer une goutte d'huile d'immersion sur l'objectif et sélectionnez l'une des ROI marqué par XYZ fenêtre de vue d'ensemble sur l'ordinateur.
- Démarrez l'imagerie en utilisant les paramètres optiques suivants: Sélectionnez le premier miroir dichroïque: 405/488/561/640. Sélectionnez 488 nm laser avec filtre d'émission 525/50 nm dans le canal 1, 561 nm laser avec filtre d'émission 595/50 dans le canal 2 et le laser 642 nm avec passe-temps filtre 650 nm dans le canal 3.
- Utilisez les paramètres de numérisation suivants avant de commencer l'acquisition d'images: Sélectionnez scanner Galvano; direction de balayage: un moyen; Vitesse de numérisation: 0,5 images par seconde.
- Sélectionnez la série Channel pour éviter le canal de purge à travers.
- Ajuster la taille de trou d'épingle à 1 unité aérienne. Numériser et régler la puissance du laser, le gain de détection et de compenser de manière appropriée pour chaque canal afin d'éviter la saturation du pixel et le niveau d'arrière-plan.
- Acquérir z-piles en utilisant la taille de voxel de 0,2 x 0,2 x 0,5 um 3 pour tous les ROIs et les préparatifs de la diapositive. Si les images sont soumises à déconvolution puis définir la taille de voxel à 0,06 x 0,06 x 0,15 um 3.
- Enregistrer les images au format .nd2 de format de fichier ou .ics.
6. Calcul de la distance entre Nuclei au sein de strié60; Muscles par la méthode de l'analyse du voisin le plus proche
- Pour cette analyse, utiliser des images confocale montrant larvaires muscles corps-mur coloré avec des anticorps de DVAP pour visualiser les muscles et avec des anticorps lamine et un marqueur nucléaire pour mettre en évidence les noyaux.
- Pour estimer la distance la plus proche entre les noyaux, utiliser des points de mesure dans le module MeasurementPro du logiciel d'analyse d'image (par exemple, Imaris). D'autres applications logicielles similaires pour l'analyse d'images peuvent être utilisés pour les mêmes fins.
- Ouvrez les images confocale. Pour lancer, double-cliquez sur l'icône du logiciel. Glissez et déposez les images z-stack confocale dans l'Arena.
- Double-cliquez sur les images pour les ouvrir automatiquement dans la vue Surpass, sous la barre icône de l'outil de menu
 . Le Surpass View a trois panneaux principaux de l'espace de travail: vue Zone, objet List et l'objet Propriétés.
. Le Surpass View a trois panneaux principaux de l'espace de travail: vue Zone, objet List et l'objet Propriétés. - Créer un volume rendu timage de canal hree en cliquant sur l'icône du menu Vue 3D
 .
. - Cliquez sur l'icône Points Ajouter une nouvelle mesure
 du Barre d'outils Objets et suivre l'assistant de création qui apparaît dans l'objet Propriétés.
du Barre d'outils Objets et suivre l'assistant de création qui apparaît dans l'objet Propriétés. - Dans l'assistant de création sélectionnez l'onglet Modifier la première et de la Manche puis spécifique. Sélectionnez le marqueur nucléaire ou le canal de lamine pour mettre en évidence les noyaux.
- Réglez le pointeur sur le mode de sélection en appuyant sur l'onglet Echap du clavier.
- Ajuster la taille de la boîte de curseur 3D avec la molette de la souris pour contenir un noyau donné dans l'image. Ajouter un point de mesure en maintenant la touche Maj et clic gauche sur le même noyau.
- Ajouter le deuxième point sur un noyau à proximité sur le même muscle en répétant les étapes précédentes. Une ligne est automatiquement établie entre les deux points et la distance mesurée entre les deux noyaux sont affichés. La distance entre les deux noyaux est maintenant enregistrée comme une variable statistique dans l'objet Propriétés sous l'onglet Statistiques> Données détaillées> Distance.
- Répétez la procédure des étapes 6.6 à 6.10 pour tous les noyaux autour d'un noyau donné.
- De Statistiques> Données détaillées> Distance affichant tous les points de mesure collectées, sélectionnez la distance la plus courte.
- En cliquant sur les statistiques d'exportation sur l'onglet Affichage dans un fichier
 disponible sous l'objet Propriétés, les données seront sauvegardées sur une feuille de calcul.
disponible sous l'objet Propriétés, les données seront sauvegardées sur une feuille de calcul. - Répétez la même procédure pour les autres noyaux environnants et pour un certain nombre de fibres musculaires par génotype.
- En utilisant les données exportées vers un fichier tableur, calculer la distance la plus courte en moyenne (D ave) pour tout le nombre M de muscles en utilisant l'équation suivante:
oad / 53821 / 53821eq1.jpg "/>
Di est la distance la plus courte vers le noyau voisin d'un noyau donné i, où i varie de 0 à N et N est le nombre de noyaux analysés par muscle. La somme des valeurs de j = 0 à j = m indique le nombre M de muscles analysés. - Vous pouvez également utiliser Spots de l'assistant de création et Spots à Spots de distance la plus proche pour estimer la distance moyenne du noyau voisin le plus proche. Pour cela, un module d'extension Matlab est nécessaire.
- Double-cliquez sur une image spécifique sur l'image 3D du volume Arena et sera affiché dans la zone View. Cliquez sur l'icône de création d'objets et ajouter de nouveaux points
 à partir de la barre d'outils Objets.
à partir de la barre d'outils Objets. - De l'assistant de création dans l'objet Propriétés, cliquez sur l'option Ignorer la création automatique, Modifier manuellement.
- Sélectionnez le lamine ou le canal de marqueur nucléaire pour afficher les noyaux.
- Maj et cliquez sur left bouton de la souris sur tous les noyaux d'un muscle spécifique dans l'image. Une tache sur chaque noyau apparaîtra.
- Sélectionnez Spots à Spots de distance la plus proche répertorié sous l'onglet Outils dans l'objet Propriétés. Spots Sélectionnez Statistiques dans le cadre du mode Résultat et une fenêtre Matlab apparaît.
- Sous l'onglet Statistiques, sélectionnez Valeurs détaillées et spécifiques. Cliquez sur le Distmin et les valeurs des distances minimales pour chaque noyau apparaîtront.
- Exporter les données dans un fichier de feuille de calcul et de calculer la moyenne de ces distances par muscle. Répétez la procédure pour tous les muscles d'un génotype donné.
- Double-cliquez sur une image spécifique sur l'image 3D du volume Arena et sera affiché dans la zone View. Cliquez sur l'icône de création d'objets et ajouter de nouveaux points
7. Détermination de la forme des noyaux dans les muscles du corps à paroi de Drosophila Larves
- Pour cette analyse, utiliser des images confocale de muscles corps à parois colorées avec lamine et un marqueur nucléaire pour visualiser les noyaux.
- Afin d'évaluer la forme de noyaux musculaires, mesure sphéricité (définie comme étant le rapport de la surzone du visage d'une sphère avec le même volume que le noyau donné, à la surface du noyau) ou ellipticité (distinction entre les ellipsoïdes et sphéroïdes aplaties oblates /).
- Ouvrir l'image comme décrit précédemment. Cliquez sur l'icône de la barre d'outils Objets Ajouter New Surfaces
 .
. - Dans l'assistant de création qui apparaît dans l'objet Propriétés, sélectionnez le marqueur coloration nucléaire comme canal Source pour afficher les noyaux.
- Réglez l'option Intensité absolue comme seuil. Assurez-vous que la plupart des noyaux montrent un rendu lisse et non surchargé en changeant la valeur de la courbe de seuil. Dans le même temps, d'éviter la présence de trous ou d'un masque incomplet à tout noyau en utilisant la même courbe.
- Utilisez le outil de filtre pour exclure tout bruit dans le rendu de surface. Sous l'onglet Modifier de la couche de surface nouvellement créée, Split ou Fusionner les surfaces de noyaux qui sont mal rendered.
- Exporter vers un fichier tableur les valeurs d'ellipticité et sphéricité de la surface rendue noyaux qui sont disponibles sous l'onglet Statistiques.
- Vous pouvez également utiliser ImageJ ou Fiji logiciel pour mesurer la circularité des noyaux où la circularité (C) est défini comme C
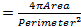 . Une valeur de l'un représente un cercle parfait alors qu'une valeur proche de zéro indique une forme plus allongée.
. Une valeur de l'un représente un cercle parfait alors qu'une valeur proche de zéro indique une forme plus allongée. - Créer des projections d'intensité maximale des z piles à partir du menu Images> Piles> Z Project. Définir le type de projection à intensité maximale.
- Diviser les canaux et sélectionnez le canal de marqueur nucléaire.
- Dans le menu principal, sélectionnez Image> Réglages> Seuil.
- Segment des noyaux en ajustant le seuil d'intensité. Si les noyaux voisins sont segmentés comme une seule unité, cliquez sur Process> Binary> Outil du bassin versant pour déconnecter les noyaux.
- Dans le menu principal, sélectionnez Modifier> Sélection> Créer sélection.
- Ajouter tous les ROIs sélectionnés dans le gestionnaire de ROI en cliquant sur le menu Analyse> Outils> Gestionnaire de retour sur investissement. Dans la fenêtre Gestionnaire de ROI cliquez sur Ajouter. Dans la même fenêtre, sélectionnez Plus> Split.
- Sélectionnez Descripteurs de forme dans Analyse> Mesures Set. Dans la fenêtre du gestionnaire de ROI cliquez sur l'onglet Mesure. Cela permet d'afficher une liste de valeurs de circularité de tous les noyaux sélectionnés.
- En outre, pour mesurer le volume nucléaire, suivez l'assistant de création de surface en utilisant le canal de coloration de marqueur nucléaire tel que décrit dans les paragraphes 7,3-7,7.
8. Rendus 3D de volume d' une sélection Nuclei dans les Drosophila larvaires Body-mur Muscles pour évaluer la intranucléaire localisation d'une protéine spécifique
- Utiliser des images confocale rapports muscles de la paroi de corps colorés avec un marqueur nucléaire et avec des anticorps spécifiques à la lamine et DVAP.
- Ouvrez les images en lançant le logiciel et select le noyau spécifique à analyser. Cela peut être fait en sélectionnant le principal élément de menu Edition> Recadrer 3D.
- Suivez l'assistant de création de surface en utilisant le canal de lamine comme décrit au paragraphe 7,3-7,7.
- Une fois que la surface est créée, cliquez sur Modifier dans la Objects Propriétés puis sélectionnez Masque tout pour isoler le signal à l'intérieur du noyau. Cela crée une nouvelle fenêtre.
- Sélectionnez signal DVAP dans le menu déroulant Select Channel. Sélectionnez le signal DVAP immunoréactivité à l'intérieur du noyau en cliquant sur l'option Set voxels Outside The Surface à zéro. Un nouveau canal masqué est créé et est disponible dans la fenêtre de réglage d'affichage pour la sélection.
- Pour visualiser la présence du signal à l'intérieur du noyau de créer un plan de contour en cliquant sur l'icône Ajouter un nouveau plan de clipping
 à partir de la barre d'outils Objets.
à partir de la barre d'outils Objets. - Ajuster interactivement l'angle de l'écrêtageavion et sa position de visualiser la répartition du signal à l'intérieur du noyau.
Résultats
La SLA est une maladie dégénérative qui affecte spécifiquement les neurones moteurs conduisant à une paralysie progressive et mortelle des muscles striés 7. Mutations faux - sens dans la VAMP-Associated Protein humaine B (hVAPB) provoquent une série de maladies des neurones moteurs , y compris la SLA de type 8 au 12 août. Une mutation faux - sens (V234I) dans le gène hVAPB a récemment été identifié dans un cas typique de l' ALS chez l'être humain 13. Pour évaluer son potentiel pathogène, nous avons généré des mouches transgéniques exprimant le hVAPB Drosophila orthologue DVAP portant la mutation responsable de la maladie (DVAP-V260I). L'expression de ce transgène est ciblée sur les muscles à l' aide du système UAS / GAL4 et le conducteur spécifique des muscles BG57-Gal4 14,15. L'effet de DVAP-V260I expression transgénique a été comparée et contrastée à celle de deux autres transgènes (DVAP-WT1 et DVAP-TT2), qui expriment différents niveaux de la protéine sauvage de DVAP 16. More spécifiquement, l'augmentation de la DVAP immunoréactivité est de 2,2 fois plus élevée que chez les témoins pour la ligne de DVAP-TT2 tandis que les niveaux d'un même signal 16 DVAP-V260I et DVAP-WT1 exposition comparables et inférieures.
Des altérations nucléaires ont été associés au vieillissement et à plusieurs maladies neurodégénératives y compris la maladie de Parkinson 17,18. Pour évaluer si notre modèle de mouche pour ALS8 présente des changements dans l' architecture nucléaire, de la position et de taille, nous avons coloré les noyaux à l'intérieur des muscles striés des génotypes appropriés avec un marqueur nucléaire et l'anticorps anti-lamine 19-22, ce qui permet de visualiser l'enveloppe nucléaire. Pour mettre en évidence les muscles, un anticorps spécifique DVAP a également été ajouté dans les mêmes échantillons (figure 1). Les images confocales ont été recueillies et des analyses morphométriques détaillées ont été effectuées en utilisant un logiciel d'analyse d'images. Dans les muscles témoins, se sont révélés être uniformément répartis le long du muscle noyauxfibres tout en DVAP-V260I et DVAP-WT exprimant les muscles, les noyaux présentent une tendance à redistribuer en grappes étroitement associés (figure 1).
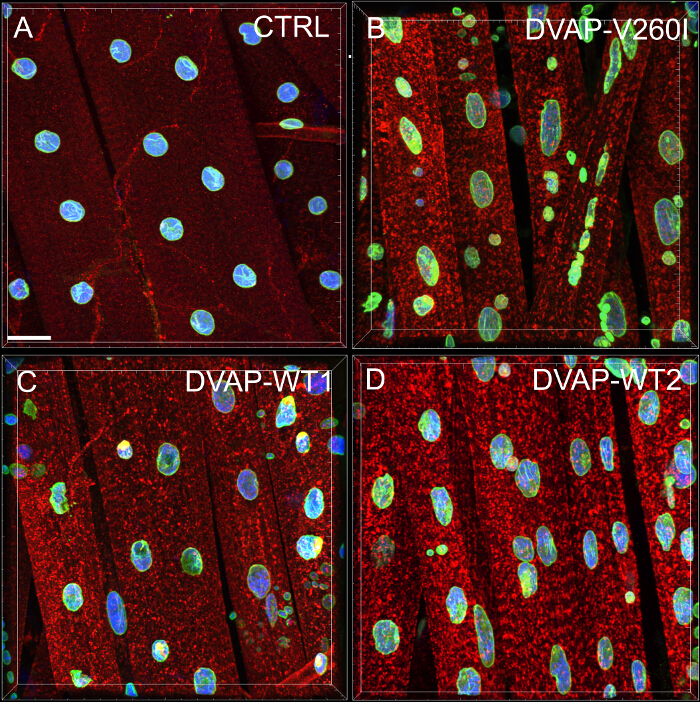
Nous avons effectué une analyse du plus proche voisin pour effectuer une évaluation quantitative de la répartition des noyaux le long des fibres musculaires de chaque génotype. Une analyse du plus proche voisin identifie d'abord le plus proche voisin pour chaque noyau en mesurant la distance entre le centre d'un noyau donné et le centre de chaque autre noyau qui l'entoure. Cette procédure est ensuite répétée pour tous les autres noyaux le long de la fibre musculaire. Enfin, la distance la plus courte entre les noyaux dans un muscle spécifique, est calculée en faisant la moyenne des distances les plus courtes de chaque noyau et ses voisins les plus proches. (Figure 2A - C). Comparativement aux témoins, les muscles exprimant soit le transgène DVAP-V260I ou l'un des transgènes surexprimant la protéine de type sauvage, Présentent une réduction dramatique de la plus courte distance moyenne entre les noyaux et, par conséquent, les noyaux semblent être étroitement associés à des clusters. L'effet de l'ALS causant allèle DVAP-V260I est plus sévère que celle qui est associée à la surexpression de la protéine de type sauvage, même si la plus forte transgène DVAP-TT2 est utilisé (Figure 1 et Figure 2D).
La surexpression de soit DVAP-V260I ou DVAP-WT transgènes présente également une grave détérioration de l' architecture nucléaire résultant dans les noyaux déformés avec une structure allongée (figure 1). Cette aberration structurale a été quantifié en utilisant le logiciel ImageJ dans lequel la circularité est définie par la formule suivante: C  Qui mesurent le rapport de largeur à longueur de chaque noyau avec C = 1 représentant un cercle parfait et C = 0 à l'infini un polygone allongé. Dans contrnoyaux ol présentant une forme ronde distincte, C est égal à 1 , tandis que dans les mutants transgéniques un changement de forme avec une perte conséquente de circularité, provoque un écart significatif de cette valeur (Figure 1 et Figure 3).
Qui mesurent le rapport de largeur à longueur de chaque noyau avec C = 1 représentant un cercle parfait et C = 0 à l'infini un polygone allongé. Dans contrnoyaux ol présentant une forme ronde distincte, C est égal à 1 , tandis que dans les mutants transgéniques un changement de forme avec une perte conséquente de circularité, provoque un écart significatif de cette valeur (Figure 1 et Figure 3).
Nous avons également constaté que , dans les muscles exprimant les transgènes mêmes, les noyaux présentent un volume nucléaire marqué à plus grande échelle par rapport aux témoins, bien que l'allèle causant la SLA semble être plus efficace dans l' induction de ce phénotype par rapport aux transgènes DVAP-WT (figure 4).
La quasi-totalité des maladies neurodégénératives sont caractérisées par l'accumulation intracellulaire d'agrégats contenant la protéine pathogène. Nous avons fait des reconstructions 3D et des rendus de volume de noyaux et nous avons constaté que dans les muscles exprimant le transgène mutant ou surexprimant la protéine de type sauvage, DVAP immunoréactivité formé un amasnd que certains d'entre eux ont également été localisés dans les noyaux (figure 5). A l' inverse, dans NMJs de commande, DVAP immunoréactivité est faiblement dispersé à travers la fibre musculaire et est exclu du noyau 16.
. Figure 1: Les images confocales de myonuclei au sein de muscles striés exprimant soit le DVAP-WT ou transgènes DVAP-260I (A) BG57-Gal4 / + contrôle, (B) BG57; DVAP-V260I, (C) BG57; DVAP-WT1 et (D) BG57; muscles DVAP-WT2 exprimant les transgènes indiquées sont colorées avec des anticorps spécifiques pour DVAP (rouge signal), lamine (signal vert) et avec un marqueur spécifique nucléaire pour visualiser les noyaux (signal bleu). Barre d'échelle = 30 pm S'il vous plaît cliquer ici pour voir uneune plus grande version de ce chiffre.
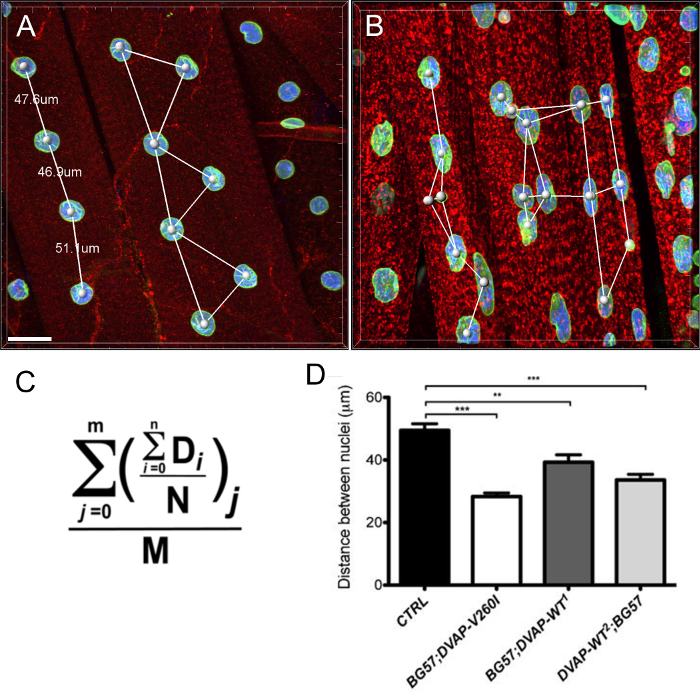
Figure 2: Analyse la plus proche voisin pour déterminer la distance moyenne entre un noyau unique et son voisin le plus proche (B) Des résultats représentatifs montrant le positionnement nucléaire altéré dans les muscles surexprimant le transgène DVAP-TT2 par rapport aux témoins dans (A).. La distance moyenne nucléaire dans les muscles des génotypes indiqués a été estimée en utilisant la formule (C) et les données sont rapportées dans (D). NMJs larvaires sont colorées avec des anticorps spécifiques pour DVAP (signal rouge), lamine (vert) et avec un marqueur nucléaire (signal bleu). Les astérisques indiquent une signification statistique. *** P <0,001, ** P <0,01. Pour l'analyse statistique de cette expérience et toutes les expériences rapportées ci-dessous un test ANOVA à sens unique a été utilisé et le multip d'un Tukeycomparaison le test a été appliqué comme un test post-hoc lorsque les différences entre les génotypes ont été jugés importants par le test ANOVA. Les barres d'erreur représentent SEM. Barre d'échelle = 30 pm S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
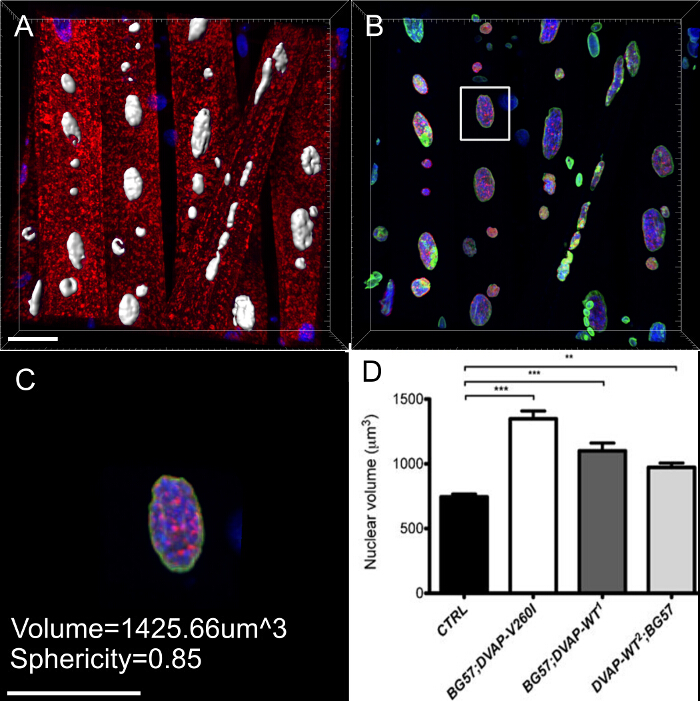
Figure 3:. Images montrant les étapes représentatives dans le calcul du volume nucléaire (A) Une image représentative montrant noyaux segmentés en utilisant l'assistant de création de surface. Noyaux à la frontière des images ont été ignorées. (B) Image montrant le signal de DVAP nucléaire après coloration DVAP environnante est masquée à l'aide de la surface créée dans le canal de marqueur nucléaire. (C) La couche de surface fournit des informations de paramètres supplémentairesy compris le volume nucléaire et la sphéricité. (D) Les données sur le volume nucléaire des différents génotypes. Les astérisques indiquent une signification statistique. NMJs disséqués ont été colorées avec des anticorps anti-DVAP (signaux rouge), les anticorps anti-lamine (signal vert) et un marqueur nucléaire (signal bleu). *** P <0,001, ** P <0,01. Les barres d'erreur représentent SEM. Barre d'échelle = 30 pm S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
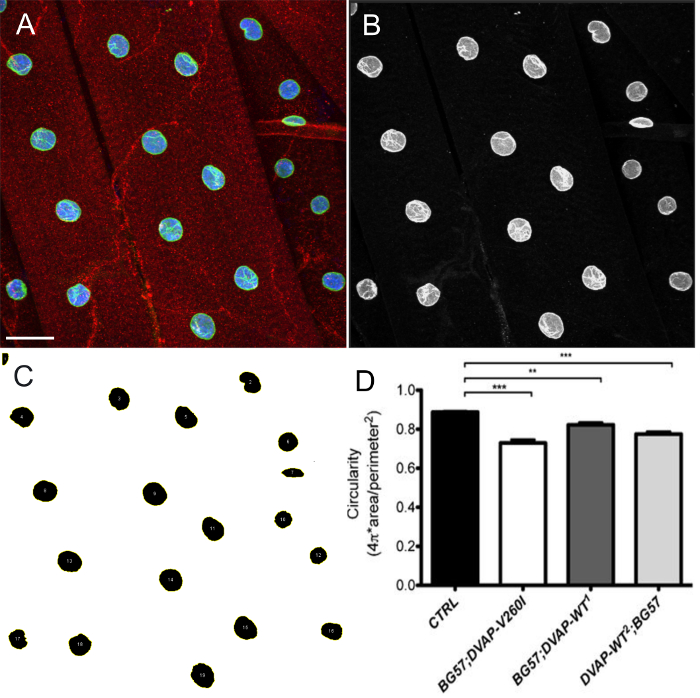
Figure 4: Images montrant des étapes représentatives dans l'estimation de la forme nucléaire par ImageJ. projection maximale d'intensité des images ont été analysées en utilisant ImageJ pour estimer la circularité des noyaux dans les muscles. (A) Un exemple représentatif de la projection d'intensitéde l'image à trois canaux comme à l'étape 7.9 du protocole. (B) Image montrant l' étape 7.10 du protocole dans lequel les canaux sont divisés et le canal de marqueur nucléaire est sélectionné. (C) Une image représentative montrant que , après l' application de seuil d'intensité pour segmenter les noyaux et gestionnaire de ROI plugin dans ImageJ, tous les noyaux d'intérêt peuvent être sélectionnés et leur forme mesurés par des descripteurs de forme (étapes 7,11-7,15). (D) Quantification de la circularité des différents génotypes. Sur les NMJs larvaires, le signal rouge indique DVAP coloration tandis que le vert décrit noyaux et correspond à la coloration de la lamine. L'intérieur de chaque noyau est marqué en bleu en raison de la coloration avec un marqueur nucléaire. Les astérisques indiquent une signification statistique. *** P <0,001, ** P <0,01. Les barres d'erreur représentent SEM. Barre d'échelle = 30 pm S'il vous plaît cliquer sur sone pour voir une version plus grande de cette figure.
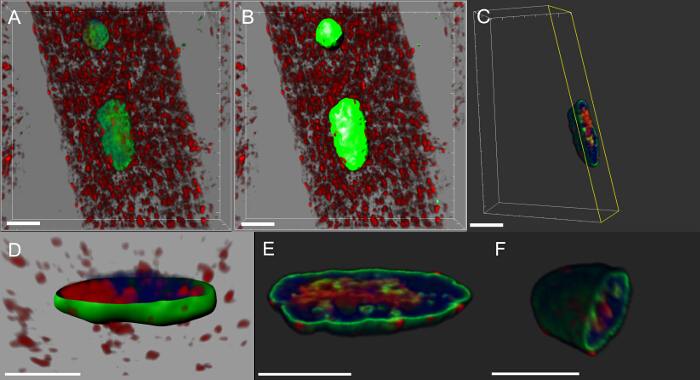
Figure 5: Images montrant les étapes spécifiques à la création de rendus de volume de myonuclei. (A) Image montrant l' intensité 3D mélangé vue des muscles colorés avec la protéine DVAP (rouge), la lamine (vert) et le marqueur d'ADN (bleu). (B) Image représentant une couche de surface générée en utilisant le canal de la lamine pour segmenter les noyaux. (C) représentant l' image d' un noyau dans lequel la couche superficielle a été utilisée pour masquer le signal de DVAP en dehors du noyau sélectionné. Surligné en jaune est un plan de coupe qui a été ajouté à l'image. Son angle de vue et la position peut être ajustée de façon interactive pour visualiser la distribution du signal à l'intérieur du noyau. (D) Une image signaler une vue en coupe transversale de l'usi couche de surface nucléaire crééeng le canal lamine fusionné avec DVAP démasqué et signaux marqueurs nucléaires. (E et F) supplémentaires des rendus de volume en coupe du même noyau. Barre d'échelle = 10 pm S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Dans le passé, les variations morphologiques au sein et entre les groupes expérimentaux ont été rarement pris en compte. Cependant, l'application des méthodes quantitatives est en train de devenir la norme dans les études comparatives de la morphologie et de la description mathématique des formes anatomiques sont calculées. L'utilisation des analyses quantitatives pour évaluer les effets des manipulations génétiques sur les processus cellulaires spécifiques, tenir la promesse dans l'amélioration de notre capacité à détecter les changements morphologiques et dans l'amélioration de la précision avec laquelle ces changements sont décrits. En outre, l'analyse statistique des données quantitatives nous permet d'évaluer si les différences observées entre les phénotypes sont importants.
Dans les muscles striés, les noyaux présentent une structure arrondie distincte et sont répartis uniformément le long de la fibre musculaire. Bien que les mécanismes moléculaires établir et maintenir la taille, la forme et l'architecture des noyaux ne sont pas connus, ces caractéristiques nucléaires sont susceptibles to jouer un rôle fondamental dans le contrôle de la fonction musculaire. En effet, plusieurs myopathies sont causées par des mutations dans les gènes régulant la morphologie et la position des noyaux dans les muscles. L'importance fonctionnelle de la forme et de la distribution des noyaux dans une cellule ne se limite pas aux muscles. L' accumulation de preuves indique que les anomalies nucléaires sont également associés à des maladies neurodégénératives telles que la maladie de Parkinson 18,24. De plus, nous commençons à comprendre que la morphologie, la taille et la distribution intracellulaire d'autres organites y compris réticulum et les mitochondries peuvent avoir des conséquences fonctionnelles endoplasmique. Par exemple, des altérations de la morphologie des mitochondries sont associées à des troubles neurologiques tels que type 1 atrophie optique (OPA1) et de Charcot-Marie-Tooth de type 2A neuropathie 25.
Pour aider dans le processus d'élucider les mécanismes moléculaires sous-jacents de ces processus importants, nous proposons de combiner haute résolution confocaledonnées avec le logiciel d'imagerie et analyses morphométriques pour évaluer quantitativement la façon dont les manipulations génétiques peuvent affecter la forme, la taille et l'emplacement des noyaux dans les fibres musculaires. La puissance et la polyvalence de la génétique de Drosophila ainsi que la nature très stéréotypée du système neuromusculaire chez les larves de drosophile rendent le NMJ larvaire un modèle expérimental particulièrement adapté à ce type d'analyses. Les JNM des larves, une analyse phénotypique peut être réalisée à une résolution de synapses unique permettant une analyse morphométrique précis où un certain nombre de NMJs peut être étudié dans le même braguette et le même identifiable NMJ peut être comparé entre les mouches de différents génotypes 3,4.
La caractérisation phénotypique de la position nucléaire, la forme et la taille à la Drosophile larvaire JNM commence en effectuant une immunocoloration de NMJs disséqués avec des anticorps qui mettent en évidence les muscles et les noyaux au sein de muscles. Dans le protocole décrit dans this papier, myonuclei ont été colorées avec des anticorps polyclonaux contre la lamine, un marqueur de l'enveloppe nucléaire, avec un marqueur nucléaire mettant en évidence les anticorps intérieurs et avec nucléaires spécifiques à DVAP pour colorer le muscle entier. Les anticorps lamine utilisés dans ces expériences ont été aimablement fournies par Paul Fisher 19-22 , mais d' autres sources d'anticorps anti-lamine peuvent être utilisés. En outre, un certain nombre d'autres anticorps spécifiques de l'enveloppe nucléaire, sont disponibles dans le commerce. Enfin, les marqueurs nucléaires, tels que le DAPI et l'iodure de propidium, sont également disponibles alors que les muscles peuvent être visualisées par coloration avec des anticorps anti-actine ou antitubuline. Si des anticorps autres que ceux qui sont utilisés dans cette procédure expérimentale sont utilisés, le protocole d'immunocoloration nécessitera extra-étapes dans lesquelles les conditions de fixation et des concentrations de travail pour les nouveaux anticorps devront être optimisés. Une étape cruciale dans ce protocole, en particulier lorsque des rendus de volume doivent être analysées, est ee montage des échantillons sur la diapositive. Dans ce cas, il est important d'inclure des éléments intermédiaires entre la lame et la lamelle couvre-objet de sorte que les échantillons ne soient pas écrasés. Trois bandes de ruban adhésif de cellulose enroulé autour de la glissière des deux côtés de la lamelle constituent un moyen facile de faire des entretoises.
Alors que ImageJ a été utilisé pour les images 2D, la plupart de l'image 3D multi-canal analyses présentées dans le présent document, ont été fait en utilisant Imaris en raison de sa disponibilité en interne. Toutefois, tout autre package similaire logiciel commercial peut être utilisé pour ces applications.
Il y a plusieurs open-source (par exemple, ImageJ, CellProfiler, Vaa3D, Icy, KNIME et autres) et les plates-formes de logiciels commerciaux disponibles pour l'analyse des images confocale. ImageJ 26, le logiciel gratuit du NIH ou sa version plus renforcée, connue sous le nom FIDJI 27, dispose d' un grand nombre de filtres d'importation, des macros et des plugins disponibles pour l'imagerie communi dans le monde entierty. La plupart de ces plugins sont axés sur le traitement des informations sur une tranche de manière tranche par cas. Il y a aussi des plugins disponibles pour la visualisation et l'analyse des images 3D multicanaux. Cependant, ils sont souvent conçus pour une tâche spécifique et les utilisateurs peuvent avoir besoin d'étendre ou d'adapter ces plugins à leurs propres besoins. D'autre part, les plates-formes commerciales ciblent les utilisateurs relativement inexpérimentés et sont souvent axés sur la facilité d'utilisation, une large couverture des tâches de traitement d'image avec une vitesse incroyable.
La procédure expérimentale ainsi que l'analyse phénotypique quantitative décrite dans le présent protocole, peut aider à élucider les mécanismes moléculaires contrôlant la organite morphologie et leur répartition au sein d'une cellule. Cependant, cette approche a la limitation évidente de l'analyse de ces processus à un point final spécifique. Le procédé de contrôle de la morphologie et la distribution des organites est susceptible d'être très dynamique et de faire varier non seulement entre les différentes cellules types, mais aussi au sein de la même cellule en fonction de l'état de développement ou physiologique. Une autre mise en œuvre de cette analyse serait représentée par lapse imagerie de temps qui permet des changements dans la morphologie des organelles et la position à surveiller au fil du temps.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
We are grateful to Dr. Andrea Chai for her insightful comments on the manuscript. This work was supported by the Wellcome Trust (grant number: Pennetta8920) and by the Motor Neuron Disease Association (grant number: Pennetta6231).
matériels
| Name | Company | Catalog Number | Comments |
| Micro-Forceps 0.3 mm x 0.25 mm | Fine Science Tools | 11030-12 | |
| Sylgard dissection plates | SIGMA-ALDRICH | 76103 | Mix the pre-weighed elastomer base with curing agent. Poor the mixture into a 5 cm Petri dish. Let cure it at 60 °C for at least 24 hr |
| Stainless/Steel Minutien Pins 0.1 mm diameter | Fine Science Tools | 26002-10 | |
| Microdissection scissors (ultra-fine) | Fine Science Tools | 15200-00 | |
| 1x PBS (Phosphate Buffered Saline). Composition: 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7 | NaH2PO4 (SIGMA-S8282), Na2HPO4 (SIGMA-S7907), NaCl (SIGMA-S7653) | ||
| Bouin's Solution. Composition: Picric Acid, Formaldehyde, Acetic Acid (15:10:1) | Picric Acid (SIGMA 197378), Formaldehyde (F8775), Acetic Acid (SIGMA-1005706) | ||
| 1x PBT (Phosphate Buffered Saline with Triton). 1x PBS + 0.1% Triton | Triton-X100. SIGMA-T8787 | ||
| Normal Goat Serum | SIGMA | G9023 | |
| Guinea Pig anti-DVAP antibody | Provided by Dr. Giuseppa Pennetta (University of Edinburgh, UK). Use at 1:200 dilution in 5% NGS | ||
| Rabbit anti-HRP (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at 1:500 dilution in PBT containing 5% NGS |
| Rabbit anti-Lamin antibody | Provided by Dr. Paul Fisher (State Univeristy of New York at Stony Brook). Use at 1:500 dilution in PBT containing 5% NGS | ||
| TO-PRO-3 | Molecular Probes | T3605 | |
| Goat anti-rabbit antibody, Alexa Fluor488, conjugated | Jackson ImmunoResearch | bs-295G-A555-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Goat anti-guinea pig IgG antibody, Cy3, conjugated | Jackson ImmunoResearch | bs-0358G-Cy3-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Vectashield mounting medium for fluorescence | Vector laboratories | H-1000 |
Références
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Curr. Opin. Neurobiol. 17 (1), 35-42 (2007).
- Fortini, M. E., Skupski, M. P., Boguski, M. S., Hariharan, I. K. A survey of human disease gene counterparts in the Drosophila genome. J. Cell Biol. 150 (2), 23-30 (2000).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. JoVE. (24), (2009).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. JoVE. (25), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Ling, S. C., Polymenidou, M., Cleveland, D. W. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 79 (3), 416-438 (2013).
- Nishimura, A. L., et al. A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am J Hum Genet. 75 (5), 822-831 (2004).
- Chen, H. J., et al. Characterization of the properties of a novel mutation in VAPB in familial amyotrophic lateral sclerosis. J Biol Chem. 285 (51), 40266-40281 (2010).
- Funke, A. D., et al. The P56S mutation in the VAPB gene is not due to a single founder: the first European case. Clin Genet. 77 (3), 302-303 (2010).
- Millecamps, S., et al. SOD1,ANG,VAPB,TARDBP, and FUS mutations in familial amyotrophic lateral sclerosis: genotype-phenotype correlations. J Med. Genet. 47 (8), 554-560 (2010).
- Landers, J. E., et al. New VAPB deletion variant and exclusion of VAPB mutations in familial ALS. Neurology. 70 (14), 1179-1185 (2008).
- Van Blitterswijk, M., et al. VAPB and C9orf72 mutations in 1 familial amyotrophic lateral sclerosis patient. Neurobiol Aging. 33 (12), 2951-2954 (2012).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Budnik, V., et al. Regulation of synapse structure and function by the Drosophila tumor suppressor gene dlg. Neuron. 17 (4), 627-640 (1996).
- Sanhueza, M., Zechini, L., Gillespie, T., Pennetta, G. Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles. Biol Open. 3 (1), 59-71 (2014).
- Worman, H. J., Ostlund, C., Wang, Y. Diseases of the nuclear envelope. Cold Spring Harb Perspect Biol. 2 (2), a000760 (2010).
- Liu, G. H., et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature. 491 (7425), 603-607 (2012).
- Pennetta, G., Hiesinger, P. R., Fabian-Fine, R., Meinertzhagen, I. A., Bellen, H. J. Drosophila VAP-33A directs bouton formation at neuromuscular junctions in a dosage-dependent manner. Neuron. 35 (2), 291-306 (2002).
- Fisher, P. A., Berrios, M., Blobel, G. Isolation and characterization of a proteinaceous subnuclear fraction composed of nuclear matrix, peripheral lamina, and nuclear pore complexes from embryos of Drosophila melanogaster. J Cell Biol. 92 (3), 674-686 (1982).
- Smith, D. E., Fisher, P. A. Identification, developmental regulation, and response to heat shock of two antigenically related forms of a major nuclear envelope protein in Drosophila embryos: application of an improved method for affinity purification of antibodies using polypeptides immobilized on nitrocellulose blots. J Cell Biol. 99 (1), 20-28 (1984).
- Smith, D. E., Gruenbaum, Y., Berrios, M., Fisher, P. A. Biosynthesis and interconversion of Drosophila nuclear lamin isoforms during normal growth and in response to heat shock. J Cell Biol. 105 (2), 771-790 (1987).
- Puckelwartz, M. J., et al. Disruption of nesprin-1 produces an Emery Dreifuss muscular dystrophy-like phenotype in mice. Hum Mol Genet. 18 (4), 607-620 (2009).
- Tsujikawa, M., Omori, Y., Biyanwila, J., Malicki, J. Mechanism of positioning the cell nucleus in vertebrate photoreceptors. Proc Natl Acad Sci USA. 104 (37), 14819-14824 (2007).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nat Rev Mol Cell Biol. 11 (12), 872-884 (2010).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon