Method Article
Por Quantificação Matérias: Caracterização de fenótipos na
Neste Artigo
Resumo
Morphology, size and location of intracellular organelles are evolutionarily conserved and appear to directly affect their function. Understanding the molecular mechanisms underlying these processes has become an important goal of modern biology. Here we show how these studies can be facilitated by the application of quantitative techniques.
Resumo
A maioria dos estudos sobre a morfogénese dependem de descrições de como qualitativas características anatómica são afectadas pela interrupção de genes específicos e vias genéticas. descrições quantitativas raramente são executadas, embora manipulações genéticas produzem uma gama de efeitos fenotípicos e as variações são observadas mesmo entre indivíduos dentro de grupos de controle. Emergentes evidência mostra que a morfologia, tamanho e localização das organelas desempenhar um papel anteriormente subestimado, mas fundamental na função celular e sobrevivência. Aqui nós fornecemos instruções passo-a-passo para a realização de análises quantitativas de fenótipos na junção neuromuscular larval Drosophila (MNJ). Usamos vários marcadores imuno-histoquímica confiáveis combinadas com técnicas de bio-imagem e análises morfométricas para examinar os efeitos de mutações genéticas em processos celulares específicos. Em particular, vamos nos concentrar na análise quantitativa dos fenótipos afetando morfologia, tamanho e posição de nuclei dentro dos músculos estriados de larvas de Drosophila. A Drosophila larval JNM é um modelo experimental útil para investigar os mecanismos moleculares subjacentes a estrutura e a função do sistema neuromuscular, tanto na saúde e na doença. No entanto, as metodologias aqui descritos pode ser alargado a outros sistemas bem.
Introdução
Qualitative analysis restricts the focus of most experimental studies to the examination of genetic manipulations leading to large phenotypic effects or to phenotypes that are not amenable to quantification, e.g., absence/presence. Quantification of phenotypes is not usually performed and variations present within members of a phenotypic group are not taken into consideration. Additionally, without mathematical descriptions of morphologies, it may be difficult to determine whether fine scale phenotypic changes are the result of genetically induced alterations or whether observed changes are simply due to random fluctuations.
We propose that for an accurate and unbiased analysis of phenotypic defects due to gene disruption, quantitative methodologies should accompany more traditional qualitative approaches. Quantitative evaluation of phenotypes is particularly beneficial for structures such as synapses that present a high degree of variability due to their intrinsic morphological and functional plasticity. We have selected examples of quantitative analyses applied to areas of investigation with which we are most familiar, namely the Drosophila larval neuromuscular junctions (NMJs). However, concepts and principles apply equally well to other experimental systems.
The larval NMJ is an excellent model system to study synaptic development and function because of the highly stereotyped nature of its structure. Each hemi-segment of the larval neuromuscular system contains 32 identifiable motor neurons forming synaptic contacts with their postsynaptic target muscle. Every hemi-segment also contains a fixed number of muscles visible as multinucleated fibers attached to the internal surface of the cuticle1. Another advantage of using the larval neuromuscular system is the power and versatility of Drosophila genetics that easily allows the generation of a number of mutant alleles and the possibility to modify gene expression in a time- and tissue-restricted manner. Finally, 75% of the human genes causing a disease have an evolutionarily conserved orthologue in Drosophila2. Indeed, entire genetic pathways are conserved between flies and humans. Because of this, the Drosophila larval neuromuscular system is a very popular experimental model to elucidate the molecular mechanisms underlying a number of human diseases including amyotrophic lateral sclerosis (ALS)1.
Here we show that the availability of several reliable immuno-histochemical markers, combined with bio-imaging techniques and accurate morphometric analyses can describe anatomical traits that are likely to play an important functional role3,4,5. Among the cellular processes that are amenable to quantitative analyses, we focus on changes in shape, size and position of intracellular structures such as the nuclei. All these are processes that we know very little about.
The challenge for molecular geneticists in the coming decades will be to extend our current knowledge by analyzing the effect of genetic mutations that produce very subtle phenotypic defects. Quantitative methodologies that allow researchers to meticulously explore the effects of genetic mutations can provide a more comprehensive understanding of how genotypes relate to phenotypes, especially for poorly understood cellular processes.
Protocolo
1. Preparação Experimental
Nota: As dissecções e procedimentos imuno-histoquímica nas seções 2 e 3 são executadas de acordo com as referências de 3-6, mas com modificações.
- Preparar solução salina tamponada 1x com fosfato (PBS) e PBS contendo 0,1% de Triton X-100 (PBT). Mantenha-os no gelo.
- Prepare fixador de Bouin (ácido pícrico 15: 10 Formaldeído: 1 Ácido acético glacial). Faça este reagente fresco.
- Selecione aço inoxidável limpo pinos minutien e uma pinça fina.
- Preparar as placas de dissecação contendo um disco Sylgard em 5 cm de placa de Petri.
2. Dissecção do terceiro instar larval NMJs
- Escolher-errante larvas de terceiro instar a partir de um frasco ou uma garrafa com um pincel fino e colocá-los em um prato de 2 centímetros de Petri contendo 4 ° C de PBS para lavar a comida residual de distância.
- Coloque uma larva no topo da superfície Sylgard da placa de dissecação e certifique-se de que é positioned com o lado dorsal para cima de modo que os dois tubos traqueais longitudinais são visíveis na parte superior.
- Usando a pinça para segurar o pino, o pino da larva para baixo em sua extremidade anterior, bem debaixo do gancho boca. Estique a larva para fora tanto quanto possível e fixar sua extremidade posterior para baixo.
- Adicionar o suficiente solução salina PBS para atingir as paredes do prato e mergulhe completamente a larva.
- Repetir o procedimento dos passos 2.1 a 2.3 para outras larvas do mesmo genótipo. Um único cinco centímetros Petri placa de dissecação prato pode facilmente acomodar até 8 larvas.
- Usando a tesoura de micro-dissecção, levantar ligeiramente a cutícula dorsal e fazer uma pequena incisão horizontal na extremidade posterior perto do pino.
- Inserir uma tesoura na incisão, a larva cortar todo o caminho até à extremidade anterior ao longo da linha média entre as duas extensões longitudinais da traqueia. Certifique-se de que os cortes de linha média são superficiais suficiente apenas para passar através da cutícula e para evitar o corte através dos músculos sobreo lado ventral.
- Em cada extremidade, dois entalhes cortados em ambos os lados esquerdo e direito.
- Abra o filete, colocando dois pinos de ambos os lados da incisão anterior. Repetir o mesmo com a extremidade posterior. Ao colocar os pinos, certifique-se de espalhar a parede do corpo distante.
- Limpar os órgãos internos utilizando fórceps e PBS solução salina. Deixar o sistema nervoso central intacto. Delicadamente esticar a larva com canto pinos até que esteja completamente esticada, mas certifique-se de que os músculos não são arrancados durante este processo.
- Repetir o mesmo procedimento de dissecção para o outro larvas na mesma placa de dissecação.
- Lavar com solução salina PBS três vezes para remover todos os órgãos internos.
- Substituir o PBS com fixador de Bouin e deixar à temperatura ambiente durante 10 min.
- Lava-se várias vezes com PBT.
- Remova os pinos com cuidado e transferir todos os preparativos, que agora são bastante rígida, para um tubo de 1,5 ml micro-centrífuga para imuno-coloração.
Coloração 3. Imuno-histoquímica da Drosophila NMJs com anticorpos específicos para os músculos e mionúcleos
- enxaguar rapidamente os filetes de larvas em PBT.
- Bloquear as preparações por incubação com soro normal de cabra a 10% (NGS) em PBT durante 2 h sob agitação constante.
- Incubar de um conjunto de NMJs dissecados em PBT contendo 5% de NGS e um anticorpo de coelho anti-lamina (a uma concentração de 1: 500) e com um anticorpo anti-DVAP cobaia (a uma concentração de 1: 500) durante 2 h à temperatura ambiente ou a 4 ° C durante a noite. O anticorpo anti-DVAP cora os músculos estriados enquanto a coloração anti-lamina detecta o contorno da mionúcleos.
- Lavar uma vez rapidamente em PBT para remover os anticorpos em excesso. Lavar em PBT durante 2 h, alterando o tampão PBT a cada 15 min.
- Incubar as amostras em PBT contendo 5% de NGS e anticorpos secundários fluorescentes-rotulados a diluição 1: 500 durante 2 horas à temperatura ambiente. As mesmas amostras Cum ser submetidos a coloração com múltiplos anticorpos ao mesmo tempo, se forem utilizados anticorpos secundários conjugados com diferentes cromóforos.
- Remover e lavar anticorpos secundários em PBT durante 2 h, alterando o tampão PBT a cada 15 min.
- Para manchar o interior dos mionúcleos lavar as amostras três vezes com PBS e proceder como segue:
- Adicionar o marcador nuclear para-PRO-3 numa diluição de 1: 1000 em PBS e incubar durante 20 min, sob agitação constante. Este marcador é usado neste estudo, mas qualquer outro marcador nuclear disponível comercialmente podem ser usados também.
- Lave depressa três vezes em PBS antes da montagem.
4. As amostras de montagem nos slides
- Escolher as amostras com uma pinça do tubo de 1,5 ml micro-centrífuga e se deitam sobre uma lâmina de processamento.
- Usando uma tesoura micro-dissecação, cortar a cabeça ea cauda dos filetes e manter a sua superfície se interna.
- Prepare the montagem deslizante por envolvimento em torno de três tiras de fita adesiva de celulose de cada lado de uma lâmina limpa a uma distância de cerca de 1 cm um do outro. Uma vez que a lamela é colocada no topo das duas tiras, uma abertura que vai ser gerado vai evitar achatamento das amostras. Isto é crucial se representações tridimensionais volume de estruturas estão a ser feitas.
- Colocar uma pequena gota de cerca de 20 ul do meio de montagem no meio da corrediça de montagem entre as três tiras de fita de celulose.
- Depois de espalhar o meio de montagem com uma pinça limpa, arrastar as larvas dissecadas para o slide de montagem no meio de montagem, mantendo a superfície up interno. Tentar montá-los em fileiras de quatro ou cinco.
- Gentilmente soltar uma lamela em cima da lâmina de montagem e se certificar de que não há bolhas de ar são geradas. Selar o slide com esmalte de unha transparente. Deixe as amostras secas durante pelo menos 10 min antes de imagem.
5. Configurações confocal for Imaging
Nota: As imagens apresentadas neste estudo são tomadas usando uma unidade confocal Nikon A1R integrado em um Ti: microscópio E invertido. No entanto, qualquer microscópio confocal com um mínimo de três unidades de laser disponíveis nas regiões de comprimento de onda de 488 nm, 561 nm e 642 nm e um sistema de detecção de canal 3 é adequado para esta finalidade.
- Ligue o lasers, unidade detector, bulbo de mercúrio, controlador de fase, microscópio e do PC. Inicie o software de controle e garantir o slide no suporte do palco.
- Para tornar a imagem mais rápida, selecionar e marcar todas as regiões de interesse (ROI) sobre a amostra usando um objetivo 20X.
- Cuidadosamente balançar o revólver ao 60X maior ampliação lente objetiva (60X Plano de Apo VC / NA 1,4 OIL).
- Coloque uma gota de óleo de imersão na lente objetiva e selecione uma das ROI marcada a partir da janela panorâmica XYZ no computador.
- Comece imaging usando as seguintes configurações ópticas: Selecione a primeira Dichroic Mirror: 405/488/561/640. Selecione 488 nm laser com filtro de emissão 525/50 nm no canal 1, 561 a laser nm com filtro de emissão 595/50 no canal 2 e laser de 642 nm com filtro passa-tempo 650 nm no canal 3.
- Use as seguintes configurações de digitalização antes de iniciar a aquisição da imagem: Escolha do scanner Galvano; direcção de varrimento: de uma forma; Velocidade de digitalização: 0,5 quadros por segundo.
- Selecione série de canais para evitar canal de sangria-through.
- Ajuste o tamanho pin-hole a 1 unidade arejado. Digitalizar e ajustar a potência do laser, ganho de detecção e compensados de forma adequada para cada canal para evitar a saturação de pixels e nível de fundo.
- Adquirir z-stacks usando tamanho voxel de 0,2 x 0,2 x 0,5 m 3 para todas as ROIs e os preparativos de slides. Se as imagens serão submetidas a deconvolução, em seguida, definir o tamanho do voxel a 0,06 x 0,06 x 0,15 mm 3.
- Salvar imagens no formato formato de arquivo ou .ics .nd2.
6. Cálculo da distância entre núcleos dentro Striated60; Músculos pelo método da Análise Nearest Neighbor
- Para esta análise, usar imagens confocal exibindo os músculos do corpo de parede larvais coradas com anticorpos DVAP para visualizar os músculos e com anticorpos de lamina e um marcador nuclear para destacar os núcleos.
- Para estimar a distância mais próxima entre os núcleos, utilizar pontos de medição no interior do módulo de MeasurementPro o software de análise de imagem (por exemplo, Imaris). Outras aplicações de software para análise de imagem semelhantes podem ser utilizados para os mesmos fins.
- Abra as imagens confocal. Para iniciar, clique duas vezes no ícone do software. Arrastar e soltar as imagens z-stack confocal para a Arena.
- Dê um duplo clique nas imagens para abri-los automaticamente na Vista Ultrapasse, sob o ícone da barra de ferramentas do menu
 . O Ultrapasse View tem três painéis principais da área de trabalho: Ver área objeto de lista e propriedades do objeto Área.
. O Ultrapasse View tem três painéis principais da área de trabalho: Ver área objeto de lista e propriedades do objeto Área. - Criar um volume rendeu timagem do canal rês, clicando no ícone do menu View 3D
 .
. - Clique no ícone Pontos Adicionar nova medição
 de Objetos barra de ferramentas e siga o assistente de criação que aparece no objeto Propriedades de área.
de Objetos barra de ferramentas e siga o assistente de criação que aparece no objeto Propriedades de área. - A partir do assistente de criação de selecionar a guia Editar em primeiro lugar e, em seguida, Canal específico. Selecione o marcador nuclear ou o canal lamina para destacar os núcleos.
- Definir o ponteiro para o modo Select pressionando a aba Esc no teclado.
- Ajuste o tamanho da caixa cursor do 3D com a roda do mouse para conter um determinado núcleo na imagem. Adicionar um ponto de medição, segurando a tecla Shift e clique no botão esquerdo do mouse sobre o mesmo núcleo.
- Adicionar o segundo ponto sobre um núcleo na proximidade, no mesmo músculo através da repetição dos passos anteriores. Uma linha é automaticamente desenhada entre os dois pontos e a distância medida entre os dois núcleos é apresentada. A distância entre os dois núcleos são agora registadas como uma variável estatística no objecto Propriedades de área sob a aba Estatísticas> dados detalhada> Distância.
- Repita o procedimento a partir das etapas 6.6 a 6.10 para todos os núcleos em torno de um determinado núcleo.
- De Estatísticas> dados detalhada> Distância exibindo todos os pontos de medição recolhidos, selecione a distância mais curta.
- Ao clicar sobre as estatísticas de exportação na guia Exibir para Arquivo
 disponíveis em Objeto Propriedades Area, os dados serão salvos em uma planilha.
disponíveis em Objeto Propriedades Area, os dados serão salvos em uma planilha. - Repetir o mesmo procedimento para os outros núcleos circundantes e para um número seleccionado de fibras musculares por genótipo.
- Usando os dados exportados para um arquivo de planilha, calcular a menor distância média (D ave) para todo o número M de músculos usando a seguinte equação:
oad / 53821 / 53821eq1.jpg "/>
Di é a distância mais curta ao núcleo vizinhos para um dado núcleo i onde i varia de 0 a N e N é o número de núcleos analisados por muscular. A soma dos valores de j = 0 para j = m indica o número M de músculos analisados. - Como alternativa, use Spots assistente de criação e pontos para pontos Menor distância para estimar a distância média para o núcleo vizinha mais próxima. Para isso, é necessário um módulo de extensão de Matlab.
- Clique duas vezes em uma imagem específica na imagem de um volume 3D Arena e será exibido na área de exibição. Clique no ícone de criação de objeto e adicionar novos Spots
 a partir da barra de ferramentas Objetos.
a partir da barra de ferramentas Objetos. - A partir do assistente de criação do objeto Propriedades de área, clique na opção de ignorar a criação automática, editar manualmente.
- Selecione a lamina ou canal marcador nuclear para exibir os núcleos.
- Shift e clique lefbotão do rato t em todos os núcleos de um músculo específico na imagem. Um ponto em cada núcleo irá aparecer.
- Selecione pontos para Spots distância mais próxima listados sob a guia Ferramentas no objecto Propriedades de área. Seleccione Spots Estatísticas sob o modo de resultado e uma janela Matlab aparece.
- Sob a guia Estatísticas, selecione Valores detalhadas e depois específicas. Clique na Distmin e os valores das distâncias mínimas para cada núcleo irá aparecer.
- Exportar os dados para um arquivo de planilha e calcular a média destas distâncias por músculo. Repita o procedimento para todos os músculos de um determinado genótipo.
- Clique duas vezes em uma imagem específica na imagem de um volume 3D Arena e será exibido na área de exibição. Clique no ícone de criação de objeto e adicionar novos Spots
7. determinar a forma de núcleos dentro dos músculos do corpo na parede de Drosophila larvas
- Para esta análise, usar imagens confocal de músculos do corpo de parede corados com lamina e um marcador nuclear para visualizar os núcleos.
- Para avaliar a forma de mionúcleos, medida esfericidade (definido como a razão entre o surárea de face de uma esfera com o mesmo volume que o núcleo dada, para a área de superfície do núcleo) ou elipticidade (distingue entre elipsóides achatados prolate / e esferóides).
- Abra a imagem tal como anteriormente descrito. Clique no ícone da barra de ferramentas Objetos Adicionar novas superfícies
 .
. - No assistente de criação que aparece no objeto Propriedades de área, selecione a coloração marcador nuclear como o canal de origem para exibir os núcleos.
- Definir a intensidade absoluta opção como o limiar. Certifique-se de que a maioria dos núcleos mostram um processamento suave e não sobrecarregado, alterando o valor da curva limite. Ao mesmo tempo, evitar a presença de orifícios ou máscara incompleto de qualquer núcleo utilizando a mesma curva.
- Use o ferramenta de filtro para excluir qualquer ruído na prestação superfície. Sob a guia Editar da camada superficial recém-criado, dividir ou mesclar as superfícies de núcleos que são incorretamente rendered.
- Exportar para uma folha de cálculo arquive os valores ellipticidade e esfericidade dos núcleos rendido superfície que estão disponíveis na guia Estatísticas.
- Em alternativa, usar o software ImageJ ou Fiji para medir a circularidade de núcleos onde a circularidade (C) é definido como C
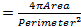 . Um valor de um representa um círculo perfeito, enquanto um valor próximo de zero indica uma forma cada vez mais alongado.
. Um valor de um representa um círculo perfeito, enquanto um valor próximo de zero indica uma forma cada vez mais alongado. - Crie projeções de intensidade máxima das pilhas z a partir do menu Imagem> Pilhas> Z Project. Defina o tipo de projeção para Max Intensidade.
- Dividir os canais e selecione o canal marcador nuclear.
- A partir do menu principal, selecione Image> Adjust> Threshold.
- Segmento os núcleos, ajustando a intensidade limiar. Se os núcleos próximas são segmentados como uma única unidade, clique em Processo> binário> ferramenta de Bacias Hidrográficas para desligar os núcleos.
- No menu principal, selecione Editar> Seleição> Criar seleção.
- Adicione todos os ROIs selecionadas para o Gerenciador de ROI, clicando no menu Analisar> Ferramentas> ROI Manager. Na janela Gerenciador de ROI, clique em Adicionar. Dentro da mesma janela, selecione Mais> Split.
- Selecione descritores de forma em Analisar> Definir Medidas. Na janela Gerenciador de ROI, clique na guia A medida. Isto irá mostrar uma lista de valores de circularidade de todos os núcleos selecionados.
- Além disso, para medir o volume nuclear, siga assistente de criação de superfície usando o canal de coloração marcador nuclear, conforme descrito nas subseções 7,3-7,7.
8. 3D Renderings Desconto de núcleos selecionados dentro os músculos do corpo de parede Drosophila larval para avaliar a Intranuclear localização de uma proteína específica
- Use imagens confocal de relatórios músculos da parede do corpo manchadas com um marcador nuclear e com anticorpos específicos para lamina e DVAP.
- Abra as imagens, iniciando o software e select o núcleo específico a ser analisado. Isso pode ser feito selecionando o principal item de menu Editar> Cortar 3D.
- Siga assistente de criação de superfície usando o canal lamina como descrito na subseção 7,3-7,7.
- Uma vez que a superfície é criada, clique em Editar no Objetos Propriedades de área do e selecione Máscara Tudo para isolar o sinal dentro do núcleo. Isso cria uma nova janela.
- Escolha um sinal DVAP a partir do menu drop-down Selecionar Channel. Seleccione o sinal de imuno-reactividade DVAP dentro do núcleo, clicando sobre a opção SET Voxels Outside The Surface to zero. Um novo canal de máscaras é criado e está disponível na janela de ajuste de exibição para selecção.
- Para visualizar a presença do sinal dentro do núcleo criar um plano de contorno clicando no ícone Adicionar novo plano de recorte
 a partir da barra de ferramentas Objetos.
a partir da barra de ferramentas Objetos. - Interativamente ajustar o ângulo do recorteavião e a sua posição para visualizar a distribuição do sinal dentro do núcleo.
Resultados
A ELA é uma doença degenerativa que afecta especificamente os neurónios motores que conduzem a uma paralisia progressiva e fatal dos músculos estriados 7. Mutações na humanos associados-VAMP Proteína B (hVAPB) causam uma série de doenças do neurônio motor, incluindo ALS tipo 8 8-12. Uma mutação sem sentido (V234I) no gene hVAPB foi recentemente identificada num dos casos de ALS típicas em seres humanos 13. Para avaliar o seu potencial patogênico, geramos moscas transgénicas que expressam o hVAPB Drosophila orthologue DVAP portador da mutação causadora da doença (DVAP-V260I). A expressão deste transgene foi alvejado para os músculos, utilizando o sistema UAS / GAL4 e específico do músculo condutor BG57-Gal4 14,15. O efeito da expressão transgénica DVAP-V260I foi comparado e contrastado com a de dois outros transgenes (DVAP para WT1 e WT2-DVAP), que expressam diferentes níveis da proteína de tipo selvagem DVAP 16. More especificamente, o aumento na imunorreactividade DVAP é 2,2 vezes maior do que nos controles para a linha DVAP-WT2 enquanto os níveis de DVAP-V260I e DVAP-WT1 exposição comparáveis e inferior do mesmo sinal 16.
Alterações nucleares têm sido associados com o envelhecimento e várias doenças neurodegenerativas, incluindo a doença de Parkinson 17,18. Para avaliar se o nosso modelo mosca para ELA8 exibe mudanças na arquitetura nuclear, posição e tamanho, nós manchado núcleos dentro de músculos estriados de genótipos apropriados com um marcador nuclear e o anticorpo anti-lamin 19-22, que visualiza o envelope nuclear. Para realçar os músculos, um anticorpo específico para o DVAP também foi adicionado às mesmas amostras (Figura 1). imagens confocais foram recolhidas e análises detalhadas morfométricas foram realizadas utilizando um software de análise de imagem. Em músculos de controle, os núcleos foram encontrados para ser distribuídos uniformemente ao longo do músculofibras enquanto em DVAP-V260I e DVAP-WT expressando músculos, núcleos exibem uma tendência para redistribuir em grupos estreitamente associado (Figura 1).
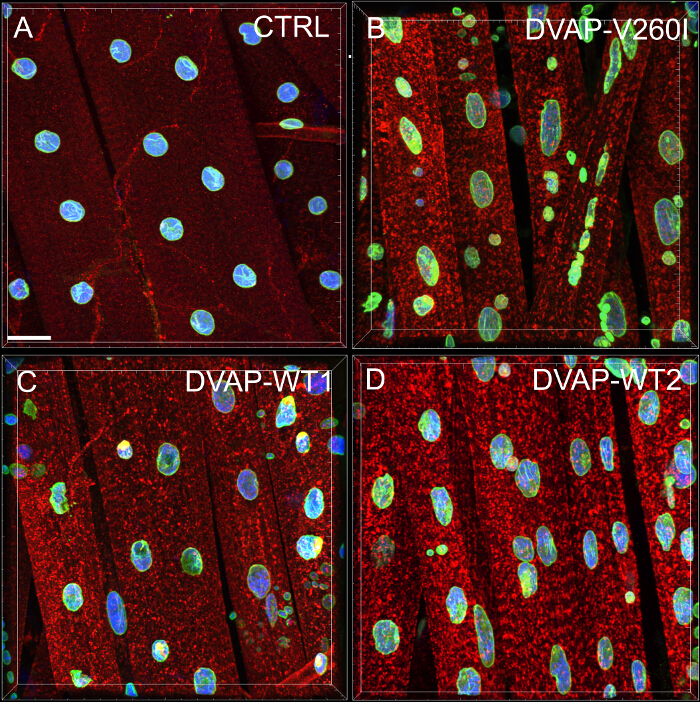
Foi realizada uma análise do vizinho mais próximo para executar uma avaliação quantitativa da distribuição de núcleos ao longo das fibras musculares de cada genótipo. Uma análise do vizinho mais próximo primeiro identifica o vizinho mais próximo para cada núcleo através da medição da distância entre o centro de um determinado núcleo e o centro de todos os outros núcleos circundante. Este procedimento é então repetido para todos os outros núcleos ao longo da fibra muscular. Finalmente, a menor distância entre núcleos dentro de um músculo específico, é calculado pela média das distâncias mais curtas de cada núcleo e seus vizinhos mais próximos. (Figura 2A - C). Comparado com os controlos, os músculos que expressam quer o transgene DVAP-V260I ou qualquer dos transgenes que sobre-expressam a proteína do tipo selvagem, Apresentar uma redução dramática na menor distância média entre os núcleos e, em consequência, os núcleos parecem estar intimamente associada em aglomerados. O efeito do alelo de ALS causando DVAP-V260I é mais grave do que a associada com a sobre-expressão da proteína do tipo selvagem, mesmo a mais forte transgene DVAP-WT2 é usado (Figura 1 e Figura 2D).
A sobre-expressão de ambos os DVAP-V260I ou DVAP-WT transgenes também exibe uma deterioração grave da arquitectura nuclear resultando em núcleos deformados com uma estrutura alongada (Figura 1). Esta aberração estrutural foi quantificada utilizando o software ImageJ na qual circularidade é definido pela fórmula C  , Que medem a relação largura comprimento de cada núcleo com C = 1 representa um círculo perfeito e C = 0 um polígono infinitamente alongado. em contrnúcleos ol exibindo uma forma redonda distinta, C é igual a 1, enquanto nos mutantes transgénicas uma mudança na forma com a consequente perda de circularidade, faz com que um desvio significativo do valor presente (Figura 1 e Figura 3).
, Que medem a relação largura comprimento de cada núcleo com C = 1 representa um círculo perfeito e C = 0 um polígono infinitamente alongado. em contrnúcleos ol exibindo uma forma redonda distinta, C é igual a 1, enquanto nos mutantes transgénicas uma mudança na forma com a consequente perda de circularidade, faz com que um desvio significativo do valor presente (Figura 1 e Figura 3).
Descobrimos também que nos músculos que expressam os mesmos transgenes, os núcleos exibir um volume nuclear alargada marcado em comparação com os controlos, embora o alelo causador ALS parece ser mais eficiente na indução este fenótipo em comparação com os transgenes DVAP-WT (Figura 4).
Quase todas as doenças neurodegenerativas são caracterizadas pela acumulação intracelular de agregados que contêm a proteína patogénica. Fizemos reconstruções 3D e representações de volume de núcleos e verificou-se que nos músculos que expressam o transgene mutante ou sobre-expressam a proteína do tipo selvagem, DVAP imuno-reactividade de aglomerados formadosnd que alguns deles também foram localizadas no núcleo (Figura 5). Por outro lado, em NMJs controlo, DVAP imuno-reactividade é fracamente disperso ao longo da fibra muscular e está excluído do núcleo 16.
. Figura 1: imagens confocal de mionúcleos dentro de músculos estriados que expressam tanto o os transgenes DVAP-260I DVAP-WT ou (A) BG57-Gal4 / + controle, (B) BG57; DVAP-V260I, (C) BG57; DVAP-WT1 e (D); BG57 músculos DVAP-WT2 que expressam os transgenes indicados são coradas com anticorpos específicos para DVAP (sinal vermelho), lamina (sinal verde) e com um marcador específico nuclear para visualizar os núcleos de sinal (azul). Barra de escala = 30 mm Por favor clique aqui para ver umaversão maior desta figura.
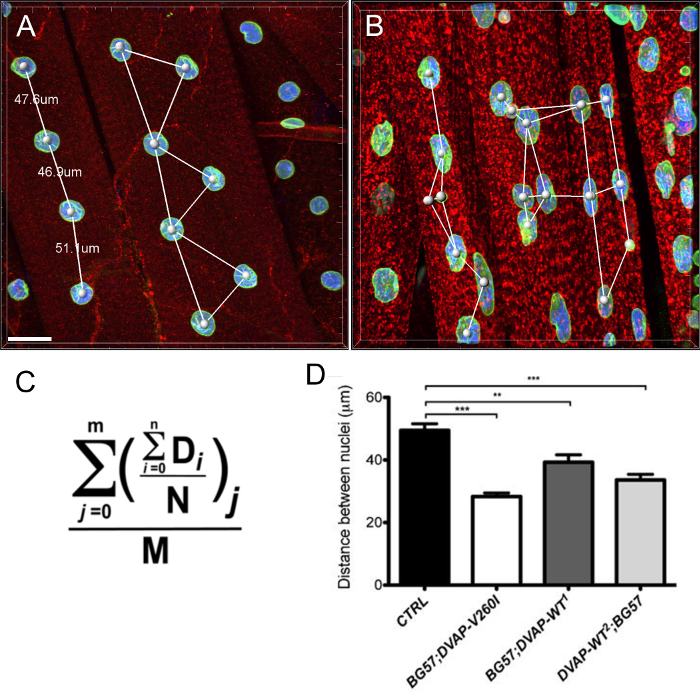
Figura 2: Análise Vizinho mais próximo para determinar a distância média entre um núcleo e seu único vizinho mais próximo (B) Os resultados representativos mostrando o posicionamento nuclear alterada nos músculos sobre-expressam o transgene DVAP-WT2 quando comparados aos controles em (A).. Nuclear distância média nos músculos dos genótipos indicados foi estimada utilizando a fórmula em (C) e os resultados são referidos em (D). NMJs larvais estão manchadas com anticorpos específicos para DVAP (sinal vermelho), Lamin (verde) e com um marcador nuclear (sinal azul). Os asteriscos indicam significância estatística. *** P <0,001, ** P <0,01. Para a análise estatística deste experimento e foi usado todas as experiências relatadas a seguir um teste ANOVA one-way e multip de Tukeyteste de comparação le foi aplicado como um teste post-hoc quando as diferenças entre os genótipos foram encontrados para ser significativa pelo teste ANOVA. As barras de erro representam SEM. Barra de escala = 30 mm Por favor clique aqui para ver uma versão maior desta figura.
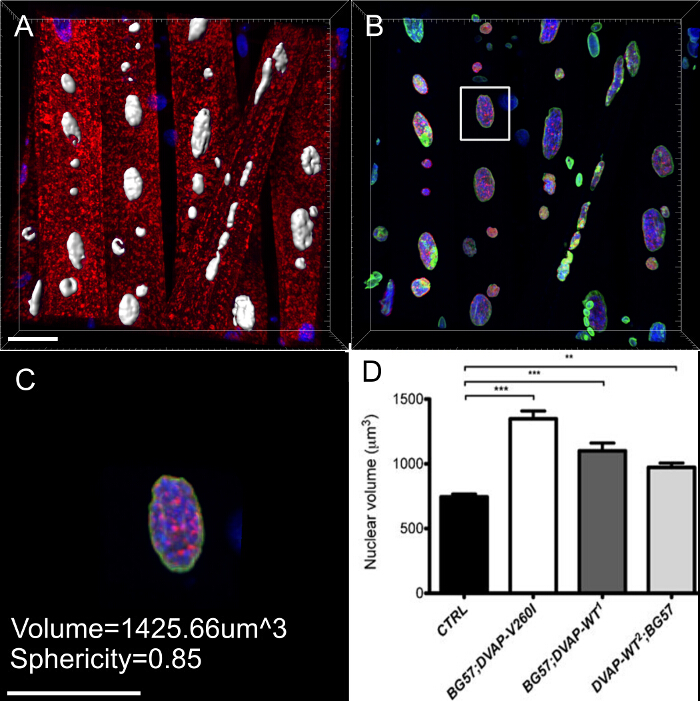
Figura 3:. Imagens que mostram os passos representativos no cálculo do volume nuclear (A) A imagem representativa mostrando núcleos segmentados usando o assistente de criação de superfície. Núcleos na fronteira das imagens foram ignorados. (B) Imagem que mostra o sinal DVAP nuclear após a coloração DVAP circundante foi mascarado usando a superfície criada no canal marcador nuclear. (C) da camada de superfície fornece informações de parâmetros adicionaisincluindo o volume nuclear e a esfericidade. (D) Os dados sobre o volume nuclear de vários genótipos. Os asteriscos indicam significância estatística. NMJs dissecados foram coradas com anticorpos anti-DVAP (sinal vermelho), anticorpos anti-laminas (de sinal verde) e um marcador nuclear (sinal azul). *** P <0,001, ** P <0,01. As barras de erro representam SEM. Barra de escala = 30 mm Por favor clique aqui para ver uma versão maior desta figura.
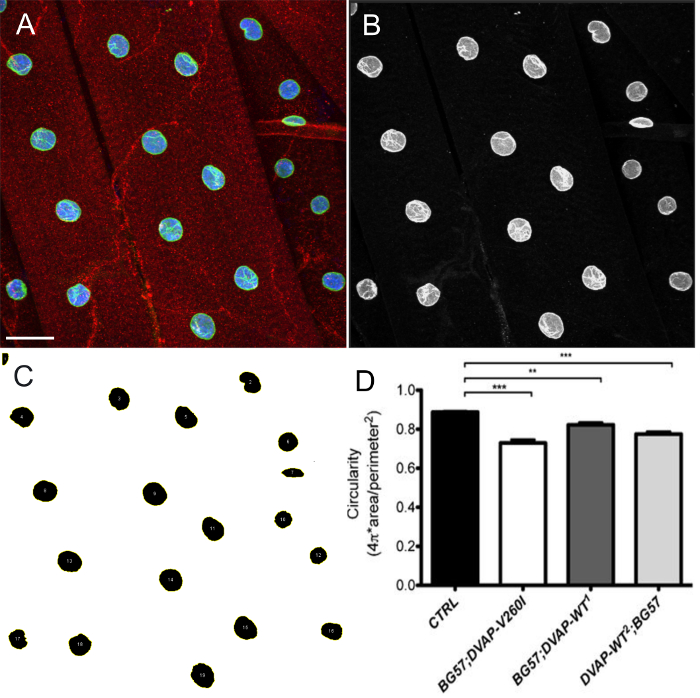
Figura 4: Imagens mostrando passos representativos na estimativa da forma nuclear por ImageJ. Máxima projecção de intensidade das imagens foram analisadas utilizando o ImageJ para estimar a circularidade de núcleos dentro de músculos. (A) Um exemplo representativo da intensidade de projecçãoda imagem de três canais como no passo 7.9 do protocolo. (B) Imagem que mostra o passo 7.10 do protocolo em que os canais são divididos e o canal marcador nuclear é selecionado. (C) A imagem representativa mostrando que após a aplicação de limiar de intensidade para o segmento de núcleos e gerente de ROI plugin no ImageJ, todos os núcleos de interesse pode ser selecionado e sua forma medido através descritores de forma (passos 7,11-7,15). (D) Quantificação da circularidade dos diferentes genótipos. Sobre o NMJs larvais, o sinal vermelho indica coloração DVAP enquanto o verde descreve núcleos e corresponde à coloração lamina. O interior de cada núcleo é rotulado em azul devido à coloração com um marcador nuclear. Os asteriscos indicam significância estatística. *** P <0,001, ** P <0,01. As barras de erro representam SEM. Barra de escala = 30 mm Por favor, clique delae para ver uma versão maior desta figura.
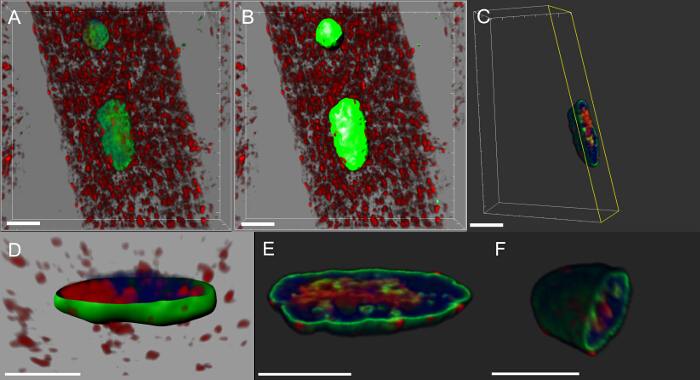
Figura 5: Imagens que mostram os passos específicos na criação de representações de volume de mionúcleos. (A) Imagem que mostra a intensidade 3D misturado vista dos músculos manchadas com proteína DVAP (vermelho), a lamina (verde) e o marcador de DNA (azul). (B) Imagem representativa de uma camada superficial gerado usando o canal de lamina de segmento dos núcleos. (C) imagem que representa um núcleo em que a camada de superfície tenha sido utilizado para mascarar o sinal de fora do núcleo DVAP seleccionado. Em destaque na amarela é um plano de corte que tenha sido adicionada à imagem. Seu ângulo de visão e posição pode ser interativamente ajustada para visualizar a distribuição do sinal dentro do núcleo. (D) Uma imagem relatar uma vista em corte transversal da camada superficial USI nuclear criadong do canal Lamin se fundiu com DVAP desmascarado e sinais de marcadores nucleares. (E e F) renderizações de volume seccionados adicionais do mesmo núcleo. Barra de escala = 10 mm Por favor clique aqui para ver uma versão maior desta figura.
Discussão
No passado, as variações morfológicas dentro e entre grupos experimentais foram raramente tidos em conta. No entanto, a aplicação de métodos quantitativos está agora a tornar-se a norma em estudos comparativos de morfologia e descrição matemática de formas anatómicas são calculados. O uso de análises quantitativas para avaliar os efeitos das manipulações genéticas em processos celulares específicos, uma promessa na melhoria da nossa capacidade de detectar alterações morfológicas e na melhoria da precisão com que essas mudanças são descritos. Além disso, a análise estatística dos dados quantitativos nos permite avaliar se as diferenças observadas entre os fenótipos são significativas.
Em músculos estriados, núcleos exibem uma estrutura arredondada distinto e estão uniformemente distribuídas ao longo da fibra muscular. Embora os mecanismos moleculares criação e manutenção de tamanho, forma e arquitectura de núcleos não são conhecidos, estas características nucleares são susceptíveis tO desempenhar um papel fundamental no controlo da função muscular. Na verdade, várias miopatias são causadas por mutações em genes que regulam a morfologia e posição dos núcleos dentro de músculos. A importância funcional da forma e distribuição dos núcleos dentro de uma célula não se limita aos músculos. As evidências acumuladas mostram que os defeitos nucleares também estão associados com doenças neurodegenerativas tais como a doença de Parkinson 18,24. Além disso, estamos começando a apreciar que a morfologia, tamanho e distribuição intracelular de outras organelas incluindo retículo endoplasmático e mitocôndrias podem ter consequências funcionais. Por exemplo, alterações na morfologia mitocondrial estão associados com doenças neurológicas, tais como tipo 1 atrofia óptica (OPA1) e Charcot-Marie-Tooth tipo 2A neuropatia 25.
Para ajudar no processo de elucidar os mecanismos moleculares subjacentes a estes processos importantes, propomos combinar confocal de alta resoluçãode dados com software de imagem e análises morfométricas para avaliar quantitativamente como manipulações genéticas podem afetar forma, tamanho e localização de núcleos nas fibras musculares. O poder ea versatilidade da genética de Drosophila juntamente com a natureza altamente estereotipados do sistema neuromuscular em larvas de Drosophila fazer a larval MNJ um modelo experimental particularmente adequado para este tipo de análises. Nas NMJs larvais, análise fenotípica pode ser efectuada a uma única resolução sinapse permitindo uma análise morfométrica precisos onde um número de NMJs pode ser estudada dentro do mesmo mosca e mesmo o mesmo JNM identificável pode ser comparada entre moscas de diferentes genótipos de 3,4.
Caracterização fenotípica da posição nuclear, forma e tamanho na Drosophila larval MNJ começa realizando imunocoramento NMJs dissecados com anticorpos que destacam os músculos e núcleos dentro de músculos. No protocolo delineado no this papel, mionúcleos foram coradas com anticorpos policlonais contra a lamina, um marcador do envelope nuclear, com um marcador nuclear destacando os anticorpos interiores e com nucleares específicos para DVAP para manchar todo o músculo. Os anticorpos de lamina utilizados nestas experiências foram gentilmente fornecidas por Paul Fisher 19-22, mas outras fontes de anticorpos anti-lamina pode ser utilizado. Além disso, um certo número de outros anticorpos específicos para o envelope nuclear encontram-se comercialmente disponíveis. Finalmente, os marcadores nucleares, tal como DAPI e iodeto de propídio, também estão disponíveis enquanto os músculos podiam ser visualizados através de coloração com anticorpos anti-actina ou anti-tubulina. Se diferentes dos utilizados neste procedimento experimental anticorpos são empregues, o Protocolo de imunocoloração exigirá extra-etapas em que as condições de fixação e as concentrações de trabalho para os novos anticorpos terão de ser optimizados. Um passo crítico neste protocolo, especialmente quando renderizações de volume precisam ser analisados, é the montagem das amostras no slide. Neste caso, é importante incluir espaçadores entre a corrediça e a lamela de modo a que os espécimes não ser esmagado. Três bandas de fita adesiva de celulose enrolados à volta da corrediça em ambos os lados da lamela representam uma maneira fácil de fazer os espaçadores.
Enquanto ImageJ foi usado para imagens 2D, a maioria da imagem multi-canal em 3D análises apresentadas neste trabalho, foram feitas usando Imaris devido à sua disponibilidade in-house. No entanto, qualquer outro pacote de software comercial semelhante pode ser usado para estas aplicações.
Existem vários open-source (por exemplo, ImageJ, CellProfiler, Vaa3D, Icy, KNIME e outros) e plataformas de software comerciais disponíveis para a análise de imagens confocal. ImageJ 26, o software livre do NIH ou sua versão mais avançada, conhecido como FiJi 27, tem um grande número de filtros de importação, macros e plugins disponíveis para o communi de imagem em todo o mundoty. A maioria desses plugins estão focados em processar a informação em uma maneira fatia fatia-a-passo. Existem também plugins disponíveis para a visualização e análise de imagens 3D multicanal. No entanto, eles muitas vezes são projetados para uma tarefa específica e os usuários podem precisar estender ou adaptar esses plugins às suas próprias necessidades. Por outro lado, as plataformas comerciais como alvo usuários relativamente inexperientes e são muitas vezes focado na facilidade de usar, ampla cobertura de tarefas de processamento de imagem com uma velocidade incrível.
O procedimento experimental juntamente com a análise fenotípica quantitativa descrito neste protocolo, pode ajudar a elucidar os mecanismos moleculares que controlam a morfologia organela e sua distribuição dentro de uma célula. No entanto, esta abordagem tem a limitação óbvia de análise destes processos a um ponto final específico. O processo de controlar a morfologia e a distribuição das organelas é provável que seja muito dinâmico e para variar não apenas entre Ty célula diferentepes, mas também dentro da mesma célula, dependendo do estado de desenvolvimento ou fisiológicos. A continuação da implementação desta análise seria representado por imagem lapso de tempo que permite alterações na morfologia organela ea posição a ser monitorado ao longo do tempo.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We are grateful to Dr. Andrea Chai for her insightful comments on the manuscript. This work was supported by the Wellcome Trust (grant number: Pennetta8920) and by the Motor Neuron Disease Association (grant number: Pennetta6231).
Materiais
| Name | Company | Catalog Number | Comments |
| Micro-Forceps 0.3 mm x 0.25 mm | Fine Science Tools | 11030-12 | |
| Sylgard dissection plates | SIGMA-ALDRICH | 76103 | Mix the pre-weighed elastomer base with curing agent. Poor the mixture into a 5 cm Petri dish. Let cure it at 60 °C for at least 24 hr |
| Stainless/Steel Minutien Pins 0.1 mm diameter | Fine Science Tools | 26002-10 | |
| Microdissection scissors (ultra-fine) | Fine Science Tools | 15200-00 | |
| 1x PBS (Phosphate Buffered Saline). Composition: 3 mM NaH2PO4, 7 mM Na2HPO4, 130 mM NaCl, pH 7 | NaH2PO4 (SIGMA-S8282), Na2HPO4 (SIGMA-S7907), NaCl (SIGMA-S7653) | ||
| Bouin's Solution. Composition: Picric Acid, Formaldehyde, Acetic Acid (15:10:1) | Picric Acid (SIGMA 197378), Formaldehyde (F8775), Acetic Acid (SIGMA-1005706) | ||
| 1x PBT (Phosphate Buffered Saline with Triton). 1x PBS + 0.1% Triton | Triton-X100. SIGMA-T8787 | ||
| Normal Goat Serum | SIGMA | G9023 | |
| Guinea Pig anti-DVAP antibody | Provided by Dr. Giuseppa Pennetta (University of Edinburgh, UK). Use at 1:200 dilution in 5% NGS | ||
| Rabbit anti-HRP (Horseradish peroxidase) | Jackson ImmunoResearch | 123-065-021 | Use at 1:500 dilution in PBT containing 5% NGS |
| Rabbit anti-Lamin antibody | Provided by Dr. Paul Fisher (State Univeristy of New York at Stony Brook). Use at 1:500 dilution in PBT containing 5% NGS | ||
| TO-PRO-3 | Molecular Probes | T3605 | |
| Goat anti-rabbit antibody, Alexa Fluor488, conjugated | Jackson ImmunoResearch | bs-295G-A555-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Goat anti-guinea pig IgG antibody, Cy3, conjugated | Jackson ImmunoResearch | bs-0358G-Cy3-BSS | Use at 1:500 dilution in PBT containing 5% NGS |
| Vectashield mounting medium for fluorescence | Vector laboratories | H-1000 |
Referências
- Collins, C. A., DiAntonio, A. Synaptic development: insights from Drosophila. Curr. Opin. Neurobiol. 17 (1), 35-42 (2007).
- Fortini, M. E., Skupski, M. P., Boguski, M. S., Hariharan, I. K. A survey of human disease gene counterparts in the Drosophila genome. J. Cell Biol. 150 (2), 23-30 (2000).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila larval NMJ dissection. JoVE. (24), (2009).
- Brent, J., Werner, K., McCabe, B. D. Drosophila larval NMJ immunohistochemistry. JoVE. (25), (2009).
- Ramachandran, P., Budnik, V. Immunocytochemical staining of Drosophila larval body-wall muscles. Cold Spring Harb Protoc. (8), (2010).
- Ling, S. C., Polymenidou, M., Cleveland, D. W. Converging mechanisms in ALS and FTD: disrupted RNA and protein homeostasis. Neuron. 79 (3), 416-438 (2013).
- Nishimura, A. L., et al. A mutation in the vesicle-trafficking protein VAPB causes late-onset spinal muscular atrophy and amyotrophic lateral sclerosis. Am J Hum Genet. 75 (5), 822-831 (2004).
- Chen, H. J., et al. Characterization of the properties of a novel mutation in VAPB in familial amyotrophic lateral sclerosis. J Biol Chem. 285 (51), 40266-40281 (2010).
- Funke, A. D., et al. The P56S mutation in the VAPB gene is not due to a single founder: the first European case. Clin Genet. 77 (3), 302-303 (2010).
- Millecamps, S., et al. SOD1,ANG,VAPB,TARDBP, and FUS mutations in familial amyotrophic lateral sclerosis: genotype-phenotype correlations. J Med. Genet. 47 (8), 554-560 (2010).
- Landers, J. E., et al. New VAPB deletion variant and exclusion of VAPB mutations in familial ALS. Neurology. 70 (14), 1179-1185 (2008).
- Van Blitterswijk, M., et al. VAPB and C9orf72 mutations in 1 familial amyotrophic lateral sclerosis patient. Neurobiol Aging. 33 (12), 2951-2954 (2012).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Budnik, V., et al. Regulation of synapse structure and function by the Drosophila tumor suppressor gene dlg. Neuron. 17 (4), 627-640 (1996).
- Sanhueza, M., Zechini, L., Gillespie, T., Pennetta, G. Gain-of-function mutations in the ALS8 causative gene VAPB have detrimental effects on neurons and muscles. Biol Open. 3 (1), 59-71 (2014).
- Worman, H. J., Ostlund, C., Wang, Y. Diseases of the nuclear envelope. Cold Spring Harb Perspect Biol. 2 (2), a000760 (2010).
- Liu, G. H., et al. Progressive degeneration of human neural stem cells caused by pathogenic LRRK2. Nature. 491 (7425), 603-607 (2012).
- Pennetta, G., Hiesinger, P. R., Fabian-Fine, R., Meinertzhagen, I. A., Bellen, H. J. Drosophila VAP-33A directs bouton formation at neuromuscular junctions in a dosage-dependent manner. Neuron. 35 (2), 291-306 (2002).
- Fisher, P. A., Berrios, M., Blobel, G. Isolation and characterization of a proteinaceous subnuclear fraction composed of nuclear matrix, peripheral lamina, and nuclear pore complexes from embryos of Drosophila melanogaster. J Cell Biol. 92 (3), 674-686 (1982).
- Smith, D. E., Fisher, P. A. Identification, developmental regulation, and response to heat shock of two antigenically related forms of a major nuclear envelope protein in Drosophila embryos: application of an improved method for affinity purification of antibodies using polypeptides immobilized on nitrocellulose blots. J Cell Biol. 99 (1), 20-28 (1984).
- Smith, D. E., Gruenbaum, Y., Berrios, M., Fisher, P. A. Biosynthesis and interconversion of Drosophila nuclear lamin isoforms during normal growth and in response to heat shock. J Cell Biol. 105 (2), 771-790 (1987).
- Puckelwartz, M. J., et al. Disruption of nesprin-1 produces an Emery Dreifuss muscular dystrophy-like phenotype in mice. Hum Mol Genet. 18 (4), 607-620 (2009).
- Tsujikawa, M., Omori, Y., Biyanwila, J., Malicki, J. Mechanism of positioning the cell nucleus in vertebrate photoreceptors. Proc Natl Acad Sci USA. 104 (37), 14819-14824 (2007).
- Westermann, B. Mitochondrial fusion and fission in cell life and death. Nat Rev Mol Cell Biol. 11 (12), 872-884 (2010).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados