このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
チトクローム p450 によるニトロソアミンのIn Vitro代謝 Nitrosamide 形成を検出するための一般的な方法
要約
Α-水酸化チトクローム p450 によって発がん性ニトロソアミンが受け入れられる代謝経路突然変異を引き起こす DNA 損傷中間体を生成します。ただし、新しいデータは、nitrosamides への酸化がさらに発生することができますを示します。一般について述べるニトロソアミンのチトクローム p450 代謝体外産 nitrosamides を検出する手法。
要約
N-ニトロソアミンは、チトクローム P450 酸化活性を示すことを必要とする環境発がん物質の老舗グループ。代謝活性化の利用可能なメカニズムを含む DNA アルキル化剤に自発的に分解する α-hydroxynitrosamines の形成。DNA 損傷と結果として得られる突然変異の蓄積は、癌にもつながります。新しい証拠は、α hydroxynitrosamines することができますさらに酸化する nitrosamides に processively シトクロム p450 を示します。Nitrosamides α-hydroxynitrosamines よりも一般的より安定、DNA をアルキレートもすることができますので、nitrosamides は発がんにおける役割を果たす可能性があります。本報告では、ニトロソアミンの体外チトクローム p450 の新陳代謝からの nitrosamide 生産を評価するための一般的なプロトコルについて述べる。このプロトコルは、関連する nitrosamides と体外チトクローム P450 代謝アッセイ検出液体クロマトグラフィー nanospray イオン化・高解像度タンデム質量分析法を用いた合成への一般的なアプローチを採用しています。このメソッドは、例におけるn ′nitrosonornicotine のマイナーな代謝産物としてn ′- nitrosonorcotinine を検出しました。高感度・選択的に正確のための質量計測手法がある.ニトロソアミン チトクローム P450 システムの多種多様なこのメソッドのアプリケーションは、この変換の一般性を決定するのに役立ちます。シトクロム p450 はポリモーフィックし、活動が異なる、ためには、個々 のがんのリスク評価に役立つ可能性が nitrosamide 形成の理解を深める。
概要
N-ニトロソアミンが食事、タバコ製品、および一般的な環境は、発ガン性物質の大規模なクラス人間の体の1に内生的に形成されることも。以上 300 のn-ニトロソ化合物をテストされていると > 90% で、発がん性評価動物モデル2,3。その発がん性を展示するには、これらの化合物はシトクロム p4501,2,3でまずアクティブする必要があります。研究を示していますそれチトクローム p450 は容易に酸化する α-hydroxynitrosamines (図 1)、半減期 ~ 5 で反応性の高い化合物であるニトロソアミン s alkyldiazohydroxides に自発的に分解する前に。後者は、H2O および N2の損失の後アルキレートの DNA することができます。結果として得られる DNA 付加体、修復されていない場合はがん開発1につながる重要な新規または腫瘍のサプレッサー遺伝子の場合、突然変異を起こすことができます。このため、代謝経路の完全に理解を取得する多くの努力が注がれてきました、DNA 付加体のおよび発がん性ニトロソアミンのチトクローム P450 酸化の下流の代謝産物。この知識は、個々 のがんリスク評価4の潜在的なアプリケーションです。
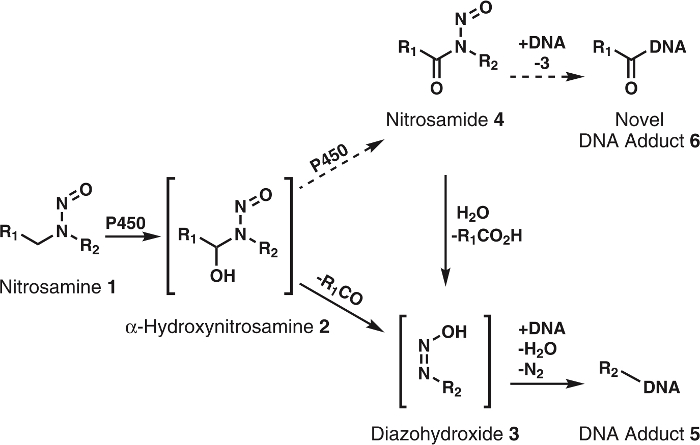
図 1: 一般的なニトロソアミンの提案の代謝。
ニトロソアミン (1) α-hydroxynitrosamines (2) alkyldiazohydroxides (3) に自発的に分解する p450 で酸化します。これらの化合物は DNA 付加体を形成する DNA にバインドできます。それは、仮定されるその2はさらに nitrosamides 4に p450 によって酸化されます。これらは、DNA 付加体または3知られている DNA 付加体を形成するために加水分解を形成する DNA に直接バインドできます。R1 R2は、任意のアルキル基を表します。この図の拡大版を表示するのにはここをクリックしてください。
Α hydroxynitrosamine 仮説は、広範なデータでしっかりとサポートされて、いくつかの矛盾があります。主要な 1 つは α hydroxynitrosamines5,6の半減期が短いです。これらの化合物を小胞体膜で生成される核 DNA を後アルキレートと知られています。数秒の一生を考えると、これらの中間体が生き残る方法必要な旅行しかし細胞質不可解です。1 つの仮説は、α hydroxynitrosamines の一部 processively nitrosamides7、8比較9ではかなり安定である酸化されてことです。これがおそらく、チトクローム P450 活性部位の α hydroxynitrosamines の保持によって発生します。このタイプの酸化のための先例は、ニコチン10、アルコール11、単純な alkylnitrosamines12,13と見られています。さらに、nitrosamides は、直動発ガン性物質2,3です。その反応性9に基づいて、これらの化合物は、DNA を作り出すため付加体の α-hydroxynitrosamines、新から生じるものと同じ、未踏の DNA 付加体の (図 1) を考えられています。したがって、この仮説だけではなく、細胞質を通じてトランスポートをについて説明します、また DNA の形成は、製品を損傷します。
本稿で体外シトクロム P450 を介する変換ニトロソアミンの nitrosamides を評価するための一般的なプロトコルが記載されています。例14 n ′- nitrosonorcotinine (NNC) チトクローム P450 2A6 によってn ′- nitrosonornicotine (NNN) の以前に報告された変換は展示されています。このプロトコルの幅広い基質酵素システムへの応用は、全体的なニトロソアミン代謝における nitrosamides の重要性を判断に役立ちます。
プロトコル
1。 材料と一般的な手順
- 合成 NNN 前述した 15。Norcotinine、P450 2A6 Baculosomes、NADPH 再生システム、0.5 x 反応バッファー、および他のすべての化学物質を取得または試薬グレードの商業ソースから溶剤 。
- 500 MHz 分光器の記録の NMR スペクトル。レポート化学シフトごとの部分として百万 (ppm)。(7.26 ppm CDCl 3) 1 H NMR の内部参照と 13 C NMR (77.2 ppm CDCl 3) として残留溶媒のピークを使用します
。 注: は、次の略語を使用ピーク分裂: s 一重項、d = ダブレット、dd = ダブレット、dt のダブレットを = = dq、三つ子のダブレット四重奏曲、ddd のダブレットを = ダブレットと m のダブレットのダブレットを = = マルチプレット 。
- 焼入れ Orbitrap ベロスと m/z としてレポート データの選択した化合物の高分解能質量分析法 (HRMS) を実行します 。
- 使用ポリグラム シリカゲル TLC 板 (40 mm x 80 mm、厚さ 0.2 mm) 薄層クロマトグラフィー (TLC) の 254 nm の蛍光指示薬がプレコート。紫外線ランプ照射による TLC の版を視覚化します 。
- 、60 Å、70 150 メッシュによるシリカゲル 1.5 cm × 15 cm のガラスカラム フラッシュ クロマトグラフィーを実行します 。
2。Nitrosamide 肯定的な制御の準備 (N ′-nitrosonorcotinine、NNC)
電磁攪拌棒を含む- ドライ、一晩オーブンで (〜 140 ° C 16 h) 25 mL 丸底フラスコ。朝は、クールなストリームの N 2 N 2 の流れを維持するオイルのバブラーを使用しながら下のフラスコ レート 1 秒あたり 1 つのバブルします
。 注: 冷却した後、N 2 の下でフラスコを保つために注意する必要はありません 。
- ヒューム フードで冷却のフラスコに norcotinine (31.8 mg、0.196 モル)、(5 mL)、無水酢酸、酢酸 (1 mL) を追加。水氷浴で 0 の ° C に冷却しながら連続的にこの混合物をかき混ぜる
。 注意:無水酢酸と酢酸はある腐食性 。
- 追加ナノ 2 (33.3 mg、0.483 モル) 1 つの部分し、連続的に 2.5 h. TLC によって反応の進行状況を監視の混合物をかき混ぜる (100% エチル、R f = 0.19、1.4 の手順を参照してください).
注: この時間をかけて混合物黄色になりますますバブルで時折 。
- (18 mL) 冷たい H 2 O に混合物を注ぐことによって反応を抑制します。18 ml の CH 2 Cl 2 スズの水溶液を即座に抽出します。CH 2 Cl 2 (9 mL) 少なくとも 2 の追加回水の層を抽出します 。
- は、MgSO 4 2 分フィルターのための ~ 100 mg 以上のプールされた有機物を乾燥、粗、黄色の油を生成する回転蒸発によってソリューションを集中し、なさい。残留の酢酸を削除する蒸発熱 30 ° C の水浴
。 注: プロトコルを一時停止できるここで CH 2 Cl 2 および 2-8 ° c. で暗い保存されてソリューションに化合物を溶解している場合 - カラムクロマトグラフィーにより原油の化合物を浄化する (手順 1.5 参照) 100% 固定相としてシリカゲルを用いる溶離液 16 としてエチル
。 注意:彼らは人間の発癌物質と見なされますよう、NNC と関連 nitrosamides を注意して処理する必要があります 。
- CDCl 3 で純粋な化合物を溶解し、NMR を使用 (手順 1.2 参照) して構造を確認し、このソリューションの 17 のモル濃度を決定します。2-8 ° c まで必要な暗闇の中で、このソリューションを保存します
。 注: このソリューションは、(ステップ 3.5) の in vitro アッセイのポジティブ コントロールとして使用されます。サポート情報では NMR スペクトルや化学シフトします 。
- 純粋な NNC ソリューションを確認正確な質量を親し、1.3 と 4.3 の手順で説明するパラメーターの下で高分解能質量分析計 (HRMS) に直接注入による製品イオン質量を決定します
。 注: 製品の質量は、体外 代謝アッセイ (ステップ 4.3) でこの化合物を検出するため使用されます 。
3。インキュベーション の in vitro 例ニトロソアミン P450
- -80 ° C のフリーザーから P450 2A6 Baculosomes、鮮やかな NADPH 再生システム、および 10 mM NADP + 在庫ソリューションを削除し、聞かせ融解は氷の上。解凍後、希釈 Baculosomes と NADPH 再生システム 1:10 と 1:50、0.5 X 反応バッファーを単一の 1 mL の管に、それぞれ。同様に、反応バッファー X nadp + 在庫ソリューション 0.5 97 μ L に 3 μ L を追加します
。 注: NADP + は、光に敏感です。このソリューション コンテナーをアルミ箔で包むことによって保護をしてください。酵素のソリューションは、凍結融解サイクルに敏感以上 2 サイクルに制限します。今後の実験に必要な因数を準備します 。
- 50 μ L の酵素液 (5 pmol P450 を含む) を 1 mL 管含む 40 μ L 反応バッファーは、4 μ M NNN ソリューションの各インキュベーションを追加。中古水槽を併用した 37 ° C で 2 分間この新しい混合物をインキュベートし、NADP + の希釈液の 10 μ L を追加します。37 分の 1 30 分の完全なシステムをインキュベート ° C
注: を用いたインキュベーション時間 5 分間隔 (例えば 5、10、15 分など) 十分な nitrosamide 形成時間コースを提供する 。
- 3.0 N ZnSO 4 の最初の追加 10 μ l と 3.0 N Ba(OH) の 10 μ L を癒す目的の培養時間後 2.このソリューションと白い沈殿物を形成する渦。沈殿物をペレットに 4 分間、8000 x g でサンプルを遠心します
。 注: 手順する必要があります一時停止この段階で形成された nitrosamides 水溶液中での安定性が限られていると。偽陰性に長い一時停止があります 。
- すぐに上澄みをピペットし、2 μ L を高分解能液体クロマトグラフィー肯定的な nanoelectrospray をイオン化タンデム質量分析法による分析 (LC NSI +-人事管理システム/MS 手順 4.1 4.3).
- 肯定的な制御の孵化のストリームの N 2 の下で 1 mL 管に 100 fmol の合成 NNC ソリューションを含む、因数を蒸発させます。このバイアルによる酵素システムを 3.2 から追加 3.3 3.4 の手順の説明に従ってし、 。
- 陰性対照の孵化の実験を説明されている (手順 3.2 3.4) として反応バッファー X 0.5 交換、50 μ L の酵素液を除いて実行します 。
4。LC NSI + の nitrosamide 検出パラメーターの例-人事管理システム/MS
- 、LC のコンポーネント、商業、手パック 18 C18 を使用して高精度システムに 4.2 の手順で次の多段グラデーションを適用 (5 μ m)100 mm x 75 μ m, 15 μ m オリフィス キャピラリーカラム 。
- を使用して 5 mM NH 4 OAc 溶剤、溶剤 B として MeCN としては 1 μ L/分で 5 %b で実行することによって列にサンプルをロードします。0 ~ 5 分と 0.3 μ L/分の流量をその後減速します。ランプ 55% B 10 分以上にし、5% に再平衡化に続いて 4 分以上にグラデーションを 5 から 20% の B を次に、実行 B.
- 実行 LC NSI +-焼入れ Orbitrap の人事管理システム/MS。NNC フルスキャンして MS 2 断片化を監視します。60,000 の解像度でフル スキャンを実行し、5 ppm の質量公差で正確な親質量 (192.07670) を抽出します。衝突誘起解離 (CID) 衝突エネルギーと 25 eV、15,000、解像度によって親イオン (2.0 amu) とフラグメントを分離し、30 ミリ秒のスキャン時間使用 MS 2 断片化 NNC (m/z のプロダクト イオンの正確な質量を抽出します。192 m/z 134.04739 と 162.07874) 5 ppm の質量公差で 。
結果
白らの作業に基づいています。19、norcotinine され、NNC にニトロソ化きれいに高収率 (80-92%)の in vitro実験のための標準。1H nmr 法、 13C NMR、居心地の良い、HRMS 親質量 [M + H] を確認すると共に HSQC (サポート情報) などの分光学的解析から得られた正常反応の構造証拠+の 5 ppm 以内、理論値 (図 2)?...
ディスカッション
ニトロソアミン代謝の解明は、その発がん性を理解するための重要なコンポーネントです。関与するチトクローム p450 および他の代謝酵素はポリモーフィックなので、さらにこの知識の応用では危険度が高い個人1,4が識別潜在的でした。新しいデータ α-hydroxynitrosamines、DNA 結合に関与するニトロソアミンの推定の主要な代謝産物のさらに酸化反応?...
開示事項
著者が明らかに何もありません。
謝辞
この研究助成金に支えられないです。国立がん研究所から CA 81301。我々 は貴重な議論のため博士アンナ, ミシェル博士アダム t. Zarth とフリーメーソンのがんセンターの分析化学共有リソースの質量分析支援のため迅明博士ピーター Villalta ボブ カールソン編集者の支援のために感謝します。入力します。分析化学共有リソースを部分的にサポートによって国立がん研究所がんセンター サポート助成金 CA-77598
資料
| Name | Company | Catalog Number | Comments |
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
参考文献
- Rom, W. N., Markowitz, S. . Environmental and Occupational Medicine. , 1226-1239 (2007).
- Preussmann, R., Stewart, B. W., Searle, C. E. . Chemical Carcinogens, ACS Monograph 182. 2, 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R., Searle, C. E. . Chemical Carcinogens. ACS monograph 173. , 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. . ACS Symposium Series. 101, 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5'(1')iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochemistry. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N'-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N'-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved